内皮素3对不同毛色绵羊黑色素细胞的影响
李亚楠,赵兵令,王海东,陈天直,刘颖,常露程,董常生
(山西农业大学,山西太谷 030801)
内皮素3对不同毛色绵羊黑色素细胞的影响
李亚楠,赵兵令,王海东,陈天直,刘颖,常露程,董常生
(山西农业大学,山西太谷 030801)
【目的】探索内皮素3(EDN3)对来源于不同毛色体外培养的黑色素细胞产生黑色素作用机制及差异的影响。【方法】体外培养不同毛色皮肤来源的黑色素细胞,通过MTT法检测不同细胞在EDN3影响下的增殖率,分别提取两种细胞的总RNA和总蛋白,总RNA经反转录合成cDNA,采用实时荧光定量PCR方法检测EDN3对两种细胞内EDNRB、NRas及TYR在mRNA水平相对表达量的影响,总蛋白通过Western blot方法检测EDN3对两种细胞内EDNRB、NRas及TYR在蛋白水平的表达量是否发生变化,结果均使用SPSS19.0软件进行差异显著性分析。【结果】MTT法测得EDN3对黑白两种来源的黑色素细胞的增殖均产生促进作用,实时荧光定量PCR结果显示添加EDN3的白色来源细胞内EDNRB mRNA的相对表达量是正常细胞组的1.7992倍,NRas是正常细胞组的1.8536倍差异极显著(P<0.01),但TYR mRNA的相对表达量未发生明显变化;添加EDN3的黑色来源细胞内EDNRB mRNA的相对表达量是正常细胞组的2.2512倍,NRas是正常细胞组的1.3859倍,TYR是正常细胞组的15.5710倍差异极显著(P<0.01);Western blot结果显示添加 EDN3的白色来源细胞内 EDNRB 蛋白表达量是正常细胞组的3.0827倍差异极显著(P<0.01),NRas是正常细胞组的1.2936倍差异显著(P<0.05),TYR蛋白表达量未发生明显变化;添加EDN3的黑色来源细胞内EDNRB 蛋白表达量是正常细胞组的3.9800倍差异极显著(P<0.01),NRas是正常细胞组的1.3658倍差异显著(P<0.05),TYR是正常细胞组的1.8498倍差异显著(P<0.05)。【结论】EDN3促进白色来源的黑色素细胞增殖但对色素合成的限速酶TYR未产生促进作用;EDN3促进黑色来源的黑色素细胞增殖并可能促进黑色素生成。
内皮素3(EDN3);绵羊;毛色;黑色素细胞
0 引言
【研究意义】内皮素(endothelin,EDN)是一类由内皮细胞合成分泌的活性肽包括 EDN1、EDN2、EDN3,各亚型的功能因分布部位不同而有一定的差异,主要作用为参与血管扩张剂的释放及促进细胞有丝分裂[1-3]。EDN3对心血管系统的稳定及血压的调节有一定的作用[4]。在毛色形成的主要部位,EDN3由角化细胞及内皮细胞合成分泌,并通过EDNRB与黑色素细胞结合通过一系列的分子调控,最后作用于MITF(小眼畸形转录因子)从而影响黑色素的合成及转运[5]。【前人研究进展】已有研究表明,在不同物种不同部位的色素沉着均显示 EDN3有明显的调控作用[6]。其中在细胞水平的研究显示,EDN3与KIT信号途径对黑色素细胞发育存在必不可少的协同作用[7],EDN3对黑色素细胞前体的迁移及增殖有较大的影响,并与生长因子一起成为形成成熟的黑色素细胞必要的因子[8]。EDN3对已成熟的羊驼黑色素细胞有促进增殖分化的作用,明显促进黑色素细胞数量的变化[9]。另有研究称EDN3对黑色素细胞分泌的黑色素小体的转运有一定的影响[10]。体外培养的黑色素细胞在EDN3 的刺激下,细胞数量显著增加黑色素的合成也相应的增多。EDN3及其受体所组成的信号通路参与黑色素的合成并发挥重要的调节作用[11]。EDN3在黑色素瘤以及人类的皮肤色素过度沉着等疾病中均发挥作用,主要表现在对黑色素细胞前体细胞的分化及已成熟细胞的增殖均有影响[12-13]。关于内皮素家族及其受体的研究进展显示其对体外培养的黑色素细胞的促增殖作用较明显,对于色素合成的相关基因有一定的促表达作用。但在不同毛色绵羊皮肤中的组织定位及表达的分析显示EDN3在黑色及白色皮肤中表达有异[14]。【本研究切入点】在体外培养的不同毛色绵羊皮肤来源的黑色素细胞中EDN3的作用是否有所不同,仍未见报道。【拟解决的关键问题】本研究通过对不同毛色的绵羊皮肤来源的黑色素细胞进行试验,分析EDN3对黑色素细胞的作用,进一步补充EDN3的作用机制。
1 材料与方法
本试验于2014年11月至2015年2月在山西农业大学羊驼生物工程实验室进行。
1.1 试剂
MELM(2201)(SCIENCELL),胰酶(1﹕250)(solarbio),胎牛血清(杭州四季青公司),RNA提取试剂盒,反转录试剂盒(Takara 公司产品),QuantiFast SYBR Green PCR Kit( QIAGEN 公司产品),EDN3,EDRB抗体(生工生物公司产品),NRas抗体(生工生物公司产品),TYR抗体(生工生物公司产品)。
1.2 材料
绵羊黑色素细胞(山西农业大学羊驼生物工程实验室提供),分别为白色绵羊皮肤来源与黑色绵羊皮肤来源(皮肤取自1岁左右小尾寒羊介休羊场提供)。
1.3 方法
1.3.1 黑色素细胞的复苏与传代 从液氮罐中取出细胞冻存管并快速置于提前加热至37℃的水浴锅中,轻轻摇动使其迅速融化。待细胞完全融化并酒精消毒后置于超净台,加入培养基轻轻吹打使细胞悬浮,将该细胞悬液转移至15mL离心管,4℃,1 000 r/min离心10 min。弃去上清液,加入黑色素培养基轻轻吹打悬浮细胞后接种于6孔细胞培养板,静置于5% CO2培养箱,37℃培养,24 h后观察细胞贴壁情况并更换新鲜培养基。
1.3.2 黑色素细胞活力的测定 采用四甲基偶氮噻唑蓝比色法(MTT法)[15]。取对数生长期细胞,0.25%胰酶+EDTA消化,分别计数并调节细胞浓度为1×104个/mL接种于96孔板静置培养24 h,更换为添加有不同浓度 EDN3的黑色素培养基,置于 5% CO2培养箱中培养72 h。每孔加入5mg·mL-1的MTT溶液200μL,放置培养箱孵育4 h,弃去上清液,每孔加二甲基亚砜(DMSO)150μL。在酶标仪上以490nm 波长测各孔吸光度值计算添加不同浓度EDN3后细胞的增值率。促增殖率=(添加EDN3 A490值-无EDN3A490值)/(无EDN3 A490值-培养基A490值)×100%[14]。
1.3.3 Real-time PCR检测 使用RNA提取试剂盒提取细胞总RNA,测定浓度后按照Takara公司反转录试剂盒合成 cDNA。根据 GenBank上的绵羊EDNRB、NRas和TYR序列,利用Premier 5.0 软件设计引物并通过NCBI初步检测引物的特异性。引物由北京华大基因公司合成。引物序列见表1。按照Applied Biosystems公司荧光定量试剂盒进行扩增,反应结束通过 2-△△CT法计算目的基因在不同毛色绵羊皮肤中的相对表达水平。△CT目的基因= CT目的基因-CT内参基因,△△CT = △CT白色绵羊组-△CT黑色绵羊组,各个目的基因mRNA表达差别倍数以2-△△CT表示。

表1 目的基因引物序列及PCR扩增条件Table 1 Sequence of premiers and conditions for PCR amplification
1.3.4 蛋白免疫印迹试验 用碧云天蛋白裂解液提取细胞总蛋白,检测总蛋白浓度,上样调整一致后进行SDS﹣聚丙烯酰胺凝胶电泳。浓缩胶与分离胶电泳条件分别为恒压80V与120V,电泳结束后转至NC膜。转膜结束后,用5%封闭蛋白干粉室温封闭1h,加入EDNRB(1﹕1 000)、NRas(1﹕500)、TYR(1﹕1 000)和β-actin(1﹕1 000)一抗4℃过夜孵育。水平摇床上用TBST清洗NC膜,10min×3次。根据一抗来源选择HRP标记的二抗(1﹕10 000)37℃摇床孵育1 h。二抗孵育结束后,用TBST漂洗NC膜5min×6次。使用康为高灵敏度ECL显色后暗室曝光,得到有条带的胶片扫描并分析。用Image-ProPlus 6.0软件对绵羊色素细胞免疫印迹结果进行分析。蛋白含量=条带面积×平均灰度,目的蛋白相对定量值=目的蛋白含量/β-actin蛋白含量。数据均用Means±SE表示,用SPSS软件进行单因素方差分析,P<0.05差异显著,P<0.01差异极显著。
2 结果
2.1 黑色素细胞的形态学观察
两种来源的黑色素细胞复苏及传代后,均呈双树突或三树突状且正常贴壁生长、状况良好,添加EDN3后,细胞无明显的形态学变化(图1)。
2.2 EDN3对细胞增殖率的影响
利用 MTT法测得细胞增值率的结果显示两种来源的黑色素细胞在EDN3的刺激下增值率均有所提高,但以EDN3在1×10-8mol·L-1浓度时细胞的增殖率变化最为明显,且浓度过高时(1×10-7,1×10-6)反而会有一定的抑制作用。比较两种细胞的增值率显示白色皮肤来源的黑色素细胞在 EDN3为 1×10-8mol·L-1时的增殖率明显高于黑色皮肤来源的黑色素细胞(图2)。
2.3 EDNRB、NRas及TYR mRNA的变化
通过qRT-PCR方法检测了1×10-8mol·L-1浓度的EDN3对EDNRB、NRas及TYR mRNA相对表达量的影响。统计结果分析显示:添加EDN3的白色来源细胞内 EDNRB mRNA 的相对表达量为1.8007±0.1434是正常细胞组的 1.7992倍,NRas mRNA的相对表达量为1.8552±0.0999是正常细胞组的1.8536倍差异极显著(P<0.01),但TYR mRNA的相对表达量为1.0005±0.0358相较正常组细胞未发生明显变化。添加EDN3的黑色来源细胞内EDNRB mRNA的相对表达量为2.2542±0.1598是正常细胞组的2.2512倍,NRas mRNA的相对表达量为1.3950± 0.0329是正常细胞组的1.3859倍,TYR mRNA的相对表达量为15.6190±0.3239是正常细胞组的15.5710倍差异极显著(P<0.01)。与正常培养的细胞相比,添加 EDN3的细胞色素相关基因的表达量均发生了变化。EDN3的受体EDNRB和下游基因NRas mRNA的表达量有显著的增加(图3-A、B),但TYR mRNA的表达量仅有黑色皮肤来源的黑色素细胞有极显著的增加,白色皮肤来源的黑色素细胞未发生明显的变化(图3-C)。

图1 绵羊黑色素细胞的形态Fig. 1 The morphology of sheep melanocytes
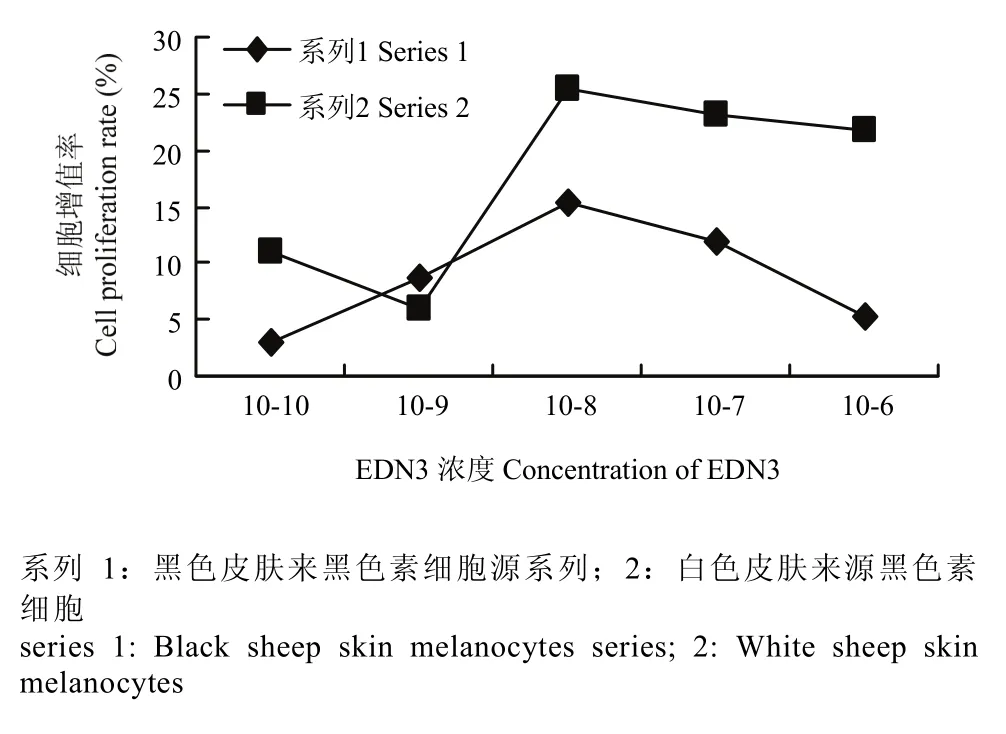
图2 不同浓度EDN3对细胞增值率的影响Fig. 2 Proliferation of sheep melanocytes induced by different concentrations of EDN3
2.4 Western blot 实验结果
通过Western blot方法检测了1×10-8mol·L-1浓度的EDN3对EDNRB、NRas及TYR 蛋白表达量的影响(图4-A)。结果分析显示:添加EDN3的白色来源细胞内EDNRB 蛋白表达量为9.5724±2.1927是正常细胞组的 3.0827倍差异极显著(P<0.01),NRas蛋白表达量为 2.1856±0.3264是正常细胞组的 1.2936倍差异显著(P<0.05),TYR蛋白表达量为3.0818± 0.5227是正常细胞组的1.0024倍,未发生明显变化。添加EDN3的黑色来源细胞内EDNRB 蛋白表达量为12.2360±2.9357是正常细胞组的3.9800倍差异极显著(P<0.01),NRas蛋白表达量为3.2779±0.2466是正常细胞组的1.3658倍差异显著(P<0.05),TYR蛋白表达量为5.2662±1.0464是正常细胞组的1.8498倍差异显著(P<0.05)。EDN3的受体EDNRB和下游基因NRas 的蛋白表达量有显著的增加(图4-B、C),但 TYR 的蛋白表达量仅有黑色皮肤来源的黑色素细胞有显著的增加,白色皮肤来源的黑色素细胞未发生明显的变化(图4-D)。

图3 EDN3对EDNRB、NRas、TYR mRNA表达量的影响Fig. 3 The relative mRNA expression of the EDNRB, NRas and TYR genes in melanocytes treated by EDN3
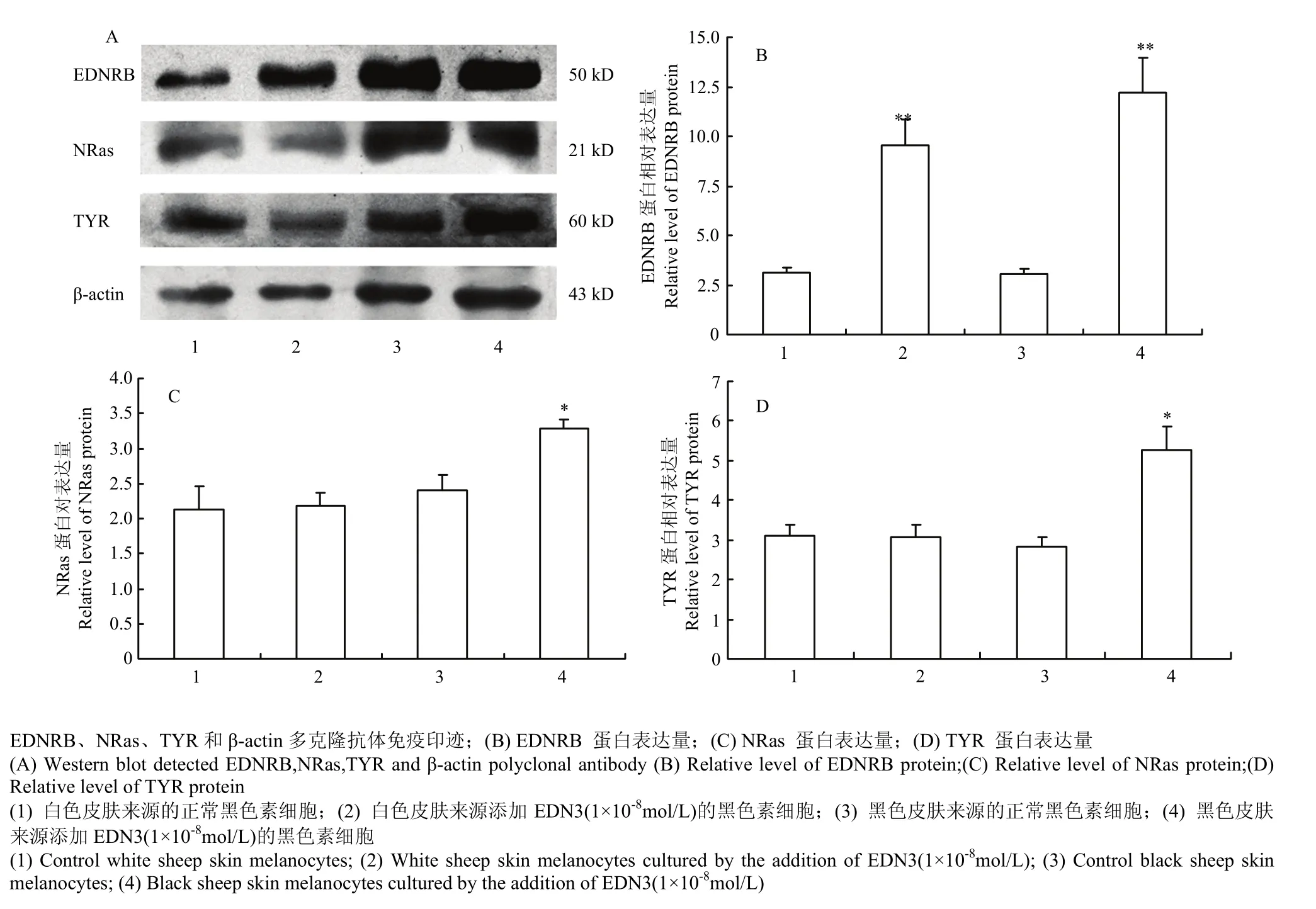
图4 EDNRB、NRas及TYR蛋白表达印迹分析Fig. 4 Western blot analysis of the expression of EDNRB,NRas and TYR protein
3 讨论
本试验通过添加不同浓度的 EDN3,对比黑白来源的黑色素细胞有不同的增值率,显示白色来源的黑色素细胞在EDN3的刺激下有较高的增值率。同时通过qRT-PCR以及Western Bolt方法对黑色素细胞合成黑色素的相关基因分析表明EDN3促进黑色来源的黑色素细胞相关基因和蛋白的表达量显著增加,对白色来源的黑色素细胞也有一定的促进作用,但与色素合成密切相关的酪氨酸酶并未产生促进效果。结果提示,EDN3对两者细胞均有促进细胞增殖和基因表达的作用,但对白色来源的细胞以促进增殖为主对色素合成并无较大的影响。对黑色来源的色素细胞有明显促进色素合成的作用。已有的研究表明内皮素家族中的EDN2、EDN3对羊、羊驼体外培养的黑色素细胞均有促进增殖及黑色素合成作用[9,16]。动物体内转基因过表达 EDN3同样显示在EDN3的刺激下,黑色素细胞前体细胞和已分化成熟的黑色素细胞在数量上均有一定的增多,随后色素的持续沉着需要EDN3的维持[17]。猫科动物的研究显示EDN3对后期表型花纹的形成有促进作用,EDN3从胚胎时期至毛色的形成对黑色素细胞有维持的作用[18]。
转基因小鼠体内的EDN3信号用以维持皮肤黑色素细胞的存在,在毛囊中的黑色素细胞受EDN3受体信号的支持不仅增加细胞数量还促进酪氨酸酶的表达从而促进其增加色素合成的能力[19]。EDNRA对于EDN1和EDN2有非常高的亲和力,但对EDN3的亲和力较小; 与此相反,EDNRB对三者都具有相似的高亲和力[20-21]。研究发现紫外线的持续照射会引起皮肤色素沉着加深,其机制包括紫外线引起角化细胞持续分泌EDN1、EDN3与EDNRB结合后加速色素合成[12,22]。EDNRB在绵羊皮肤中是主要参与介导黑色素细胞增殖的受体,并且参与黑色素的生成[23]。EDN1的作用机制是在黑色素合成过程中磷酸化MITF并增加TYR等酶的表达量,在黑色素的转运机制中诱导黑色素细胞向角化细胞转运的黑素小体的增加,这种诱导机制可通过抑制内皮素受体的功能禁止[13,24-25]。同时中等浓度的EDN3会产生与EDN1相似的功能及影响。本试验添加 EDN3体外培养的细胞显示黑色素细胞合成色素相关的基因在 EDN3的刺激下表达均有所提高,但白色皮肤来源的黑色素细胞中TYR的表达未发生变化。这一结果提示 EDN3发挥类似EDN1的作用,促进正常色素的合成及转运,但是白色毛发的形成未有色素颗粒的正常生成,猜测白色皮肤来源的黑色素细胞合成黑色素的过程受到其他基因调控,致使色素生成的限速酶合成受到限制。据此可以推测白色绵羊最终毛色表型的形成在色素合成的过程中受到调控,但是内皮素家族对色素细胞的作用仅为色素基因的一部分,在不同年龄不同动物形成白色毛发的机制可能会存在差异,尚未明确仍需进一步研究。
另有研究显示体外培养的神经嵴细胞在干细胞生长因子和EDN3的共同刺激或仅有EDN3刺激下均可分化发育为黑色素细胞,单独由干细胞生长因子刺激分化发育为未成熟细胞[26-28]。这一结果提示 EDN3对早期黑色素细胞的形成有至关重要的作用,本试验结果提示EDN3对已成熟的黑色素细胞有促进细胞增殖和色素生成的作用,但对白色来源的黑色素细胞以促进细胞增殖为主。EDN3在不同时期发挥不同的功能,对不同来源的细胞也会产生不同的作用。不能正常合成黑色素的细胞在EDN3的作用下相关基因的表达量有所增加,但影响色素合成的主要基因未发生变化,具体机制仍有待研究。
4 结论
内皮素3可促进白色来源的黑色素细胞增殖但对色素合成的限速酶 TYR未产生促进作用;内皮素 3可促进黑色来源的黑色素细胞增殖并可能促进黑色素生成。
[1] INOUE A, YANAGISAWA M, KIMURA S, KIMURA S, KASUYA Y, GOTO Y, MASAKI T. The human enothelin family: three structurally and pharmacologically distinct isopeptides predicted by three separate genes. Proceedings of the National Academy of Sciences of the United States of America, 1989, 86 (8):2863-2867.
[2] SALDANA-CABOVERDE A, KOS L. Roles of endothelin signaling in melanocyte development and melanoma. Pigment Cell & Melanoma Research, 2010, 23(2):160-170.
[3] IMOKAWA G, YADA Y, MIYAGISHI M. Endothelins secretedfrom human keratinocytes are intrinsic mitogens for human melanocytes. Journal of Biological Chemistry, 1992, 267(34): 24675-24680.
[4] KEDZIERSKI R M, YANAGISAWA M. Endothelin system: the double-edged sword in health and disease. Annual Review of Pharmacology & Toxicology, 2001, 41(1): 851-876.
[5] LIN J Y, FISHER D E. Melanocyte biology and skin pigmentation. Nature, 2007, 445(7130): 843-850.
[6] KINOSHITA K, AKIYAMA T, MIZUTANI M, SHINOMIYA A, ISHIKAWA A, YOUNIS H H, TSUDZUKI M, NAMIKAWA T, MATSUDA Y. Endothelin receptor B2 (EDNRB2) is responsible for the tyrosinase-independent recessive white (mo(w)) and mottled (mo) plumage phenotypes in the chicken. PLoS One, 2014, 9(1): e86361-e86361.
[7] AOKI H, MOTOHASHI T N, YAMAZAKI H, et al. Cooperative and indispensable roles of endothelin 3 and KIT signalings in melanocyte development. Developmental Dynamics, 2005, 233(2):407-417.
[8] FANG D, LEISHEAR K, NGUYEN T K, FINKO R, CAI K, FUKUNAGA M, LI L, BRAFFORD P A, KUIP A N, XU X, SMALLEYS K S, HERLYN M. Defining the conditions for the generation of melanocytes from human embryonic stem cells. Stem Cells, 2006, 24(7): 1668-1677.
[9] 耿建军, 白俊明, 范瑞文, 杨姗姗, 庞亚妙, 董常生. 内皮素-3对羊驼黑色素细胞特征及细胞内毛色基因表达的影响. 畜牧兽医学报, 2013, 44(7): 1070-1077.
GENG J J, BAI J M, FAN R W, YANG S S, PANG Y M, DONG C S, The effect of endothelin-3 on the melanocyte characteristic and expression of hair color genes in melanocytes from alpaca (Lama Pacos) in vitro. Acta Veterinaria et Zootechnica Sinica, 2013, 44(7): 1070-1077.(in Chinese)
[10] HIROBE T. How are proliferation and differentiation of melanocytes regulated?. Pigment Cell & Melanoma Research, 2011, 24(3): 462-478.
[11] REGAZZETTI C, DE DONATIS G M, GHORBEL H H, CARDOTLECCIA N, AMBROSETTI D, BAHADORAN P, CHIQNONSICARD B, LACOUR JP, BALLOTTI R, MAHNS A, PASSERON T. Endothelial cells promote pigmentation through endothelin receptor B activation. Journal of Investigative Dermatology, 2015, 135(12): 3096-3104.
[12] VON KOSCHEMBAHR A M, SWOPE V B, STARNER R J, ABDEL-MALEK Z A. Endothelin-1 protects human melanocytes from UV-induced DNA damage by activating JNK and p38 signalling pathways. Experimental Dermatology, 2015, 24(4): 269-274.
[13] SKOVSTED GF, KILIC S, EDVINSSON L. Endothelin-1 and endothelin-3 regulate endothelin receptor expression in rat coronary arteries. Basic & Clinical Pharmacology & Toxicology, 2015, 117(5): 297-305.
[14] 李亚楠, 赵兵令, 马淑慧, 赫晓燕, 范瑞文, 王海东, 耿建军, 董常生. 内皮素 3在不同毛色绵羊皮肤的表达与定位.畜牧兽医学报, 2015, 46(12):2322-2328.
LI Y N, ZHAO B L, MA S H, HE X Y, FAN R W, WANG H D, GENG J J, DONG C S. EDN3 expression and localization in sheep skin with different coat color. Acta Veterinaria et Zootechnica Sinica, 2015, 46(12): 2322-2328. (in Chinese)
[15] MOSMANN T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. Journal of Immunological Methods, 1983, 65(s 1–2):55-63.
[16] 秦以龙, 董常生, 庞亚妙, 崔玉琮, 赵园园, 耿建军. 内皮素-2(ET-2)促进体外培养的绵羊皮肤黑色素细胞增殖及黑色素生成.中国生物化学与分子生物学报, 2015, 31(11): 1199-1205.
QIN Y L, DONG C S, PANG Y M, CUI Y C, ZHAO Y Y,GENG J J. Endothelin-2 (ET-2) promotes cultured ovine skin melanocytes proliferation and melanin synthesis in vitro. Chinese Journal of Biochemistry and Molecular Biology, 2015, 31(11): 1199-1205.(in Chinese)
[17] REID K,TURNLEY AM, MAXWELL GD, KURIHARA H, BARTLETT PF, MURPHY M. Multiple roles for endothelin in melanocyte development: regulation of progenitor number and stimulation of differentiation. Development, 1996, 122: 3911-3919.
[18] KAELIN C B, XU X, HONG LZ, DAVID V A, MCGOWAN K A, SCHMIDT-KUNTZEL A, ROELKE M E, PINO J, PONTIUS J, COOPER G M, MANUEL H, SWANSON W F, MARKER L, HARPER CK, VAN DYK A, YUE B, MULLIKIN JC, WARREN WC,EIZIRIK E, O’BRIEN SJ, BARSH GS, MENOTTI-RAYMOND M. Specifying and sustaining pigmentation patterns in domestic and wild cats. Science, 2012, 337(6101): 1536-1541.
[19] BARNES K J, SPENCER N J. Can colonic migrating motor complexes occur in mice lacking the endothelin-3 gene?. Clinical & Experimental Pharmacology & Physiology, 2015, 42(5): 485-495.
[20] ARAI H, HORI S, ARAMORI I, OHKUBO H, NAKANISHI S. Cloning and expression of a cDNA encoding an endothelin receptor. Nature, 1990, 348(6303):730-732.
[21] SAKURAI T, YANAGISAWA M, TAKUWA Y,; MIYAZAKI H,KIMURA S, GOTO K, MASAKI T. Cloning of a cDNA encoding a non-isopeptide-selective subtype of the endothelin receptor. Nature, 1990, 348(6303):732-735.
[22] BENADUCE A P, BATISTA D, GRILO G, JORGE K, CARDERO D, MILIKOWSKI C, KOS L. Novel UV-induced melanoma mouse model dependent on Endothelin3 signaling. Pigment Cell & Melanoma Research, 2014, 27(5):839–842.
[23] 耿建军, 孙乐天, 穆晓丽, 张杰, 姜俊兵, 张映, 李宏全, 董常生.内皮素受体在不同毛色绵羊皮肤中的表达和定位分析. 中国农业科学, 2010, 43(24): 5147-5154.
GENG J J, SUN L T, MU X L, ZHANG J, JIANG J B, ZHANG Y, LI H Q, DONG C S. Immunolocalization and expression analysis of endothelin receptor in sheep skin of different hair color. Scientia Agricultura Sinica, 2010, 43(24): 5147-5154.(in Chinese)
[24] GARCIA RJ, ITTAH A, MIRABAL S, FIQUEROA J, LOPEZ L, GLICK AB, KOS L. Endothelin 3 induces skin pigmentation in a keratin-driven inducible mouse model. Journal of Investigative Dermatology, 2008, 128(1): 131-142.
[25] SATO-JIN K, NISHIMURA E K, AKASAKA E, HUBER W, NAKANO H, MILLER A, DU J, WU M, HANADA K, SAWAMURA D, FISHER D E, IMOKAWA G. Epistatic connections between microphthalmia-associated transcription factor and endothelin signaling in Waardenburg syndrome and other pigmentary disorders. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 2008, 22(4):1155-1168.
[26] KAWA Y, ITO M, ONO H, ASANO M, TAKANO N, OOKA S, WATABE H, HOSAKA E, BABA T, KUBOTA Y, MIZOGUCHI M. Stem cell factor and/or endothelin-3 dependent immortal melanoblast and melanocyte populations derived from mouse neural crest cells. Pigment Cell Research, 2000, 13 (Supplement s8): 73-80.
[27] THOMAS A J, ERICKSON C A. The making of a melanocyte: the specifcation of melanoblasts from the neural crest. Pigment Cell & Melanoma Research, 2008, 21(6): 598-610.
[28] ABDLE-MALEK Z, SWOPE VB, SUZULI I, AKCALI C, HARRIGER M D, BOYCE S T, URABE K, HEARING V J. Mitogenic and melanogenic stimulation of normal human melanocytes by melanotropic peptides. Proceedings of the National Academy of Sciences, 1995, 92(5): 1789-1793.
(责任编辑 林鉴非)
Effect of EDN3 on of Sheep Skin Melanocytes with Different Coat Colors in Vitro
LI YaNan, ZHAO BingLing, WANG HaiDong, CHEN TianZhi, LIU Ying, CHANG LuCheng, DONG ChangSheng
(College of Animal Science and Veterinary Medicine, Taigu 030801, Shanxi)
【Objective】 The objective of this study is to explore the effects of EDN3 in vitro on sheep melanocytes with different coat colors and to find the mechanisms of production of melanin and their differences. 【Method】 Melanocytes from black and white coat colors were cultured in vitro, and MTT assay was used to detect different cell proliferation rates by affected EDN3. After extraction of total RNA and total protein of both cells, the total RNA was reversely transcribed to cDNA, and then the effect of EDN3 on mRNA relative expression of EDNRB, NRas and TYR was analyzed by RT-PCR, and Western blot was performed to ensure whether EDN3 had influence on the protein expression of EDNRB, NRas and TYR. Significant difference was analyzed by using statistical method with software SPSS19.0. 【Result】 MTT assay showed that EDN3 promoted cells proliferation from both black and white coat colors. RT-PCR revealed that compared with the control group, the relative expressions of EDNRB and NRasmRMA in EDN3 group from white coat color were significantly increased by 1.7992 folds and 1.8536 folds respectively (P<0.01), while TRY mRNA had no significant difference. In cells from black coat color, the expressions of EDNRB, NRas and TYR were all induced significantly with multiples of 2.2512, 1.3859 and 15.5710 respectively (P<0.01). The result of Western blot in EDN3 group was consistent with RT-PCR, the EDNRB protein expression from white coat color was 3.0827 times of control group (P<0.01), and the NRas protein expression was 1.2936 fold of control group (P<0.05), while TYR had no change. The protein expressions in cells from black coat color of EDNRB, NRas and TYR were observably added up to 3.9800 time (P<0.01), 1.3658 and 1.8498 times (P<0.05), respectively. 【Conclusion】 EDN3 promoted melanocytes proliferation from both black and white coat colors, while had no effect on TYR which is a rate-limiting enzyme of pigment synthesis in cells from white coat colors, and might play a role in producing melanin in cells isolated from black coat color.
EDN3; sheep; coat color; melanocytes
2016-03-01;接受日期:2017-01-22
国家自然科学基金(31302049),国家高技术研究发展计划(“863”计划,2013AA102506)
联系方式:李亚楠,Tel:18404966095;E-mail:18404966095@163.com。赵兵令,Tel:18404981230;E-mail:921695051@qq.com;李亚楠与赵兵令为同等贡献作者。通信作者董常生,Tel:0354-6288980;E-mail:csdong18@163.com

