黑曲霉胺氧化酶的粗酶液酶学特性及降解生物胺的研究
黄瑶,朱霞,彭铭烨,付彩霞,周梦舟,高冰,李冬生,徐宁*
黑曲霉胺氧化酶的粗酶液酶学特性及降解生物胺的研究
黄瑶1,朱霞1,彭铭烨1,付彩霞2,周梦舟1,高冰1,李冬生1,徐宁1*
(1.湖北工业大学工业发酵湖北省协同创新中心湖北省食品发酵工程技术研究中心,湖北武汉430068;2.湖北土老憨调味食品股份有限公司,湖北宜昌443000)
选取黑曲霉SPFJ05为实验菌种,诱导其产生胺氧化酶。对诱导的黑曲霉菌体破碎后得到含有胺氧化酶的粗酶液,研究粗酶的部分酶学性质并用粗酶液对自制酱油和市售酱油进行处理。实验结果表明,粗酶的最适温度为35℃;最适pH值为7.0;1.0 mmol/L的Cu2+对酶活有激活作用;常见的抑制剂乙二胺四乙酸(EDTA)和巯基乙醇对酶活有明显抑制效果;底物特异性方面,该酶对正己胺的降解率最大为116%,对尸胺的降解率最差为16%。粗酶液对自制酱油中总生物胺的降解率达到78.29%,对市售酱油中总生物胺的降解率达到69.50%。该实验为发酵酱制品中生物胺的去除提供了新的途径。
黑曲霉;生物胺;胺氧化酶;酱油
生物胺存在于各类食品中,如水果、蔬菜、肉类、牛奶和鱼等本身就含有低浓度的生物胺,但生物胺的形成主要是由氨基酸经过脱羧作用形成的,所以在蛋白质、氨基酸含量丰富的尤其是发酵食品(如葡萄酒、奶酪)中生物胺含量较高。当人体摄入过量的生物胺(尤其是同时摄入多种生物胺)时,会引起诸如头痛、心悸、呼吸紊乱等过敏反应,严重的还会危及生命[1-5]。发酵豆制品(酱油、豆豉)和发酵肉制品(香肠、火腿)的发酵过程中有可能产生高含量的生物胺,这些发酵食品由于原料蛋白质丰富,成品氨基酸含量高,因此产生的生物胺种类较多,含量较高[6-7]。研究发现,来自不同生产厂家的40种酱油中都含有不同程度的生物胺,其中主要是酪胺、组胺、精胺、亚精胺、尸胺等五种生物胺含量较高[8]。由于生物胺的过量摄取对人体健康有影响,再加上现在社会各界食品安全问题的尤为关注,因此如何控制发酵食品中生物胺的含量也就成了一个亟需解决的问题。
目前对于发酵肉制品中生物胺的防治研究较多,如鱼露、发酵香肠生产中通过冷冻、辐射从而减少食品中生物胺的累积[9-10],此外多种微生物含有降解生物胺的胺氧化酶,该酶可催化生物胺分解为乙醛、氨和过氧化氢,如沙克乳杆菌(Lactobacillus sakei)可减少组胺的积累[11],干酪乳杆菌(Lactobacillus casei)和植物乳杆菌(Lactobacillus plantarum)可去除酪胺[12],微球菌属的某些种可降解酪胺,亚麻短杆菌(Brevibacterium linens)可减少组胺与酪胺的含量[13],木糖葡萄糖球菌(Staphylococcus xylosus)也可以降解组胺与酪胺[14]。
黑曲霉(Aspergillus niger)是生产豆酱、白酒、食醋等发酵食品常用的安全菌种,也是发酵生产酶制剂(蛋白酶、淀粉酶、果胶酶)和有机酸(如柠檬酸、葡萄糖酸等)的主要菌种。有研究报道指出黑曲霉中含有产胺氧化酶的基因,只需要给予合适的诱导环境就可以诱导出胺氧化酶[15]。已有研究从A.nigerAKU3302中提取出胺氧化酶,并对其酶学特性等进行了初步研究,但其应用于发酵食品中生物胺的制的研究未见报道。本实验的目的是研究一株从中国传统发酵食品中分离筛选出的降解生物胺能力较强的黑曲霉SPFJ05菌株所产胺氧化酶粗酶的酶学性质、对不同种类生物胺的降解特性力,以及对酱油样品中生物胺降解能力的研究。
1 材料与方法
1.1 材料与试剂
黑曲霉(Aspergillus niger)SPFJ05:湖北省食品发酵工程技术研究中心保藏。愈创木酚、正丁胺、正己胺、苄胺、正戊胺:上海阿拉丁生化科技股份有限公司;辣根过氧化物酶、尸胺、腐胺、精胺、亚精胺、酪胺、组胺、苯乙胺、色胺:美国Sigma Aldrich公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HUP系列超声细胞破碎仪:天津市恒奥科技发展有限公司;WFJ2000紫外可见分光光度计:上海尤尼柯仪器有限公司;LC-20A高效液相色谱仪:日本岛津公司;LS-100HJ灭菌锅:河南兄弟仪器设备有限公司。
1.3 试验方法
1.3.1 粗酶的酶学性质
黑曲霉培养、胺氧化酶诱导及粗酶提取:从黑曲霉斜面接种1~2环孢子到种子培养基(装液量50 mL/250 mL),30℃、180 r/min培养36 h进行活化。菌体生长培养条件:取体积分数1%种子液接种至发酵培养基,180 r/min培养36 h。诱导培养方法参照周小虎等[16]研究,诱导产酶培养条件:取体积分数1%发酵液接种至诱导培养基,30℃、180 r/min培养24 h。
取1 g的菌丝加入10 mL离心管中,加入5 mL磷酸钾缓冲液,进行冷冻超声破碎,超声功率为60%,间隔为2 s,时间5 min。得到的粗酶液10 000 r/min离心1 min,取上清液即得粗酶液,再用pH 7.0的磷酸钾定容,4℃保存待用。
胺氧化酶先作用于胺类生成相应的醛类、H2O2和氨,然后使用辣根过氧化物酶催化释放的H2O2产生氧气,使无色的愈创木酚氧化成红棕色的四邻甲氧基连酚。该产物在波长470 nm处有最大的光吸收,可通过测定ΔA470nm间接表示胺氧化酶的活力[17-18]。3 mL反应体系包括0.1 mol/L的磷酸盐缓冲液(pH7.0),0.2 mmol/L正丁胺,0.2 mg/mL辣根过氧化物酶,0.05 mol/L愈创木酚,100 μL稀释酶液。25℃条件下检测波长470 nm处的吸光度值变化(ΔA470nm)。以每分钟内A470nm变化0.01为1个酶活性单位(U)。相对酶活力以每组实验中所产酶活力最高为100%。
胺氧化酶粗酶最适温度:分别取5支试管加入等体积粗酶液,分别在20℃、25℃、30℃、35℃、40℃℃水浴锅的条件下反应10 min,分别测定其酶活。
胺氧化酶粗酶最适pH:配制pH值为5.5、6、6.5、7、7.5、8的磷酸钾缓冲液,分别加入等体积的粗酶液,反应10 min,分别测定其酶活。
胺氧化酶粗酶温度稳定性:取等体积处理好的粗酶液置于5支试管,分别放置在25℃、35℃、45℃、55℃、65℃恒温水浴锅中反应,每隔30 min测定残留酶活(以最高酶活为100%),共测定2 h。
胺氧化酶粗酶pH稳定性:等体积酶液分别与一定量的磷酸钾缓冲液(pH5.8~9.0范围内)混合,置于4℃条件下反应24 h,取出后在35℃条件下测定其残余酶活。
金属离子对胺氧化酶粗酶酶活的影响:用测定体系缓冲液配制10 mmol/L不同金属离子(NaCl、KCl、CaCl2、FeSO4、CuSO4)溶液,与酶液混合,形成1mmol/L、5mmol/L、10mmol/L浓度的金属离子,在30℃条件下反应30min,测定残余酶活。以不添加金属离子时的粗酶酶活为100%酶活。
酶抑制剂对胺氧化酶粗酶酶活的影响:用测定体系缓冲液配制不同浓度(0.2 mmol/L、0.4 mmol/L、1.0 mmol/L)的酶抑制剂(十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、巯基乙醇、二硫苏糖醇(DL-dithiothreitol,DTT))溶液,与等体积酶液混合,形成0.1 mol/L、0.2 mmol/L、0.5 mmol/L的酶抑制剂溶液,测定残余酶活,以不添加酶抑制剂时的粗酶酶活为100%酶活。
1.3.2 酶底物特异性
胺类溶液:用0.1 mol/L的HCl溶液分别配制正丁胺、正己胺、尸胺、腐胺、酪胺、组胺、苯乙胺、色胺、精胺、亚精胺、苄胺和正戊胺等12种胺类成100 μg/mL的溶液,4℃冷藏待用。
降解率计算公式如下:

1.3.3 对酱油样品中生物胺的检测
取2mL实验室自制酱油和市售酱油样品分别加入1mL粗酶液在35℃条件下反应30min,分别检测处理前(对照组)后(实验组)酱油中的生物胺含量,检测方法参考邹阳等[19]的方法并稍加修改,采用C18色谱柱(4.6mm×250mm×5μm),紫外检测波长254 nm,柱温为30℃,进样量20 μL。流动相A为甲醇,流动相B为水,梯度洗脱,流速为1.0 mL/min。
2 结果与分析
2.1 胺氧化酶粗酶的酶学性质
2.1.1 胺氧化酶的最适温度和温度稳定性
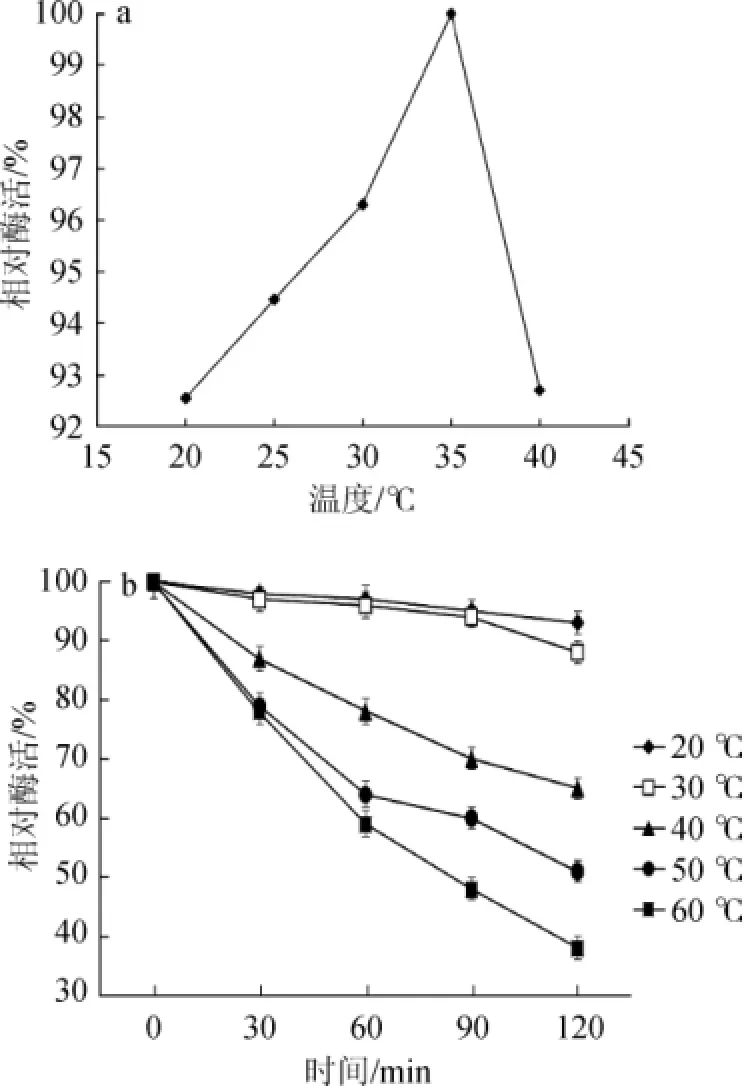
图1 胺氧化酶的最适温度(a)和温度的稳定性(b)Fig.1 The optimal temperature(a)and temperature stability(b)of amine oxidases
凡图1(a)可知,胺氧化酶的最适酶温度为35℃。在20~40℃时都保持较高活力(相对酶活81.6%以上),与肉中葡萄球菌、枯草芽孢杆菌胺氧化酶最适温度37℃相似[20]。
由图1(b)可知,该酶在20℃和30℃条件下有良好的稳定性,保温120 min后分别还有93%和88%的残余酶活。在40℃条件下,酶活受到影响,120 min后有65%的残余酶活;50℃和60℃温度条件下对酶活的影响较大,120 min后分别仅有51%和38%酶活。说明该酶在40℃下,热稳定性较好,50℃以上,热稳定较差。与报道的从A.niger中提取的胺氧化酶的温度稳定性基本一致[21]。
2.1.2 胺氧化酶的最适pH和pH稳定性
由图2(a)可知,胺氧化酶的最适pH值为7.0,过酸性或者过碱性都会导致胺氧化酶的酶活下降。这与报道[22-23]的从A.nigerAKU3302中提取的胺氧化酶最适pH值为7.5和从Micrococcus varians分离出的胺氧化酶最适pH在7~8是比较一致的,但是这两类胺氧化酶在pH值为6时都有强抑制作用,而本实验在pH值为6并没有表现强抑制性,这与实验结果有差异。
由图2(b)可知,该酶在pH 6.3~7.8范围内具有良好的pH稳定性(残余酶活在83%以上)。这与YAMADA B H等[24]从黑曲霉A.niger中提取的胺氧化酶在pH 6.0~7.0保持稳定结果较为一致。

图2 胺氧化酶的最适pH(a)和pH稳定性(b)Fig.2 The optimal pH(a)and pH stability(b)of amine oxidases
2.1.3 金属离子和酶抑制剂对胺氧化酶酶活的影响

图3 金属离子(a)和酶抑制剂(b)对胺氧化酶酶活的影响Fig.3 Effect of different metal ions(a)and enzyme inhibitors(b)on amine oxidases activity
由图3(a)可知,钠盐和钾盐对胺氧化酶酶活基本无影响,1 mmol/L的Cu2+对酶活有激活作用,但是当铜盐浓度升高,对酶活反而又有抑制作用。而铁盐和钙盐对其抑制作用比较明显。有文献报道[25]少量的Cu2+会使从葡萄球菌等提取出来的胺氧化酶酶活上升,与本实验结果一致。
由图3(b)可知,0.5 mmol/L EDTA、巯基乙醇已经能完全抑制胺氧化酶酶活,而EDTA在0.1 mmol/L时,抑制效果不明显,但当浓度越高抑制效果越明显,到0.5 mmol/L时,相对酶活只剩下34%。
2.2 底物特异性

图4 胺氧化酶对不同的胺类相对降解率的影响Fig.4 Effect of different amine oxidase on degradation rates of various amines
由图4所示,在实验的12种胺类中,添加的胺氧化酶粗酶液对正己胺的降解率是最好的(116%),对尸胺的降解率是最差的(16%)。而在发酵食品常见的八种生物胺中(尸胺,腐胺,酪胺,苯乙胺,组胺,色胺,精胺,亚精胺),酶学底物特异性与IVO F等[22,24]的研究中提到从黑曲霉中提取出的胺氧化酶底物特异性有较大差异,特别是腐胺,两篇文献中报道的胺氧化酶酶对腐胺的降解率都在<10%,而实验酶对腐胺的降解率达到了89%;文献中提取得到的酶对精胺与亚精胺无降解能力,实验酶降解能力分别达到了38%和45%;酪胺降解率(75%)较弱于文献报道(109%);苄胺的降解率相对较弱58%,文献中高达100%;其余几种生物胺降解能力与文献报道基本一致。
2.3 对酱油样品中生物胺的处理应用
由表1可知,实验室自制酱油含有色胺、酪胺、苯乙胺、腐胺等4种生物胺,其他都未检出。其中含量最多的为酪胺,为542.5 μg/kg,总生物胺为853.0 μg/mL。经过粗酶液处理后,腐胺和色胺未检出,而酪胺的降解率也到了80.78%,苯乙胺达到63.37%,总生物胺含量降低到185.1 μg/kg,总生物胺的降解率达到了78.29%。
国内某品牌酱油样品中测出了常见的8种生物胺,其种类与MOWER H F等[26-27]的报道一致,含量略有差别。其生物胺的种类和含量都高于实验室自制酱油。可能是在酱油工业化生产中,由于其生产工艺和开放式发酵体系等原因,容易污染产氨基酸脱羧酶的微生物,使其生物胺的含量增加。发现该市售酱油样品中腐胺、酪胺、组胺、苯乙胺是最主要的生物胺,总生物胺的含量达到了2 064 μg/kg。LU Y等[27]研究了40种酱油中的生物胺含量,发现的特征性生物胺有5种,其中97%的酱油中都有酪胺,其次是亚精胺、组胺、尸胺和精胺,这40种酱油中总生物胺含量在41.7~1357mg/L,这与本实验结果略有差别。可能由于酱油生产工艺和产地等差异,导致酱油中生物胺总类和含量都有较大差异。而BOVER-CID S等[28]研究报道酪胺主要是在发酵前期由肠球菌(Enterococcusfaecum)形成的。经过含有胺氧化酶粗酶液处理后,腐胺和色胺的降解率都达到了84%以上,酪胺和精胺的降解率都达到了73%以上,总生物胺的降解率达到了66.61%。
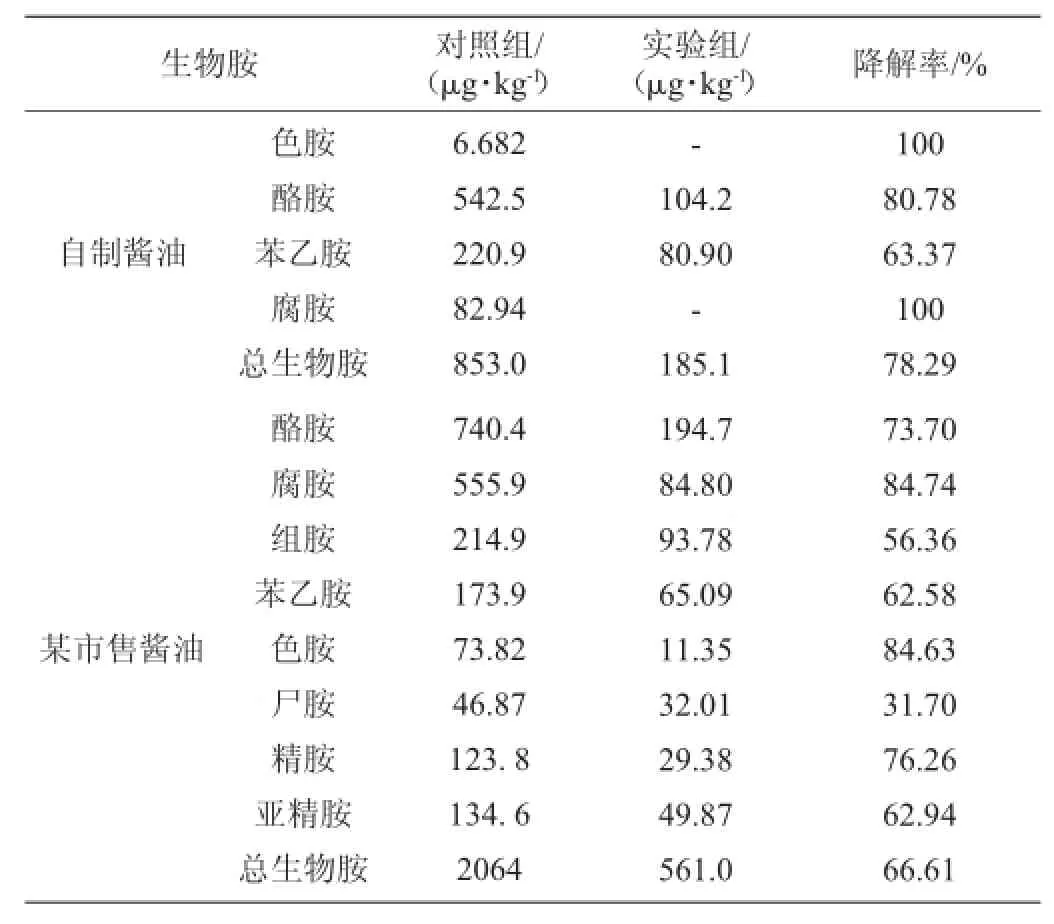
表1 自制酱油和市售酱油中的生物胺含量以及相对降解率Table 1 Biogenic amine contents and relative degradation rates of homemade soy sauce and commercial soy sauce
3 结论
经过一系列的实验得到黑曲霉SPFJ05胺氧化酶粗酶液的一些基本酶学特性:其粗酶最适反应温度为35℃;最适反应pH值为7.0并且1.0 mmol/L Cu2+对其酶活有激活作用,最佳底物为正己胺,常见的酶活抑制剂如EDTA都能抑制其酶活。在生物胺降解应用方面,本实验得到的粗酶液能够有效减少酱油中的生物胺含量,在自制酱油油中总生物胺的降解率达到78.29%,在市售酱油中,总生物胺的降解率达到69.50%,这说明用此方法降解酱油类等调味品中的生物胺的方案切实可行,能够有效降解酱油中的生物胺含量。
[1]SILLA SANTOS M H.Biogenic amines:their importance in foods[J].Int J Food Microbiol,1996,29(2-3):213-231.
[2]PREMONT R T,GAINETDINOV R R,CARON M G.Following the trace of elusive amines[J].Proc Natl Acad of Sci USA,2001,98(17): 9474-9475.
[3]MEDINA M A,URDIALES J L,RODRÍGUEZ-CASO C,et al.Biogenic amines and polyamines:similar biochemistry for different physiological missions and biomedical applications[J].Crit Rev Biochem Mol Biol, 2008,38(1):23-59.
[4]MARC L,ANISSA A,CHRISTOPHER V D,et al.Dopamine and serotonin transporters in patients with schizophrenia:An imaging study with [123I]β-CIT[J].Biol Psychiat,2000,47(5):371-379.
[5]SOUTHWICK S M,BREMNER J D,RASMUSSON A,et al.Role of norepinephrine in the pathophysiology and treatment of posttraumatic stress disorder[J].Biol Psy,1999,46(9):1192-1204.
[6]AYMERICH M T,GARRIGA M,MONFORT J M,et al.Bacteriocinproducing lactobacilli in Spanish-style fermented sausages:characterization of bacteriocins[J].Food Microbiol,2000,17(1):33-45.
[7]BOVERCID S,SCHOPPEN S,IZQUIERDO-PULIDO M,et al.Relationship between biogenic amine contents and the size of dry fermented sausages[J].Meat Sci,1999,51(4):305-311.
[8]LU Y,CHEN X,JIANG M,et al.Biogenic amines in Chinese soy sauce [J].Food Control,2009,20(6):593-597.
[9]NAILA A,FLINT S,FLETCHER GC,et al.Histamine degradation by diamine oxidase,LactobacillusandVergibacillus halodonitrificansNai18 [J].J Food Proc Techno,2012,3(6):1-4.
[10]TAPINGKAE W,TANASUPAWAT S,PARKIN KL,et al.Degradation of histamine by extremely halophilic archaea isolated from high salt-fermented fishery products[J].Enzyme Microb Technol,2010,46(2):92-99.
[11]DAPKEVICIUS M L N E,NOUT M J R,ROMBOUTS F M,et al.Biogenic amine formation and degradation by potential fish silage starter microorganisms[J].Int J Food Microbiol,2000,57(1-2):107-114.
[12]FADDA S,VIGNOLO G,OLIVER G.Tyramine degradation and tyramine/histamine production by lactic acid bacteria andKocuriastrains [J].Biotechnol Lett,2001,23(24):2015-2019.
[13]LEUSCHNER R G K,HAMMES W P.Tyramine degradation by micrococci during ripening of fermented sausage[J].Meat Sci,1998,49(3): 289-296.
[14]FAUSTO G,MARIA M,ANTONIETTA C M,et al.Use ofStaphylococcus xylosusas a starter culture in dried sausages:effect on the biogenic amine content[J].Meat Sci,2002,61(3):275-283.
[15]MATSUMURA K,HISADA H,OBATA H,et al.A novel amine oxidase-encoding gene fromAspergillus oryzae[J].J Biosc Bioeng,2004, 98(5):359-365.
[16]周小虎,朱霞,王磊,等.黑曲霉产胺氧化酶培养及诱导条件的优化[J].中国酿造,2016,35(6):96-100.
[17]MATSUMURA K,HISADA H,OBATA H,et al.A novel amine oxidase-encoding gene fromAspergillus oryzae[J].J Biosci Bioeng,2004, 98(5):359-365.
[18]徐芝勇,严群,强毅,等.大豆过氧化物酶纯化及酶学特性研究[J].中国粮油学报,2006,21(2):82-85.
[19]邹阳,赵谋明,赵海锋.高效液相色谱法同时测定酱油中的8种生物胺[J].现代食品科技,2012,28(5):570-573.
[20]LEE J I,KIM Y W.Enzymatic quantification of biogenic amines in foods using a bacterial monoamine oxidase[J].New Biotechnol,2012, 29:87.
[21]YAGODINA O V,NIKOL′SKAYA E B,KHOVANSKIKH A E,et al. Amino oxidases of microorganisms[J].J Evol Biochem Physiol,2002, 38(3):193.
[22]IVO F,HISANORI T,HIROKI I,et al.Two distinct quinoprotein amine oxidases are induced by n-Butylamine in the mycelia of Aspergillus niger AKU 3302[J].Eur J Biochem,1996,237(1):255-265.
[23]LEUSCHNER R G,HEIDEL M,HAMMES W P.Histamine and tyramine degradation by food fermenting microorganisms[J].Int J Food Microbiol,1998,39(1-2):1-10.
[24]LENOBEL R,SEBELA M,FREBORT I.Mapping the primary structure ofcopper/topaquinone-containingmethylamineoxidasefromAspergillus niger[J].Folia Microbiologica,2005,50(5):401.
[25]YAGODINA O V,NIKOL’SKAYA E B,SHEMAROVA I Y,et al. Amine oxidase in unicellular microorganismsMethanosarcina barkeri, andTetrahymena pyriformis[J].J Evol Biochem Physiol,2000,36(3): 244-248.
[26]MOWER H F,BHAGAVAN V.Tyramine content of Asian and Pacific foods determined by high performance liquid chromatography[J].Food Chem,1989,31:251-257.
[27]LU Y,CHEN X,JIANG M.Biogenic amines in Chinese soy sauce[J]. Food Control,2009,20:593-597.
[28]BOVER-CID S,IZQUIERDO-PULIDO M,VIDAL-CAROU M C.Influence of hygienic quality of raw materials on biogertic amine production during ripening and storage of dry fermented sausage[J].J Food Protect,2000,63:1544-1550.
Characterization of crude enzyme fromAspergillus nigeramine oxidase and study on its degradation of biogenic amines
Aspergillus nigerSPFJ05 as experimental strain was induced to produce amine oxidase.The cell of inducedA.nigerwas crushed and then the amine oxidase crude enzyme solution was obtained.The properties of crude enzyme were studied and the crude enzyme solution was used for the treatment of homemade soy sauce and commercial soy sauce.The experimental results showed that the optimum temperature of the crude enzyme solution was 35℃,the optimal pH was 7,and 1.0 mmol/L Cu2+had a stimulatory effect on enzyme activity.Ethylene diamine tetraacetie acid (EDTA)and mercapto ethanol had obvious inhibitory effect on enzyme activity;in the aspect of substrate specificity,the maximum degradation rate of n-hexylamine was 116%,the minimum degradation rate of cadaverine was 16%.The degradation rate of crude enzyme solution on total biogenic amines in homemade soy sauce reached 78.29%,and the degradation rate on total biogenic amines in commercial soy sauce reached 69.50%.A new method for the removal of biogenic amines in fermented soy sauce products was provided.
Aspergillus niger;biogenic amines;amine oxidase;soy sauce
Q55
0254-5071(2017)03-0121-05
10.11882/j.issn.0254-5071.2017.03.025
2016-09-19
湖北省自然基金(2015CFB679);湖北省科技厅项目(2015BCE028)
黄瑶(1994-),男,硕士研究生,研究方向为食品发酵。
*通讯作者:徐宁(1979-),男,副教授,博士,研究方向为发酵工程。
HUANG Yao1,ZHU Xia1,PENG Mingye1,FU Caixia2,ZHOU Mengzhou1,GAO Bing1,LI Dongsheng1,XU Ning1*
(1.Hubei Cooperative Innovation Center for Industrial Fermentation,Research Center of Food Fermentation Engineering and Technology of Hubei,Hubei University of Technology,Wuhan 430068,China;2.Hubei Tulaohan Flavouring and Food Co.,Ltd.,Yichang 443000,China)

