海洋肌酐水解酶菌株的筛选鉴定及其酶学性质研究
石群,张庆芳,杨丽娜,王晓辉,窦少华,迟乃玉*
海洋肌酐水解酶菌株的筛选鉴定及其酶学性质研究
石群1,2,张庆芳1,2,杨丽娜1,2,王晓辉1,2,窦少华1,2,迟乃玉1,2*
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116622)
从渤海海泥中筛选出一株肌酐水解酶高产菌株S-09,经形态学、生理生化特征并结合16S rDNA系统发育分析,鉴定菌株为微小杆菌属(Exiguobacteriumsp.)。对所产肌酐水解酶进行酶学性质研究表明,该酶的最适作用温度为30℃,热稳定性较差;最适作用pH值为7.5,碱性条件下,pH值稳定性较好;Co2+、Mn2+对酶的激活作用较强,Ag+、Hg2+对酶有显著的抑制作用。
海洋;肌酐水解酶;菌株筛选;鉴定;酶学性质
肌酐(creatinine)是一种低分子质量的含氮化合物,是肌酸代谢的终末产物[1]。它仅仅由肾小球排泄,不被肾小管重吸收,所以血清中肌酐浓度主要与肾小球滤过率相关,如果肌酐值超过707 μmol/L就被诊断为尿毒症,因而血清中的肌酐浓度是一项判断肾功能的重要指标[2-3]。目前肌酐的检测方法主要有化学法和酶促法[4]。化学方法专一性不强、敏感性差、易受样品干扰,而酶促法具有专一性强和灵敏度高等特点[5-6],因而备受国际临床化学联盟与我国临床检验中心重视并逐渐成为临床主要检测方法[7]。肌酐水解酶(creatininase)EC 3.5.2.10作为酶促检测法中的关键酶之一,其性能的好坏直接影响到测定系统的可靠性[8]。但是直到目前,我国仍没有自主研制的肌酐测定的工具酶,原酶生产技术不成熟及临床所用的检测试剂盒也主要依赖进口[9-10],并且鲜见从海洋中筛选产肌酐水解酶的菌株的相关报道和研究。为了推广酶促法检测肌酐,降低检测成本,为临床诊断提供可靠的依据,针对国内这个几乎空白的市场,本实验利用海洋这个巨大的资源筛选获得高产肌酐水解酶的菌株S-09,对其进行形态学、生理生化特征及16S rDNA序列分析,进而确定其种属并研究酶学性质,为研究海洋微生物发酵生产肌酐水解酶进而实现肌酐水解酶的国产化奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
试验菌株筛选自渤海海域(123°371′E,39°6972′N)海泥样品,经鉴定为微小杆菌属(Exiguobacteriumsp.),命名为S-09,现由辽宁省海洋微生物工程技术研究中心保藏。
1.1.2 培养基
初筛培养基:肌酐1%,酵母浸粉0.5%,琼脂2%,K2HPO40.2%,KH2PO40.05%,MgSO4·7H2O 0.01%,KCl 0.005%,水1 000 mL,pH 7.0,121℃灭菌20 min。
LB(Luria-Bertani)培养基[11]:胰蛋白胨1%,酵母浸粉0.5%,琼脂2%,NaCl 1%,水1 000 mL,pH 7.0,121℃灭菌20 min。
种子培养基:胰蛋白胨1%,酵母浸粉0.5%,NaCl 1%,水1 000 mL,pH 7.0,121℃灭菌20 min。
发酵培养基:肌酐0.5%,胰蛋白胨0.5%,K2HPO40.1%,KH2PO40.05%,MgSO4·7H2O0.05%,KCl0.05%,水1000mL,pH 7.0,121℃灭菌20 min。
1.1.3 试剂
蛋白Marker:加拿大Fermentas公司;肌酐、肌酸:大连凯美化工工程配套有限公司;苦味酸:生工生物工程(上海)股份有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
HZP-250全温振荡培养箱:上海精宏实验设备有限公司;CX21FS3显微镜:日本奥林巴斯有限公司;MLS-3750高压蒸汽灭菌器:日本三洋电机株式会社;SCIENTZ-ⅡD超声波细胞破碎机:宁波新芝生物科技股份有限公司;UV-H232可见紫外分光光度计:菲迪康乐(广州)科学仪器有限公司;DYY-6C电泳仪:北京市六一仪器厂。
1.3 方法
1.3.1 菌株初筛
取10 g海泥加入90 mL带有玻璃珠的无菌水中,振荡30 min。用无菌水从10-1依次梯度稀释至10-7,分别取10-4、10-5、10-6、10-7稀释度样品各0.1 mL,均匀涂布于初筛培养基上,25℃倒置培养。挑取能够在初筛培养基上生长的菌株,结合菌落形态与显微镜观察,纯化得到菌株于LB培养基,4℃保藏。
1.3.2 菌株复筛
将初筛获得的菌株接入种子培养基中在25℃、200r/min培养24 h,按5%的接种量转入相同种子培养基中,25℃、200r/min培养24h,按5%的接种量接种于初始发酵培养基,25℃、200 r/min培养24 h。通过测定发酵液肌酐水解酶活,筛选出肌酐水解酶活高的菌株作为目的菌株进行后续实验。
1.3.3 菌株鉴定
(1)细菌形态观察
在初筛培养基上观察菌落的形状、大小、颜色等形态学特征,通过革兰氏染色在光学显微镜(10×100)下观察菌体形态。
(2)菌株生理生化特征鉴定
根据《常见细菌系统鉴定手册》[12]进行生理生化试验。主要包括葡萄糖氧化发酵测定、氧化酶反应、接触酶反应、硝酸盐还原试验、产生吲哚试验、淀粉水解试验、糖、醇类发酵试验、脲酶试验、硫化氢产生、含碳化合物的利用、柠檬酸盐的利用。
(3)16S rDNA的PCR扩增和序列分析
采用Ezup柱式细菌基因组DNA抽提试剂盒提取菌株DNA。以提取到的菌株S-09 DNA为模板,以16S rDNA基因通用引物对16S rDNA序列片段进行聚合酶链反应(polymerase chain reaction,PCR)。其引物如下:正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)。扩增后交由生工生物工程(上海)股份有限公司进行测序,测序结果在GenBank中进行BLAST比对分析,根据分析结果对菌株S-09进行种属鉴定,利用MEGA软件构建系统发育树。
1.3.4 肌酐水解酶活测定方法[13-14]
取0.1 mL的酶液加入0.9 mL肌酸溶液中,37℃反应10 min后取出0.1 mL反应液加入1 mol/L NaOH和0.5%苦味酸(各1 mL)终止反应,加入0.9 mL蒸馏水,于25℃水浴锅水浴20 min后于波长520 nm处测吸光度值。肌酐水解酶活力定义:在上述反应条件下,每分钟催化1 μmol肌酐转变成产物所需要的酶量为一个酶活力单位(U)。
1.3.5 粗酶液的制备
将纯化后的菌株S-09接于发酵培养基中,培养36 h。发酵菌液于4℃、4000r/min离心30min得到菌体,用超纯水将菌体水洗2次,4℃、4000r/min离心30min。将离心得到的湿菌体用0.1 mol/L pH 7.5的磷酸缓冲液溶解。冰浴条件下用超声波细胞粉碎机裂菌(作用3s,间隔3s,120W,共10min)。低温(4℃)10 000 r/min离心10 min收集上清液即为肌酐水解酶粗酶液。
1.3.6 酶学性质的初步研究
(1)酶最适反应温度
取一定量酶液,分别在20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃条件下,测定肌酐水解酶酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(2)酶的热稳定性
将酶液分别置于30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃水浴中保存30 min立即冷却,并测定肌酐水解酶酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(3)酶最适作用pH
在酶最适作用温度下,分别在pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的磷酸盐缓冲液反应体系中测定肌酐水解酶酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(4)酶的pH稳定性
在pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的磷酸盐缓冲液中加入酶液,于25℃保温24 h,测定肌酐水解酶酶活,相对酶活计算以同组最高酶活为100%,每次做3组平行实验。
(5)不同化学物质对酶活性的影响
以不添加任何化学物质的发酵液为对照,在发酵液中加入不同化学物质,于25℃处理30 min,使ZnSO4·7H2O、FeSO4·7H2O、CoCl·6H2O、MnCl2·4H2O、CuSO4·5H2O、MgSO4·7H2O、CrCl2·6H2O、HgCl2、AgNO3终浓度均为1mmol/L,鳌合剂乙二胺四乙酸(ethylenediaminetetraaceticacid,EDTA)终浓度为20 mmol/L,表面活性剂Tween-20 0.1%及TtritonX-100 0.5%,测定肌酐水解酶活力,每次做3组平行实验。
2 结果与分析
2.1 菌株筛选及形态特征
对渤海海域海泥进行初筛和复筛,得到9株具有肌酐水解酶活性的菌株。从中获得一株高产肌酐水解酶菌株,该菌株发酵产酶稳定,命名为S-09。其菌落形态及革兰氏染色结果见图1。

图1 菌株S-09菌落形态及革兰氏染色结果Fig.1 Colonial morphology and gram staining results of strain S-09
由图1可知,该菌株在LB培养基25℃培养18~36 h,菌落呈淡橙色、圆形、平坦、不生孢、不透明,革兰氏染色呈阳性。菌株S-09幼龄细胞为杆状,常呈V形排列,老龄细胞呈球状。细胞培养过程中有明显的杆、球状周期变化。
2.2 生理生化鉴定结果
按照《常见细菌系统鉴定手册》(第8版)对菌株S-09进行生理生化试验,结果如表1所示。

表1 菌株S-09的生理生化特征Table 1 Physiological and biochemical characteristics of strain S-09
由表1可知,菌株S-09生理生化特征如下:好氧,氧化酶、脲酶试验呈阴性,过氧化氢酶、硝酸盐还原、接触酶均呈阳性。利用葡萄糖不产酸不产气,能利用多种含碳化合物如柠檬酸钠、乙酸钠等。能利用多种碳水化合物如D-果糖、甘露醇、葡萄糖、D-木糖。不能利用L-山梨糖和棉子糖。
2.3 16S rDNA序列分析与系统发育树的构建
菌株S-09经PCR扩增电泳,结果见图2。邻接(Neighbor-Joining,NJ)法进行系统发育树构建,结果见图3。

图2 菌株S-09的16S rDNA PCR扩增结果Fig.2 16S rDNA PCR amplification results of strain S-09
由图2可知,PCR扩增产物序列长度为1 516 bp。由图3可知,该菌株与Exiguobacteriumsp.9AN NR 114970.1同源性较高,相似度为99%,结合菌体形态特征和16S rDNA的序列系统发育树分析,确定该菌株属于微小杆菌属(Exiguobacteriumsp.)。
2.4酶学性质初步研究
2.4.1 酶作用的最适温度
由图4可知,肌酐水解酶最适作用温度为30℃。该酶在25~35℃低温环境下能保持较高水平的酶活,符合低温酶性质[15]。这对于缩短反应时间、降低开发成本具有重要意义。

图4 酶最适作用温度曲线Fig.4 Optimal temperature curve of creatininase
2.4.2 酶的热稳定性
将酶液在不同温度下处理30 min后测定酶活力,结果见图5。由图5可知,该酶在30~50℃处理30min后保持较高酶活且相对稳定。在60℃处理30 min后,相对酶活为70%;65℃处理30 min后,相对酶活仅为45%,说明该酶热稳定性较差。

图5 酶的热稳定性Fig.5 Thermostability of the creatininase
2.4.3 酶作用的最适pH及稳定性
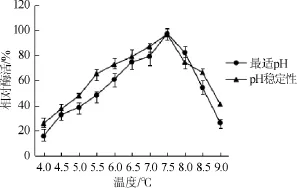
图6 酶的最适pH及其pH稳定性曲线Fig.6 Optimal pH and pH stability curve of creatininase
由图6可知,肌酐水解酶的最适作用pH值为7.5。在pH值>8.0时,相对酶活呈下降趋势;当pH值为7.0~8.0时,该酶的相对酶活能保存80%以上,说明该酶在偏碱性环境下稳定性较好。因此,选择pH 7.5作为最佳保藏的pH值。
2.4.4 不同化学物质对酶活性的影响
以不添加任何化学物质的发酵液为对照,在发酵液中加入不同化学物质,于25℃处理30 min,使ZnSO4·7H2O、FeSO4·7H2O、CoCl·6H2O、MnCl2·4H2O、CuSO4·5H2O、MgSO4·7H2O、CrCl2·6H2O、HgCl2、AgNO3终浓度均为1 mmol/L,鳌合剂EDTA终浓度为20 mmol/L,表面活性剂Tween-200.1%及TtritonX-1000.5%,测定肌酐水解酶活力,结果见表2。

表2 不同化学物质对酶活性的影响Table 2 Effect of different chemical substances on creatininase activity
由表2可知,Ag+、Hg2+几乎能使酶完全丧失失活;Co2+、Mn2+对酶的激活作用较强;Cr2+、EDTA、Triton X-100、表面活性剂Tween-20对酶有较弱的抑制作用;Cu2+、Zn2+、Fe2+、Mg2+对酶几乎无影响。
3 结论
本实验共从渤海海域的海泥中筛选出9株产肌酐水解酶的菌株,并选中一株酶活较高的菌株命名为S-09,对其进行形态学、生理生化特征、16S rDNA序列分析,鉴定菌株S-09为微小杆菌属。菌株S-09与国内外筛选的其他产肌酐水解酶的菌株相比[16],具有最适生长温度低(25℃)、高耐压能力(菌株筛选深度>100 m)、原始菌株产酶活力高等优点。菌株S-09作为一株产肌酐水解酶的新菌源,具有潜在的开发价值。对其所产的肌酐水解酶酶学性质进行初步研究,结果表明,该酶的最适作用温度为30℃;酶的最适作用pH值为7.5;酶的作用温度较低,属于低温酶类。海洋微生物发酵生产低温肌酐水解酶具有很大优势,肌酐水解酶在低温下具有高酶活力及高催化效率,在应用中能减少工艺流程可大大缩短处理时间并省却昂贵的加热或冷却费用[17-18]。海洋肌酐水解酶的研究,为实现我国自主研发的肌酐检测试剂盒并将其商品化拓宽了应用前景。后续关于该酶的分离纯化及工业发酵等试验还在进一步深入探究中。
[1]BURKE D G,MACLEAN P G,WALKER R A,et al.Analysis of creatine and creatinine in urine by capillary electrophoresis[J].J Chromatogr B, 1999,732(2):479-485.
[2]李萍,赵莹,余霆.肌酐在肾小球滤过功能损伤诊断中的价值的系统评价[J].中国循证医学杂志,2004,11(4):752-758.
[3]MATSUDA Y,WAKAMATSU N,INOUYE Y,et al.Purification and characterization of creatine amidinohydrolase ofAlcaligenes origin[J]. Chem Pharm Bull,1986,34(5):2155-2160.
[4]卢红波,马晓航.肌酸水解酶的研究及其应用[J].科技通报,2009,25(4):437-440.
[5]THIENPONT L M,VAN LANDUYT K G,STOCKL D,et al.Candidate reference method for determining serum creatinine by isocratic HPLC: Validation with isotope dilution gas chromatography-mass spectrometry andapplicationforaccuracyassessmentofroutinetest kits[J].Clin Chem, 1995,41(7):995-1003.
[6]石凌波,林龙顺.常见肌酐测定方法中存在的干扰[J].中华检验医学杂志,2001,24(2):102-104.
[7]ZHI Q,KONG P Y,HU C M.Biochemical and molecular characterization of a novel high activity creatine amidinohydrolase fromArthrobacter nicotianaestrain 02181[J].Process Biochem,2009,44(4):460-465.
[8]赵更峰,马晓航,贾小明,等.节杆菌肌酐水解酶的纯化及特性研究[J].生物工程学报,2005,21(2):250-253
[9]罗侃,崔有宏.诊断用酶的研究进展[J].西北国防医学杂志,2000,21(1):57-59.
[10]OGUSHIS,NAGAOK,EMIS,etal.SarcosineoxidasefromArthrobacter ureafaciens:Purification and some properties[J].Chem Pharm Bull, 1988,36(4):1445-1450.
[11]李载平.分子克隆实验指南(第3版)[J].科学通报,2002,47(24):1888.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-65.
[13]YADAV S,DEVI R,BHAR P,et al.Immobilization of creatininase, creatinase and sarcosine oxidase on iron oxide nanoparticles/chitosang-polyaniline modified Pt electrode for detection of creatinine[J]. Enzyme Microb Tech,2012,50(4-5):247-254.
[14]SONG L,DAI J,ZHEN K,et al.Production of novel NaN3-resistant creatine amidinohydrolase in recombinantEscherichia coli[J].Bioengineered,2015,6(4):248-250.
[15]王强,李旭,窦少华,等.海洋葡甘聚糖酶菌株的分离鉴定及酶学性质研究[J].中国酿造,2016,35(6):65-69.
[16]赵更峰.一株产肌酐水解酶菌株的分离及酶特性研究[D].杭州:浙江大学,2003.
[17]UEDA M,GOTO T,NAKAZAWA M,et al.A novel cold-adapted cellulase complex fromEisenia foetida:characterization of a multienzyme complex with carboxymethylcellulase,β-glucosidase β-1,3 glucanase, and β-xylosidase[J].Comp Biochem Phys Part B:Biochem Mol Biol, 2010,157(1):26-32.
[18]CAVICCHIOLI R,CHARLTON T,ERTAN H,et al.Biotechnological usesofenzymesfrompsychrophiles[J].Microb Biotech,2011,4(4):49-60.
Screening and identification of creatininase-producing strain from marine and its enzymatic properties
SHI Qun1,2,ZHANG Qingfang1,2,YANG Lina1,2,WANG Xiaohui1,2,DOU Shaohua1,2,CHI Naiyu1,2*
(1.School of Life Science and Biotechnology,Dalian University,Dalian 116622,China; 2.Liaoning Marine Microbial Engineering and Technology Center,Dalian 116622,China)
A high creatininase-producing strain S-09 was screened from the Bohai Sea mud,and identified asExiguobacteriumsp.by morphology, physiological and biochemical characteristics and 16S rDNA phylogenetic analysis.The research of enzymatic properties of creatininase showed that the optimal temperature was 30℃,the thermostability was weaker;the optimal pH was 7.5,pH stability was better in alkaline condition;the activation of Co2+and Mn2+on creatininase was stronger,the Ag+and Hg2+had significant inhibitory effect on creatininase.
marine;creatininase;strain screening;identification;enzymatic characteristics
Q93
0254-5071(2017)03-0019-05
10.11882/j.issn.0254-5071.2017.03.005
2017-02-08
国家高技术研究发展计划“863”计划项目(2007AA021306);辽宁省自然科学基金(NO.2050775)
石群(1990-),女,硕士研究生,研究方向为微生物与酶工程。
*通讯作者:迟乃玉(1965-),男,教授,博士,研究方向为微生物与酶工程。

