海洋枝顶孢霉BH0531发酵液杀线虫组分的分离及活性测定
刘晓霞,李娜,苗丽华,申佩娟,冯欣,2,孟庆恒,2*,孙建华,2
(1.天津师范大学生命科学学院,天津300387;2.天津市动植物抗性重点实验室,天津300387)
海洋枝顶孢霉BH0531发酵液杀线虫组分的分离及活性测定
刘晓霞1,李娜1,苗丽华1,申佩娟1,冯欣1,2,孟庆恒1,2*,孙建华1,2
(1.天津师范大学生命科学学院,天津300387;2.天津市动植物抗性重点实验室,天津300387)
实验采用生物活性跟踪法,通过超滤、Sephadex凝胶层析、离子交换树脂、硅胶板薄层层析,以及特异性鉴别染色等方法对海洋枝顶孢霉BH0531发酵液的杀线虫活性组分进行分级分离和初步的性质分析。结果表明,Sephadex凝胶柱层析(G-25,G-10)可有效分离获得杀线虫活性组分,3 d的线虫校正死亡率达98.33%;以正丁醇:水:无水乙醇=1∶1∶1(V/V)为展开剂的薄层层析,可将活性组分有效分离,Rf=0.31,斑点洗脱物的线虫校正死亡率达到94.00%;定性染色结果显示,茚三酮反应阳性,证实有α-氨基存在,茚三酮吡啶呈红色,显现出寡肽性质;双甲酮染色呈亮黄色,表明具有酮糖性质。结果表明,BH0531杀线虫活性代谢物应为含有酮糖基团的短肽类化合物。
海洋枝顶孢霉;杀线活性组分;活性跟踪;分离
植物寄生线虫是一类世界性分布的重要植物病原物,全球每年因植物线虫造成的经济损失高达千亿美元[1],已成为仅次于真菌病害的第二大植物病害[2],防控形势严峻。真菌杀线剂(具杀线活性的代谢产物)作为继杀线虫活菌剂(淡紫拟青霉活菌剂)之后的第二代生防制剂,已引起国际上的广泛重视[3]。而海洋真菌因其特殊的生境,秉承了代谢物种类和代谢途径的多样性,业已成为寻找新型杀线虫活性物质的的资源库。已有来自海洋的真菌Lachnumpapyraceum(Karst.)产生的异香豆素(isocoumarin)的卤化衍生物被证实具有明显的杀线虫活性[4];澳大利亚学者从南澳大利亚海筛选出两株具有杀线虫活性的海洋真菌Aspergilluscaneus和Raspailiasp.[5]。肖永堂等[6]对188株海洋真菌代谢物进行了杀线虫毒力测定,并观察到一株海洋真菌的代谢物对小杆线虫有作用,推测该菌株代谢物作用机理可能与伊维菌素类似,是一种神经毒剂。郭道森等[7]先后从青岛近海分离得到了具有杀线活性的轮枝孢霉(Verticilliumsp.)和青霉(Penicilliumsp.)。这些研究进展显示,从海洋真菌中筛选杀线虫活性代谢物已成为可能。
海洋枝顶孢霉BH0531是一株从渤海水域自主分离得到的具有明确杀线虫活性的丝状真菌,其杀线活性与代谢产物密切相关[8]。进一步的黄瓜盆栽实验结果证实,该菌所产生的活性代谢物对南方根结线虫(Meloidogyneincognita)同样有明确的杀线活性,并使根结指数明显降低,同时还具有改善土壤微生态环境的作用[9];研究还发现,发酵液对染病植株的生长及保护酶具有促进作用[10],而对线虫体内保护酶则呈现出抑制作用[11]。活性物还具有分子质量小、水溶性好、耐热和pH适应范围宽的特点[8]。为进一步明确其活性组分的理化特性,阐明相关物质与杀线虫功能的关系,实验采用生物活性跟踪法,以松材线虫为靶标线虫,对杀线虫活性组分进行了初步的分离纯化和杀线活性测定,旨在为菌株BH0531的进一步开发应用提供实验依据。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
海洋枝顶孢霉(Acremoniumsp.)BH0531,菌种保藏号CGMCC-5445:由天津师范大学生命科学学院微生物实验室提供。
1.1.2 供试线虫
松材线虫(Bursaphelenchus xylophilus):中国农科院植保所提供。
1.1.3 供试培养基
活化培养基(马铃薯葡萄糖琼脂培养基(potatodextrose agar,PDA)):去皮土豆200 g/L煮汁,葡萄糖20 g/L,琼脂15 g/L,pH自然。121℃、0.1 MPa灭菌20min。
发酵培养基:去皮土豆200 g/L(浸汁),葡萄糖20 g/L,pH自然。121℃、0.1 MPa灭菌20 min。
1.1.4 供试药品
葡聚糖凝胶Sephadex G-25、G-10:北京索莱宝科技有限公司;离子交换树脂:南开大学化工厂;水合茚三酮:天津市光复科技发展有限公司;双甲酮(98%):北京百灵威科技有限公司;正丁醇、吡啶、甲醛(均为分析纯):天津市北方天医化学试剂厂;HSGF245薄层层析硅胶板:烟台市黄务硅胶开发试验厂。
1.2 仪器与设备
Centrifuge 5810R型冷冻离心机:德国Eppendorf AG公司;SPX-250B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂;GZX-9140MBE型数显鼓风干燥箱:上海博迅实业有限公司医疗设备厂;BSZ-100型自动部分收集器:上海沪西分析仪器厂;TP10-20型超滤泵、MT系列UEOS-503中空纤维膜组件(50 mm×386 mm,截留分子质量6 ku):天津天膜工程技术有限公司;UV-2550型紫外可见分光光度仪:美国Varian公司;DME/MVC2000型显微镜:德国徕卡公司;凝胶柱层析(0.5 cm×40 cm):上海华美实验仪器厂;96孔板:美国Costar公司;无菌式针头过滤器(0.22 μm孔径):德国Sartorius公司。
1.3 试验方法
1.3.1 发酵液小分子粗提物的制备
将4℃保藏的海洋枝顶孢霉BH0531菌种接入活化培养基(PDA),26℃条件下生化培养箱静置培养7 d活化。加入无菌水洗下孢子,制备成106个/mL的孢子悬液,以1%的接种量将孢子悬液接入装有50 mL发酵培养基的250 mL三角瓶中,26℃、120 r/min培养4 d[12]。将发酵好的发酵液8 000 r/min离心30 min除菌体,再经孔径0.22 μm微孔滤膜过滤,即为发酵大分子滤液。采用截留分子质量为6 000 u的中空纤维膜组件对发酵滤液进行超滤。超滤后滤液置于真空干燥箱内,抽真空710 MPa,50~60℃进行干燥。
1.3.2 代谢物分级分离及杀线虫活性
Sephadex G-25凝胶柱层析:取1.48 g萃取后真空干燥浓缩的发酵液干物质溶于10 mL无菌水中,经过孔径为0.22 μm的微孔滤膜过滤后,上样量为1 mL,超纯水做洗脱剂。通过恒流泵控制流速1mL/管,用自动收集器收集30管。共收集10次,收得总液体300 mL,平均每个组分10 mL。将分离收集得到的分离活性物的每个组分的10 mL液体浓缩为2.5 mL,分别检测杀线虫活性。Sephadex G-10凝胶柱层析:将经过Sephadex G-25凝胶柱有活性管合并,过G-10凝胶柱收集(同上G-25),做杀线活性检验。
1.3.3 分离物性质及活性分析
溶解性质采用水饱和乙酸乙酯萃取法,将分离物萃取3次后收集酯相和水相,分别检测杀线活性,以判断活性代谢物的溶解性质。萃取后有活性相,分别采用001×7型阳离子交换树脂和201×7型阴离子交换树脂分离活性组分,并通过杀线活性分析判断带电荷情况。装柱高2/3、平衡、上样量1 mL、超纯水洗脱。
1.3.4 活性组分的薄层分离及初步定性分析
以正丁醇∶水∶无水乙醇(1∶1∶1,V/V)的比例作为展开剂,在10cm×5cm的硅胶板下端1cm处点样,点样间距为1.5cm,密闭式展开,展开方式为上行展开,展开时间为90 min。用茚三酮溶液(0.2 g本品溶于100 mL无水乙醇)喷板,于110℃烘箱内烘烤30 min显色检验α-氨基酸[13];用1%茚三酮吡啶溶液与冰醋酸按5∶1混合,喷板后于100℃加热5 min显色检验二肽或三肽短肽类物质;用双甲酮溶液(10 g双甲酮溶于90 mL乙醇与10 mL 85%磷酸中)显色,喷板后于110℃加热15~20 min检验酮糖[14]。根据显色的Rf值将斑点溶解做杀线活性检验。斑点洗脱物进一步在波长200~600 nm范围内进行紫外全波长扫描,并以超纯水作空白校准基线,用以判定紫外吸收特性。
1.3.5 杀线虫活性(杀线率)的测定方法
以无菌水为对照组,松材线虫为靶标线虫,取无菌96孔板,每孔加入100 μL的靶标悬虫液(约100头),再将收集的分离液分别取100 μL等体积加入。设3组重复,26℃培养箱中培养3 d于显微镜下观测靶标线虫的死亡情况,线虫校正死亡率的公式为:

2 结果与分析
2.1 分级分离物及杀线虫活性
超滤获得的菌株BH0531发酵液粗提物进一步经Sephadex G-25凝胶柱层析分离,分离结果如表1所示。

表1 菌株BH0531发酵液G-25凝胶柱层析分离的各组分线虫存活率(3 d)Table 1 Mortality for each component of BH0531 fermentation broth by G-25 gel chromatography on nematodes(3 d)
从表1可以看出,杀线活性组分主要集中在13~25管收集物(杀线率≥60%),达到A级(杀线率≥90%)的有5管,其中杀线率≥95%的主要集中在14~17管,处于分离过程的中段区域。另有5管(18~21、24管)达到B级(杀线率≥80%),主要出现在分离过程的后段。这一现象表明,活性组分为Sephadex G-25分离范围内的分子质量相对较小的组分。先行收集的相对分子质量较大的组分未表现出明显的杀线活性(杀线率≤40%)。在此基础上,将G-25凝胶柱分离收集的有活性管合并,进一步进行了分离范围更小的Sephadex G-10凝胶柱分离检验,结果显示,G-10凝胶柱的分离物3 d的线虫死亡率为88.72%,校正死亡率达到88.20%,接近A级。提示活性物质的分子质量介于G-25分离范围的下限和G-10的上限之间。
2.2 分离物性质及活性分析
为进一步判别活性组分的理化性质,实验采用水饱和乙酸乙酯萃取和离子交换的方法对分离物进行了进一步的分离和活性检验,结果见表2。
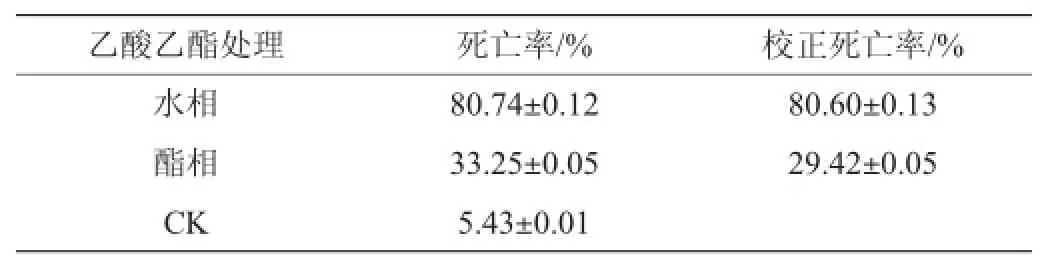
表2 菌株BH0531发酵液不同萃取相的杀线虫活性(3 d)Table 2 Nematicidal activity of different extraction phases of BH0531 fermentation broth(3 d)
由表2可知,分离物的杀线虫活性主要出现在水相组分,校正死亡率达到B级,而酯相杀线活性较弱,表明杀线虫活性组分为具有一定极性的水溶性物质。
用处理好的001×7型阳离子交换树脂、201×7型阴离子交换树脂洗脱分离物见表3。

表3 菌株BH0531发酵液水相萃取物离子交换树脂的杀线虫活性(3 d)Table 3 Nematicidal activity of aqueous phase of BH0531 fermentation broth by different anion-exchange resins(3 d)
由表3可知,经过阳离子交换并洗脱后杀线虫校正死亡率达91.24%,而201×7型阴离子树脂交换后,因结合牢固而未能将活性组分洗脱下来。表明海洋枝顶孢霉BH0531杀线虫活性物质含有较强的正电荷。
2.3 分离物属性的定性分析
对G25凝胶柱分离的菌株BH0531杀线活性物进行了进一步的硅胶板薄层层析色谱分离,紫外观察可见到明显的分离物显色斑点(图1A),茚三酮乙醇溶液染色呈阳性(图1B),表明分离物含α-氨基,印证了前期研究提出的活性物可能为含氮糖类的推测[12]。随后的茚三酮吡啶溶液染色可见红色显色斑点(Rf3=0.31),提示该组分应为二肽或三肽(图1C)。双甲酮溶液染色可见到亮黄色斑点组分(Rf4=0.31),表明含有酮糖基团(图1D)。紫外-可见光全波长扫描结果显示(图2),在波长217.5 nm处有单一较大吸收峰(Abs=3.704),表明活性组分存在n→π*、π→π*跃迁的吸收带,提示有C=O,N=O等基团[15]。依据Rf对未染色的相应组分进行洗脱并进行杀线活性检验的结果表明,3 d的线虫校正死亡率为94.32%,证实该组分即为杀线虫活性组分。
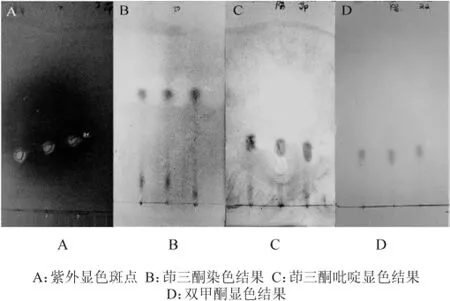
图1 分离物硅胶板薄层层析色谱分离及显色结果Fig.1 Isolation and chromogenic results of silica gel plate by thin layer chromatography

图2 分离物紫外可见全波长扫描结果Fig.2 Scanning results of ultraviolet visible wavelength of the separated products
3 结论
上述研究结果表明,采用杀线虫活性跟踪检测的方法,经6 000 u超滤、Sephadex G-25、G-10凝胶柱层析等分级分离方法可有效获得海洋枝顶孢霉BH0531杀线虫活性组分,活性物杀线虫校正死亡率最高可达98.33%。进一步的水饱和乙酸乙酯萃取法萃取、离子交换结果证实该活性组分为带正电的水溶性物质。硅胶板薄层层析可进一步分离、并纯化获得该组分。定性分析结果表明,杀线虫活性组分应为含有酮糖基团的短肽类物质。这类物质的生物活性在其他领域已有研究报道,如MALMSTRM J等[17]在裸孢壳菌Emericella variecolor代谢物中发现三种聚酮varitriol,varioxirane,dihydroterrein具有抗菌作用;CHEN Z M等[18]在海洋真菌枝顶孢霉SCSIO 115的发酵液中分离了对肿瘤细胞具有毒性的三种新环肽。但在杀线虫活性的研究中的有相关报道还不多见,其具体化学结构和杀线虫作用的机理还有待进一步的深入研究。
[1]CHITWOOD D J.Research on plant-parasitic nematode biology conducted by the United States department of agriculture-agricultural research service[J].Pest Manag Sci,2003,59(6-7):748-753.
[2]路雪君.根结线虫的生物防治研究进展[J].中国农业科技导报,2010,12(4):44-48.
[3]ANASTASIADIS I A,GIANNAKOU I O,PROPHETOU-ATHANASIADOU D A.et al.The combined effect of the application of a biocontrol agentPaecilomyces lilacinus,with various practices for the control of root-knot nematodes[J].Crop Protect,2008,27(3-5):352-361.
[4]STADLER M,ANKE H,STERNER O.New metabolites with nematicidal and antimicrobial activities from the ascomyceteLachnum papyraceum (Karst.)Karst.VII.structure determination of brominated lachnumon and mycorrhizin A derivatives[J].Cheminform,1995,26(42):149-153.
[5]WEST L M.Two new clerodane diterpenes from the New Zealand marine spongeRaspailiasp.[J].Aust J Chem,1998,51(12):1097-1101.
[6]肖永堂,郑忠辉,黄耀坚,等.海洋真菌杀虫活性的初步研究[J].厦门大学学报:自然科学版,2005,44(6):847-850.
[7]李子,周长景,陈聪聪,等.杀松材线虫海洋真菌的鉴定及培养条件研究[J].青岛大学学报,2015,30(2):102-107.
[8]MENG Q H,SHI X X.Isolation of anAcremoniumsp.From a screening of 52 seawater fungal isolates and preliminary characterization of its growth conditions and nematicidal activity[J].Biotechnol Lett,2012,34 (10):1847-1850.
[9]黄敏,刘晓霞,申佩娟,等.海洋枝顶孢霉BH0531对黄瓜根结线虫防治的微生态效应[J].中国酿造,2016,35(3):52-56.
[10]杜海霞,蒙春蕾,王勇勇,等.海洋枝顶孢霉BH0531代谢物对松材线虫形态和酶活的影响[J].中国酿造,2014,33(6):23-26.
[11]蔡爽,申佩娟,刘晓霞,等.海洋真菌BH0531对黄瓜促生长作用的研究[J].中国酿造,2016,35(3):27-31.
[12]史晓讯.丝状海洋真菌杀线虫代谢物的性质及发酵条件研究[D].天津:天津师范大学,2010.
[13]杨远帆,倪辉,吴黎明.茚三酮法测定蜂蜜及果葡糖浆中的氨基酸含量[J].中国食品学报,2013,13(2):171-176.
[14]张维杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987:37-45.
[15]常建华,董绮功.波普原理及解析[M].北京:科学出版社,2005:26-31.
[16]王勇勇,蒙春蕾,蔡爽,等.抗白色念珠菌海洋真菌的筛选及抑菌活性初探[J].中国酿造,2015,34(2):55-59.
[17]MALMSTRM J,CHRISTOPHERSEN C,BARRERO A F,et al.Bioactive metabolites from a marine-derived strain of the fungusEmericella variecolor[J].J Nat Prod,2002,65(3):364-367.
[18]CHEN Z M,SONG Y X,CHEN Y C,et al.Cyclic heptapeptides,cordyheptapeptides C-E,from the marine-derived fungusAcremonium persicinumSCSIO 115 and their cytotoxic activities[J].J Nat Prod,2012, 75(6):1215-1219.
Separation and activity determination of nematicidal components from marine-derived Acremoniumsp.BH0531 fermentation broth
LIU Xiaoxia1,LI Na1,MIAO Lihua1,SHEN Peijuan1,FENG Xin1,2,MENG Qingheng1,2*,SUN Jianhua1,2
(1.College of Life Science,Tianjin Normal University,Tianjin 300387,China;2.Tianjin Key Laboratory of Animal and Plant Resistance, Tianjin 300387,China)
The nematicidal active components from marine-derivedAcremoniumsp.BH0531 fermentation broth were fractionated and preliminarily identified through the methods of ultra-filtration,Sephadex gel chromatography,anion-exchange resin,thin layer chromatography(TLC),as well as specific differential staining under the guidance of bio-active assay.The results showed that the nematicidal active components were separated and purified effectively by Sephadex G-25 and Sephadex G-10 gel chromatography,the adjusted mortality of the nematodes at 3 d was up to 98.33%.The TLC results indicated that the active components can be effectively separated using 1-butanol,H2O,anhydrous ethanol(1∶1∶1)(V/V)as developing solvent,Rf=0.31.The spot of silica gel plate,which adjusted mortality of the nematodes was 94.00%.The qualitative staining results indicated that the inhydrin color reaction was positive,which proved the presence of α-amino group.The inhydrin pyridine color reaction was red,showing oligopeptide properties.The dimedone staining was bright yellow,showing the properties of ketose.These results suggested that the marine-derived fungusAcremoniumsp.BH0531 fermentation broth with nematicidal activity should contain oligopeptides compounds with ketose groups.
marine-derivedAcremoniumsp.;nematicidal active components;activity tracking;separation
Q939.9
0254-5071(2017)03-0035-04
10.11882/j.issn.0254-5071.2017.03.008
2017-01-01
国家自然科学基金资助项目(31272019);天津市自然基金联合项目(15JCYBJC51400)
刘晓霞(1992-),女,硕士研究生,研究方向为微生物的活性物质。
*通讯作者:孟庆恒(1963-),副教授,硕士,研究方向为应用微生物。

