不同介质中丹参酮ⅡA的纳米囊体外释放度研究
刘翔宇,余晓莉
1.湖北民族学院医学院(湖北 恩施 445000) 2.华中科技大学同济医学院附属武汉市儿童医院(武汉市妇幼保健院)(湖北 武汉 440000)
不同介质中丹参酮ⅡA的纳米囊体外释放度研究
刘翔宇1,余晓莉2*
1.湖北民族学院医学院(湖北 恩施 445000) 2.华中科技大学同济医学院附属武汉市儿童医院(武汉市妇幼保健院)(湖北 武汉 440000)
目的 制备丹参酮ⅡA纳米囊,比较其与原料药在溶出度试验条件下的4种溶出介质中的体外释放规律。方法 应用透析膜,小杯法,四种溶质中不同时间点测定丹参酮ⅡA的累积浓度, DDSolver软件进行相关拟合分析。结果 在四种溶质中丹参酮ⅡA纳米囊释放度与原料药相比存在显著性差异,释放时间延长,拟合分析显示丹参酮ⅡA溶出曲线更符合威布尔分布模型, 60 h内丹参酮ⅡA纳米囊释药量≥84.6%。结论 丹参酮ⅡA纳米囊比原料药明显释放缓慢,有利于药物吸收。
丹参酮ⅡA纳米囊;体外释放度;DDSolver软件
丹参酮ⅡA作为一种小分子脂溶性药物,半衰期短,约为1~2 h,胃肠道停留时间短,导致口服吸收率低,限制了药物的生物利用度。纳米囊制剂可延长释放时间,提高生物利用度。测定体外释放度的方法有转篮法、桨法、往复筒法、流通池法等[1]。本实验运用小杯法[2]比较丹参酮ⅡA纳米囊[3]和原料药,在溶出度试验条件的4种溶出介质[4][1%十二烷基硫酸钠助溶[5](SDS)]中的释放度差异,观察纳米囊体外释放规律。
1 仪器与试药
1.1 仪器 分析天平(梅特勒)高效液相色谱仪(岛津 I sersie);色谱工作站(第三军医大学);透析袋,分子量3 500(Spectrum美国光谱);RCZ-6B3智能溶出仪(上海圣科仪器有限公司)。
1.2 试剂 纯水(怡宝水),色谱甲醇(sigma),冰乙酸(杭州邦易化工有限公司),SDS(sigma),丹参酮ⅡA(shanghai sunny biotech Co.Ltd),壳聚糖(西安瑞盈生物科技有限公司),无水乙醇(MERCK)。
2 方法与结果
2.1 丹参酮ⅡA含量测定
2.1.1 色谱条件与系统适应性 高效液相色谱(HPLC)柱为Thermo Fisher C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水(85∶15)(V/V);波长270 nm;柱温室温;流速0.8 mL/min;进样量20 μL,理论塔板数≥4 000,丹参酮ⅡA保留16.5 min,见图1。
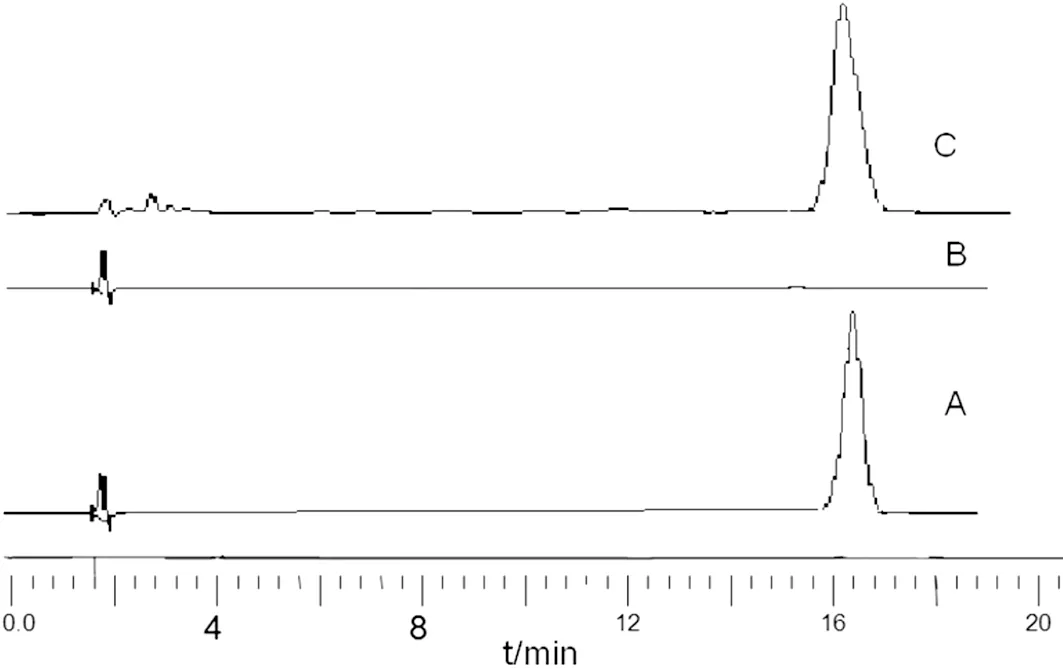
A:丹参酮ⅡA标准品图;B:空白纳米囊图;C:丹参酮ⅡA纳米囊
2.1.2 标准品配制和标准曲线绘制 丹参酮ⅡA定量准确称取2.5 mg,溶于5 mL甲醇,终浓度500 μg/mL。准确量取500 μg/mL丹参酮ⅡA溶液5,15,25,50,500 μL,甲醇定容至5 mL,制成终浓度分别为0.5,1.5,2.5,5,50 μg/mL的标准溶液。按上述色谱条件进样,制作浓度标准曲线Y=45 525 734.6X+5 540.597 24(r=0.999 8),线性范围0.5~50 μg/mL。
2.1.3 供试品溶液的制备 称取纳米囊后溶于5 mL甲醇,探头超声,甲醇定容至10 mL,滤膜过滤备用(孔径0.22 μm)。
2.1.4 精密度和稳定性试验 取50 μg/mL丹参酮ⅡA标准液按上述色谱条件连续测定5次峰面积,求浓度,RSD为0.81%;取50 μg/mL丹参酮ⅡA标准液分别在0,2,4,6,8,10,12 h进样,以锋面积求浓度,RSD为1.01%。
2.1.5 回收率试验 取同一批丹参酮ⅡA纳米囊供试品溶液3份,分别加入100、300、500 μL体积的标准品溶液混匀,微孔滤膜过滤,按上述色谱条件连续测定3次,浓度回收率均在 98%~102%之间。
2.1.6 专属性实验 分别量取丹参酮ⅡA对照品甲醇溶液、丹参酮 ⅡA纳米囊供试品溶液、空白纳米囊甲醇溶液上述色谱条件测定,考察方法的专属性。由色谱图可见,丹参酮ⅡA纳米囊样品主峰与对照品具有一致的保留时间,即辅料不干扰测定。
2.2 体外释放
2.2.1 溶出介质及不同溶出介质饱和溶解度、透析袋处理 溶出介质①水+1% SDS;②pH6.8磷酸盐缓冲液+1% SDS;③pH4.0醋酸盐缓冲液+1% SDS;④pH1.2稀盐酸+1% SDS,不同溶出介质的饱和溶解度见表1。透析袋预处理:将透析袋剪成8 cm左右,在2 L透析袋处理液中将透析袋煮沸10 min(透析袋处理液:1 mmol/L乙二胺四乙酸二钠(EDTA)(pH8.0)、2%碳酸氢钠)。蒸馏水将透析袋洗干净,然后将透析袋放在1 mmol/L乙二胺四乙酸二钠(pH8.0)的溶液中煮沸10 min,待自然冷却,再将透析袋浸泡在4℃的EDTA 溶液中备用,透析袋需使用时应提前用去离子水彻底洗净[6]。

表1 丹参酮ⅡA原料药在不同溶剂中饱和溶液中的浓度
2.2.2 溶出度测定 采用小杯法测定,精密称取丹参酮ⅡA和丹参酮ⅡA纳米囊(以丹参酮 ⅡA计),加经脱气预热的适量溶出介质体积溶解,倒入透析袋中,扎紧透析袋,固定到桨上,置于脱气的溶出介质200 mL的溶出瓶中,转速100 r/min,温度 (37±0.5)℃。原料药组在5,15,30,45 min,1,2,3,5 h取样4 mL,滤膜过滤孔径0.45 μm,每次取样后补足同体积同温度的脱气溶出介质,HPLC测定峰面积,计算不同溶剂中原料药的累积溶出百分率。丹参酮ⅡA纳米囊组在5,15,30,45 min,1,2,3,5,7,9,11,24,36,48,60 h取样4 mL,滤膜过滤(孔径0.45 μm),每次取样后补同体积同脱气温度的溶出介质,高校液相色谱测定峰面积,计算丹参酮ⅡA累积溶出的百分数,见表2。

表2 丹参酮ⅡA原料药、丹参酮ⅡA纳米囊的累积释药百分数/%
续表2:
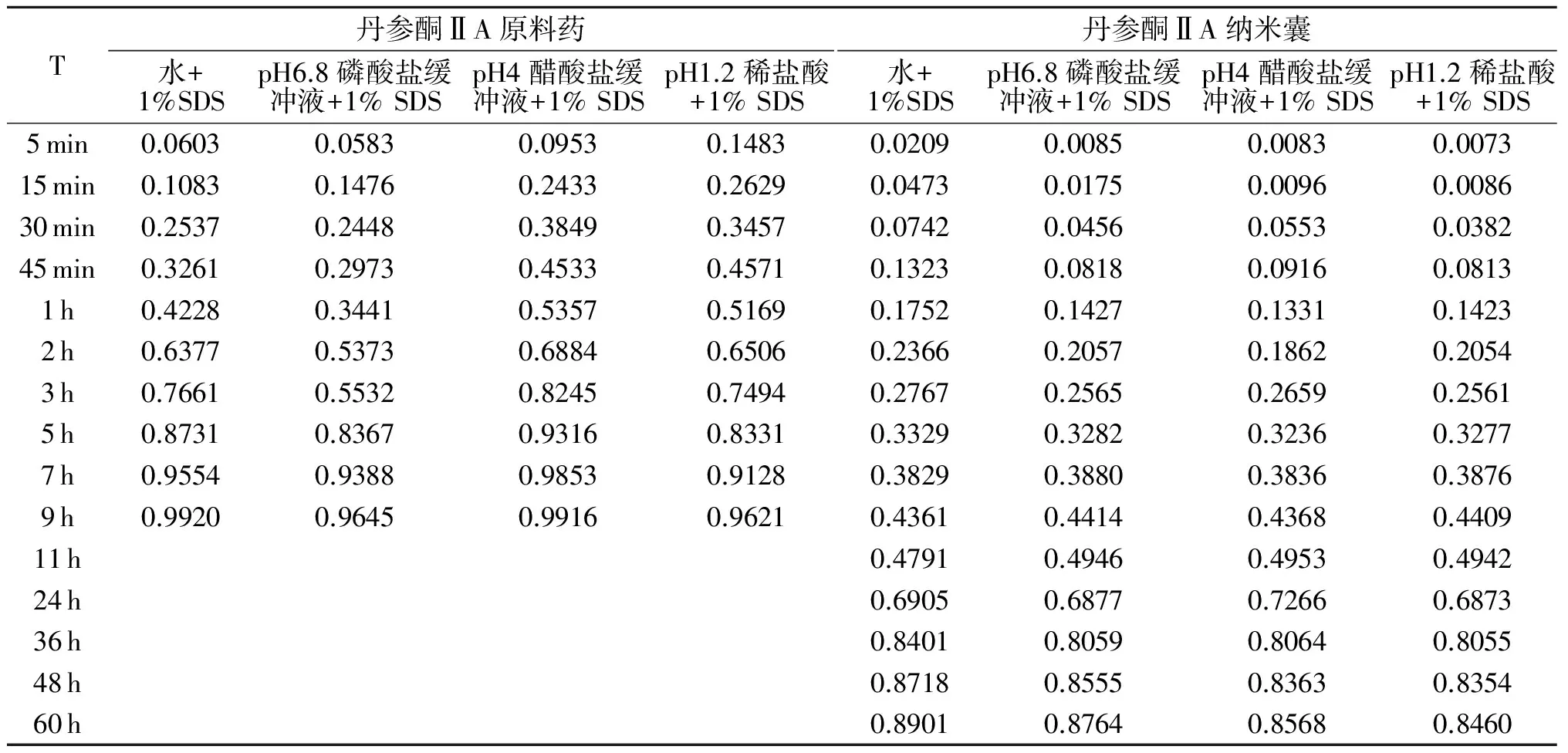
T丹参酮ⅡA原料药水+1%SDSpH6.8磷酸盐缓冲液+1%SDSpH4醋酸盐缓冲液+1%SDSpH1.2稀盐酸+1%SDS丹参酮ⅡA纳米囊水+1%SDSpH6.8磷酸盐缓冲液+1%SDSpH4醋酸盐缓冲液+1%SDSpH1.2稀盐酸+1%SDS5min0.06030.05830.09530.14830.02090.00850.00830.007315min0.10830.14760.24330.26290.04730.01750.00960.008630min0.25370.24480.38490.34570.07420.04560.05530.038245min0.32610.29730.45330.45710.13230.08180.09160.08131h0.42280.34410.53570.51690.17520.14270.13310.14232h0.63770.53730.68840.65060.23660.20570.18620.20543h0.76610.55320.82450.74940.27670.25650.26590.25615h0.87310.83670.93160.83310.33290.32820.32360.32777h0.95540.93880.98530.91280.38290.38800.38360.38769h0.99200.96450.99160.96210.43610.44140.43680.440911h0.47910.49460.49530.494224h0.69050.68770.72660.687336h0.84010.80590.80640.805548h0.87180.85550.83630.835460h0.89010.87640.85680.8460
2.2.3 溶出曲线数学方程拟合和溶出参数计算 采用DDSolver[7]拟合,见表3。
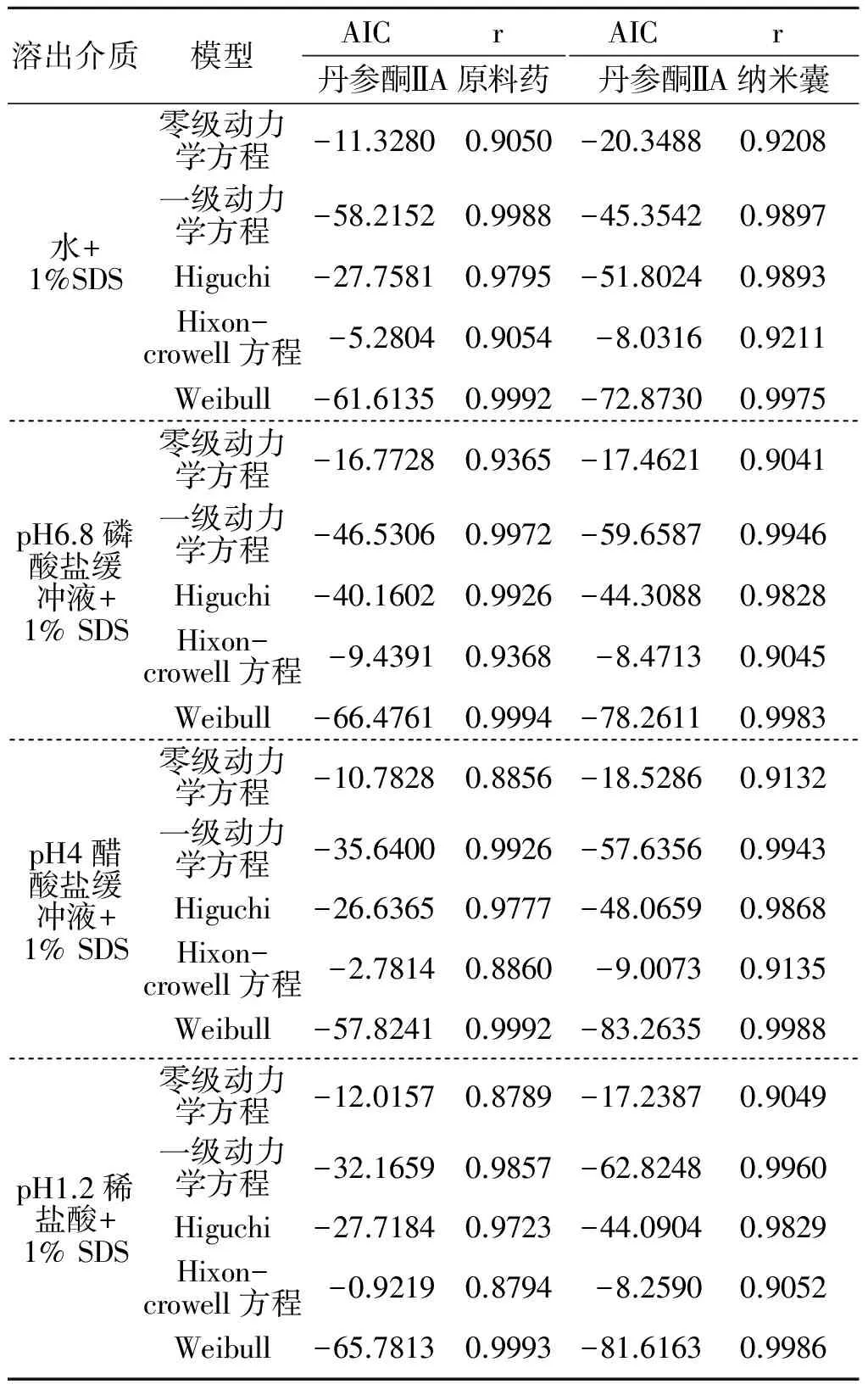
表3 丹参酮ⅡA原料药、丹参酮ⅡA纳米囊体外释放药物累积释药分数的拟合结果
从拟合结果看出,丹参酮ⅡA溶出曲线更符合威布尔分布模型,因此选择威布尔分布模型进行丹参酮ⅡA溶出参数Td(溶出63.2%所需时间)的计算,见表4。

表4 丹参酮ⅡA溶出参数Td(h)
从表4中发现,4种溶出介质中丹参酮ⅡA纳米囊的平均滞留时间均长于原料药(P<0.05),丹参酮ⅡA纳米囊的体外释放度与原料药相比存在着显著统计学差异。丹参酮ⅡA纳米囊制剂可以延缓药物释放。参照药物累积释药百分数,在60 h内丹参酮ⅡA纳米囊释药量≥84.6%。
3 讨论
药物在体内的吸收受许多因素的影响,对脂溶性成分而言,胆汁、食物、磷脂、蛋白等肠内容物以及肠道血液循环都可明显影响其溶解与吸收。对于水难溶性药物,以水为介质的体外溶出度试验不能完全代表体内的具体情况,一般主张添加必要的助溶出物,如胆盐、磷脂、表面活性剂等,以更接近于体内环境,其中SDS为众所推荐[8]。根据相关研究[9]对SDS用量一般不超过1%的建议,本实验加入1%SDS溶液来检测体外溶出。
实验过程中配制的1%SDS、pH6.8磷酸盐缓冲液+1% SDS 、pH4.0醋酸盐缓冲液+1% SDS、pH1.2溶液+1% SDS室温放置容易析出SDS,使用前应该提前1 h 37℃水浴预热使之澄清透明。为了防止气泡对溶出过程产生影响,预热后及时超声去气备用。
[1] 刘艳,张志鹏,索绪斌,等.缓控释制剂体外释放度的研究进展[J].时珍国医国药,2011,22(3):701-703.
[2] 国家药典委员会.中国药典[S].二部.北京:中国医药科技出版社,2010:附录85.
[3] 吴俊洪,罗惠都,何丽冰,等.丹参酮ⅡA纳米囊的制备及其性能评价[J].中药新药与临床药理,2013,24(1):101-103.
[4] 谢沐风.溶出度研究列评《日本药品品质再评价工程》[J].中国药品标准,2006,1(7):43-44.
[5] 李晓光,李东晓,李兴平,等.丹参酮IIA的体外溶出与体内吸收的关系研究[J].中药新药与临床,2010,26(4):18-21.
[6] 庄晓峰,张宏福,陈亮.不同透析袋对仿生消化法评定猪饲料原料干物质和磷体外消化率的影响[J].动物营养学报,2012,24(8):1 527-1 533.
[7] Zhang Y,Huo M,Zhou J,et al.DDSolver: an add-in program for modeling and comparison of drug dissolution profiles[J].AAPS J,2010,12(3):263-271.
[8] 李新中.齐墩果酸聚氰基丙烯酸正丁酯纳米囊的制备及其肝靶向性研究[D].长沙:中南大学,2007.
[9] 赵丽丽,蔡露茜,叶竞雄,等.表面活性剂SDS辅助微波提取金佛手总黄酮工艺及抗氧化活性评价[J].食品科学,2014,35(18):47-51.
责任编辑:艾 茜
The Study of Tanshinone ⅡA Nanocapsule Release Rate With Different Solutes in Vitro
Liu Xiangyu1,Yu Xiaoli2*
(1.TheMedicalCollegeofHubeiUniversityforNationalities,Enshi445000,China; 2.TheWuhanChildren′sHospital(WuhanMaternalandChildHeathcareHospital),TongjiMedicalCollegeofHuazhongUniversityofScienceandTechnology,Wuhan440000,China)
Objective To compare the release regularity of Tanshinone ⅡA nanocapsule with the drug substance in vitro.Methods The cumulative concentration of Tanshinone ⅡA was determined at different times in four solutes with dialysis membrane cup method.The DDSolver software was used to analyze the correlation.Results The difference of release between Tanshinone ⅡA nanocapsule and the drug substance in four different solutes was statistically significant.If the release time was prolonged,the fitting analysis showed that the dissolution curve of Tanshinone ⅡA fit into the Weibull distribution model.The release quantity of Tanshinone ⅡA nanocapsule was greater than or equal to 84.6% within 60 hours.Conclusion The release of Tanshinone ⅡA nanocapsule was slower than that of the drug substance. So it is favorable for drug absorption.
Tanshinone ⅡA nanocapsule;Release rate in vitro;DDSolver software
刘翔宇,男,硕士在读,研究方向:中医基础理论;*
余晓莉,女,主要从事脑缺血神经元保护机制方面的研究。
R943
A
1008-8164(2017)01-0053-03
2016-11-12

