组织芯片检测溶血磷脂酸受体2蛋白在胃癌组织中的表达及其临床意义
张志丽,张 煦
1.兰州大学基础医学院病理学研究所(甘肃 兰州 730000) 2.酒泉市第二人民医院病理科(甘肃 酒泉 735000)
组织芯片检测溶血磷脂酸受体2蛋白在胃癌组织中的表达及其临床意义
张志丽1,2,张 煦1*
1.兰州大学基础医学院病理学研究所(甘肃 兰州 730000) 2.酒泉市第二人民医院病理科(甘肃 酒泉 735000)
目的 探讨溶血磷脂酸受体2(LPA2)蛋白在胃癌组织中的表达水平及其与临床病理特征的关系。方法 选取52例手术切除胃癌组织标本、22例上皮内瘤变标本及13例正常胃黏膜标本为研究对象,采用免疫组织化学SP法检测上述3组标本组织芯片中LPA2的表达水平;分析LPA2表达水平与胃癌患者临床病理特征(年龄、性别、临床分期、部位、浸润深度、肿瘤分级和淋巴结转移情况)是否存在相关性。结果 LPA2主要表达于细胞膜和胞浆,呈棕褐色颗粒状,在胃癌组织、上皮内瘤变及正常胃粘膜中的阳性表达率分别为73.1% (38/52)、54.5%(12/22)和46.2%(6/13),癌组织中的阳性率显著高于上皮内瘤变及正常胃粘膜(P<0.05);LPA2阳性表达与患者年龄、性别、肿瘤部位、分化程度无关(P>0.05),而与肿瘤浸润深度、淋巴结转移情况及临床分期有关(P<0.05)。浸润浆膜层、存在淋巴结转移和晚期患者LPA2阳性率显著高于未浸润浆膜层、无淋巴结转移和早期患者。结论 LPA2在胃癌组织中阳性表达率较高,并与肿瘤的浸润深度、淋巴结转移及临床分期有关,可作为胃癌预后的潜在生物学标志物。
胃癌;组织芯片;上皮内瘤变;溶血磷脂酸受体2
胃癌是消化系统常见的恶性肿瘤,其发病率和死亡率一直居高不下,胃癌的发生发展分子机制目前仍未完全阐明。近年来研究[1-2]显示肿瘤癌基因的过表达与抑癌基因的低表达在胃癌的发生发展中起到重要作用。溶血磷脂酸受体2(lysophosphatidic acid 2,LPA2)在多种恶性肿瘤中高表达,与患者临床特征和预后有关[3]。LPA2蛋白由LPA基因编码,定位于人19号染色体,编码蛋白LPA2为G蛋白偶联受体,LPA2与其配体结合后可激活溶血磷脂酸信号通路,促进细胞增殖及细胞恶性转化[4]。文献报道[5]LPA2在乳腺癌等实体肿瘤中呈现高表达并参与了肿瘤的增殖与侵袭过程,但LPA2在胃癌中的表达及其与胃癌发生发展的关系鲜有报道。本研究选取52例胃癌组织、22例胃粘膜上皮内瘤变组织及13例正常胃粘膜上皮为研究对象,探讨LPA2在上述组织中的表达情况及其与临床病理特征的关系。
1 材料与方法
1.1 材料 选取2010年3月—2016年4月酒泉市第二人民医院收治并手术切除的52例胃癌组织标本、22例上皮内瘤变标本及13例正常胃黏膜标本为研究对象。纳入标准:①有明确病理学诊断;②术前未接受过新辅助治疗包括放疗、化疗和生物治疗;③有完整的临床病理资料;④组织标本获取经患者及家属同意;排除组织病理学诊断不明确、术前接受过新辅助放化疗及临床资料不完整者。52例胃癌患者男性32例,女性20例,平均年龄(66.8±15.6)岁,贲门癌20例,胃体癌15例,幽门癌17例;按照AJCC(2002)胃癌TNM 分期标准,Ⅰ期10例,Ⅱ期14例,Ⅲ期15例,Ⅳ期13例,高分化腺癌16例,中分化17例,低分化19例。22例上皮内瘤变患者男性18例,女4例,平均年龄(56.7±13.6)岁。13例正常胃粘膜组男性12例,女1例,平均年龄(55.7±17.1)岁。
1.2 试剂与仪器 兔抗人LPA2单克隆抗体(北京博奥森公司)1∶500稀释、SP9001试剂盒及DAB显色试剂盒(北京中杉公司)。石蜡切片机(德国徕卡公司),显微镜(日本奥林巴斯公司)、电热恒温箱(上海荣珂检测仪器有限公司)。
1.3 方法
1.3.1 组织芯片制作 复查HE切片, 在显微镜下对需要穿取组织定位,并对照蜡块的位置作标记,确定取材位点。用制备组织芯片的模具制作2 mm的空心蜡模,内径为2 mm的组织芯片取样器在蜡块的标记位点取出组织蜡芯, 将其放入空心蜡模孔中,制成6×7组织微阵列并对组织芯片蜡块进行4 μm厚连续切片, 裱附于APES防脱片载玻片上。
1.3.2 免疫组织化学染色 切片经脱蜡、梯度酒精水化后,pH 6.0柠檬酸高温高压修复抗原,3%过氧化氢处理10 min,用于清除内源酶活性,试剂A室温封闭10 min,滴加一抗4 ℃冰箱过夜,二抗37 ℃孵育16 min,试剂C 37℃孵育18 min,DAB显色,苏木素复染,封片后进行显微镜下观察,以PBS代替一抗做阴性对照。
1.4 结果判定 两位资深的病理专科医师独立进行阅片,在高倍镜下选取5个视野,计算每个视野下的LPA2阳性细胞比例。阳性细胞均以细胞质/胞膜中出现棕黄色颗粒为主。阳性细胞<5%为(-);阳性细胞5%~25%为(+);阳性细胞25%~50%为(++);阳性细胞>50%为(+++)。
1.5 统计学处理 采用SPSS 20.0统计学软件,LPA2在胃癌组织、上皮内瘤变和正常胃粘膜中的表达采用率表示,组间比较采用趋势卡方检验(chi-square);LPA2阳性表达与胃癌患者临床病理特征关系分析采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组中LPA2阳性表达率 LPA2主要表达于细胞膜和胞浆,呈棕褐色颗粒状(图1)。在胃癌组织、上皮内瘤变及正常胃粘膜中的阳性表达率分别为73.1% (38/52)、54.5%(12/22)和46.2%(6/13),癌组织中的阳性率显著高于上皮内瘤变及正常胃粘膜,差异有统计学意义(χ2=4.36, 3.96,P<0.05)。
2.2 LPA2表达与患者临床病理特征的关系 LPA2阳性表达与患者年龄、性别、肿瘤部位、分化程度无关(P>0.05),而与肿瘤浸润深度、淋巴结转移情况及临床分期有关(P<0.05)。浸润浆膜层、存在淋巴结转移和晚期患者LPA2阳性率显著高于未浸润浆膜层、无淋巴结转移和早期患者(P<0.05),见表1。
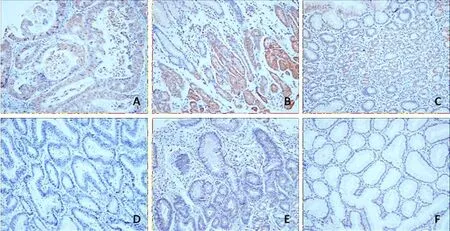
A:LPA2在胃癌组织中呈阳性表达;B:LPA2在上皮内瘤变组织中呈阳性表达;C: LPA2在正常胃粘膜组织中呈阳性表达;D: LPA2在胃癌组织中呈阴性表达; E: LPA2在上皮内瘤变组织中呈阴性表达; F: LPA2在正常胃粘膜组织中呈阳性表达。图1 LPA2在胃癌组织、上皮内瘤变和正常胃粘膜中的表达(×20)
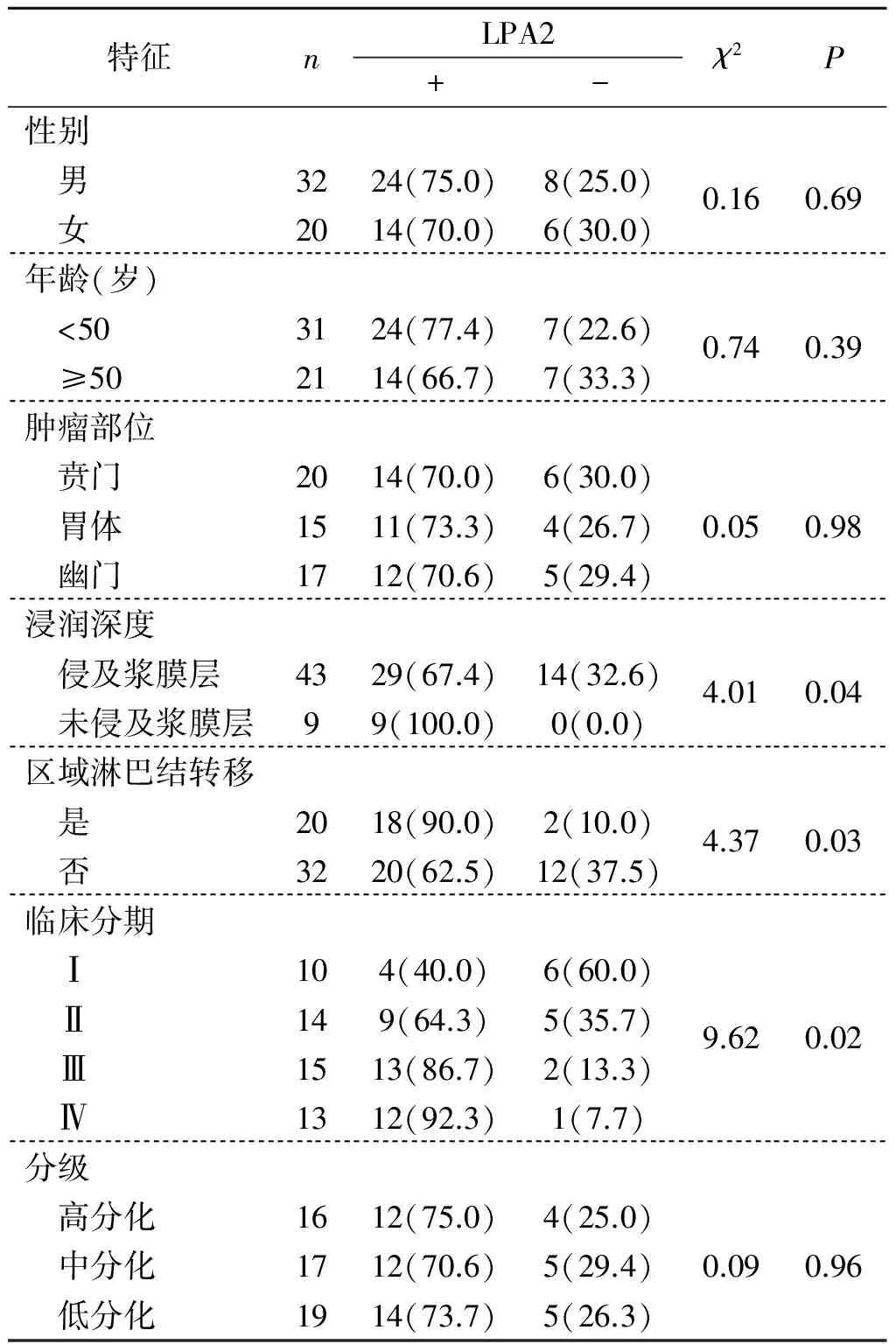
特征nLPA2+-χ2P性别 男3224(75.0)8(25.0)0.160.69 女2014(70.0)6(30.0)年龄(岁) <503124(77.4)7(22.6)0.740.39 ≥502114(66.7)7(33.3)肿瘤部位 贲门2014(70.0)6(30.0) 胃体1511(73.3)4(26.7)0.050.98 幽门1712(70.6)5(29.4)浸润深度 侵及浆膜层4329(67.4)14(32.6)4.010.04 未侵及浆膜层99(100.0)0(0.0)区域淋巴结转移 是2018(90.0)2(10.0)4.370.03 否3220(62.5)12(37.5)临床分期 Ⅰ104(40.0)6(60.0) Ⅱ149(64.3)5(35.7)9.620.02 Ⅲ1513(86.7)2(13.3) Ⅳ1312(92.3)1(7.7)分级 高分化1612(75.0)4(25.0) 中分化1712(70.6)5(29.4)0.090.96 低分化1914(73.7)5(26.3)
3 讨论
胃癌在临床上较为常见,北美流行病学资料显示[6],2012年美国胃癌新发病例为21 000余例,当年胃癌死亡病例为10 000余例。我国尚缺乏全国范围内胃癌发病率方面的权威流行病学数据,但区域流行病数据显示[7],我国胃癌的发病率一直居高不下,农村发病率显著高于城市,欠发达地区高于发达地区,且近年来发病率有升高趋势。与日本、欧美等发达国家不同,我国胃癌患者存在自身的流行病学特点,发病年龄轻,青年胃癌患者比例较高,同时晚期患者比例较高,大多数患者确诊时已发生区域淋巴结转移或远处转移,预后较差[8]。虽然胃癌在全世界范围内高发,但其发生发展和侵袭转移的确切分子机制目前仍不完全明显。随着分子生物学技术的不断进步,越来越多的研究显示[9]癌基因的异常激活和抑癌基因的缺失表达在胃癌的发生发展中发挥重要作用,并与其恶性生物学行为如异常分裂增殖、迁移能力增强、凋亡比例降低等有关。
LPA2蛋白由LPA基因编码,该基因定位于人19号染色体,编码蛋白LPA2为G蛋白偶联受体,LPA2与其配体结合后可激活溶血磷脂酸信号通路,促进细胞增殖及细胞恶性转化[10-11]。LPA2蛋白在多种实体肿瘤中异常表达与患者预后及临床病理特征相关已有报道。高峰等[5]采用real-time PCR和免疫组织化学法检测了乳腺癌组织和癌旁组织中LPA2的表达情况,并探讨了其表达与患者临床病理特征和预后的关系。结果显示,LPA2在乳腺癌组织中高表达者高于低表达者,提示LPA2可能参与了乳腺癌的发生发展过程。同时,LPA2阳性表达与乳腺癌患者的分期及淋巴结转移有关,且阳性者无疾病进展生存时间短于阴性患者。上述结果提示LPA2阳性表达与乳腺癌患者的预后不良有关。但关于LPA2在胃癌中的表达情况及其与患者临床病理特征关系鲜有报道。因此,本研究选取了52例胃癌组织、22例胃粘膜上皮内瘤变组织及13例正常胃粘膜组织为研究对象,探讨LPA2在上述组织中的表达情况及其与临床病理特征的关系。研究结果发现,胃癌组织中的阳性率显著高于上皮内瘤变及正常胃粘膜,提示LPA2蛋白的异常表达可能在胃癌的发生中发挥重要作用。但其调控胃癌细胞增殖的分子机制并未完全阐明。LPA2阳性表达与肿瘤浸润深度、淋巴结转移及临床分期有关(P<0.05)。侵润浆膜层、存在淋巴结转移和晚期患者LPA2阳性率显著高于未侵润浆膜层、无淋巴结转移和早期患者。浸润深度、淋巴结转移及临床分期是胃癌预后的独立危险因素,阳性表达患者中,肿瘤浸润较深、存在淋巴结转移且临床分期较晚, LPA2阳性患者提示预后可能较差,并可作为胃癌预后的潜在生物学标志物。
[1] Kim MH,Kim H.Oncogenes and tumor suppressors regulate glutamine metabolism in cancer cells[J].J Cancer Prev,2013,18(3):221-226.
[3] Kim HJ,Hwang SH,Han ME,et al.LPA2 is widely overexpressed in diverse digestive tract cancers and regulates motility of cancer cells[J].PLoS One,2012,7(6):e39 482.
[4] Li M,Xiao D,Zhang J,et al.Expression of LPA2 is associated with poor prognosis in human breast cancer and regulates HIF-1α expression and breast cancer cell growth[J].Oncol Rep,2016,36(6):3 479-3 487.
[5] 高峰,肖栋,李晓军.溶血磷脂酸受体2在乳腺癌中的表达及预后相关性分析[J].实用医学杂志,2015,31(10):1 590-1 593.
[6] Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[7] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China, 2015[J].CA Cancer J Clin,2016,66(2):115-132.
[8] Lin Y,Ueda J,Kikuchi S,et al.Comparative epidemiology of gastric cancer between Japan and China[J].World J Gastroenterol,2011,17(39):4 421-4 428.
[9] Kim MH,Kim H.Oncogenes and tumor suppressors regulate glutamine metabolism in cancer cells[J].J Cancer Prev,2013,18(3):221-226.
[10] Yoshida M,He P,Yun CC.Transgenic Expression of Human Lysophosphatidic Acid Receptor LPA2 in Mouse Intestinal Epithelial Cells Induces Intestinal Dysplasia[J].PLoS One,2016,11(4):e0 154 527.
[11] Knowlden SA,Capece T,Popovic M,et al.Regulation of T cell motility in vitro and in vivo by LPA and LPA2[J].PLoS One,2014,9(7):e 101 655.
责任编辑:艾 茜
LPA2 Expression in Gastric Cancer and Its Clinical Significance by Tissue Chip Detection
Zhang Zhili1,2,Zhang Xu1*
(1.TheDepartmentofPathology,SchoolofBasicMedicalSciencesinLanzhouUniversity,Lanzhou730000,China; 2.TheDepartmentofPathology,theSecondPeople′sHospitalofJiuquan,Jiuquan735000,China)
Objective To evaluate the LPA2 expression in gastric cancer and its clinical significance by tissue chip detection.Methods 52 gastric cancer tissues, 22 intraepithelial neoplasia specimen and 13 normal gastric tissues were collected and were tested the LPA2 expression by tissue microarray immuno histochemistry assay.The LPA2 expression pattern and patients′ clinical pathological features such as age, gender, location invasion depth and lymph node metastasis were analyzed.Results The LPA2 was mainly expressed in the cell membrane and patina with brown granular.The positive expression rates were 73.1% (38/52),54.5%(12/22) and 46.2%(6/13)for cancer tissue,intraepithelial neoplasia and normal gastric mucosa respectively with statistical difference (P<0.05).The positive rate of cancer tissue was significantly higher than that of intraepithelial neoplasia and normal gastric mucosa (P<0.05).The LPA2 positive expression was not associated with age,gender,tumor location and tumor grading (P>0.05),but was related with tumor invasion depth,lymph node metastasis and clinical stage (P<0.05).The LPA2 positive rates of patients with infiltrating serosa and lymph node metastasis in the advanced stage were significantly higher than those of patients without infiltrating serosa and lymph node metastasis in the early stage.Conclusion The LAP was highly expressed in gastric cancer correlating with tumor invasion depth,lymph node metastasis and clinical stages.It could be a potential biomarker for prognosis of gastric cancer.
gastric cancer;tissue chip;intraepithelial neoplasia;lysophosphatidic acid 2;clinical pathology features
张志丽,女,主治医师,研究方向:肿瘤病理与临床;*
张煦,男,副教授,主要从事消化系统临床病理研究。
R735.2
A
1008-8164(2017)01-0016-04
2016-12-09

