高剂量枸橼酸咖啡因维持疗法防治早产极低出生体质量儿呼吸暂停效果观察
张清,韦秋芬,闭宏娟
(广西壮族自治区妇幼保健院,南宁530002)
高剂量枸橼酸咖啡因维持疗法防治早产极低出生体质量儿呼吸暂停效果观察
张清,韦秋芬,闭宏娟
(广西壮族自治区妇幼保健院,南宁530002)
目的观察高剂量枸橼酸咖啡因防治早产极低出生体质量儿呼吸暂停的效果及安全性。方法选择早产极低出生体质量儿156例,随机分为A、B、C三组各52例,于生后24 h内给予枸橼酸咖啡因治疗。A组先予负荷剂量20 mg/(kg·d),24 h后维持剂量5 mg/(kg·d);B组先予负荷剂量20 mg/(kg·d),24 h后再次给予负荷剂量20 mg/(kg·d),48 h后维持剂量5 mg/(kg·d);C组先予负荷剂量20 mg/(kg·d),24 h后维持剂量10 mg/(kg·d)。三组维持剂量使用至患儿出生后纠正胎龄34周为止。比较三组呼吸暂停程度、重复上机例数、支气管肺发育不良例数、氧疗时间,观察给药后心动过速、喂养不耐受、高血糖等不良反应的发生情况。结果C组发生呼吸暂停例数、呼吸暂停消失天数及严重程度评分、重复上机例数、支气管肺发育不良例数均少或轻于其他两组(P均<0.05)。三组治疗过程中不良反应发生率比较无统计学差异。结论早产极低出生体质量儿应用枸橼酸咖啡因防治呼吸暂停时,按照负荷剂量20 mg/(kg·d)、维持剂量10 mg/(kg·d)直至纠正胎龄34周的给药方案能够减少呼吸暂停的发生,临床效果显著,安全性更高。
枸橼酸咖啡因;早产儿;极低出生体质量儿;呼吸暂停
早产儿呼吸暂停通常是指原发性呼吸暂停,定义为早产儿呼吸停止20 s或更长时间,多伴有青紫或心率减慢情况发生[1]。呼吸暂停是新生儿重症监护治疗中最常见的问题,如发现不及时或治疗效果不佳,可导致脑组织及其他重要脏器缺氧损伤,甚至死亡。枸橼酸咖啡因是甲基黄嘌呤类药物,通过兴奋呼吸中枢来治疗早产儿原发性呼吸暂停,对早产极低体质量儿早期使用枸橼酸咖啡因不仅可以治疗呼吸暂停,还可以起到预防呼吸暂停的作用。枸橼酸咖啡因按说明书推荐治疗方案有不同维持剂量,如剂量不足可能应答不充分导致临床效果不佳,超量有可能引起心动过速、喂养不耐受等不良反应。目前对于枸橼酸咖啡因防治极低出生体质量儿呼吸暂停的最优方案尚未统一。本研究对早产极低出生体质量儿早期采取不同的枸橼酸咖啡因给药方案,观察各组呼吸暂停的发生情况,为临床治疗提供参考。
1 资料与方法
1.1 临床资料 选择2013年1月~2016年7月我院NICU收治的早产极低出生体质量儿,胎龄<32周,体质量<1 500 g,出生时间<24 h,排除可能危害生命或影响神经系统发育的先天性疾病及死亡患儿。将患儿随机分为A、B、C组各52例,A组男38例、女14例,胎龄(30.58±1.12)周,体质量(1 195.00±160.97)g,B组男32例、女20例,胎龄(30.90±1.01)周,体质量(1 254.23±148.84)g,C组男30例、女22例,胎龄(30.70±2.68)周,体质量(1 219.23±136.38)g。三组性别、胎龄、出生体质量具有可比性。本研究经医院医学伦理委员会批准,患儿家属均签署知情同意书。
1.2 治疗方法 患儿入NICU后均参照《早产儿管理指南》[2]进行管理。根据枸橼酸咖啡因(意大利凯西制药公司,20 mg/mL,相当于咖啡因10 mg)说明书推荐剂量,A组给予常规剂量,入院后立即使用枸橼酸咖啡因20 mg/kg静脉输注30 min,24 h后给予5 mg/kg维持量静脉输注10 min,1次/d,维持至纠正胎龄34周。B组入院后立即使用枸橼酸咖啡因20 mg/kg静脉输注30 min,24 h后再次给予负荷剂量20 mg/kg维持量静脉输注30 min,24 h后以5 mg/kg的维持量静脉输注10 min,1次/d,维持至纠正胎龄34周。C组入院后立即给予枸橼酸咖啡因20 mg/kg静脉输注30 min,24 h后给予10 mg/kg的维持量静脉输注10 min,1次/d,维持至纠正胎龄34周。对药物治疗仍有反复呼吸暂停症状者,采用经鼻持续气道正压通气,必要时行气管插管机械辅助通气治疗。
1.3 观察指标 用药期间观察患儿呼吸暂停(呼吸暂停超过20 s,或出现心率减慢<100次/min、青紫、血氧饱和度降低和肌张力减低)的发生情况,将呼吸暂停严重程度分为4级,进行呼吸暂停程度评分[3]。一级,可自行恢复,计1分;二级,有发作症状,需用氧气鼻前部刺激才能恢复,计2分;三级,上述处理后并足底刺激才能恢复,计3分;四级,需经面罩正压给氧通气后恢复自主呼吸,计4分。记录呼吸暂停例数、呼吸暂停程度评分、支气管肺发育不良例数、再次接受呼吸机辅助通气例数、吸氧天数,观察心动过速(心率>180次/min)、高血糖(血糖>7.0 mmol/L)、喂养不耐受等不良反应的发生情况。相应诊断标准参照《实用新生儿学》第4版[1]。
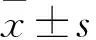
2 结果
2.1 三组呼吸暂停发生情况比较 用药过程中,A组16例、B组9例、C组2例发生呼吸暂停,C组发生呼吸暂停例数最少(P<0.05)。
2.2 三组呼吸暂停消失天数比较 三组呼吸暂停消失天数分别为(7.01±2.28)、(4.77±2.94)、(2.53±1.50)d,C组较A、B两组缩短(P均<0.05)。
2.3 三组呼吸暂停严重程度评分比较 A、B、C组呼吸暂停严重程度评分1分各9、7、0例,2分各4、1、2例,3分各5、3、1例,4分各0、1、1例。C组评分较A、B两组降低(P均<0.05)。
2.4 三组再次接受辅助机械通气支气管肺发育不良情况比较 A组20例、B组14例、C组4例需要再次使用呼吸机,C组再次接受呼吸机辅助通气的例数少于A、B两组(P均<0.05);三组吸氧天数分别为(20.62±2.64)、(20.35±2.78)、(21.50±1.51)d,组间比较无统计学差异(P均>0.05);A组12例、B组8例、C组5例出现支气管肺发育不良,C组肺发育不良的发生率低于A、B两组(P均<0.05)。
2.5 三组不良反应比较 A组出现心动过速5例、高血糖2例、喂养不耐受4例,不良反应发生率为21.1%,B组分别为4、5、1例及19.2%,C组分别为5、3、6例及26.9%。三组不良反应发生率比较差异无统计学意义(P均>0.05)。
3 讨论
呼吸暂停在早产儿治疗中较为常见,早产超低体质量儿中约80%会发生呼吸暂停,但低出生体质量儿或孕34周后出生的早产儿中仅有25%会发生呼吸暂停[4],故原发性呼吸暂停与孕周和体质量有一定关系。反复发作的早产儿呼吸暂停可导致脑室周围白质软化等脑损伤发作,严重者甚至死亡[5]。因此,早期防治呼吸暂停在早产极低体质量儿管理中尤为重要[6]。
治疗早产儿呼吸暂停的甲基黄嘌呤类药物主要有氨茶碱和枸橼酸咖啡因,国外使用咖啡因治疗呼吸暂停效果已得到公认[7,8]。研究[9,10]证实,咖啡因用于治疗早产儿呼吸暂停的作用机制主要在于给药后能够迅速进入脑部,兴奋呼吸中枢,有效治疗呼吸暂停,可减少重复上机,提高撤机成功率,并减少支气管肺发育不良,改善患儿预后。WHO对枸橼酸咖啡因治疗呼吸暂停的剂量规定为负荷量20 mg/kg,继之以5 mg/kg、1次/d的维持量[11]。而枸橼酸咖啡因推荐治疗呼吸暂停给药方案中提出,如早产儿对推荐的负荷剂量临床应答不充分,可在24 h后给予20 mg/kg的第2次负荷剂量,维持阶段应答不充分者可以考虑10 mg/(kg·d)的维持量。有研究认为,对于孕周<28周的早产儿,初始维持剂量应>7.9 mg/kg,对减少呼吸暂停的再发和提高撤机成功率有一定临床疗效[12]。2004年Steer在澳洲进行随机对照双盲研究比较了20 mg/kg和5 mg/kg咖啡因维持剂量的效果,结果显示高剂量组拔管成功率高。高维持剂量咖啡因治疗可缩短机械通气治疗时间,提高撤机率,减少肺损伤,降低支气管肺发育不良率[13]。目前,在咖啡因治疗早产极低体质量儿呼吸暂停方面,高剂量咖啡因在防治呼吸暂停方面优于常规剂量已得到肯定,但是何种剂量为咖啡因最优化剂量,尚未达成共识[14,15]。国内因咖啡因上市时间短,应用范围不广,相关报道为数不多。
本研究显示,C组在治疗过程中不但呼吸暂停发生例数和消失天数较其余两组明显减少,呼吸暂停严重程度评分低,而且再次接受呼吸机辅助通气的例数、远期发生支气管肺发育不良的例数也明显减少,三组治疗过程中的不良反应发生率无统计学差异。表明高剂量枸橼酸咖啡因维持治疗对于防治呼吸暂停效果明显,且未增加不良反应。因此建议,出生后24 h即使用枸橼酸咖啡因20 mg/kg静脉输液30 min为负荷量,间隔24 h后给予维持剂量10 mg/kg、1次/d静脉输注,至纠正胎龄34周,可作为早产极低体质量儿防治呼吸暂停推荐优化剂量。而对于增加维持剂量后是否会引起早产儿远期不良中枢神经系统反应还有待进一步随访观察。
[1] 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2011:245-247.
[2] 陈超,魏克伦,姚裕家,等.早产儿管理指南[J].中华儿科杂志,2006,44(3):188-191.
[3] 周道强.氨茶碱+多巴胺多巴酚丁胺治疗早产儿原发性呼吸暂停的疗效观察[J].求医问药,2012,10(12):244-245.
[4] Davis PG, Schmidt B, Roberts RS, et al. Caffeine for apnea of prematurity trial: benefits may vary in subgroups[J]. J Pediatr, 2010,156(3):382-387.
[5] Mathew OP. Apnea of prematurity: pathogenesis and management strategies[J]. J Perinatol, 2011,31(5):302-310.
[6] Patel RM, Leong T, Carlton DP, et al. Early caffeine therapy and clinical outcomes in extremely preterm infants[J]. J Perinatol, 2013,33(2):134-140.
[7] Aranda JV, Beharry K, Valencia GB, et al. Caffeine impact on neonatal morbidities[J]. J Matern Fetal Neonatal Med, 2010,23(Suppl 3):20-23.
[8] Skouroliakou M, Bacopoulou F, Markantonis SL. Caffeine versus theophylline for apnea of prematurity: a randomised controlled trial[J]. J Paediatr Child Health, 2009,45(10):587-592.
[9] Kreutzer K, Bassler D. Caffeine for apnea of prematurity: a neonatal success story[J]. Neonatology, 2014,105(4):332-336.
[10] Schmidt B, Roberts RS, Davis P, et al. Caffeine therapy for apnea of prematurity[J]. N Engl J Med, 2006,354(20):2112-2121.
[11] Henderson-Smart DJ, Steer P. Methylxanthine treatment for apnea in preterm infants[J]. Cochrane Database Syst Rev, 2010,12(1):CD000140.
[12] Taha D, Kirkby S, Nawab U, et al. Early caffeine therapy for prevention of bronchopulmonary dysplasia in preterm infants[J]. J Matern Fetal Neonatal Med, 2014,27(16):1698-1702.
[13] Nobile S, Carnielli VP. Caffeine for preterm infants: current indications and uncertainties[J]. Acta Biomed, 2015,86(Suppl 1):32-35.
[14] Mcpherson C, Neil JJ, Tjoeng TH, et al. A pilot randomized trial of high-dose caffeine therapy in preterm infants[J]. Pediatr Res, 2015,78(2):198-204.
[15] Dobson NR, Patel RM, Smith PB, et al. Trends in caffeine use and association between clinical outcomes and timing of therapy in very low birth weight infants[J]. J Pediatr, 2014,164(5):992-998.
10.3969/j.issn.1002-266X.2017.42.019
R722
B
1002-266X(2017)42-0059-03
广西卫计委自筹经费科研课题(Z2015235)。
闭宏娟(E-mail: yeyuruxin@163.com)
2017-01-11)

