结直肠癌组织中miR-31、PDCD4 mRNA表达及意义
李建枫,徐衍全,程辉,孙洋
(三亚市人民医院,海南三亚572000)
结直肠癌组织中miR-31、PDCD4 mRNA表达及意义
李建枫,徐衍全,程辉,孙洋
(三亚市人民医院,海南三亚572000)
目的观察结直肠癌组织中miR-31、程序性细胞死亡因子4(PDCD4)的表达情况,分析其与结直肠癌发生发展的关系。方法选择80例结直肠癌患者,收集其临床资料(包括性别、年龄、肿瘤直径、TNM分期、分化程度、淋巴结是否转移等)。取患者手术切除的癌组织和癌旁组织,采用RT-PCR法检测miR-31、PDCD4 mRNA表达,分析miR-31、PDCD4 mRNA表达与临床病理特征的相关性,采用简单相关分析法分析癌组织中miR-31、PDCD4 mRNA表达的相关性。结果癌组织中miR-31相对表达量高于癌旁组织,PDCD4 mRNA相对表达量低于癌旁组织(P均<0.05)。癌组织中miR-31、PDCD4 mRNA表达与TNM分期、分化程度及淋巴结是否转移有关(P均<0.05),与癌症部位、性别、年龄、肿瘤直径无关(P均>0.05)。相关性分析显示,癌组织中miR-31与PDCD4 mRNA表达呈负相关(r=-0.412,P<0.05)。结论结直肠癌组织中miR-31表达升高、PDCD4 mRNA表达降低,二者异常表达与结直肠癌病情进展及恶化转移有关。
结直肠癌;微小RNA-31;程序性细胞死亡因子4
结直肠癌是消化道常见的恶性肿瘤之一。近年来,由于人口老龄化及居民生活方式和饮食习惯的改变等多种因素的影响,我国结直肠癌发病率呈逐年上升趋势,且发病人群呈年轻化趋势[1]。目前对于结直肠癌的治疗手段主要以手术切除为主、放化疗为辅,但治疗效果并不理想。因此寻找与结直肠癌发生发展有关的分子标志物,对于疾病早期干预和治疗具有重要价值。微小RNA(miRNA)是广泛存在于真核细胞内的一类小型内源性非编码RNA调控因子,在细胞分化、细胞周期和凋亡的调控中发挥重要作用。近年研究发现,多种miRNA的表达异常与肿瘤的发生、发展及预后有关[2],miR-31与结直肠癌、胃癌等恶性肿瘤关系的研究也受到广泛关注。程序性细胞死亡因子4(PDCD4)是一种新发现的细胞凋亡基因,可抑制蛋白转录及翻译,调控细胞程序性死亡,从而发挥抑制肿瘤细胞生长的作用。研究发现,PDCD4在多种恶性肿瘤中均呈现不同程度的表达降低或缺失,并可作为抗肿瘤的治疗靶点[3]。本研究通过观察结直肠癌组织中miR-31、PDCD4 mRNA的表达变化及其与结直肠癌发生发展的相关性,旨在为结直肠癌的诊断、治疗及预后评估提供依据。
1 资料与方法
1.1 临床资料 选择2014年1月~2017年1月在我院行手术治疗的80例结直肠癌患者,男49例、女31例,年龄40~81(54.8±9.7)岁。患者均经术后病理检查确诊,结肠癌29例、直肠癌51例。肿瘤直径≥4 cm 38例,<4 cm 42例;TNM分期Ⅰ~Ⅱ期44例,Ⅲ~Ⅳ期36例;细胞分化程度高分化31例,中分化26例,低分化23例;合并淋巴结转移34例,无淋巴结转移46例。患者均为首次诊断和治疗;术前进行放化疗及其他辅助治疗;排除其他恶性肿瘤。本研究经本院医学伦理委员会批准通过,患者均知情同意。
1.2 临床资料收集 查阅患者的病历本,收集患者的性别、年龄、肿瘤大小、TNM分期、分化程度、淋巴结是否转移等相关临床资料。
1.3 癌组织及癌旁组织中miR-31、PDCD4 mRNA表达检测 采用RT-PCR法。收集癌组织及癌旁(距离癌组织5 cm以上)正常黏膜组织,液氮速冻后,-80 ℃保存。取大肠组织50~100 mg剪碎,TRIzol法提取总RNA,使用TaKaRa逆转录试剂盒逆转录生成cDNA,-20 ℃保存备用。采用SYBR GreenⅠ荧光定量PCR法进行cDNA的定量检测。PCR mix的扩增采用SYBR®Premix EX TaqTMⅡ(TaKaRa)。miR-31茎环引物序列为5′-GTCGTATCCAGTGCTGGGTCCGAGTGATTCGCACTGGAT-ACGACCAG-CTA-3′,miR-31上游引物为5′-ACGCGGCAAGATGCTGGCA-3′,下游引物为5′-CAGTGCTGGGTCCGAGTGA-3′;PDCD4 mRNA上游引物为5′-CAGTTGGTGGGCCAGTTTATTG-3′,PDCD4 mRNA下游引物为5′-AGAAGCACGGTAGCCTTATCCA -3′;U6上游引物为5′-CTCGCTTCGGCAGCACA-3′,U6下游引物为5′-AACGCTTCACGAATTTGCGT-3′。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,共40个循环,重复3次。以U6为内参基因记录各样本反应管中的荧光信号到达设定阈值时所对应的循环数,即Ct值,采用2-ΔΔCt法计算miR-31、PDCD4 mRNA的相对表达量。
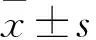
2 结果
2.1 结直肠癌组织及癌旁组织中miR-31、PDCD4 mRNA的表达差异 癌组织中miR-31、PDCD4 mRNA的相对表达量分别为8.751±2.161、3.986±1.232,癌旁组织分别为2.011±1.018、7.192±3.915。癌组织中miR-31的相对表达量高于癌旁组织,PDCD4 mRNA的相对表达量低于癌旁组织(P均<0.01)。
2.2 结直肠癌组织中miR-31、PDCD4 mRNA表达与患者临床病理特征的关系 癌组织中miR-31、PDCD4 mRNA表达与TNM分期、分化程度及淋巴结是否转移有关(P均<0.05);而与病灶部位、性别、年龄、肿瘤直径无关(P均>0.05)。见表1。
2.3 癌组织中miR-31与PDCD4 mRNA表达的相关性 癌组织中miR-31与PDCD4 mRNA表达呈负相关(r=-0.412,P<0.05)。
3 讨论
目前对于结直肠癌的病因及具体发病机制尚不明确,学者普遍认为其与遗传及饮食因素密切相关,且是一种多基因参与的多阶段发展过程。结直肠癌的预后效果不佳,其早期诊断的存活率仅约为60%[4],淋巴结转移、肿瘤浸润深度、TNM分期等均为影响其预后的重要因素[5,6]。对结直肠癌在发病前进行早期诊断及干预治疗对提高疗效、改善预后具有重要价值。目前对于结直肠癌的筛选方法主要是结肠镜检查和粪便隐血试验等常规手段,其特异性及敏感性不甚理想。近年来随着各种分子检测技术的发展,探寻与结直肠癌发生发展及预后有关的分子标志物成为研究热点。
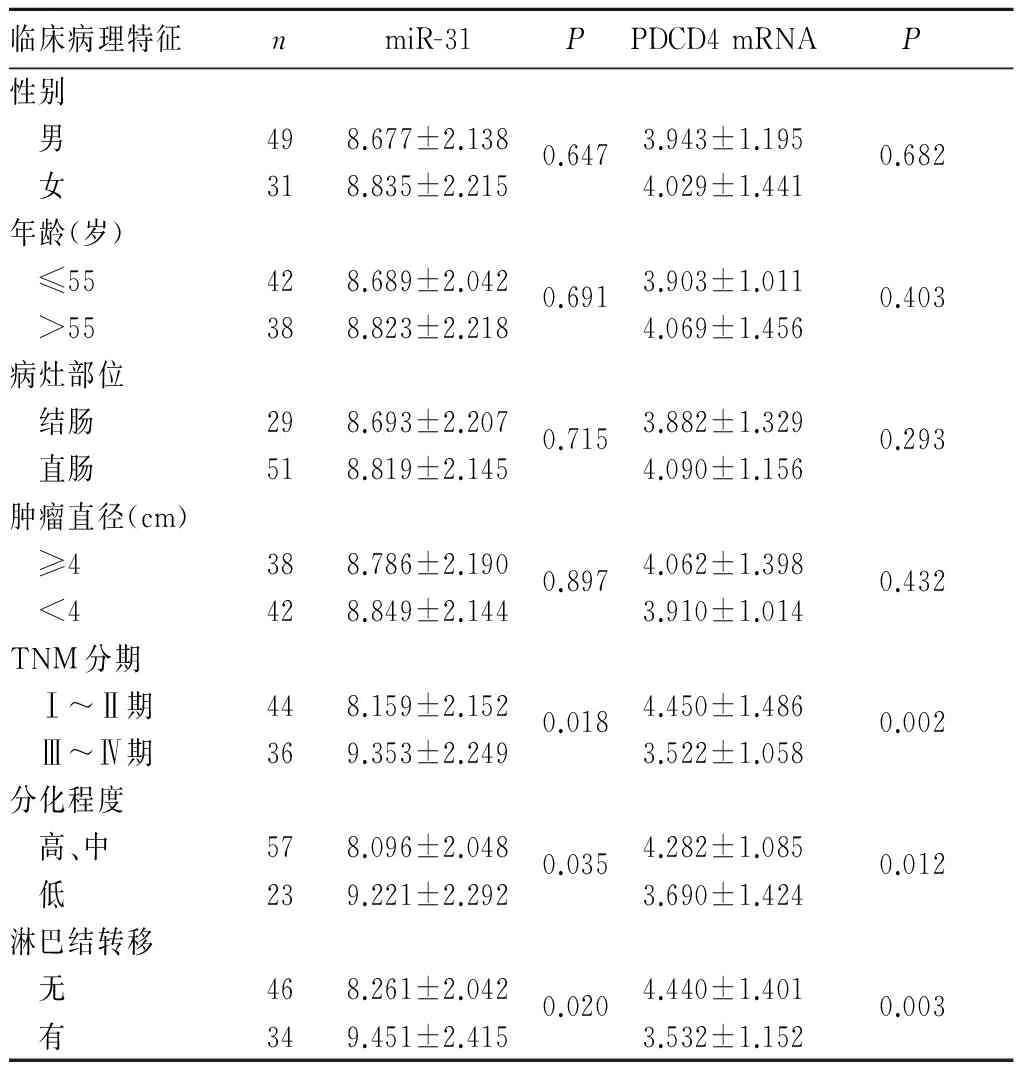
表1 结直肠癌组织中miR-31、PDCD4 mRNA表达与患者临床病理特征的关系
miRNA是一类内源性非编码单链RNA,长度为19~22个核苷酸,在细胞内发挥重要的基因表达调控作用。目前已发现千余种miRNA,其产生过程及生物学功能各有差异。miRNA在细胞内可与其他蛋白质结合生成RNA-诱导沉默复合体,或通过与靶分子mRNA结合,影响mRNA的翻译及蛋白转录过程,从而促进或抑制细胞生长。研究发现,miR-17-92[7]、miR-1914、miR-1915[8]、miR-21、miR-31、miR-145[9]等多种miRNA的异常表达均可能参与结直肠癌等恶性肿瘤的发生发展过程,促进癌症的侵袭与转移。王朝杰等[10]报道,结直肠癌的发生发展与miR-31高表达有关,通过特异性抑制HCT-116细胞中miR-31表达可有效抑制细胞的迁移能力。本研究结果显示,结直肠癌组织中miR-31相对表达量高于癌旁组织,且癌组织中miR-31表达与患者TNM分期、分化程度及淋巴结是否转移有关。提示结直肠组织中miR-31高表达参与了结直肠癌的发生,并促进癌症的侵袭与转移。miRNA在癌症患者体内发挥作用的机制包括:①与靶向mRNA的3′非编码区域(3′-UTR)不完全配对,阻断其翻译过程,从而下调靶向mRNA表达;②与靶向mRNA的3′-UTR完全配对,使靶基因互补区发生特异性断裂,从而产生基因沉默而无法表达;③通过加速靶向mRNA的3′端polyA的脱腺苷酸化,使靶向mRNA迅速降解[11]。有研究显示,miR-31的靶向mRNA可能是PDCD4[12]。
PDCD4是一种抑癌基因,位于人类染色体10q24中,蛋白序列可编码485个氨基酸。是细胞发生程序性死亡的调控因子,同时还可通过抑制细胞的转录、翻译及多种信号通路而发挥调节肿瘤细胞凋亡的作用。研究显示,PDCD4在肺癌、乳腺癌、胰腺癌等多种恶性肿瘤组织中均表现为程度不一的减少或缺失,可用于判断癌症的恶性程度及患者的生存时间[13,14]。本研究结果显示,结直肠癌组织中PDCD4 mRNA相对表达量低于癌旁组织,且癌组织中miR-31表达与患者TNM分期、分化程度及淋巴结是否转移有关,与文献[15]报道一致。说明低水平表达的PDCD4可促进结直肠癌的发生及发展进程。其作用机制可能在于:结直肠癌组织中PDCD4通过发生甲基化[15]或与上游基因miR-21结合,导致mRNA发生降解或表达沉默,从而使其对肿瘤细胞凋亡的调控作用受到抑制;PDCD4基因还可通过抑制核转录因子AP-1或其表达蛋白与翻译起始因子eIF4A和eIF4G结合来抑制基因转录或翻译,诱导细胞生长或转化的抑制[16]。
本研究进一步对癌组织中miR-31与PDCD4 mRNA表达的相关性进行分析,结果显示,二者呈负相关。提示二者可相互作用,共同促进结直肠癌的发生发展。miR-31可能通过靶向结合PDCD4 mRNA的3′-UTR,阻断其翻译过程或发生基因沉默,而降低或丧失其对肿瘤细胞的凋亡作用,从而促进肿瘤细胞的生长、分化及转移。
综上所述,结直肠癌组织中miR-31及PDCD4 mRNA均异常表达,两者通过负调节作用,共同参与结直肠癌的发生发展过程,可能成为结直肠癌早期诊断、治疗及预后评估的新靶点。对于两者的具体作用途径尚待进一步研究。
[1] 代珍,郑荣寿,邹小农,等.中国结直肠癌发病趋势分析和预测[J].中华预防医学杂志,2012,46(7):598-603.
[2] 来建飞,丁蕾,窦晓兵.miRNA在结直肠癌中的作用研究进展[J].浙江临床医学,2017,19(2):374-376.
[3] 杨飞,邓跃华,刘弋,等.胃癌中 MTDH 与PDCD4 的表达及其临床意义[J].安徽医科大学学报,2014,49(7):954-957.
[4] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[5] 易呈浩,葛维挺,黄彦钦,等.1 368例结直肠癌TNM分期及预后分析[J].中国肿瘤临床,2012,39(9):597-601.
[6] 龚杨明,吴春晓,张敏璐,等.上海人群结直肠癌生存率分析[J].中国癌症杂志,2015,25(7):497-504.
[7] Du P, Wang L, Sliz P, et al. A biogenesis step upstream of micropro-cessor controls miR-17~92 expression[J]. Cell, 2015,162(4):885-899.
[8] Hu J, Cai G, Xu Y, et al. The plasma microRNA miR-1914 and -1915 suppresses chemoresistant in colorectal cancer patients by down-regulating NFIX[J]. Curr Mol Med, 2015,16(1):70-82.
[9] 李旭.miR-21、miR-31和miR-145在大肠癌组织中的表达及与癌细胞生物学行为的关系[D].昆明:昆明医学院,2011.
[10] 王朝杰,马宁,周云.结直肠癌组织和结肠癌细胞中miR-31的表达及功能[J].郑州大学学报(医学版),2013,48(5):625-629.
[11] Gurtner A, Falcone E, Garibaldi F, et al. Dysregulation of microRNA bioge-nesis in cancer: the impact of mutant p53 on Drosha complex activity[J]. J Exp Clin Cancer Res, 2016,35(1):45.
[12] 薛迪新,陈积贤,任约翰,等.miR-21和PDCD4 mRNA在大肠癌组织中的表达及其临床意义[J].中华普通外科杂志,2011,26(12):1023-1026.
[13] Qi C, Shao Y, Li N, et al. Prognostic significance of PDCD4 expression in human salivary adenoid cystic carcinoma[J]. Med Oncol, 2013,30(1):491.
[14] Horiuchi A, Iinuma H, Akahane T, et al. Prognostic significance of PDCD4 expression and association with microRNA-21 in each Dukes′ stage of colorectal cancer patients[J]. Oncol Rep, 2012,27(5):1384-1392.
[15] 李日恒,杨瑞红,宋艳敏,等.结直肠癌组织中PAQR3、PDCD4基因甲基化水平与结直肠癌的关系[J].中国老年学杂志,2015,35(13):3533-3535.
[16] 张顺荣,何寄琴,李东芳.程序性细胞死亡因子4(PDCD4)在胃癌中作用的研究进展[J].中华中医药学,2017,35(1):212-214.
10.3969/j.issn.1002-266X.2017.42.029
R735.3
B
1002-266X(2017)42-0088-03
海南省普通医学科研项目(14A210225)。
2017-07-11)

