手性杯[4]丝氨酸衍生物的合成及其催化性能
李正义, 郑崇谦, 陈 远, 殷 乐, 王治明, 孙小强
(常州大学 石油化工学院,江苏 常州 213164)
·研究论文·
手性杯[4]丝氨酸衍生物的合成及其催化性能
李正义, 郑崇谦, 陈 远, 殷 乐, 王治明, 孙小强
(常州大学 石油化工学院,江苏 常州 213164)
以对叔丁基苯酚为原料,经环化缩合、脱叔丁基、酚羟基醚化、甲酰化和氧化反应制得5-羧基-25,26,27,28-四正丙基杯[4]芳烃(5); 5与O-苄基-N-苄氧羰基丝氨酸反应制得5-(O-丝氨酸)-25,26,27,28-四正丙基杯[4]甲酸酯(7),其结构经1H NMR,13C NMR和MS(ESI)表征。研究了溶剂和水的用量对7催化性能的影响。结果表明:水为溶剂,其用量为10 eq.时,收率和非对映选择性分别为95%和3∶97dr;当水的用量为30 eq.时,收率和非对映选择性分别为93%和98 ∶2dr。
对叔丁基苯酚; 杯[4]丝氨酸; 合成; 催化; Mannich反应; 催化性能
杯芳烃作为继环糊精和冠醚之后的第三代超分子主体分子,被广泛应用于分子识别、功能材料及催化反应等领域[1-3]。因其骨架中的空腔具有疏水性能和包结客体分子的功能,基于杯芳烃平台的催化剂在相转移催化领域显示出很好的应用前景[4-7]。此外,由于杯芳烃上下边缘易于修饰和功能化,因此基于杯芳烃平台的手性超分子催化剂的合成已成为一项重要课题,且手性杯芳烃在不对称催化反应领域也得到广泛的应用[3,8-12]。本课题组成功将手性脯氨酸衍生物引入到杯[4]芳烃上沿或下沿形成功能化的有机超分子催化剂,并成功应用到不对称Aldol反应[13]和Biginelli反应[14],展现出了很好的催化效果。

Scheme 1

Scheme 2
近年来,丝氨酸及其衍生物作为催化剂在不对称催化领域中的应用也日益广泛,Yong课题组[15]将叔丁基二苯基硅烷与丝氨酸以醚键形式相连接,成功将其应用于水相中不对称Mannich催化反应中,取得了较好的催化效果。
本文以对叔丁基苯酚为原料,经环化缩合、脱叔丁基、酚羟基醚化、甲酰化及氧化反应制得5-羧基-25,26,27,28-四正丙基杯[4]芳烃(5); 5与O-苄基-N-苄氧羰基丝氨酸(6)反应制得5-(O-丝氨酸)-25,26,27,28-四正丙基杯[4]甲酸酯(7, Scheme 1),其结构经1H NMR,13C NMR和MS(ESI)表征。考察了7及其对应的模型催化剂O-(4-丙氧基苯甲酰基)-丝氨酸(9, Scheme 2)在不对称Mannich反应(Scheme 3)中的催化性能。
1 实验部分
1.1 仪器与试剂
SGW X-4型显微熔点仪(温度未校正);AVANCE 300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);LCMS-2020型质谱仪;LC-20A型高效液相色谱仪[手性测试条件:Danicel Chiralpak AD-H手性色谱柱,洗脱剂:正己烷/异丙醇=80/20(V/V),流速1.0 mL·min-1,柱温25 ℃,检测波长254 nm]。
所用试剂均为分析纯。
1.2 合成
(1) 5,11,17,23-四叔丁基-25,26,27,28-四羟基杯[4]芳烃(1)的合成[16]
在三口瓶中依次加入对叔丁基苯酚80.0 g(531 mmol),甲醛49.6 mL(240 mmol),氢氧化钠0.96 g(24 mmol),于110~120 ℃反应2 h(变成黄色块状固体)。冷却至室温,加入二苯醚640 mL,继续反应1 h;升温至160 ℃回流反应2 h。冷却至室温,加入乙酸乙酯1.2 L,静置(析出白色沉淀),抽滤,滤饼依次用乙酸乙酯,乙酸和蒸馏水洗涤,干燥得白色固体1 51.8 g,收率63%; m.p.>300 ℃;1H NMRδ: 10.34(s, 4H), 7.05(s, 8H), 4.24(d,J=12.5 Hz, 4H), 3.52(d,J=12.5 Hz, 4H), 1.21(s, 36H)。
(2) 25,26,27,28-四羟基杯[4]芳烃(2)的合成[17]
在单口瓶中依次加入1 13.0 g(20.03 mmol),苯酚9.1 g(96.70 mmol)和干燥甲苯200 mL,搅拌下分批加入无水AlCl314.0 g(105 mmol),于室温反应1.5 h。加入1 mol·L-1盐酸100 mL,分液,有机相依次用水和饱和食盐水洗涤至澄清,减压蒸除溶剂,残余物加入甲醇静置,抽滤,滤液经无水Na2SO4干燥得白色固体2 6.7 g,收率79%, m.p.>300 ℃;1H NMRδ: 10.26(s, 4H), 7.08(d,J=7.5 Hz, 8H), 6.75(d,J=7.5 Hz, 4H), 4.28(d,J=12.5 Hz, 4H), 3.62(d,J=12.5 Hz, 4H)。
(3) 25,26,27,28-四正丙基杯[4]芳烃(3)的合成[17]
在烧瓶中依次加入2 19.08 g(45 mmol),NaH 6.48 g(270 mmol)和无水DMF 600 mL,于室温反应至无气泡生成;加入碘丙烷21.8 mL(225 mmol),加毕,升温至55 ℃反应6 h。减压蒸除溶剂,依次加入甲醇,氯仿和稀盐酸溶液,分液,有机相依次用水和饱和食盐水洗涤,无水Na2SO4干燥,减压蒸除氯仿,加入甲醇析出固体,抽滤,滤饼经无水Na2SO4干燥得白色固体3 20.4 g,收率70%, m.p.198~200 ℃;1H NMRδ: 6.61~6.55(m, 12H), 4.47(d,J=13.2 Hz, 4H), 3.90(t,J=7.2 Hz, 8H), 3.17(d,J=13.2 Hz, 4H), 1.94~1.90(m, 8H), 1.01(t,J=7.2 Hz, 12H)。
(4) 5-甲酰基-25,26,27,28-四正丙基杯[4]芳烃(4)的合成[18]
在烧瓶中依次加入3 0.5 g(0.84 mmol)和干燥CHCl325 mL,搅拌下于-35 ℃迅速加入无水四氯化锡0.14 mL(1.26 mmol)和1,1-二氯甲基甲醚0.11 mL(1.26 mmol),加毕,于-35 ℃反应0.5 h(TLC检测)。加入水50 mL淬灭反应,静置,分液,水相用氯仿(3×10 mL)萃取,合并有机相,依次用水和饱和食盐水洗涤,无水Na2SO4干燥,经硅胶柱层析[洗脱剂:A=V(乙酸乙酯)/V(石油醚)=1/10]纯化得白色固体4 0.12 g,收率 22%,m.p.178~179 ℃;1H NMRδ: 9.55(s, 1H), 6.98(s, 1H), 6.73(t,J=5.2 Hz, 4H), 6.67(t,J=7.2 Hz, 2H), 6.43~6.36(m, 3H), 4.49~4.41(m, 4H), 3.93~3.76(m, 8H), 3.24~3.13(m, 4H), 1.95~1.85(m, 8H), 1.05~0.94(m, 12H)。
(5) 5的合成[19]
在单口瓶中加入4 2.0 g(3.22 mmol),氯仿50 mL和丙酮50 mL,搅拌下滴加含NaClO20.78 g(8.63 mol)和NH2SO3H 0.71 g(7.34 mmol)的水溶液4 mL,滴毕,于室温反应15 h。减压蒸除溶剂,加入1 mol·L-1盐酸 20 mL,抽滤,滤饼依次经水洗涤和甲醇重结晶得白色固体5 1.8 g,收率88%, m.p.280~282 ℃;1H NMRδ: 12.23(s, 1H), 7.09(s, 2H), 6.73(d,J=7.6 Hz, 2H), 6.63(t,J=7.6 Hz, 2H), 6.40~6.34(m, 3H), 5.76(s, 2H), 4.35(d,J=13.2 Hz, 2H), 4.33(d,J=13.2 Hz, 2H), 3.84~3.73(m, 8H), 3.24(d,J=13.2 Hz, 2H), 3.16(d,J=13.2 Hz, 2H), 1.89~1.82(m, 8H), 1.00(t,J=7.6 Hz, 6H), 0.95(t,J=7.6 Hz, 6H)。
(6) 7的合成
在单口瓶中加入5 0.32 g(0.5 mmol),二氯甲烷20 mL, 6 0.18 g(0.55 mmol), EDCI 0.14 g(0.75 mmol)和DMAP 30 mg(0.25 mmol),于室温反应10 h。减压除去溶剂,残余物经硅胶柱层析(洗脱剂:A)纯化得白色固体。转移至单口瓶中,加入甲醇15 mL和10%Pd/C催化剂40 mg,在氢气氛围下于室温反应5 h(TLC检测)。在硅藻土助滤下除去Pd/C,减压除去溶剂得白色固体7 0.15 g,收率42%, m.p. 150~151 ℃;1H NMR(CD3OD)δ: 7.43~6.02(m, 11H), 4.63~4.48(m, 1H), 4.41~4.30(m, 4H), 4.01~3.56(m, 10H), 3.15~3.01(m, 4H), 1.89~1.78(m, 8H), 0.98~0.88(m, 12H);13C NMRδ: 7.8, 9.3, 9.4, 9.5, 9.7, 23.0, 23.1, 30.4, 30.5, 76.4, 76.5, 76.6, 121.6, 121.7, 121.8, 122.4, 127.7, 128.1, 128.4, 129.7, 130.2, 133.5, 133.6, 134.5, 134.6, 134.9, 135.4, 136.1, 155.9, 156.0, 156.8, 161.8, 166.3 cm-1; MS(ESI)m/z: 746{[M+Na]+}。
(7) 4-丙氧基苯甲酸(8)的合成[20]
在反应瓶中加入对羟基苯甲酸4.14 g(30 mmol),氢氧化钾5.04 g(75 mmol)和少量去离子水,升温至78~80 ℃,加入碘化钾1.5 g(9 mmol),缓慢滴加含溴丙烷(3.2 mL)的乙醇溶液15 mL,保温反应24 h。加水50 mL,滴加1 mol·L-1盐酸至白色沉淀析出,抽滤,滤饼经乙醇/水重结晶得白色晶体8 4.5 g,收率83%, m.p.143~144 ℃;1H NMRδ: 12.60(s, 1H), 7.88(d,J=8.4 Hz, 2H), 7.00(d,J=8.4 Hz, 2H), 3.99(t,J=6.4 Hz, 2H), 1.85~1.68(m, 2H), 0.97(t,J=7.2 Hz, 3H)。
Scheme 3
(8) 9的合成
在反应瓶中加入8 0.36 g(2.0 mmol), CH2Cl230 mL, 6 0.72 g(2.2 mmol), EDCI 0.58 g(3.0 mmol)和DMAP 0.12 g(1.0 mmol),于室温反应8 h。过滤除去不溶物,滤液减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A)纯化得白色固体。转移至单口瓶,加入甲醇15 mL和10%Pd/C催化剂40 mg,在氢气氛围下于室温反应5 h(TLC检测)。在硅藻土的助滤下除去Pd/C催化剂,滤液减压蒸除溶剂得白色固体9 0.26 g,收率49%, m.p.150~151 ℃;1H NMR(CD3OD)δ: 8.04(d,J=9.0 Hz, 2H), 6.99(d,J=9.0 Hz, 2H), 4.75~4.61(m, 2H), 4.08(dd,J=5.7 Hz, 3.3 Hz, 1H), 4.02(t,J=6.3 Hz, 2H), 1.89~1.78(m, 2H), 1.07(t,J=7.5 Hz, 3H);13C NMRδ: 9.4, 22.1, 53.6, 63.0, 69.4, 113.8, 121.2, 131.7, 163.6, 165.9, 169.3; MS(ESI)m/z: 290 {[M+Na]+}。
(9) 不对称Mannich反应
在试管中加入环己酮0.31 mL(3 mmol),对硝基苯甲醛0.151 g(1 mmol),苯胺0.093 g(1 mmol),水0.54 mL和7 0.014 g(0.02 mmol),于室温反应12 h(TLC检测)。用乙醚(3×2 mL)萃取,合并有机相,用无水MgSO4干燥,过滤,滤液浓缩,残余物经硅胶柱层析(洗脱剂:A)纯化得淡黄色液体10 0.30 g,收率93%;1H NMRδ: 7.42~7.30(m, 4H), 7.26~7.21(m, 1H), 7.11~7.06(m, 2H), 6.59~6.54(m, 2H), 4.83(d,J=4.2 Hz, 1H), 4.73(s, 1H), 2.81~2.74(m, 1H), 2.51~2.31(m, 2H), 1.95~1.76(m, 6H)。
2 结果与讨论
2.1 催化性能
研究了溶剂和水的用量对7催化性能的影响。
(1) 溶剂
环己酮3 mmol, 7 2 mol%,其余条件同1.2(9),研究了不同溶剂对7催化性能的影响,结果见表1。由表1可见,以环己酮自身作溶剂,可获得较好的非对映选择性(5 ∶95),但收率(67%)和主产物(anti)的ee(7%)都不理想。其它溶剂中的收率和立体选择性也较差,其中二氯甲烷和DMSO中的主产物为syn-构型,而乙腈、DMF和1,4-二氧六环中却是anti-构型产物。当水为溶剂时,收率明显提高(84%),且主产物(syn)的ee(38%)也有所提高。表明水的存在有利于7发挥其相转移催化功能,从而提升了反应活性。故最佳溶剂为水。

表1 溶剂对7催化性能的影响
*溶剂2 mL。
(2) 水的用量
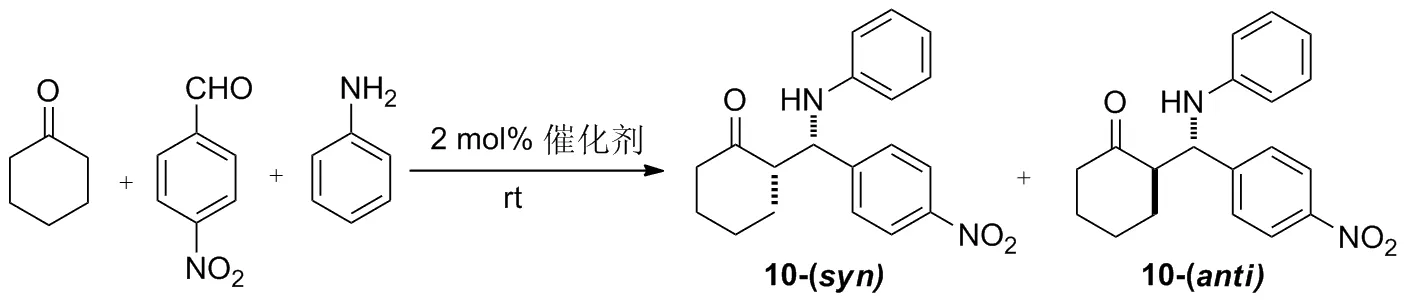
环己酮3 mmol, 7 2 mol%,水为溶剂,其余条件同1.2(9),考察了水的用量对7催化性能的影响,结果见表2。由表2可见,当水的用量为10 eq.时,收率和非对映选择性分别为95%和3∶97,但anti-主产物几乎没有光学活性。随着水的用量增大,syn-产物逐渐占据主导,当水的用量为30 eq.时,立体选择性达到最佳(98 ∶2dr,48%ee),再增加水的用量,反应的收率和选择性都会下降。故最佳水的用量为30 eq.。
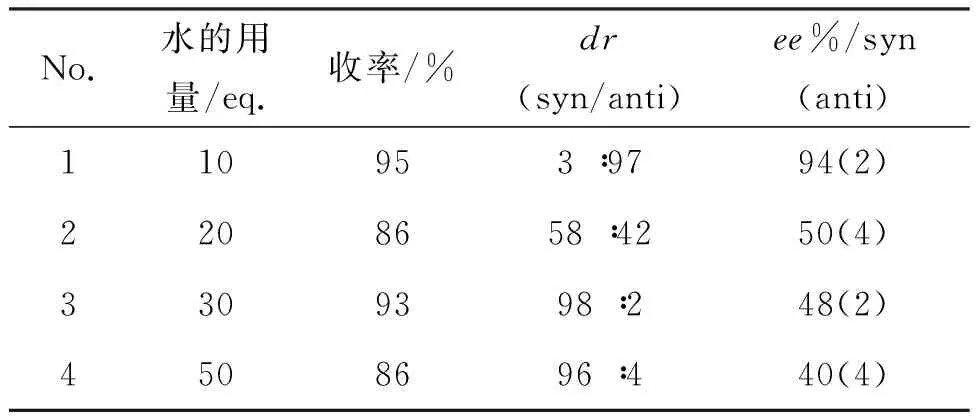
表2 水的用量对7 的催化性能影响
2.2 催化机理
为进一步说明杯芳烃骨架对反应的影响,研究了相同条件下9的催化性能,结果见表3。由表3可见,与7相比,不含空腔的9的催化效果较差,这表明杯芳烃骨架对收率和选择性具有重要的作用:(1)7同时具有疏水的杯芳烃空腔和亲水的氨基和羧基,在水相中可以起到相转移催化功能,从而提高了反应收率; (2)体积较大的杯芳烃骨架有利于反应的立体选择性。此外,杯芳烃空腔与反应底物之间可能存在π—π, C—H…π等超分子相互作用,从而进一步提升了反应的立体选择性。
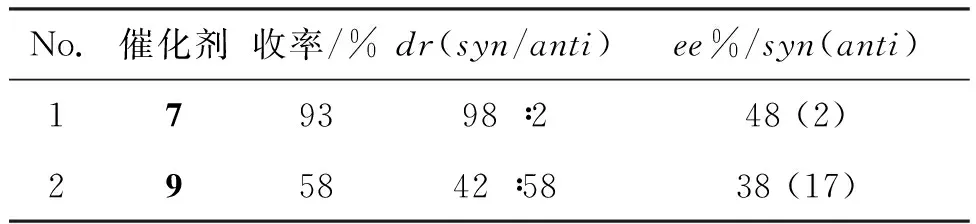
表3 7和9的催化性能对比
将手性的丝氨酸引入杯[4]芳烃的上沿,制备了一种新型的手性超分子7,并成功实现了水相中环己酮、对硝基苯甲醛和苯胺的不对称Mannich反应。催化结果表明,水的存在有利于充分发挥催化剂的相转移催化功能,提高反应的收率,且水的用量可以调控反应的非对映性选择性;相同条件下催化剂7的催化性能明显优于不含空腔的模型催化剂9,从而提出了可能的催化机理。该研究为杯芳烃的应用和水相中绿色不对称反应研究提供了新的思路和重要的参考依据。
[1] Yang H,Yuan B,Zhang X,etal. Supramolecular chemistry at interfaces:Host-guest interactions for fabricating multifunctional biointerfaces[J].Acc Chem Res,2014,47(7):2106-2115.
[2] Delbianco M,Bharate P,Varela-Aramburu S,etal. Carbohydrates in supramolecular chemistry[J].Chem Rev,2016,116(4):1693-1752.
[3] Li Z Y, Chen J W, Liu Y,etal. The use of calixarenes in asymmetric catalysis[J].Curr Org Chem,2011,15(1):39-61.
[4] Yang F F, Guo H Y, Jiao Z Y,etal. Calixarene ionic liquids:Excellent phase transfer catalysts for nucleophilic substitution reaction in water[J].J Iran Chem Soc,2012,9(9):327-332.
[5] Akceylan E, Yilmaz M. Synthesis of calix[4]arene alkylamine derivatives as new phase-transfer catalysts for esterification reaction[J].Tetrahedron,2011,67(34):6240-6245.
[6] Wan L M, Li H X, Zhao W,etal. Oxidative polymerization of 2,6-dimethylphenol to form poly (2,6-dimethyl-1,4-phenylene oxide) in water through one water-soluble copper(II) complex of a zwitterionic calix[4]arene[J].J Polym Sci Pol Chem,2012,50(23):4864-4870.
[7] 李成龙,徐珍,吕早生,等. 杯芳冠醚的合成及其催化合成对氟硝基苯[J].化工进展,2016,35(7):2109-2113.
[8] Uyanik A,Bayrakci M,Eymur S,etal. Upper rim-functionalized calix[4]arene-based L-proline as organocatalyst for direct asymmetric aldol reactions in water and organic media[J].Tetrahedron,2014,70(49):9307-9313.
[9] Khiri-Meribout N,Bertrand E,Bayardon J,etal.p-Chirogenic phosphines supported by calix [4] arene:New insight into palladium-catalyzed asymmetric allylic substitution[J].Organometallics,2013,32(9):2827-2839.
[10] Durmaz M, Tataroglu A, Yilmaz H,etal. Calixarene-derived chiral tertiary amine-thiourea organocatalyzed asymmetric Michael additions of acetyl acetone and dimethyl malonate to nitroolefins[J].Tetrahedron:Asymmetry,2016,27(2-3):148-156.
[11] Herbert S A, Van L J, Castell D C,etal. Inherently chiral calix[4]arenes via oxazoline directed ortholithiation:Synthesis and probe of chiral space[J].Beilstein J Org Chem,2014,10(1):2751-2755.
[12] Eymur S, Akceylan E, Sahin O,etal. Direct enantioselective aldol reactions catalyzed by calix[4]arene-based L-proline derivatives in the water[J].Tetrahedron,2014,70(30):4471-4477.
[13] Li Z Y, Chen J W, Wang L Y,etal. Highly enantioselective direct aldol reactions catalyzed by proline derivatives based on a calix[4]arene scaffold in the presence of water[J].Synlett,2009,(14):2356-2360.
[14] Li Z Y, Xing H J, Huang G L,etal. Novel supramolecular organocatalysts of hydroxyprolinamide based on calix[4]arene scaffold for the enantioselective Biginelli reaction[J].Sci Chin Chem,2011,54(11):1726-1734.
[15] Teo Y C, Lau J J, Wu M C. Direct asymmetric three-component Mannich reactions catalyzed by a siloxy serine organocatalyst in water[J].Tetrahedron:Asymmetry,2008,19(2):186-190.
[16] Gutsche C D, Iqbal M.p-tert-Butylcalix[4]arene[J].Org Synth,1990,68:234-237.
[17] Düker M H, Gómez R, Velde C M L V,etal. Upper rim tetrathiafulvalene-bridged calix[4]arenes[J].Tetrahedron Lett,2011,52(22):2881-2884.
[18] Arduini A, Fanni S, Manfredi G,etal. Direct regioselective formylation of tetraalkoxycalix[4]arenes fixed in the cone conformation and synthesis of new cavitands[J].J Org Chem,1995,60(5):1448-1453.
[19] Sansone F, Barboso S, Casnati A,etal. Synthesis and structure of chiral cone calix[4]arenes functionalized at the upper rim with L-alanine units[J].Eur J Org Chem,1998,(5):897-905.
[20] 贾永飞,韩相恩,冯卫方. 末端为噻吩基团酯类化合物的合成、表征及液晶性能研究[J].化工新型材料,2010,2(38):29-31.
Synthesis and Catalytic Properties of Chiral Calix[4]serine Derivative
LI Zheng-yi, ZHENG Chong-qian, CHEN Yuan, YIN Yue, WANG Zhi-ming, SUN Xiao-qiang*
(School of Petrochemical Engineering, Changzhou University, Changzhou 213164, China)
5-Carboxyl-25,26,27,28-tetra(1-propyloxy)calix[4]arene(5) was synthesized by serial reactions of cyclizative condensation, elimination of tert-butyl, etherification of phenolic hydroxyl, formylation and oxidation reaction from para tert-butyl phenol. 5-(O-serine)-25,26,27,28-tetra(1-propyloxy)calix[4]arene formate(7) was prepared by reaction of 5 withO-benzyl-N-[(benzyloxy)carbonyl]serinate. The structure was characterized by1H NMR,13C NMR, and MS(ESI). Catalytic properties of 7 were investigated by screening different solvents and loading of water. The results illustrated that 95% yield and 3 ∶97drwere observed when the reaction was performed in 10 eq. water while 93% yield and 98 ∶2drwere obtained by using 30 eq. water.
para tert-butyl phenol; calix[4]serine; synthesis; catalysis; Mannich reaction; catalytic property
2016-08-30;
2017-01-04
国家自然科学基金资助项目(21572026, 21002009); 江苏省高校自然科学研究重大项目(14KJA150002); 常州大学江苏省先进催化与绿色制造协同创新中心资助项目(ACGM2016-06-05)。
李正义(1979-),男,汉族,江苏扬州人,博士,主要从事有机合成和催化的研究。 E-mail: zyli@cczu.edu.cn
孙小强,教授, E-mail: sunxiaoqiang@yahoo.com
O625.31; O621.3
A
10.15952/j.cnki.cjsc.1005-1511.2017.03.16222

