奈达铂同步化疗对中晚期宫颈癌患者uPA、VEGF及Ki-67表达的影响
束萍凤
·论著·
奈达铂同步化疗对中晚期宫颈癌患者uPA、VEGF及Ki-67表达的影响
束萍凤
目的 探讨奈达铂同步化疗对中晚期宫颈癌患者uPA、VEGF及Ki-67表达的影响。方法 收治的80例原发性宫颈癌患者随机分为观察组和对照组,每组40例。观察组采用奈达铂同步化疗治疗,对照组采用单纯放疗治疗,比较2组患者治疗效果及治疗前后uPA、VEGF和Ki-67表达阳性率变化。结果 观察组治疗总有效率为95.0%显著高于对照组的80.0%(P<0.05);随访期2组患者生存率、复发率和远处转移率差异有统计学意义(P<0.05);宫颈癌患者癌变组织中uPA、VEGF和Ki-67表达阳性率显著高于正常宫颈组织,差异有统计学意义(P<0.05);2组患者治疗后uPA、VEGF和Ki-67表达阳性率显著下降(P<0.05),且观察组下降程度显著高于对照组(P<0.05);观察组患者奈达铂同步化疗Ki-67阳性组化疗有效率显著高于阴性组,差异有统计学意义(P<0.05);观察组与对照组不良反应率比较差异无统计学意义(P>0.05)。结论 奈达铂同步化疗能够显著降低中晚期宫颈癌患者宫颈组织中uPA、VEGF和Ki-67表达阳性率,提高中晚期宫颈癌患者治疗疗效,且患者能够耐受相关不良反应,值得临床推广使用。
同步放化疗;宫颈肿瘤;血管内皮生长因子;尿激酶型纤溶酶原激活物;Ki-67
宫颈癌是发病率居于第二位的恶性肿瘤,占所有女性恶性肿瘤疾病的13%[1]。据世界卫生组织国际癌症研究署估计,59%的宫颈癌发生在亚洲,我国宫颈癌发病率为9.98/10万,病死率为3.25/10万,对我国女性身体健康产生严重影响[2]。宫颈癌患者临床治疗以根治性手术和放疗为主,疗效确切,但对于中晚期宫颈癌患者来说,放疗效果更好。然而,由于约35%的浸润性宫颈癌患者在放疗后出现复发或疾病尚未控制,故单纯放疗疗效并不理想[3]。同步放化疗(CCRT)方案应用小剂量化疗药物增加患者肿瘤细胞对化疗敏感性,提高化疗对肿瘤细胞的杀伤效果,目前这一治疗方案已成为中晚期宫颈癌患者标准治疗方案[4]。血管内皮生长因子(VEGF)、尿激酶型纤溶酶原激活物(uPA)和Ki-67是研究最多的肿瘤标志物,其在肿瘤组织中的表达水平能够有效预测化疗反应,但同步放化疗对于该类肿瘤标志物影响的研究报道甚少。我院于2012年3月开始采用奈达铂同步放化疗治疗中晚期宫颈癌患者,观察患者治疗前后VEGF、uPA和Ki-67变化,分析其与临床疗效的相关性,为临床筛选中晚期宫颈癌患者同步放化疗方案提供理论指导。
1 资料与方法
1.1 一般资料 选择盐城市大丰区人民医院2011年3月至2015年3月所收治的原发性中晚期宫颈癌患者80例,年龄40~70岁,平均年龄(58.3±10.7)岁。FIGO分期情况:ⅡB期20例,ⅢA期47例,ⅢB期13例;组织学分级情况:G1级11例,G2级45例,G3级24例;肿瘤直径:<4 cm 20例,≥4 cm 60例;病理类型:鳞癌51例,腺癌29例。将80例患者随机分为观察组和对照组,每组40例。观察组采用奈达铂同步化疗治疗,对照组采用单纯放疗治疗。2组患者年龄、FIGO分期、组织学分级和病理类型等一般资料比较差异无统计学意义(P>0.05),具有可比性。另选取因子宫肌瘤采用子宫全部切除术治疗的正常宫颈组织30例作为正常宫颈组织对照。本研究获得患者及其家属同意,并签署知情同意书,并符合伦理委员会相关要求,获得我院伦理委员会批准。见表1。
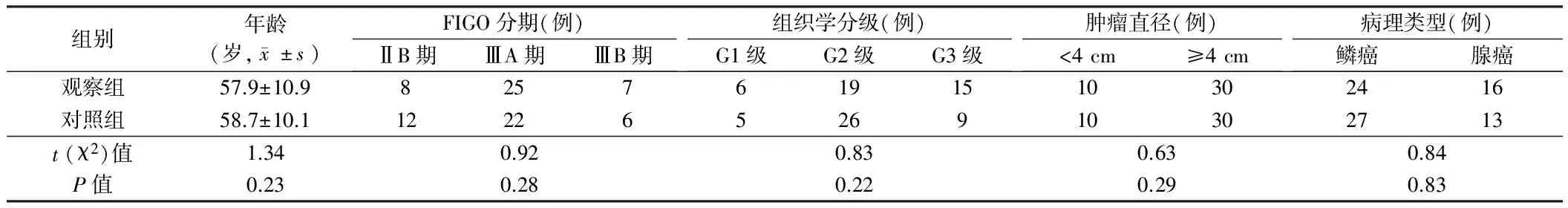
表1 2组患者一般资料比较 n=40
1.2 纳入与排除标准
1.2.1 纳入标准:①近2周未服用化疗药物或者影响本次研究疗效的药物;②纳入经病理活检确诊的患者;③纳入符合国际妇产科协会(FIGO)和国际妇科肿瘤协会(IGCS)2009年共同制定的 《妇科恶性肿瘤分期及临床实践指南》[5]中宫颈癌诊断标准患者 ;④纳入治疗前肝肾功能、血常规和心电图检查无明显异常患者;⑤纳入凝血功能正常,血小板计数≥100×109/L,血白细胞计数≥4×109/L患者;⑥纳入自愿参与本研究的患者。
1.2.2 排除标准:①排除具有化疗禁忌证患者;②排除恶性肿瘤病史患者;③排除合并其他恶性肿瘤患者;④排除孕妇或妊娠期女性。
1.3 方法 对照组采用单纯放疗,采取体外照射与腔内近距离装照射联合放疗方式进行,共放疗5周,具体放疗方案:采用6~15MVX线进行放疗,体外照射为全盆腔前后野对穿照射,2.0Gy/次,5 次/周。照射4周后改为盆腔四野照射,中挡铅,2.0Gy/次,5次/周。与四野照射同时进行腔内后装治疗,总剂量为30Gy。放疗期间每天进行阴道冲洗,每周行血常规检查,并定期复查肝肾功能,必要时给予止吐、升高白细胞、护肝和护肾等对症处理。观察组患者在放疗的间隙期进行化疗,化疗方案:每周第2、3天时,静脉滴注奈达铂40mg/m2,直至外照结束时停止。
1.4 观察指标
1.4.1 疗效评价:2组患者在治疗前和治疗后3个月时进行近期疗效评价,具体评价标准参照国际抗癌联盟(UICC)疗效评价标准[6]进行,将肉眼观察无新病灶产生,肿瘤完全消失视为完全缓解(CR),肿瘤缩小高于50%且无新病灶产生视为部分缓解(PR),肿瘤缩小低于50%且无新病灶产生视为稳定(SD),肿瘤无缩小且有新病灶产生视为进展(PD),CR和PR率之和记为治疗总有效率。所有患者随访1年,记录随访期间患者生存率、复发率和远处转移率,并记录患者不良反应情况。
1.4.2 宫颈癌组织中uPA、VEGF及Ki-67表达情况:取患者治疗前、治疗结束后3个月时宫颈组织以及正常宫颈组织进行免疫组化检测,检测宫颈组织中uPA、VEGF及Ki-67表达阳性率。检测方法为免疫组化SP法[7],具体操作参照试剂盒(武汉博士德生物工程有限公司)说明书进行。采用PBS代替一抗作为阴性对照,采用已知阳性切片作为阳性对照。Ki-67阳性为细胞核出现棕黄色颗粒,uPA和VEGF阳性为细胞质内出现棕黄色颗粒。所有组织切片在400倍的光镜下随机选取10个视野观察,统计阳性细胞数目,计算阳性细胞百分比。uPA、VEGF及Ki-67表达阳性判断标准:阳性细胞半分比≥10%视为阳性,<10%视为阴性。
1.4.3 患者治疗期间不良反应参照CommonTerminologyCriteriaforAdverseEventsv3.0 (CTCAE)标准评价。

2 结果
2.1 2组患者治疗效果评价 所有患者除死亡者外,均在1年内获得随访并记录结果。观察组治疗结束3个月时治疗总有效率为95.0%(38/40),对照组治疗总有效率为80.0%(32/40),2组近期疗效差异有统计学意义(P<0.05)。随访1年,2组患者生存率、复发率和远处转移率比较,差异均有统计学意义(P<0.05)。见表2,图1。
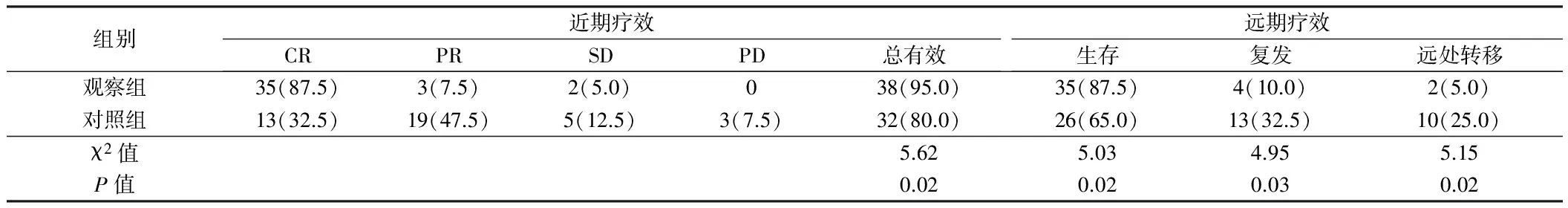
表2 2组患者疗效比较 n=40,例(%)
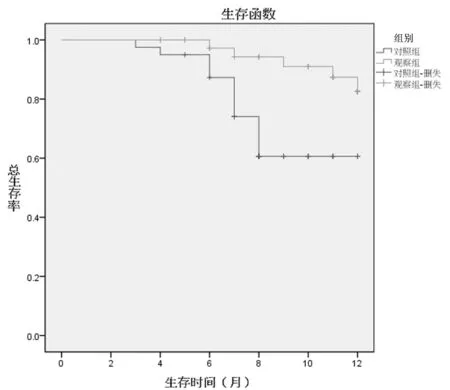
图1 2组患者的生存曲线
2.2 正常宫颈组织与癌变组织uPA、VEGF和Ki-67比较 宫颈癌患者癌变组织中uPA、VEGF和Ki-67表达阳性率显著高于正常宫颈组织,差异有统计学意义(P<0.05)。见表3。
2.3 2组患者治疗前后uPA、VEGF和Ki-67比较 2组患者治疗后uPA、VEGF和Ki-67表达阳性率显著下降(P<0.05),且观察组下降程度显著高于对照组(P<0.05)。见表4,图2。
2.4 2组不良反应情况比较 2组患者不良反应发生情况差异无统计学意义(P>0.05)。见表5。
3 讨论
宫颈癌是发病率仅次于乳腺癌的恶性女性肿瘤疾病,中晚期的宫颈癌治疗方以放疗为主[8]。但近二十年来,放疗治疗中晚期宫颈癌疗效进入平台期,治疗效果并欠佳。宫颈癌特殊的解剖位置和细胞特性决定了化疗对其敏感性较差[9]。近年来,部分学者研究发现小剂量的化疗药物能够提高宫颈癌患者对放疗的敏感性,从而提高治疗效果。美国国立癌症研究所提出将同步放化疗(CCRT)方案作为晚期宫颈癌治疗的标准方案。尽管治疗效果显著,但同步放化疗对血管内皮生长因子(VEGF)、尿激酶型纤溶酶原激活物(uPA)和Ki-67等肿瘤标志物影响的研究报道较少[10]。本研究采用奈达铂同步放化疗治疗中晚期宫颈癌患者,观察患者治疗前后VEGF、uPA和Ki-67变化,旨在为临床筛选中晚期宫颈癌患者同步放化疗方案提供理论依据。

表3 正常宫颈组织与癌变组织uPA、VEGF和Ki-67表达阳性率比较 例(%)

表4 2组患者治疗前后uPA、VEGF和Ki-67表达阳性率比较 n=40,例(%)
CCRT治疗方案是近年来宫颈癌治疗的新进展,但其并非是简单的放疗和化疗叠加,而是通过小剂量化疗药物增加肿瘤细胞对放疗的敏感性来提高治疗效果[11]。Ushijima等[12]采用同步放化疗治疗局部晚期宫颈癌患者,治疗总有效率为94.1%,5年Ⅰ期生存率为71.5%,Ⅲ期生存率为46.2%,复发率为58.8%。从宵霞[13]分别采用同步放化疗和单独放疗治疗中晚期宫颈癌患者,治疗结束后3月时2组治疗有效率均为100%,疗效较好。笔者采用同步放化疗和单独放疗治疗中晚期宫颈癌患者,治疗总有效率分别为95.0%和 80.0%,差异有统计学意义(P<0.05),随访期2组患者生存率、复发率和远处转移率差异显著(P<0.05),与Sirák等[14]研究结果一致。分析认为,奈达铂同步放化疗能够提高放疗敏感性,从而提高疗效。奈达铂提高肿瘤细胞放疗敏感性可能机制[15]:(1)奈达铂能够直接破坏宫颈癌组织中DNA复制,杀灭放射部位癌细胞,从而增加控制率,降低远处转移率;(2)奈达铂能够抑制肿瘤细胞放疗后的快速增值;(3)奈达铂同步化G/S期加强了癌组织的放射效应;(4)奈达铂对放射剂量-反应曲线产生影响,从而抑制损伤修复,起到放疗增敏的作用。
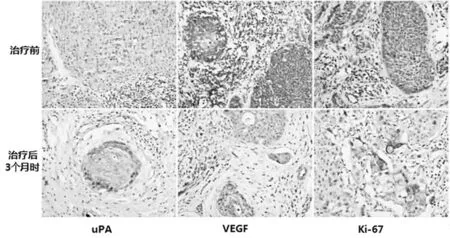
图2 治疗前后uPA、VEGF和Ki-67在宫颈癌组织中的阳性表达(SP×400)

表5 2组患者不良反应情况比较n=40,例(%)
血管渗透性因子(VEGF)能够促进内皮细胞增殖和血管新生,与肿瘤组织复发和远处转移显著相关[16];uPA为丝氨酸蛋白酶中的一种,肿瘤组织中的具有活性的uPA能够转化为纤溶酶,从而降解肿瘤细胞基底膜和细胞外基质成分,最终引起肿瘤细胞侵袭和转移[17]。本研究观察发现,奈达铂同步放化疗后VEGF和uPA表达阳性率降低,提示奈达铂同步放化疗下调了VEGF和uPA表达,抑制宫颈癌进展,提高治疗效果。
Ki-67是近年来研究最多的肿瘤标志物,与肿瘤生物学行为和患者预后相关,患者化疗后组织标本中的表达量对于预测化疗反应意义重大。以往研究表明,Ki-67在正常宫颈、、癌前病变和宫颈癌中表达阳性率差异显著,是反映宫颈癌细胞增值活性的灵敏性指标[18]。本研究发现,宫颈癌患者癌变组织中Ki-67表达阳性率显著高于正常宫颈组织,与刘嵘等[19]研究结果一致。刘嵘等[20]指出,新辅助化疗后宫颈癌组织中Ki-67表达阳性率降低,且术前Ki-67表达阴性患者治疗有效率低,提示Ki-67表达阳性率可作为新辅助化疗疗效的参考指标。但是,关于奈达铂同步放化疗患者治疗前后Ki-67表达阳性率变化笔者未见文献报道。笔者还发现,同步放化疗治疗宫颈癌患者,患者治疗后Ki-67表达阳性率低于单独放疗组,Ki-67表达阳性率与治疗效果相关,提示奈达铂同步放化疗能够提高患者肿瘤细胞对放疗敏感性,从而进一步降低Ki-67表达情况,提高治疗效果。同时,Ki-67表达阳性率可作为同步放化疗治疗效果的参考指标。
综上所述,奈达铂同步化疗能够有效提高患者治疗有效率和生存率,降低复发率和远处转移率,并显著降低中晚期宫颈癌患者宫颈组织中uPA、VEGF和Ki-67表达阳性率,提高治疗效果。在不良反应方面,患者能够耐受相关不良反应,值得临床推广使用。
1UmayaharaK,TakekumaM,HirashimaY,etal.PhaseIIstudyofconcurrentchemoradiotherapywithweeklycisplatinandpaclitaxelinpatientswithlocallyadvanceduterinecervicalcancer:TheJACCROGY-01trial.Gynecologiconcology,2015,140:253-258.
2ParkSH,SohnTS,LeeJ,etal.PhaseIIItrialtocompareadjuvantchemotherapywithcapecitabineandcisplatinversusconcurrentchemoradiotherapyingastriccancer:finalreportoftheadjuvantchemoradiotherapyinstomachtumorstrial,includingsurvivalandsubsetanalyses.JournalofClinicalOncology,2015,33:3130-3136.
3 靳红,张云艳,李奇,等.同步放化疗联合斑蝥酸钠维生素B6注射液治疗晚期宫颈癌的疗效分析.实用临床医药杂志,2013,17:149-151.
4YamadaS,YanamotoS,TakahashiH,etal.FeasibilityofpostoperativeconcurrentchemoradiotherapyinJapanesepatientswithoralsquamouscellcarcinomashowinghigh-riskfactorsforrecurrence.JournalofOralandMaxillofacialSurgery,Medicine,andPathology,2015,27:11-15.
5 中华人民共和国国家卫生和计划生育委员会.宫颈癌及癌前病变规范化诊疗指南(试行).医药前沿杂志(电子版),2013,43:40-49.
6MichelettiE,LaFaceB,BianchiE,etal.ContinuousinfusionofcarboplatinduringconventionalradiotherapytreatmentinadvancedsquamouscarcinomaofthecervixuteriIIB-IIIB(UICC):aphaseI/IIandpharmacokineticstudy.Americanjournalofclinicaloncology,1997,20:613-620.
7KimCK,ParkSY,ParkBK,etal.Bloodoxygenationlevel-dependentMRimagingasapredictoroftherapeuticresponsetoconcurrentchemoradiotherapyincervicalcancer:apreliminaryexperience.Europeanradiology,2014,24:1514-1520.
8 王琦,黄桂琼.根治性子宫切除术联合术前同步放化疗治疗局部晚期宫颈癌的临床疗效及预后多因素分析.实用癌症杂志,2014,29:1032-1034.
9LiXS,FanHX,FangH,etal.ValueofR2*obtainedfromT2*-weightedimaginginpredictingtheprognosisofadvancedcervicalsquamouscarcinomatreatedwithconcurrentchemoradiotherapy.JournalofMagneticResonanceImaging,2015,42:681-688.
10TakekumaM,KasamatsuY,KadoN,etal.Reconsiderationofpostoperativeconcurrentchemoradiotherapywithfluorouracilandcisplatinforuterinecervicalcancer.JournalofObstetricsandGynaecologyResearch,2015,41:1638-1643.
11 陈艳,廖妮红,黄雪芳,等.顺铂联合多西他赛同步放化疗治疗中晚期宫颈癌的临床观察.实用癌症杂志,2014,29:699-701.
12UshijimaK,FujiyoshiK,KawanoK,etal.Concurrentchemoradiotherapywithlow-dosedailycisplatinforhighriskuterinecervicalcancer:along-termfollow-upstudy.JournalofGynecologicOncology,2013,24:108-113.
13 从宵霞.宫颈癌放疗增敏研究进展及TC同步放化疗治疗中晚期宫颈癌疗效观察.肿瘤研究与临床,2012,24:126-128.
14SirákI,PeteraJ,OdrazkaK,etal.Chemotherapyintensityimportanceinconcurrentchemoradiotherapyoflocallyadvancedcervicalcancer.Ceskagynekologie/CeskalekarskaspolecnostJEvPurkyne,2006,71:308-311.
15 刘倩,刘忠山,赵汝栋,等.顺铂增敏同步放化疗治疗中晚期宫颈癌的疗效.中国老年学杂志,2014,16:4712-4714.
16 热伊拉·麦买提伊敏,开丽曼·阿不都巴热,杨杰,等.多西紫杉醇联合顺铂同步放化疗治疗中晚期宫颈癌的疗效观察.医药前沿,2015,5:84-85.
17KawaguchiR,NakamuraH,MoriokaS,etal.ComparisonofNeoadjuvantIntraarterialChemotherapyVersusConcurrentChemoradiotherapyinPatientsWithStageIIIBUterineCervicalCancer.WorldJournalofOncology,2014,4:221-229.
18TokunagaH,NakanishiT,IwataT,etal.Effectsofchemotherapyonpatientswithrecurrentcervicalcancerpreviouslytreatedwithconcurrentchemoradiotherapy:aretrospectivemulticentersurveyinJapan.InternationalJournalofClinicalOncology,2015,20:561-565.
19 刘嵘,濮德敏,祝达,等.uPA,Ki-67 和VEGF在宫颈癌组织中的表达及相关性研究.华中科技大学学报:医学版,2014,43:516-519.
20 刘嵘,李天,何泓,等.宫颈癌新辅助化疗前后uPA,VEGF和Ki-67 的表达及其临床意义.华中科技大学学报:医学版,2013,42:712-714.
Efffects of nedaplatin concurrent chemotherapy on the expression levels of uPA,VEGF and Ki-67 in patients with cervical cancer at middle stage or advanced stage
SHUPingfeng.
DepartmentofObstetricsandGynecology,People’sHospitalofDafengDistrict,Jiangsu,Yancheng224100,China
Objective To observe the efffects of nedaplatin concurrent chemotherapy on the expression levels of uPA,VEGF and Ki-67 in patients with cervical cancer at middle stage or advanced stage.Methods Eighty patients with primary cervical cancer who were admitted and treated in our hospital from March 2011 to March 2012 were randomly divided into observation group (n=40)andcontrolgroup(n=40).Thepatientsinobservationgroupweretreatedbynedaplatinconcurrentchemotherapy,however,thepatientsincontrolgroupweretreatedbyradiotherapyonly.ThetherapeuticeffectsandpositiveexpressionratesofuPA,VEGFandKi-67beforeandaftertreatmentwereobservedandcomparedbetweentwogroups.Results The total effective rate in observation group was 95.0%,which was significantly higher than that (80.0%) in control group (P<0.05).Duringfollow-upthereweresignificantdifferencesinsurvivalrate,relapserateanddistantmetastasisratebetweentwogroups(P<0.05).ThepositiveexpressionratesofuPA,VEGFandKi-67incanceroustissuesofpatientswithcervicalcancerweresignificantlyhigherthanthoseinnormalcervicaltissues(P<0.05).ThepositiveexpressionratesofuPA,VEGFandKi-67wereobviouslydecreasedaftertreatmentinbothgroups(P<0.05),moreover,thedecreasedegreeinonservationgroupwasmoreobviousthanthatincontrolgroup(P<0.05).TheeffectiveratesinobservationgroupwithpositiveKi-67weresignificantlyhigherthanthoseinobservationgroupwithnegativeKi-67 (P<0.05).Howevertherewerenosignificantdifferencesintheincidenceratesofadversereactionsbetweentwogroups(P>0.05).Conclusion The nedaplatin concurrent chemotherapy can obviously decrease the positive expression rates of uPA,VEGF and Ki-67 in patients with cervical cancer at middle stage or advanced stage and can enhance therapeutic effect,without obvious adverse reactions,thus,which is worth using widely in clinical practice.
concurrent chemoradiotherapy; cervix neoplasms;vascular endothelial growth factor;urokinase-type plasminogen activator; Ki-67
10.3969/j.issn.1002-7386.2017.04.004
224100 江苏省盐城市大丰区人民医院妇产科
R
A
1002-7386(2017)04-0495-05
2016-08-19)

