鹅Caspase-1基因的克隆与序列分析
刘文俊,邱金辉,阳佑天,黄运茂,许丹宁,田允波
(1.仲恺农业工程学院动物科技学院,广东 广州 510225;2.广东省水禽健康养殖重点实验室,广东 广州 510225;3.佛山科学技术学院医药工程学院,广东 佛山 528000)
广东是养鹅大省,素有“水禽之乡”的美誉,2009年以来鹅饲养量稳定在7 000万只以上,每年以2%左右的速度递增[1-2]。养殖技术水平落后引致的免疫紊乱、疫病频发,造成了巨大的经济损失,限制了养鹅业的发展[3]。炎症在动物疾病的发生发展中起着重要作用,对炎症系统的研究有助于从分子层面了解致病机制。
半胱氨酸蛋白酶(Caspase)家族是一类具有特异性天冬氨酸的半胱氨酸蛋白酶,该家族蛋白在细胞凋亡和炎症机制网络中居中心地位[4]。Caspase-1是Caspase家族中最早被鉴定的成员,其在细胞凋亡中的作用并不突出,但是在炎症的发生中起关键作用[5]。该蛋白以前体pro-Caspase-1的形式存在于细胞质中,被称为“炎性体”的胞质中多种蛋白构成的复合体激活,水解成具有活性的Caspase-1,并进一步切割/加工前白介素1β(pro-IL-1β)和前白介素18(pro-IL-18),使之成为成熟的促炎细胞因子IL-1β和IL-18,进而促使细胞炎症的发生[6-7]。NLRP3炎性体是研究最为透彻的炎性体之一,该炎性体于2002年由Martinon等研究发现,它由NLRP3分子与下游凋亡相关点样蛋白(ASC)、Caspase-1组成,该复合体对Caspase-1的激活非常重要[8-9]。NLRP3蛋白主要表达于巨噬细胞、单核细胞、中性粒细胞等髓系细胞,能够被多种类型的刺激物激活,包括损伤/危险信号相关分子模式(DAMP)和病原体相关分子模式(PAMP),可通过识别胞内的ROS等因子激活,激活的Caspase-1还可降解抗炎因子Sirtuin-1〔一种烟酰胺腺嘌呤二核苷酸(NAD)依赖的组蛋白脱乙酰酶蛋白〕,在细胞内诱导其他炎症途径的激活[10]。
目前关于鹅炎症系统的基础研究未见报道,相关基因还未有克隆。本研究采用兼并引物法,参考鸡的Caspase-1基因设计引物,克隆鹅炎症通路关键蛋白Caspase-1全长基因,并进行了系统的生物信息学分析,为进一步研究鹅炎症系统的功能和作用奠定基础。
1 材料与方法
1.1 试验材料
试验动物:70日龄健康马岗鹅3只,购自清远市金羽丰鹅业有限公司。屠宰后,无菌采集鹅的脾脏,-80℃保存备用。
主要试剂:Trizol RNA 提取试剂盒、PrimeScript RT-Master反转录试剂盒、Taq DNA聚合酶、胶回收试剂盒、pMD18-T Vector、Marker、DH5α感受态细胞等,均购自TaKaRa公司。
主要仪器:核酸凝胶成像系统(Tanon 4100,上海)、超微量分光光度计(Nano-200,美国)、PCR仪(ABI2720,美国)和4℃冷冻高速离心机(Thermo,美国)。
1.2 试验方法
1.2.1 引物设计及合成 参照GenBank数据库中鸡Caspase-1基因的核苷酸序列(No.AF031351),设计1对PCR扩增引物对(P1:5′CAGGGCCACCCCGCAGAC3′,P2:5′GGGTGGAAGTGGCTCTCAGGG3′),由上海生工生物工程技术服务有限公司合成。
1.2.2 RNA提取与全长基因扩增 采用Trizol RNA提取试剂盒,从鹅脾脏中提取总RNA,cDNA的合成采用PrimeScript RT-Master反转录试剂盒,按说明书操作。以总RNA反转录的cDNA为模板,利用引物对Caspase-1基因进行PCR扩增,总反应体系为25μL,包括 10×PCR buffer 2.5μL,2.5 mmol/L dNTP 2μL,上下游引物(10μmol/L)各 0.75μL,Ex Taq 0.25 μL,dH2O 16.75μL,cDNA模板 2μL。反应条件为:95℃ 30 s;95℃ 30 s、50℃ 30 s、72℃ 2 min,30个循环,PCR产物经1%琼脂糖凝胶电泳,凝胶成像系统检测。在紫外灯下切取目的片段,利用凝胶回收试剂盒按说明回收纯化,并连接T载体,使用BamHⅠ和HindⅢ酶切鉴定后,送上海生工生物工程技术服务有限公司测序。
1.2.3 序列分析与结构预测 测序结果采用Seqmen软件进行拼接,使用Blast N程序将拼接序列在GenBank数据库中比对鉴定。ORF分析采用SeqBuilder软件进行划分,并翻译成氨基酸序列。在GenBank数据库下载已发表的所有物种Caspase-1基因序列,用MegAlign软件进行同源性比较。蛋白理化性质分析采用ExPAsy服务系统中的ProtParam工具(http://web.expasy.org/protparam/);蛋白二级结构分析采用PredictProtein 在线分析工具(https://www.predictprotein.org/);蛋白结构域分析采用NCBI CDD Tools在线软件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi);蛋白三维建模,通过将氨基酸序列提交至瑞士生物信息研究所(SIB)SWISS-MODEL服务器(http://swissmodel.expasy.org/),利用 Automated Mode,搜索与目的序列结构相似的氨基酸序列,以搜索到的模板蛋白质PDB作为同源性模板预测蛋白质3D结构[11]。利用MEGA6软件构建系统发育进化树,基于General Time Reversible model(GTR) 模型,以最大似然法构建进化树,并采用重复抽样分析1 000次的方法检验各分支的置信度。
2 结果与分析
2.1 马岗鹅Caspase-1基因克隆和序列测定
应用兼并引物,以鹅脾脏cDNA为模板,RT-PCR扩增,凝胶电泳结果显示成功扩增片段,长度约为1 200 bp(图1)。对目的片段连接的T载体进行酶切和测序验证,测序结果显示大小为1 233 bp(图2)。通过GenBank数据库中Blast N比对,鉴定结果显示所克隆的基因为Caspase-1基因,表明成功克隆了鹅Caspase-1基因,命名为go-Caspase-1。SeqBuilder软件ORF Finder分析显示,go-Caspase-1扩增片段包含完整的ORF,长度为813 bp,编码270个氨基酸(图3)。将该序列提交至GenBank数据库,序列登录号为MG463109。
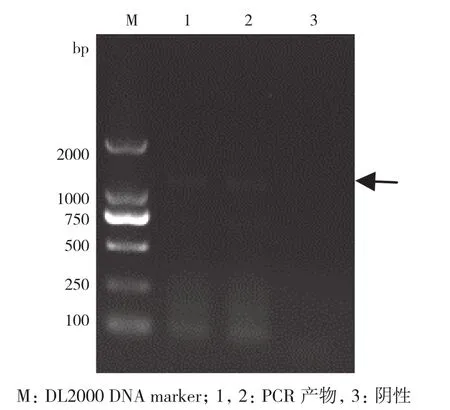
图1 马岗鹅Caspase-1基因的扩增
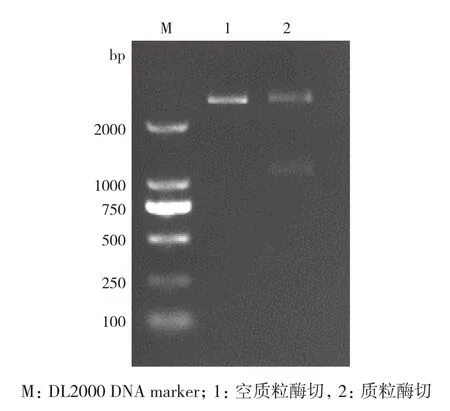
图2 马岗鹅Caspase-1质粒的酶切鉴定

图3 马岗鹅Caspase-1核苷酸及蛋白质序列
2.2 Caspase-1基因序列同源性分析
使用DNAstar软件将鹅与人、鼠、大鼠、猪、牛、羊、马、鸡、鸭、家蝇等18个物种的Caspase-1编码区进行基因同源性比对分析,结果(图4)显示,鹅与其他物种的同源性在99.1%~37.4%之间,鹅与鸭的同源性最高为99.1%,与鸡达到84.6%,与中华鳖为64.7%,与余物种的基因同源性均低于60%,证明不同物种间该基因的同源性差异较大,在禽类中有较高的同源性。
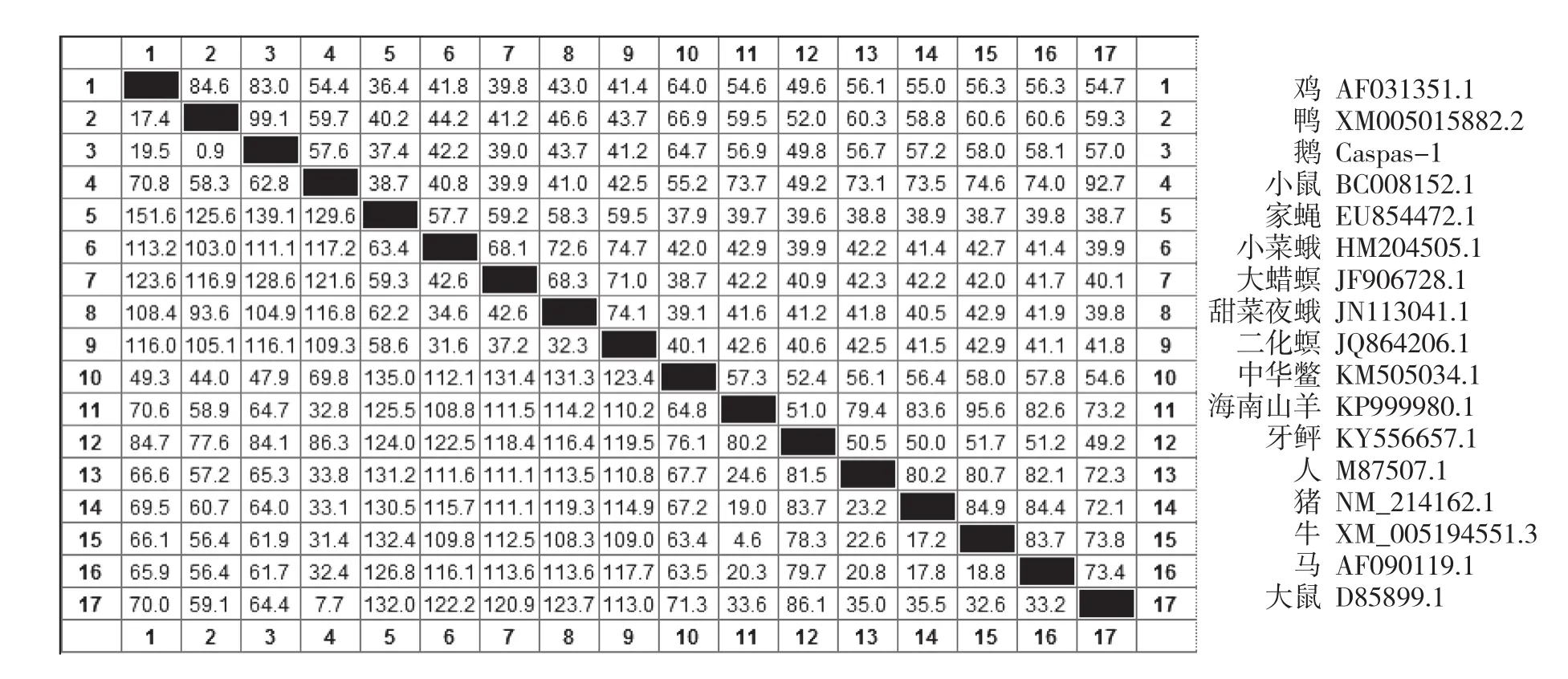
图4 不同物种Caspase-1基因的核苷酸同源性(%)比较
2.3 go-Caspase-1蛋白基本理化特征分析
采用DNAstar软件和ExPAsy服务系统中的ProtParam工具对Caspase-1基因编码蛋白序列的基本理化性质进行综合预测分析。结果表明,go-Caspase-1蛋白共含有270个氨基酸,分子式为C1383H2166N388O405S13,分子量31.13 ku;含带正电的氨基酸(Arg+Lys)33个、带负电的氨基酸(Asp+Glu)32个,理论等电点为7.8;含疏水氨基酸86个、极性氨基酸73个,总平均疏水性(GRAVY)为-0.42,说明该蛋白质具有亲水性,蛋白在体内的半衰期为30 h,属于长寿命蛋白。使用PredicrProtein在线分析工具对蛋白的二级结构进行分析,结果表明该蛋白环状结构(Loop)占61.48%,α螺旋结构(alphahelix)占21.85%,β折叠结构(beta-sheet)占16.67%;go-Caspase-1蛋白由20种氨基酸组成,各氨基酸含量在1.1%~10%之间,其中亮氨酸含量最高(占10%)、丙氨酸占4.1%、谷氨酸占3.7%、甲硫氨酸占3.7%,与该蛋白α螺旋结构的形成有关。对α螺旋结构阻碍性较强的脯氨酸(4.8%)和甘氨酸(4.8%)含量较高,可能是蛋白结构以环状结构为主的原因。
2.4 go-Caspase-1蛋白结构特征分析
采用NCBI CDD Tools在线软件分析Caspase-1分子的结构特征,结果显示go-Caspase-1分子主体包含半胱氨酸蛋白酶(CASc Superfamily,CAScS )结构域,符合典型的Caspase-1结构特征。比较不同物种Caspase-1蛋白,结果(图5)显示,鹅含有270个氨基酸,鸭含有217个氨基酸,鸡含有283个氨基酸,与人(404个氨基酸)、鼠(402个氨基酸)等哺乳类动物蛋白大小相差较大。结构上所有物种均含有CAScS结构域,且结构域内的功能结构基本相同,推测各物种该蛋白均具有相同的功能。此外,分析结果显示禽类Caspase-1蛋白均不含有死亡结构域(Death domain superfamily,DDS)。
2.5 Caspase-1蛋白三维结构分析
采用SWISS-MODEL ( ProMod version1.1.0)3D同源建模对Caspase-1蛋白进行三维结构预测,结果如图6所示。同源搜索结果显示最相似的蛋白模型PBD号为3e4c.1.A,go- Caspase-1蛋白3D预测结果显示模型覆盖率为97%,全模型质量估测(Global Model Quality Estimation,GMQE)值为0.74,该数值越接近1则建模质量越高;全模型和每个残基模型质量(Global and per-residue model quality,QMEAN)值为 -2.66,该数值大于-4,表明建模质量优秀,评分结果表明预测模型可信。建模结果显示,鹅与鸡和人的Caspase-1蛋白三维结构呈大致相同的空间构型,由α螺旋结构和β折叠结构或环装结构交替组成。仅有几处细微结构上的差别(图6箭头所示),N端的差异最为显著,人Caspase-1蛋白有一段较长的α螺旋结构,鹅与鸡在N端的螺旋结构较短;此外,3种蛋白还存在部分环状结构的空间差异,但对于整体空间结构影响较小,研究结果验证了Caspase-1蛋白的空间结构的保守性。

图5 不同物种Caspase-1蛋白结构域比较
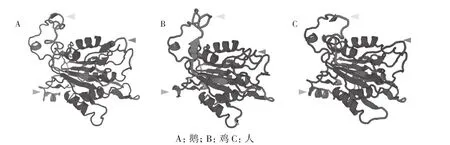
图6 不同物种Caspase-1蛋白三维结构比较
2.6 Caspase-1基因系统发育进化树分析
不同物种间Caspase-1基因分子进化分析结果显示,Caspase-1基因的物种进化呈较明显的分化(图7),家蝇等属于节肢动物门,其进化程度相对较低,进化地位最原始,成为一个分支,位于整个进化树的基部;其他物种均属于脊索动物门中的脊椎动物亚门,共同组成一个大分支。其中硬骨鱼纲鲽形目牙鲆,进化地位较低,单独一支位于底部;脊椎动物亚门中的哺乳纲、鸟纲、爬行纲组成一个较大的分支。鹅与同属水禽的鸭基因进化距离最近,与鸡同属一个分支,爬行纲的中华鳖其基因与禽类的进化距离较近。
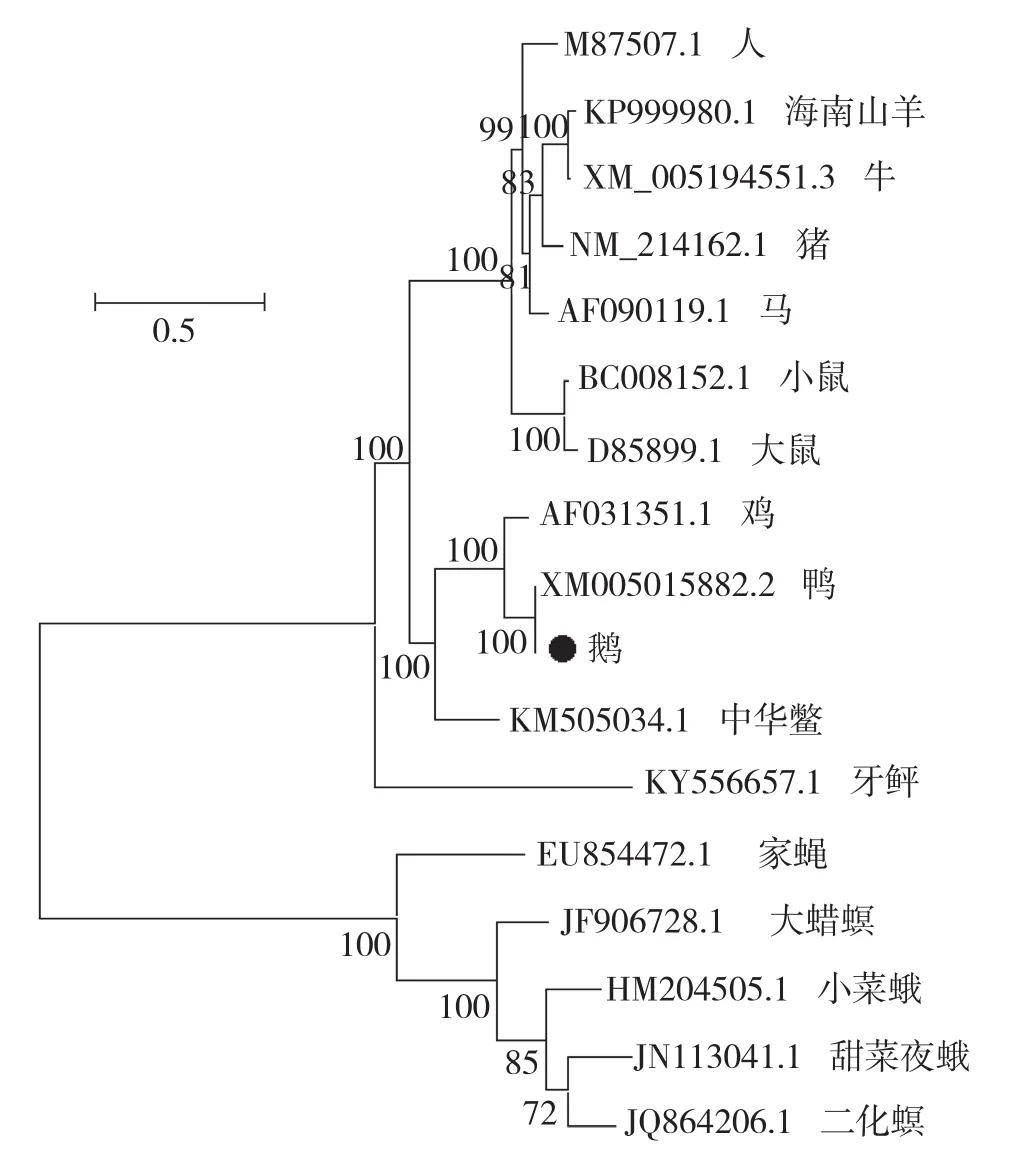
图7 Caspase-1基因的系统发育进化树
3 结论与讨论
广东养鹅业具有得天独厚的自然环境和种质资源,广东四大名鹅(马岗鹅、阳江鹅、狮头鹅、乌鬃鹅)中包含世界上最大的鹅种狮头鹅和最小的鹅种乌鬃鹅,本研究的样品采自广东养殖规模最大的马岗鹅。伴随着鹅养殖量逐年增加,相应的问题也愈发突出,粗放的养殖模式导致的疫病高发与生长缓慢,限制了行业的发展。炎症是疫病发生发展的核心,适度的炎症反应有助于机体对抗损伤,但如果炎症细胞过度活化,则会加重损伤,所带来的细胞病变及生理功能障碍是造成疾病的主要因素[12]。
Caspase 家族的共同特征是能通过自身催化位点的半胱氨酸残基特异性切割目标蛋白的天冬氨酸残基,在调控炎症反应和细胞凋亡中起重要作用。其中Caspase-1、Caspase-4和Caspase-5参与炎症反应的诱导,Caspase-2、Caspase-8、Caspase-9和Caspase-10参与细胞凋亡的诱导过程,而Caspase-3、Caspase-6和Caspase-7是细胞凋亡发生的效应蛋白。该家族蛋白比较保守,染色体所处的位置也较为相似。人Caspase-1蛋白可以分成3个结构域:N端主要包含一个CARD区,该区能够与其他携带CARD区的蛋白相互结合;p20大亚基与p10小亚基则是发挥Caspase-1催化活性的区域,激活后p20与p10形成二聚体,再进一步形成四聚体,发挥其生物学功能[13]。Caspase-1蛋白可以被多种炎性体激活,如NLRP1炎性体、NLRP3炎性体、AIM2炎性体、RIG-I炎性体以及NLRC4炎性体等[14-15]。其在体内扮演了调控细胞程序性死亡、调控炎症反应、介导炎症性坏死等多种角色,对Caspase-1的进一步研究有助于了解炎症系统,从而达到预防和治疗疾病的目的[16]。
本研究首次克隆了马岗鹅Caspase-1基因,并对其基因同源性、进化表达蛋白的特性、结构域及空间结构进行了分析,结果显示,家禽的Caspase-1基因同源性较高,但与哺乳类动物在基因长度和蛋白结构域上存在较大差异,禽类Caspase-1基因均不含有DDS 结构域,该结构域通过与DDS家族其他成员包括PYRIN和DED(Death Effector Domain)相关联,是信号通路中的衔接子,该部分结构的差异预示禽类在Caspase-1激活的机制上可能与哺乳类动物存在差异。Caspase-1基因在细胞生长、死亡、炎性等多种过程中发挥重要作用,围绕该基因进一步研究,将有助于疫病的防控和揭示家禽免疫系统的调控机制。
[1]王晓峰,钱勇. 现代家禽产业技术体系—— 行业发展的科技支撑[J]. 中国禽业导刊,2009(5):2-12.
[2]张辉玲,郑业鲁,黄修杰,等. 2011年广东水禽产业发展现状分析[J]. 广东农业科学,2012(7):15-17.
[3]施振旦,孙爱东,黄运茂,等. 广东省近年养鹅业的存在问题和发展趋势[J]. 养禽与禽病防治,2003(11):2-4.
[4]弓娟琴. Fas介导的凋亡与Caspase家族[J]. 国外医学·皮肤性病学分册,2001(5):279-281.
[5]赵瑞杰,李引乾,王会,等. Caspase家族与细胞凋亡的关系[J]. 中国畜牧杂志,2010(17):73-78.
[6]Schroder K,Tschopp J. The inflammasomes[J].Cell,2010,140(6):821-832.
[7]Medzhitov R. Origin and physiological roles of inflammation[J]. Nature,2008,454(7203):428-435.
[8]陶攀. 山羊NLRP3炎症小体构成蛋白组织特异性表达和分布研究[D]. 广州:华南农业大学,2016.
[9]Vandanmagsar B,Youm Y H,Ravussin A,et al.The NLRP3 inflammasome instigates obesityinduced inflammation and insulin resistance[J].Nat Med,2011,17(2):179-188.
[10]Davis B K,Wen H,Ting J P. The inflammasome NLRs in immunity,inflammation,and associated diseases[J]. Annu Rev Immunol,2011,29:707-735.
[11]Biasini M,Bienert S,Waterhouse A,et al.SWISS-MODEL:modelling protein tertiary and quaternary structure using evolutionary information[J]. Nucleic Acids Res,2014,42:W252-W258.
[12]Stienstra R,Joosten L A,Koenen T,et al. The inflammasome-mediated caspase-1 activation controls adipocyte differentiation and insulin sensitivity[J]. Cell Metab,2010,12(6):593-605.
[13]Sagulenko V,Vitak N,Vajjhala P,et al. Caspase-1 is an apical caspase leading to caspase-3 cleavage in the AIM2 inflammasome response,independent of caspase-8[J]. J Mol Biol,2018,430(2):238-247..
[14]Liang N,Yang Y P,Li W,et al. Overexpression of NLRP3,NLRC4 and AIM2 inflammasomes and their priming-associated molecules (TLR2,TLR4,Dectin-1,Dectin-2 and NFkappaB)in Malassezia folliculitis[J]. Mycoses,2018,61(2):111-118..
[15]Winkler S,Rosen-Wolff A. Caspase-1:an integral regulator of innate immunity[J]. Semin Immunopathol,2015,37(4):419-427.
[16]姜华,闫宜青,江维,等. NLRP3炎症小体活化、调控机制及相关疾病机制[J]. 中国科学,2017,47(1):125-131.

