菠萝蜜种子中总黄酮的提取工艺及其抗氧化性研究
张锦东,王小玉,游淑珠,赵国锋,余以刚
(1.华南理工大学食品科学与工程学院,广东 广州 510641;2.珠海出入境检验检疫局技术中心,广东 珠海 519000;3.珠海市禾协农产品有限公司,广东 珠海 519100)
菠萝蜜又称树菠萝、木菠萝,主要分布于热带亚热带地区,是常见的热带水果。我国种植菠萝蜜的记载可追溯至1 000多年前,广泛分布于广东、海南、云南、四川等地,近年来种植面积和产量日益增长。菠萝蜜在实际生产中以果肉销售为主,而生产过程中产生约70%的副产物,如种子、果瓤等鲜少被开发利用,产生的废弃物造成了环境污染。菠萝蜜种子在整果中的含量约为12%,菠萝蜜种子含有丰富的淀粉和蛋白质,其主要组成成分与小麦粉类似;同时菠萝蜜种子还含有各种矿物质和总黄酮等功能性成分[1-3],有益气养血和消炎止痛的功效,营养价值较高。目前,国内外对菠萝蜜种子的研究利用主要集中在对菠萝蜜种子的化学组成、淀粉提取工艺及理化性质方面[4-10],对菠萝蜜种子中黄酮等功能性成分的相关研究较少,为此,我们采用四因素三水平的正交试验设计优化了菠萝蜜种子中总黄酮的提取工艺,并采用DPPH法和水杨酸法测定了总黄酮粗提液的抗氧化性,为菠萝蜜种子的深加工及综合利用提供理论依据。
1 材料与方法
1.1 试验材料
菠萝蜜种子由珠海禾协农产品有限公司提供,芦丁标准品(纯度95%)为国药集团化学试剂有限公司产品。主要试剂:抗坏血酸、二苯代苦味酰基自由基(1,1-pheny-2-picrylhydrazyl,DPPH)、水杨酸、无水乙醇、FeSO4、H2O2、NaNO2、Al(NO2)3、NaOH 等,实验所用试剂均为分析纯。
主要仪器:752S型紫外可见分光光度计(上海棱光技术公司)、JJ200型电子天平(常熟双杰测试仪器厂)、冷冻干燥机(广东永利机械设备有限公司)、数显恒温水浴锅(金坛市白塔金昌实验仪器厂)、DFY-500型摇摆式高速粉碎机(温岭市林大机械有限公司)、JW-3021HR型高速冷冻离心机(安徽嘉文仪器设备有限公司)等。
1.2 芦丁标准曲线的绘制[11-13]
准确称取0.0100 g芦丁标准品,置于50 mL容量瓶中,用60%乙醇溶液经超声波溶解后定容至刻度,即配制成0.2 g/L的标准溶液。分别准确移取标准溶液0.00、2.00、4.00、6.00、8.00、10.00 mL(相当于 0.00、0.40、0.80、1.20、1.60、2.00 mg无水芦丁)于6支25 mL容量瓶中,分别加入蒸馏水至约10.0 mL。依次加入配置好的7.25×10-1mol/L的NaNO2溶液1.0 mL,摇匀并静置6 min;依次加入配置好的1.59 mol/L Al(NO3)3溶液 1.0 mL,摇匀并静置 6 min;依次加入配置好的5 mol/L NaOH溶液4.0 mL,分别用蒸馏水定容至刻度,摇匀并静置15 min。以试剂空白调节零点,在λ= 510 nm处测定吸光度值A。每个处理3次重复。
1.3 总黄酮提取工艺的优化
1.3.1 单因素实验设计 (1)样品预处理:菠萝蜜种子经真空冷冻干燥处理后,用粉碎机粉碎成粉末,过孔径0.250 mm筛,装入锡箔袋密封避光保存。
(2)总黄酮粗提液的配制:准确称取一定质量的菠萝蜜种子粉样品,在文献[14-17]的基础上,以乙醇浓度、料液比、提取温度、提取时间作为实验设计参数,以乙醇溶液为溶剂,把样品加入一定量溶剂中,加热提取、抽滤,4 000 r/min离心15 min,取上清液;将滤渣按上述方法处理1次,抽滤、离心,合并提取液,将所得到的提取液定容于50 mL容量瓶中;从上述50 mL溶液中准确移取5.0 mL置于比色皿中,加入7.25×10-1mol/L的NaNO2溶液1.0 mL,摇匀并静置6 min;加入1.59 mol/L的Al(NO3)3溶液1.0 mL,摇匀并静置6 min;加入5 mol/L的NaOH溶液4.0 mL,摇匀并加入0.4 mL蒸馏水,摇匀并静置15 min,在510 nm处测其吸光度值A。根据线性回归方程y = 0.4174x + 0.0001,计算菠萝蜜种子中总黄酮含量。菠萝蜜种子中总黄酮提取率计算公式为:

(3)乙醇浓度的确定:固定提取时间40 min、提取温度60℃、料液比1∶5 g/mL,选择乙醇浓度为40%、50%、60%、70%、80%分别提取菠萝蜜种子中黄酮化合物。
(4)料液比的确定:固定乙醇浓度60%、提取时间40 min、提取温度60℃,选择料液比为 1∶5、1∶10、1∶15、1∶20、1∶25 g/mL 分别提取菠萝蜜种子中黄酮化合物。
(5)提取温度的确定:固定乙醇浓度60%、提取时间40 min、料液比1∶15 g/mL,选择提取温度为40、50、60、70、80℃分别提取菠萝蜜种子中黄酮化合物。
(6)提取时间的确定:固定乙醇浓度60%、提取温度70℃、料液比1∶15 g/mL,选择提取时间为30、40、50、60、70 min分别提取菠萝蜜种子中黄酮化合物。
1.3.2 正交试验设计 在单因素试验的基础上,根据组合试验设计原理,对乙醇浓度(A)、提取温度(B)、料液比(C)、提取时间(D)4个变化因素,采用L9(34)即四因素三水平的分析方法,分析4种因素对菠萝蜜种子中总黄酮提取率的影响。根据单因素试验结果,确定正交试验因素水平(表1)。
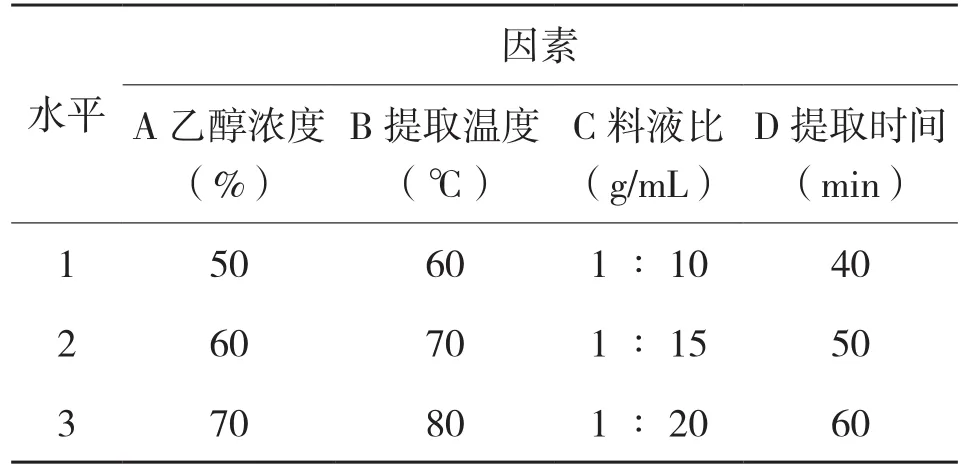
表1 正交试验因素水平
1.4 总黄酮抗氧化活性的测定
1.4.1 DPPH法 DPPH法可以快速、简便、灵敏地检测出天然抗氧化剂的抗氧化活性。其氧化活性用清除率来表示,清除率越大,抗氧化性越强。在文献[18-22]的基础上,按如下测定步骤操作:(1)取0.25 mL 1.26×10-4mol/L的DPPH溶液与1.0 mL无水乙醇混合并摇匀,在37℃下静置30 min,以无水乙醇为空白在517 nm波长处测定其吸光度值,记为A0。(2)分别取1 mL提取液与0.25 mL无水乙醇混合并摇匀,在37℃下静置30 min,以无水乙醇为空白在517 nm测定其吸光度值,记为Aj。(3)分别取1 mL提取液与0.25 mL 1.26×10-4mol/L的DPPH溶液混合并摇匀,在37℃下静置30 min,以无水乙醇为空白在517 nm测定其吸光度值,记为Ai。计算总黄酮提取液对DPPH的清除率:
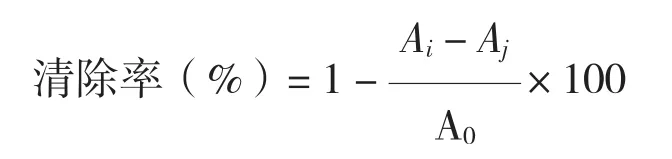
式中,A0为样品空白在517 nm波长下测得的吸光度值,Aj为提取液不加DPPH时在517 nm波长下测得的吸光度值,Ai为提取液加DPPH后在517 nm波长下测得的吸光度值。
以同样方法测定Vc对DPPH的清除能力,作为对照。3次重复。
1.4.2 水杨酸法 Fenton反应会产生羟自由基(·OH),水杨酸与羟自由基反应产生2,3-二羟基苯甲酸,该物质在510 nm处的吸光值与·OH的含量成正比。因此可通过紫外分光光度法测定·OH的含量并描述待测物质对·OH的清除能力。在文献 [23-27]的基础上,按如下测定步骤操作:(1)取1.0 mL 9.0×10-3mol/L的FeSO4溶液与1.0 mL 9.0×10-3mol/L的水杨酸、1.0 mL 8.8×10-3mol/L的 H2O2、1.0 mL蒸馏水混合并摇匀,在37℃下静置1 h,以蒸馏水为空白在510 nm波长处测定其吸光度值,记为A0。(2)取 1.0 mL 9.0×10-3mol/L 的 FeSO4溶液与1.0 mL 9.0×10-3mol/L的水杨酸、1.0 mL 8.8×10-3mol/L的H2O2、1.0 mL粗提液混合并摇匀,在37℃下静置1 h,以蒸馏水为空白在510 nm波长处测定其吸光度值,记为Ai。(3)取1.0 mL 9.0×10-3mol/L的FeSO4溶液与1.0 mL 9.0×10-3mol/L的水杨酸、1.0 mL粗提液、1.0 mL蒸馏水混合并摇匀,在37℃下静置1 h,以蒸馏水为空白在510 nm波长处测定其吸光度值,记为Aj。计算总黄酮粗提取液对·OH的清除率:
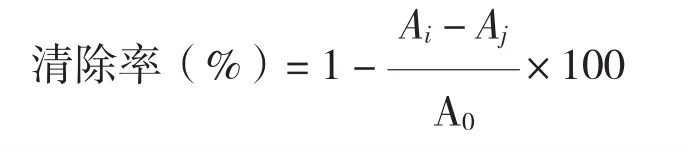
式中,A0为样品空白在510 nm波长下测得的吸光度值,Ai为粗提液加H2O2后在510 nm波长下测得的吸光度值,Aj为粗提液不加H2O2时在510 nm波长下测得的吸光度值。
试验数据通过Excel处理,以邓肯新复极差检验法进行多重比较。
2 结果与分析
2.1 总黄酮的检测
以吸光度值A为纵坐标,芦丁含量为横坐标,绘制标准曲线,芦丁标准曲线见图1。通过线性拟合得到回归方程y = 0.4174x + 0.0001,相关系数R2= 0.9993。根据样品吸光度值和标准曲线计算样品中总黄酮含量,结果表明,黄酮含量在0~2.0mg范围内线性关系良好。
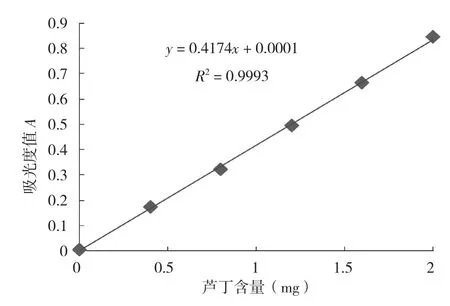
图1 芦丁标准曲线
2.2 总黄酮的提取工艺
2.2.1 单因素试验结果及分析 (1)乙醇浓度对总黄酮提取率的影响:由图2可知,当乙醇浓度低于60%时,随着乙醇浓度的提高,总黄酮含量增加趋势显著,总黄酮提取率递增,其中,乙醇浓度60%时的总黄酮提取率为1.82%,比乙醇浓度40%时高了75.7%;当乙醇浓度高于60%时,总黄酮提取率递增速率明显降低,乙醇浓度80%时的总黄酮提取率只比60%时高3.3%,说明此时菠萝蜜种子中总黄酮提取已经较充分。考虑综合成本等实际因数,选取60%为合适的乙醇浓度。
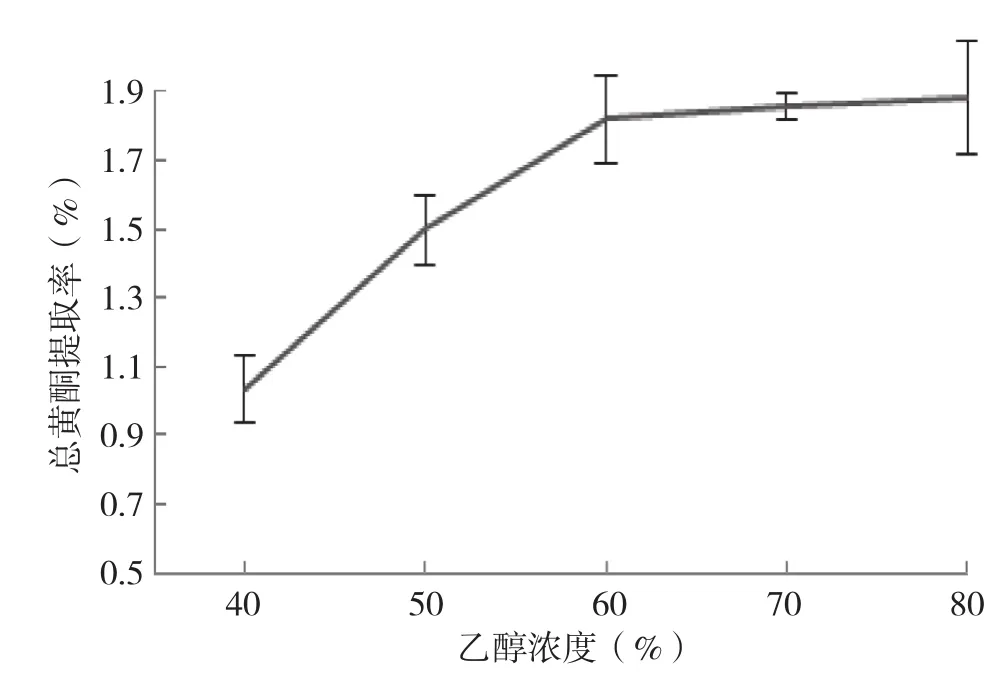
图2 乙醇浓度对黄酮提取率的影响
(2)料液比对总黄酮提取率的影响:由图3可知,随着料液比的降低,总黄酮提取量逐渐递减;当料液比高于1∶15 g/mL时,总黄酮提取率随料液比的降低而逐渐递增,料液比为1∶15 g/mL时总黄酮提取率达到峰值2.73%,比1∶5 g/mL时高了50.0%;当料液比小于1∶15 g/mL时,总黄酮提取率随料液比的降低而无明显变化。因此当料液比为1∶15 g/mL时,认为总黄酮的提取已经比较充分。综上所述,选取1∶15 g/mL为提取的合适料液比。
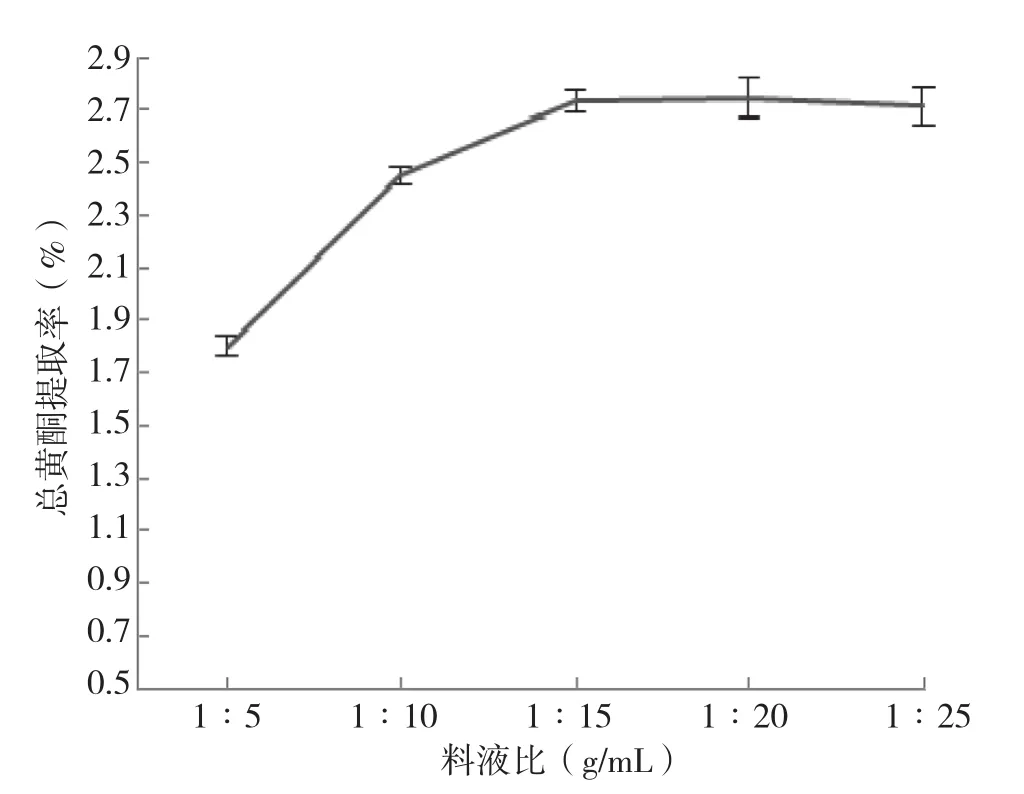
图3 料液比对黄酮提取率的影响
(3)提取温度对总黄酮提取率的影响:由图4可知,当提取温度在40~70℃时,随着提取温度的提高,总黄酮含量逐渐递增,总黄酮提取率也随之逐渐递增,提取温度在70℃时出现峰值2.84%,其中提取温度为70℃时的总黄酮提取率比40℃时提高了78.6%。当提取温度超过70℃时总黄酮提取量与提取率均呈现递减趋势,提取温度为80℃时的总黄酮提取率比70℃时降低了6.4%,说明温度过高破坏了黄酮的提取体系,不利于提取。综上所述,选取70℃为合适的提取温度。
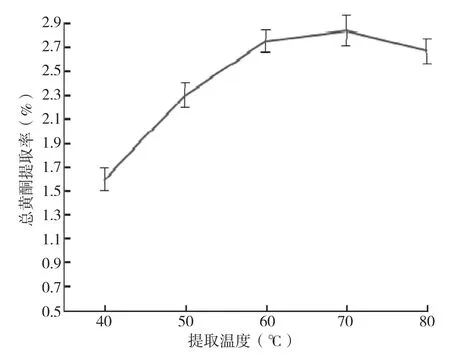
图4 提取温度对黄酮提取率的影响
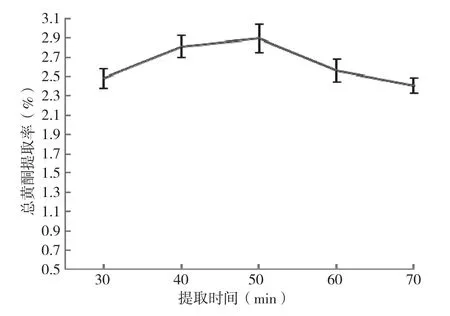
图5 提取时间对黄酮提取率的影响
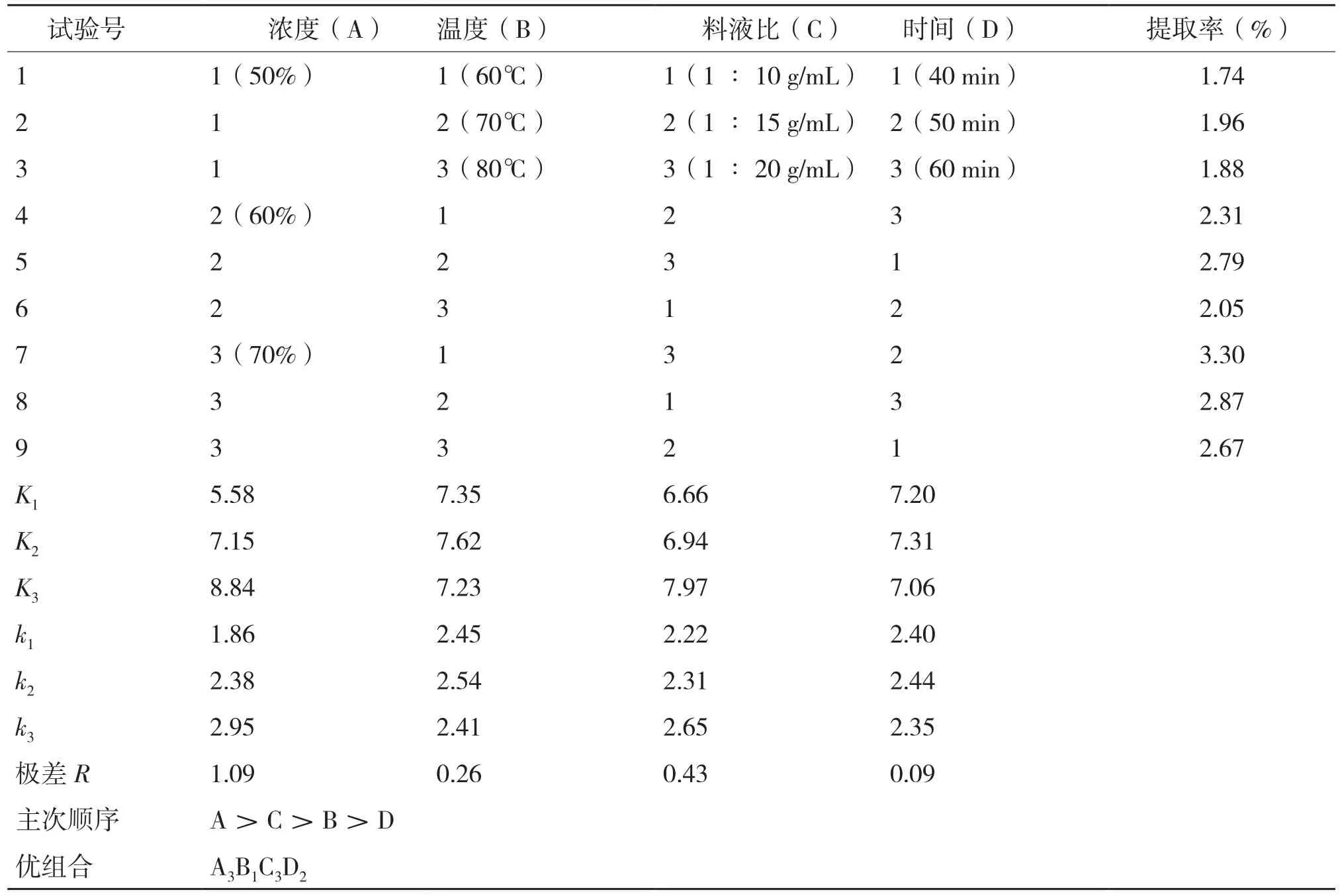
表2 正交试验结果
(4)提取时间对总黄酮提取率的影响:由图5可知,当提取时间在30~50 min时,随着提取时间的延长,总黄酮含量逐渐递增,总黄酮提取率也随之逐渐递增,提取时间在50 min时出现总黄酮提取率峰值(2.89%),其中提取时间为50 min时的总黄酮提取率比30 min时提高了16.7%。当提取温度超过50 min时总黄酮提取量与提取率均呈现递减趋势,提取温度为70 min时的总黄酮提取率比50 min时降低了5.9%,表明提取时间过长不利于总黄酮的提取,这可能是由于在高温下提取时间过长对部分黄酮造成了影响所致。综上所述,选取50 min为提取的合适时间。
2.2.2 正交试验结果及分析 由表2可知,在水浴提取条件下,乙醇浓度为极显著影响因素,提取温度、料液比、提取时间为显著因素,从实际生产情况考虑,最终确定生产的最优工艺为A3B1C3D2,即70%乙醇、60℃水浴提取50 min、料液比为1∶20。最优条件下,菠萝蜜种子中总黄酮提取率达到3.30%。
2.3 总黄酮粗提液的抗氧化活性
2.3.1 DPPH法 从图6可以看出,菠萝蜜种子中总黄酮提取液和Vc溶液对DPPH的清除能力均随浓度的提高而增强,在浓度小于0.1 mg/mL时,总黄酮提取液对DPPH的清除能力强于Vc,当浓度大于0.10 mg/mL后,Vc对DPPH的清除能力稍强。菠萝蜜种子中总黄酮提取液的IC50>Vc的IC50值,表明低浓度下菠萝蜜种子中总黄酮提取液的对DPPH的清除能力较强,抗氧化活性较强。
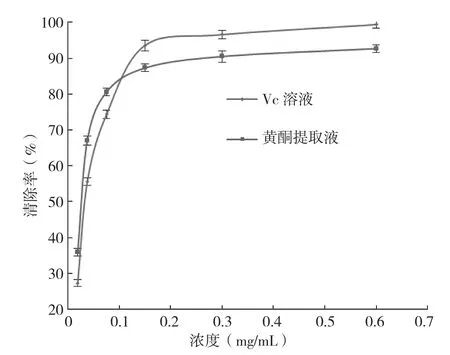
图6 不同浓度下反应液对DPPH的清除率
2.3.2 水杨酸法 从图7可以看出,随浓度的提高,总黄酮粗提液和Vc溶液对·OH的清除能力逐渐增强,在浓度小于0.38 mg/mL时,总黄酮提取液对DPPH的清除能力强于Vc,黄酮提取液的IC50>Vc的IC50。当浓度大于0.380 mg/mL后,Vc对·OH的清除能力稍强。在最优提取工艺条件下,浓度为0.6 mg/mL的菠萝蜜种子中总黄酮粗提液对·OH清除达到95.3%,表明其总黄酮粗提液对·OH有较高的清除能力,具有较高的开发利用价值。
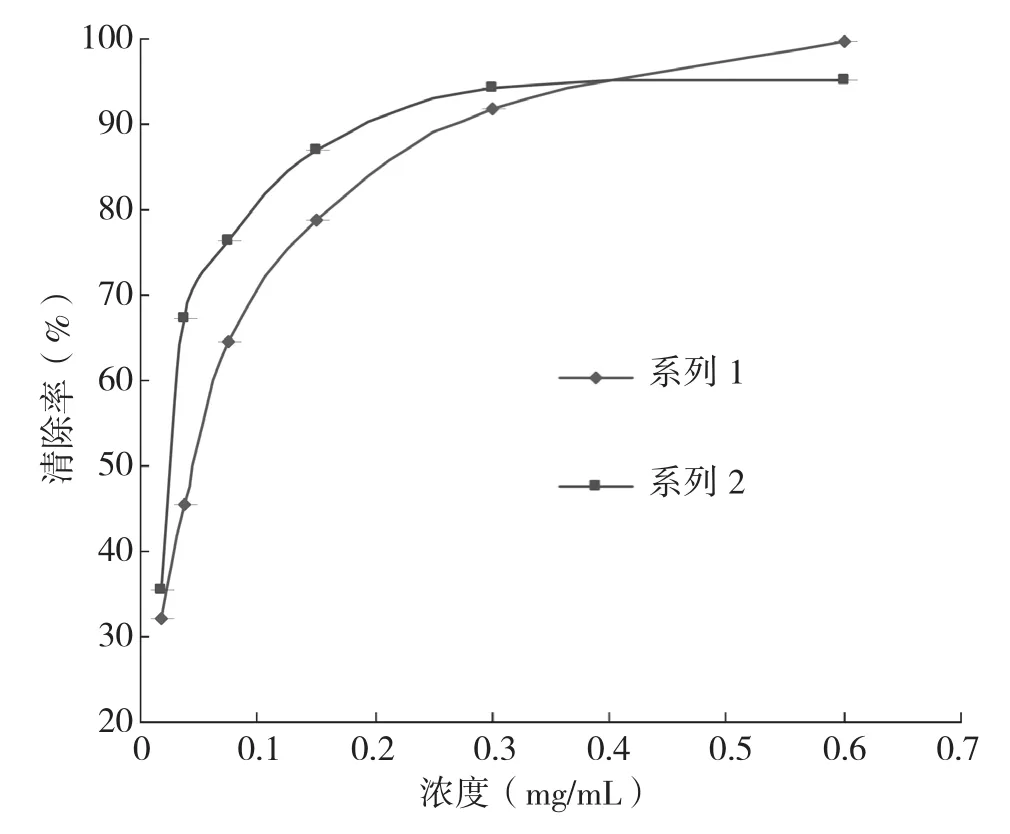
图7 不同浓度下反应液对·OH的清除率
3 结论与讨论
(1)在水浴条件下,4个因素对菠萝蜜种子粉总黄酮提取率的影响大小为:乙醇浓度>料液比>提取温度>提取时间。其中,乙醇浓度对总黄酮提取率影响极显著,料液比、提取温度、提取时间对总黄酮提取率影响显著;菠萝蜜种子中总黄酮的提取最优工艺为乙醇体积分数70%,料液比1:20 g/mL,60℃水浴提取50 min,提取率达到3.30%。
(2)菠萝蜜种子中总黄酮粗提液对DPPH及·OH的清除能力随浓度的提高而增强,浓度在0.3 mg/mL时对DPPH及·OH的清除率分别达到90.2%和94.1%,说明菠萝蜜种子中的总黄酮具有较强的抗氧化能力,可作为天然健康食品原料。
(3)菠萝蜜品种众多,按肉质和水分含量可分为干苞和湿苞两种类型;按花期可分为单造和双造两种类型等。由于各品种营养品质差异较大,且各营养成分间的相关性尚有待研究,本试验未对多品种菠萝蜜种子的提取工艺及抗氧化性作进一步分析,因此仍需进一步研究完善。
[1]尹道娟,张国治,薛慧,等. 菠萝蜜种子粉主要化学成分和加工性能研究[J]. 河南工业大学学报(自然科学版),2014(1):87-91.
[2]张涛,潘永贵. 菠萝蜜营养成分及药理作用研究进展[J]. 广东农业科学,2013,40(4):88-90,103.
[3]S B Swami,N J Thakor,P M Haldankar,et al.Jackfruit and its many functional components as related to human health[J]. Comprehensive Reviews in Food Science and Food Safety,2012,11 (6):565-576.
[4]胡美杰. 菠萝蜜种子淀粉提取工艺、物化特性及其在饼干中的应用[D]. 哈尔滨:黑龙江东方学院,2016.
[5]杨慧强,白新鹏,吕晓亚,等. 菠萝蜜种子淀粉提取工艺及其物性的研究[J]. 食品科技,2016(3):237-242.
[6]初众,胡美杰,徐飞,等. 响应面法优化酶法提取菠萝蜜种子淀粉工艺[J]. 食品工业科技,2016,37(20):189-193,200.
[7]张彦军,朱红梅,田建文,等. 菠萝蜜种子淀粉制备香草兰微胶囊的工艺研究[J]. 热带作物学报,2017(6):1127-1133.
[8]Fateatun N,Md J R,Md S M,et al. Physicochemical Properties of Flour and Extraction of Starch from Jackfruit Seed[J]. International Journal of Nutrition and Food Sciences,2014,4(3):347-354.
[9]P L Tran,D H D Nguyen,V H Do,et al.Physicochemical properties of native and partially gelatinized high-amylose jackfruit(Artocarpusheterophyllus Lam.)seed starch[J]. LWT-Food Science and Technology,2015,62 (2):1091-1098.
[10]K Rengsutthi,S Charoenrein. Physicochemical properties of jackfruit seed starch(Artocarpusheterophyllus)and its application as a thickener and stabilizer in chilli sauce[J].LWT-Food Science and Technology,2011,44(5):1309-1313.
[11]河北省技术监督局. DB13/T 385-1998. 食品中总黄酮(芦丁)的测定[S]. 1998.
[12]湖南省技术监督局. DB43/T 476-2009. 植物源性食品中总黄酮的测定[S]. 2009.
[13]全国果品标准化技术委员会. NY/T27 41-2015.仁果类水果中类黄酮的测定[S]. 2015.
[14]江新德,江桂仙,邱深玉,等. 菠萝蜜叶中水溶性黄酮的分离与纯化[J]. 南昌工程学院学报,2015(4):11-14,25.
[15]郝倩. 菠萝蜜叶黄酮类化合物的提取及其浸膏的应用[D]. 北京:北京林业大学,2014.
[16]李绚,龙敏仪. 紫外分光光度法测定食用玫瑰花中类黄酮的含量[J]. 食品研究与开发,2015(23):142-144.
[17]邓梦琴. 菠萝蜜果皮总黄酮的提取、分离纯化、结构鉴定及其抗氧化活性研究[D]. 广州:华南农业大学,2016.
[18]韦献雅,殷丽琴,钟成,等. DPPH法评价抗氧化活性研究进展[J]. 食品科学,2014(9):317-322.
[19]袁园,张潇,陈碧琼,等. 草果总黄酮的提取及DPPH自由基清除活性研究[J]. 食品研究与开发,2017(15):63-68.
[20]姚文红,李飞阳,王娟,等. 女贞花总黄酮提取及清除DPPH自由基作用的研究[J]. 食品研究与开发,2016(14):42-45,67.
[21]林恋竹,赵谋明. 反应时间对DPPH·法、ABTS+·法评价抗氧化性结果的影响[J]. 食品科学,2010(5):63-67.
[22]韦献雅,殷丽琴,钟成,等. DPPH法评价抗氧化活性研究进展[J]. 食品科学,2014(9):317-322.
[23]李艳,巩士磊,车影,等. Fenton反应考察抗坏血酸清除羟基自由基能力及动力学[J]. 应用化学,2015(8):948-954.
[24]代沙. 紫苏叶抗氧化物质提取、含量测定及抗氧化活性研究[D]. 雅安:四川农业大学,2013.
[25]文红波,曹运长,吴玉兰,等. 金樱子总黄酮体外抗氧化活性的研究[J]. 天然产物研究与开发,2014(7):1127-1131.
[26]李粉玲,蔡汉权,林泽平. 红豆多糖抗氧化性及还原能力的研究[J]. 食品工业,2014(2):190-194.
[27]Maja M P,Anton L,Valentina S,et al. Extraction methods,Comparison of major taste compounds and antioxidative properties of fruits and flowers of different Sambucus species and interspecific hybrids[J]. Food Chemistry,2016,200:134-140.

