不同温度下银耳生理变化规律与出耳农艺性状分析
张海洋,林 辉,王长文,张琪辉,郑 峻,孙淑静,4,胡开辉,4,钟冬季
(1.福建农林大学生命科学学院,福建 福州 350002;2. 古田县食用菌研发中心,福建 古田 352200;3.福建省食用菌技术推广总站,福建 福州 350002;4.福建农林大学(古田)菌业研究院,福建 古田 352200;5.古田县恒春农业开发有限公司,福建 古田 352200)
银耳(Tremella fuciformis)为中国特产,别名白木耳、白耳子、川耳等,质量上乘者称为雪耳,以其形似人耳、色如银而得名,是一种经济价值很高、在我国医学中久负盛名的食药两用真菌,素有“菌中之冠”的美誉[1-3]。银耳在我国已有130多年的栽培历史[4],随着国家对食用菌产业的支持,银耳栽培已有了长足的进步,但是由于缺乏相关的科研技术与科研人员,目前银耳生产模式主要还是采用传统的家庭小作坊式生产,生产管理者主要靠经验,对银耳生产过程中关键的影响因素如温度、湿度、光照、氧气等没有系统而准确的认识。小作坊生产无法准确调控环境如温度、湿度,必须依靠季节来生产,一旦天气反常,会造成减产,带来巨大的经济损失。因此工厂化生产将成为必然趋势,目前古田正处在转型阶段,已有少数几家进行工厂自动化栽培的公司。工厂化生产的优点表现在可以控温控湿,一年不停歇进行生产,不再受季节影响,这样不仅能够带来更多的产量,而且经济利润也增加。温度和湿度在银耳整个生产过程中都是关键因素,对菌丝的理化参数影响较大,对银耳的产量与品质都起着关键的作用。分析理化参数的变化可以更好的掌握菌丝对栽培料基质的利用情况,从而能够合理的调整栽培料的配比。
1 材料与方法
1.1 试验材料
银耳菌种Tr01由古田珍稀食用菌研究所提供。供试菌包(对折55 cm×13 cm)由古田建宏农业开发有限公司提供。
菌包培养基(栽培料)配方:棉籽壳84%,麸皮15%,石膏粉1.5%(含水量55%~60%)。机械化混匀栽培料,分装栽培袋、打空穴,用胶布贴封空穴制成菌包,105~108℃灭菌12 h。
1.2 试验方法
1.2.1 菌包培养 无菌条件下,使用银耳接种器通过菌包上的空穴将银耳菌种接种到栽培料中,接种后分别放入20、24、28℃恒温生化培养箱进行避光培养。每隔5 d测定菌袋的变化情况(其中菌包培养20 d,20~30 d为出耳阶段)。
1.2.2 样品前处理 在整个菌丝生长过程中(从接种后开始),每隔5 d,取出3袋栽培料作为重复试验样品,分别切取以中间的接种穴为中心的6 cm宽的培养料放入不锈钢盆中用手充分揉捻均匀,充分混匀后,准确称取20 g培养料用于制备粗酶液,另取10 g栽培料置于60℃烘干至恒重,用于测定含水量与总糖含量。
1.2.3 粗酶液的制备 将称取好的20 g栽培料,在三角瓶中按照料水比1∶5加入ddH2O于25℃、150 r/min恒温振荡摇床充分浸提90 min,取出三角瓶使用双层纱布进行过滤,过滤完成后置于50 mL离心管,9 000 r/min离心15 min,上清液即为粗酶液,用于测定pH值等生理生化指标。
1.2.4 总糖及蛋白含量测定 总糖含量参照肉品总糖含量测定的国家标准[5]进行测定,还原糖含量参照薛丹等[6]的方法进行测定,可溶性蛋白含量参照牛建峰等[7]的方法进行测定。
1.2.5 酶活力测定 (1)羧甲基纤维素酶活力:参照赵玉萍等[8]的方法稍作改动,反应体系3 mL:在试管中加入1 mL 1% CMC-Na溶液、0.5 mL粗酶液(对照灭活),50℃保温30 min,后加入1.5 mL DNS试剂,沸水浴7 min显色,然后用冷流水冷却终止反应,用蒸馏水定容至10 mL,于540 nm处测量吸光度。
(2)淀粉酶活力:参照孙静等[9]的方法稍作改动,吸取4 mL可溶性淀粉溶液于试管中,置于60℃恒温水浴中预热5 min。加入pH 6.0磷酸缓冲液1 mL、粗酶液500 μL(对照灭活),立即计时反应30 min。立即吸取反应液1 mL,加入盛有0.5 mL稀盐酸和5 mL稀碘液的试管中,在660 nm处测定吸光度。
(3)中性蛋白酶活力:参考蛋白酶活力测定的国家标准[10]进行测定。
(4)漆酶活力:参考郭艳艳等[11]的方法,采用ABTS法测定。
试验数据采用DPS软件进行处理,LSD多重比较法进行单因素方差分析,用EXCEL软件作图。
2 结果与分析
2.1 菌包内理化指标变化
2.1.1 含水量 菌包内水分来源于两方面,一是原料栽培料配置所添加的水,表现为原始菌包的含水量,二是菌丝通过新陈代谢产生的水分,表现为菌包内含水量增高。因此含水量的变化在一定程度上反映了培养基质的分解程度。从图1可以看出,银耳菌包在不同培养温度下含水量变化具有明显差异。在培养过程中银耳菌包的含水量在3个温度下变化趋势一致,均不断上升,其中在24℃下菌包内含水量变化最大,菌包中含水量明显高于20、28℃,培养20 d菌包含水量达到67.5%;20、28℃下菌包培养过程含水量变化基本一致,差别微弱。说明24℃下菌丝菌丝生长发育比较旺盛。
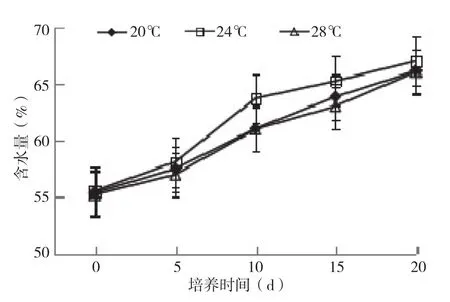
图1 不同培养温度下银耳菌包的含水量变化
2.1.2 pH值 食用菌在代谢过程,通过对碳水化合物的吸收、利用,会产生酸性或者碱性代谢产物影响基质中的pH,因此基质中酸碱度的变化速度,在一定程度上可以反应出菌丝的营养代谢情况。从图2可以看出,刚灭菌的菌包原始pH值一致,均在5.3左右,随着培养时间的推进,银耳菌包中栽培料的pH逐渐上升,培养0~20 d菌包pH上升幅度最大,进入出耳阶段(培养20~30 d)栽培料的pH维持在一定水平(6.7左右)。其中24℃培养条件下,银耳菌包内的培养料的pH变化速度明显高于20、28℃条件下。pH变化大说明菌丝活力大,代谢能力强,转化快,24℃下香灰菌丝代谢强度最大。
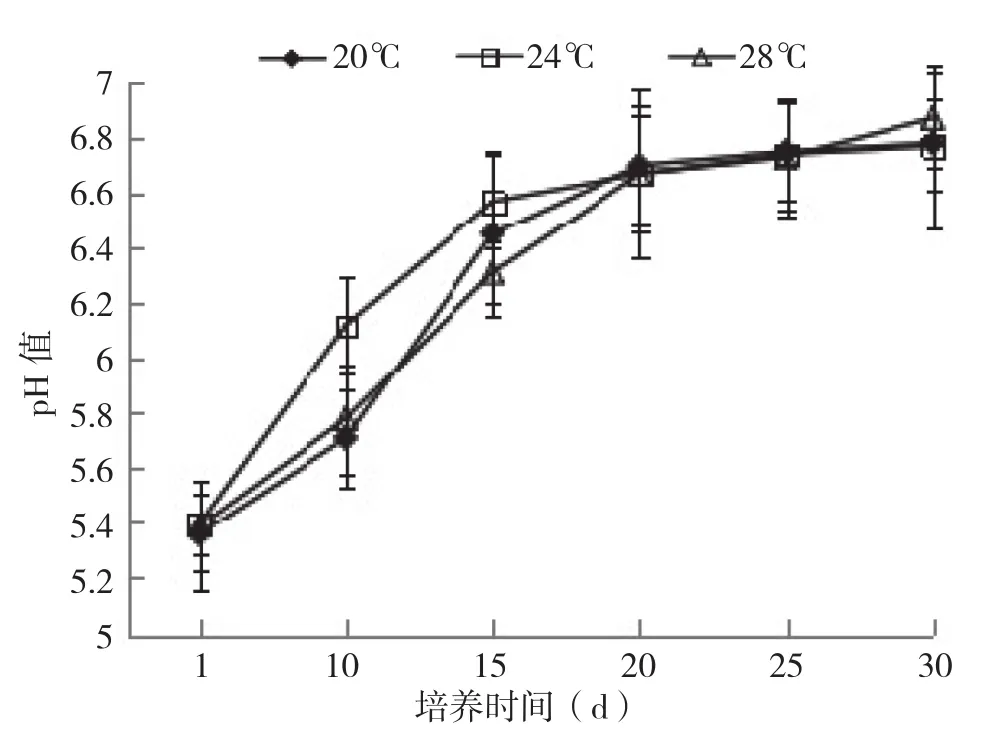
图2 不同培养温度下银耳菌包的pH变化
2.1.3 可溶性蛋白含量 食用菌的新陈代谢是通过对外界碳水化合物的分解利用而进行的,外界碳水化合物如纤维素、半纤维素、木质素的分解利用主要通过真菌分泌到胞外基质降解酶的分解作用,因此基质降解酶是胞外可溶性蛋白的重要组成部分,胞外可溶性蛋白的变化间接反应了真菌对基质的分解利用能力。
由不同培养温度下银耳菌包可溶性蛋白含量的变化(图3)可知,刚灭菌的初始菌包内可溶性蛋白含量很低,随着培养时间延长,菌包内可溶性蛋白含量迅速增加,在培养20 d达到最大值;进入出耳阶段后,随着菌包的继续培养,菌包内可溶性蛋白含量开始迅速下降。其中24℃条件下培养20 d可溶性蛋白含量高达258 μg/g,比20、28℃条件下的蛋白含量高,20℃和28℃温度下菌包内可溶性蛋白含量接近,说明24℃条件下由于菌丝生长发育比20、28℃要旺盛,分泌的胞外酶最多,对基质的分解利用能力最强。
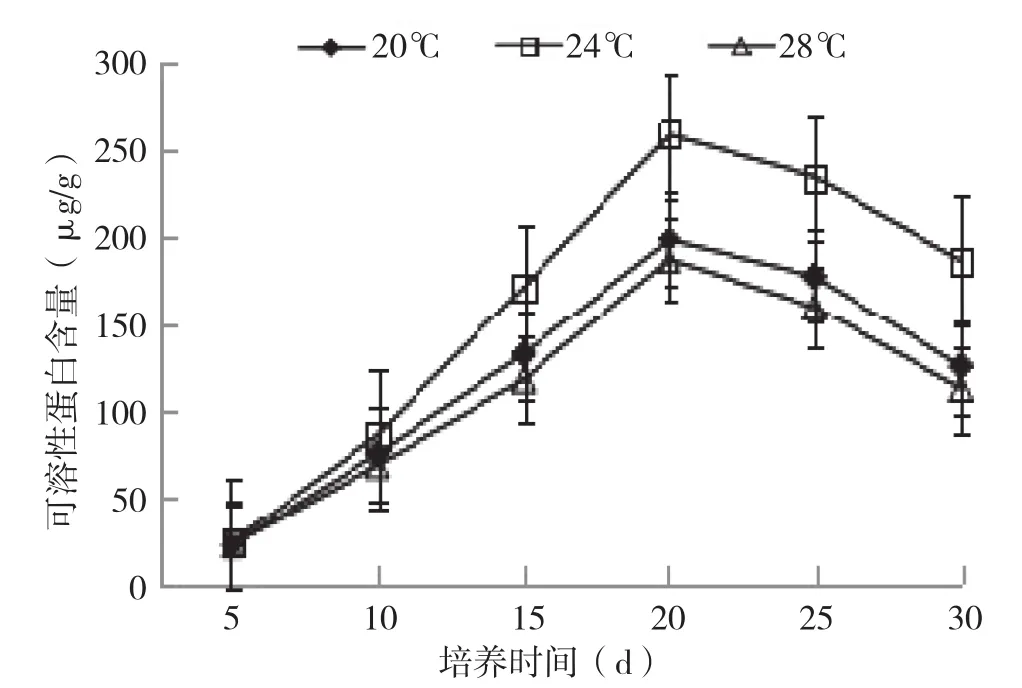
图3 不同培养温度条件下银耳菌包内可溶性蛋白变化情况
2.1.4 还原糖含量 真菌对纤维素、木质素等碳水化合物不能直接利用,需要借助相应的降解酶降解成还原糖再进行利用,因此还原糖的变化体现了真菌对碳水化合物的供应和转化能力。
还原糖随培养时间变化(图4)显示,3种温度下菌包培养0~20 d(菌包培养阶段)还原糖随培养时间增加呈不断增加趋势,培养20~30 d(出耳阶段)呈下降趋势,降幅较缓慢。不同温度培养条件下菌包内还原糖含量差异明显,24℃>28℃>20℃,其中24℃下培养20 d达到高峰875 μg/mL,显著高于20℃与28℃(仅800 μg/mL左右)。前期菌丝生长代谢旺盛,对碳水化合物转化快,产生足量的还原糖为生殖生长提供充足的养料基础,还原糖逐渐积累,以24℃培养条件下银耳菌丝原料转化效果最好。
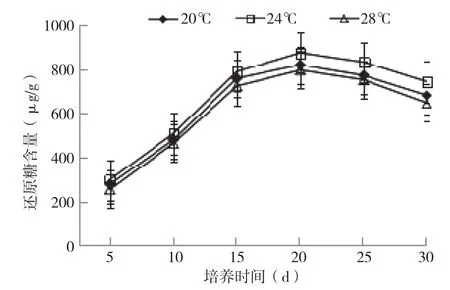
图4 不同培养温度条件下银耳菌包内还原糖变化情况
2.1.5 总糖含量 食用菌通过分解培养料中的纤维素、木质素等多糖转化为自身生长代谢所需,不断消耗培养料中的多糖,并最终产生为水和CO2,随着培养料多糖不断转化为CO2释放入空气中,导致培养料的糖总量不断减少,因此培养料中总糖变化情况可以直接说明食用菌对原料利用的强弱。
由总糖含量变化情况(图5)可知,3种温度下菌包内总糖含量均随着培养时间延长逐渐降低。总糖含量平均以1%(总糖/料干重)左右的速率降低,培养30 d后,总糖下降30%左右。其中24℃条件下总糖下降幅度最大,20℃与28℃下降速率接近,这是由于24℃条件下菌丝代谢旺盛,碳源糖类物质比20℃和28℃的消耗大,因此菌包内剩余总糖量相对低一点。
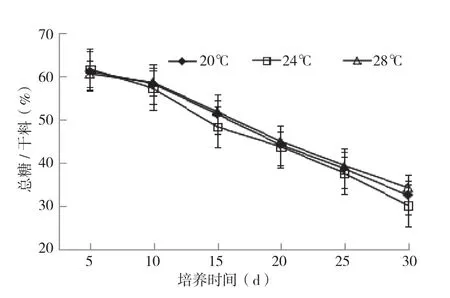
图5 不同培养温度条件下银耳菌包内总糖变化情况
2.2 菌包酶活变化
2.2.1 羧甲基纤维素酶活力变化 木屑、棉籽壳含有大量的纤维素与半纤维素,是银耳栽培的主要原料,食用菌不能直接利用,通过纤维素酶的酶解作用,纤维素被分解成碳水化合物和氨基酸以构成细胞物质和供给食用菌生长发育所需的能量。培养过程中始终存在降解纤维素的过程,为后期出耳提供充足营养。
从图6可以看出,3种培养温度条件下银耳菌包培养0~25 d纤维素酶活力均逐渐提高,进入出耳阶段后(培养20 d)酶活力基本稳定在200 U/mL以上。其中培养0~25 d酶活力增幅较大,培养25~30 d酶活力上升幅度极小,基本平稳;纤维素酶活力以24℃下最大,20℃下酶活最小。
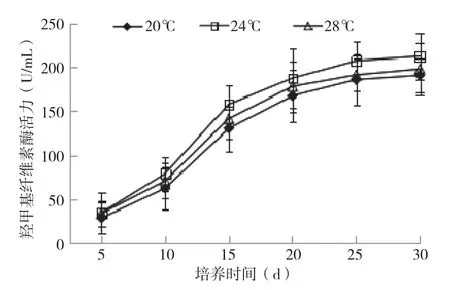
图6 不同培养温度银耳菌包羧甲基纤维素酶活力变化情况
2.2.2 淀粉酶活力变化 淀粉酶可降解培养料中的大量淀粉等多糖类,水解为单糖后才能供给菌丝生长发育,因此淀粉酶也是菌丝生长过程碳代谢中的关键酶之一。从淀粉酶活性随菌包培养时间的变化(图7)可以看出,3种温度下菌包在培养0~15 d酶活逐渐上升,15~30 d酶活力逐渐下降。其中,前期24℃酶活上升幅度最大,于15 d出现峰值2 210 U/mL,而20℃下峰值仅1 850 U/mL;后期28℃下酶活降幅最大,24℃下降最少。整个过程均以24℃下酶活力最大,这可能是由于24℃下菌丝的生长发育最强,菌丝活力最大。
2.2.3 中性蛋白酶活力变化 蛋白酶在菌丝吸收氮素营养过程中起着至关重要的作用。菌丝生长发育所需要的氮源来自蛋白酶的水解作用,通过蛋白酶将栽培料中的蛋白质分解成氨基酸、尿素、氨等小分子化合物。
中性蛋白酶活性随培养时间的变化见图8。在菌丝培养阶段,3个温度条件下,培养0~15 d蛋白酶活力呈增长趋势,培养15 d达到最大值,之后随着培养时间的继续延长蛋白酶活力开始下降。其中24℃培养条件下蛋白酶活力最高,20℃与28℃下差别不大;24℃下菌丝活力最强,氮源需求量最多,降解蛋白质最多,促进酶活分泌最多。
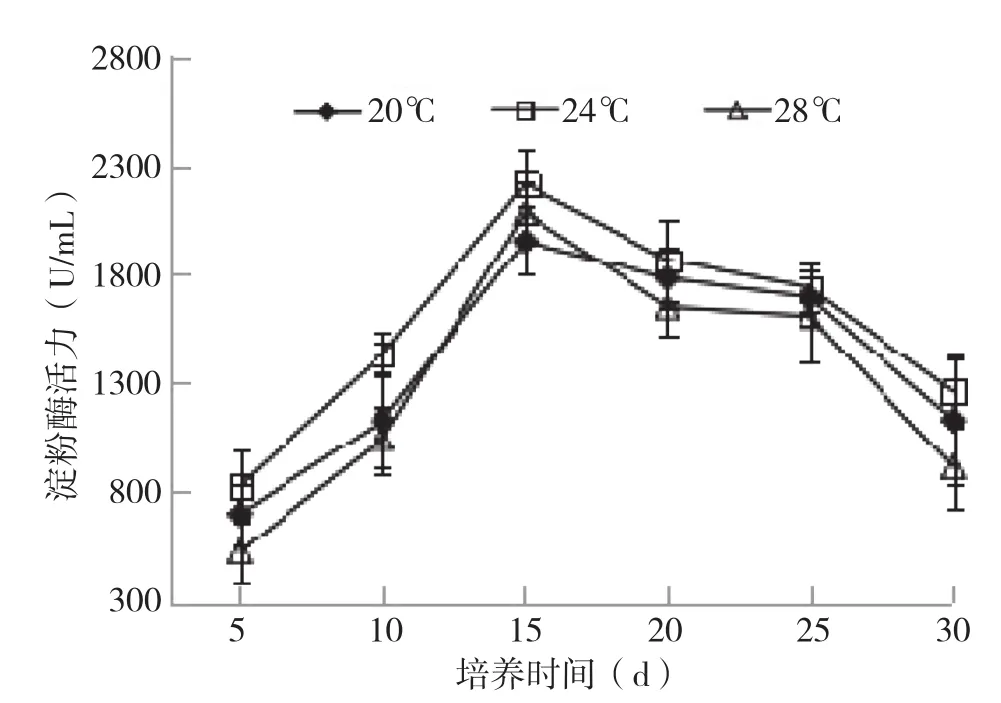
图7 不同培养温度银耳菌包淀粉酶活力变化情况
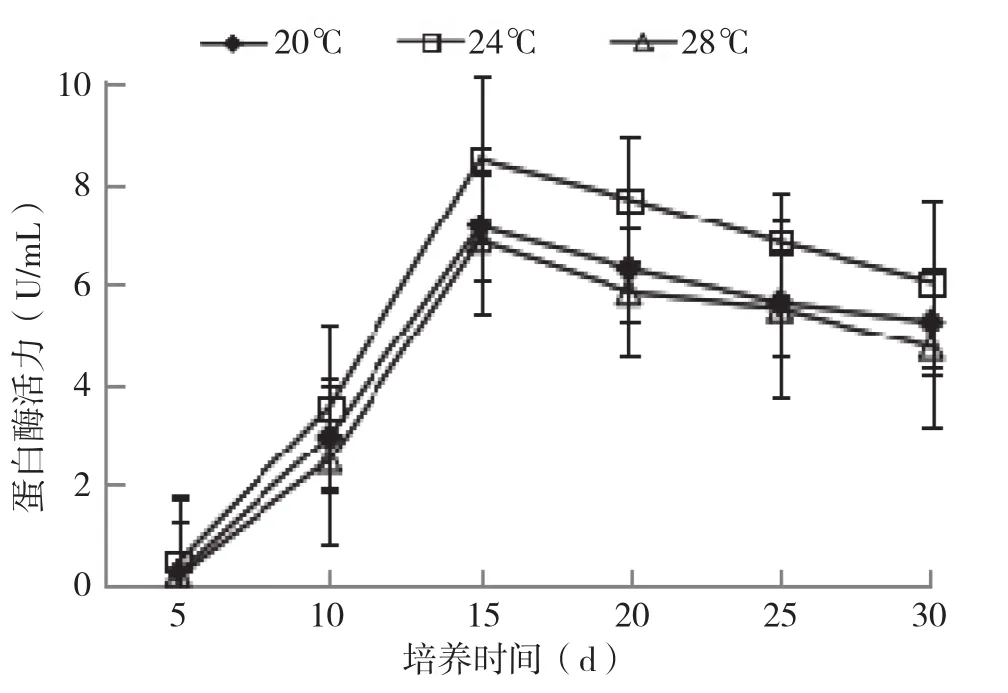
图8 不同培养温度银耳菌包中性蛋白酶的变化情况
2.2.4 漆酶活力变化 漆酶是一种与木质素分解相关的多酚氧化酶,在食用菌生长过程中通过分解木质素为菌丝提供营养物质。另外,有研究表明,漆酶的代谢产物醌能增强菌种的抗病能力,抑制杂菌的污染。
从漆酶活性随培养时间的变化(图9)可以看出,培养0~15 d漆酶活力随培养时间延长而不断上升到峰值,培养15 d后酶活一直下降直至检测不到。其中24℃的酶活最高,培养15 d达到74 U/mL,菌丝培养过程中,菌丝代谢由弱变强,菌丝的抗病能力增强可能是由于袋料基质中漆酶代谢产物不断积累而抑制了漆酶的活性。
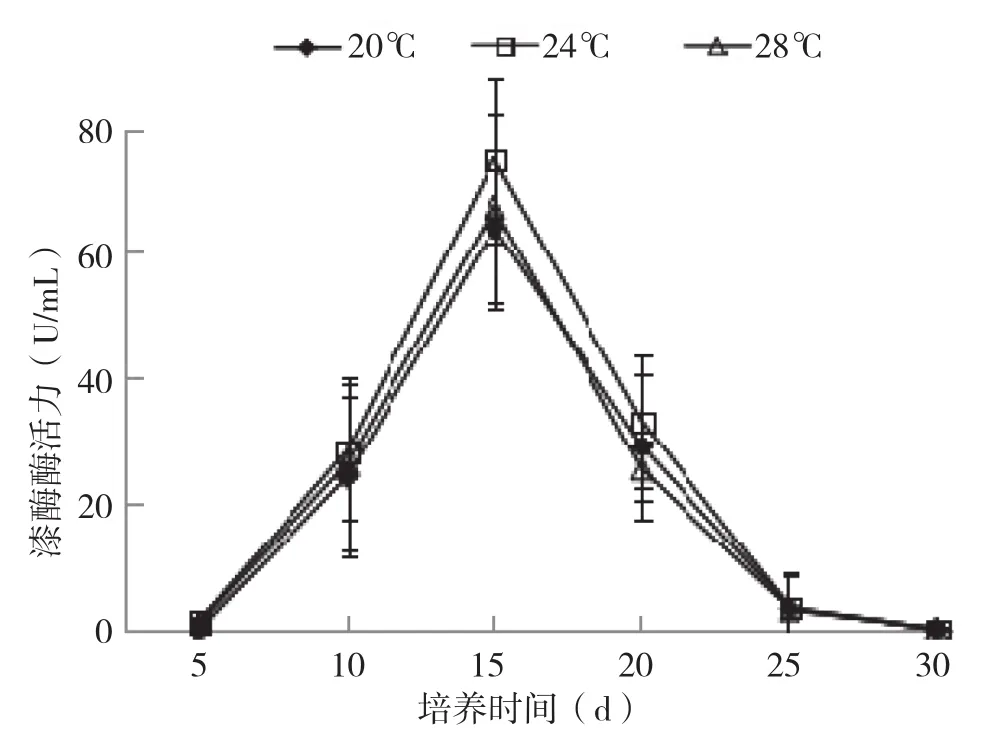
图9 不同培养温度银耳菌包漆酶的变化情况
2.3 菌包培养中菌丝生长情况
菌包在接种后分别置于20、24、28℃下进行菌丝培养,菌丝培养过程中定时取样拍照,观察菌丝生长情况和菌包的颜色变化,见表1和图10。从图10(彩插一)和表1可以看出,随着培养时间的延长,菌圈直径不断扩大,28℃条件下菌袋表面菌圈直径比24℃和20℃大,但中下部菌丝吃料比24℃要弱;黑色素分泌随培养时间的延长不断增加,培养18 d表面观察黑色素均较多。

图10 不同温度培养银耳菌丝及菌包颜色变化
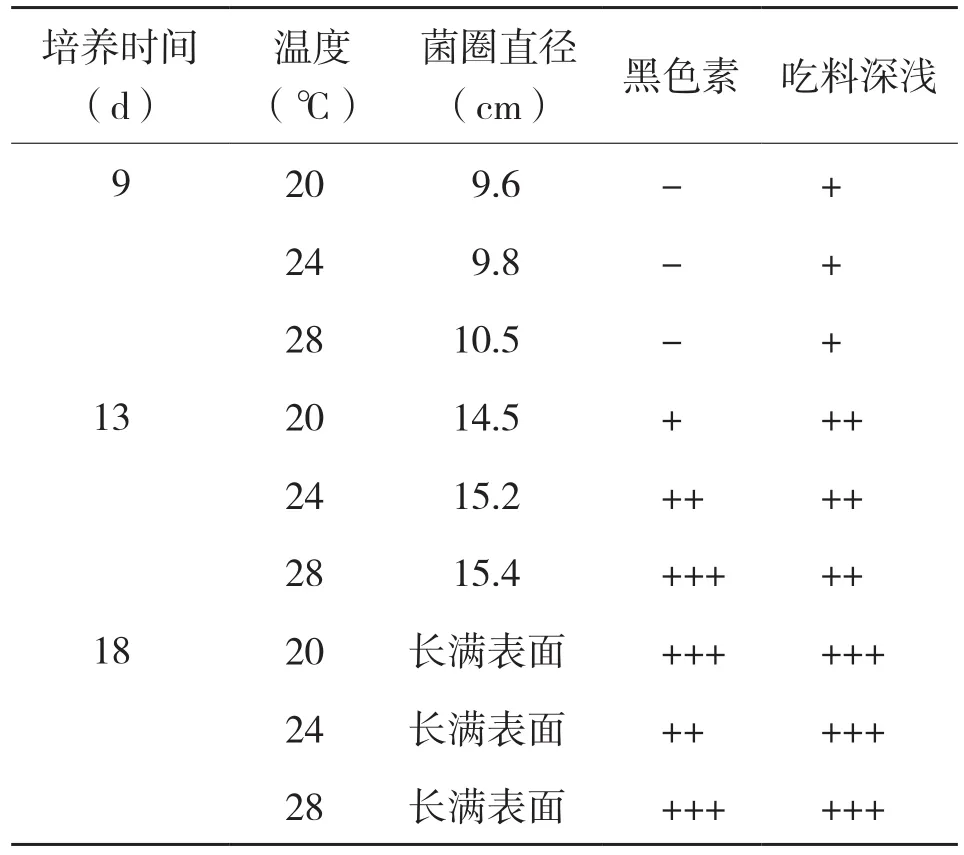
表1 不同培养温度的菌包菌丝变化情况
2.4 银耳采收农艺性状
从图11(彩插一)、表2可以看出,20℃条件下银耳朵型较圆正,耳片呈淡黄色,耳片较大顶部分叉,隆起度较低,收缩不够紧密,不厚实;24℃条件下银耳朵型圆正,耳片白色肉肥厚,整朵成圆形,有光泽,厚实;28℃条件下银耳朵型不够圆正不规则,耳片较大顶部分叉且呈黄色,隆起度低,耳片收缩较差,不厚实。不同温度条件下出耳直径和隆起度测定结果表明,24℃条件下出耳直径与隆起度略高于20℃,28℃条件下出耳直径、隆起度最低。

图11 不同温度条件银耳出耳情况
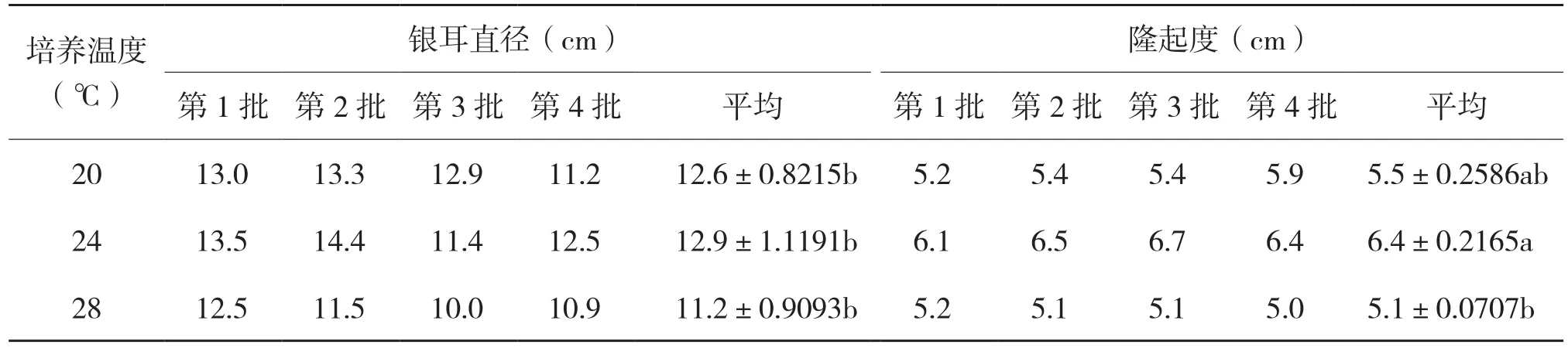
表2 不同温度下出耳的银耳农艺性状
2.5 菌包不同培养温度条件下银耳采收重量
从图12可以看出,不同温度条件下培养的菌包,出耳产量差异显著。其中,24℃条件下银耳单袋的平均产量可以达到90 g,20℃的单袋产量为75 g,28℃的产量只有55 g,比24℃低产40%左右。
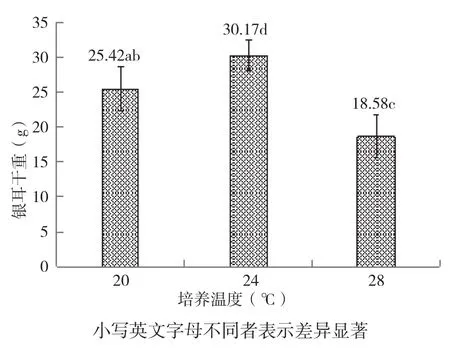
图12 不同温度条件下出耳的单朵银耳平均干重
3 讨论
不同培养温度影响银耳菌包培养过程中理化参数(含水量、pH、还原糖、总糖、可溶性蛋白)的测定结果表明,24℃条件下银耳菌包内含水量、pH、总糖变化速度最大,还原糖、可溶性蛋白积累量明显高于20、28℃,这可能是由于在24℃培养条件下菌包菌丝生长最旺盛、活力最强。为了供应自身生长和代谢的需要,分泌更多的胞外酶消耗栽培料中的多糖,导致栽培料中总糖下降加快,转化成更多的还原糖供应消化吸收,产生大量的酸性或者碱性代谢产物和水分,胞内含水量、pH变化更为明显,这与斑玉蕈研究的结果部分相同[12],但由于银耳生长特性与斑玉蕈的不同,存在一定差异。
栽培料的酶活力变化能反映菌丝对培养料的利用情况。银耳菌丝不能直接吸收纤维素、淀粉、蛋白等大分子物质作为能源,必须要靠香灰菌分泌相应的酶将大分子物质降解成小分子,才能供银耳菌丝直接利用。24℃条件下菌包内菌丝代谢最强,相应的菌丝分泌胞外蛋白最多,体现出高基质降解酶活力。栽培料内含有大量纤维素,长期需要有纤维素酶进行纤维素降解,因此羧甲基纤维素酶菌丝发育期酶活逐渐上升,在吐蕾期及出耳期酶活一直保持较高的水平,这与在白灵菇、香菇、平菇上的研究相似[13-14],后期纤维素酶一直保持较高的活性,满足了子实体生长发育对碳源的需求,其原因可能是子实体生长发育促进纤维素的降解,这与对香菇的研究结果相似[15]。淀粉酶活力前期迅速上升,后期又较快速下降,变化趋势与白灵菇和金针菇等食用菌的研究结果相似[14,16]。淀粉在菌丝生长期是最先被利用的,而淀粉酶是一种诱导酶,前期培养料中有大量淀粉,菌丝生长增殖旺盛需要大量淀粉被分解,因而酶活上升较快,随着培养料中淀粉类物质被逐渐消耗,酶活下降。蛋白酶活力的变化趋势在菌丝营养期不断上升,原基发育期酶活快速下降,子实体生长期酶活上升并维持在较高的水平,这与姬松茸的研究结果相似[17],子实体生长期分解培养料中蛋白质利用培养料中氮源,满足实体中的生长。漆酶活力随培养时间呈先上升后下降趋势,与金针菇的培养过程的研究相似[18],漆酶不仅参与木质素的降解,还可产生酚类或醌类化合物抑制杂菌生长。
菌包培养的温度条件不同,最终的产量存在差异,从产量统计结果看,24℃培养的菌包,其产量明显高于28℃的产量,这可能是由于菌丝长期处于28℃的温度下,菌丝活力弱,菌丝易吐黄水,造成烂耳蒂,最后产量较低,而20℃培养的菌丝,活力较弱,对基质的养分吸收转化较低,导致产量低。从整个培养过程中测定的生理生化参数来看,24℃条件下菌包总糖消耗率和胞外基质降解酶活力最高,因此24℃培养条件下出耳产量显著高于20、28℃。
本研究明确了不同温度下银耳菌丝培养阶段菌包内的生理变化规律以及不同温度对银耳出耳的影响,为银耳栽培温度的控制提供了理论依据,可望应用于银耳的工厂化生产管理。
[1]戴玉成,杨祝良. 中国药用真菌名录及部分名称的修订[J]. 菌物学报,2008,27(6):801-824.
[2]戴玉成,周丽伟,杨祝良,等. 中国食用菌名录[J]. 菌物学报,2010,29(1):1-21.
[3]黎勇,王晓东,高敏. 我国银耳的研究历史及现状[J]. 北方园艺,2014(16):188-191.
[4]罗信昌. 中国银耳研究之历史回顾[J]. 菌物学报,2013,32(Z1):14-19.
[5]国家质量监督检验检疫总局,中国国家标准化管理委员. GB/T 9695.31-2008肉制品总糖含量测定[S]. 2008.
[6]薛丹,黄豆豆,姚风艳,等. 中药木瓜中总糖及还原糖的含量测定[J]. 中国医药导报,2016,121(12):121-124,128.
[7]牛建峰,王广策,曾呈奎,等. 带形蜈蚣藻多糖和可溶性蛋白含量测定及藻红蛋白分析鉴定[J]. 海洋科学,2006,30(8):50-53.
[8]赵玉萍,杨娟. 四种纤维素酶酶活测定方法的比较[J]. 食品研究与开发,2006,27(3):116-118.
[9]孙静,耿慧莉,莫德馨. 中温α-淀粉酶活性的定量测定[J]. 教学仪器与实验,2009,25(11):44-45.
[10]中华人民共和国专业标准. SB/T 10317-1999 蛋白酶活力测定法[S]. 1999.
[11]郭艳艳,阮玲云,冯宏昌,等. 不同营养条件下斑玉蕈菌丝生长及产酶特性[J]. 菌物学报,2014,33(3):697-705.
[12]黄清荣,辛晓林,王艳华,等. 真姬菇深层培养条件的研究[J]. 安徽农业科学,2006,34(3):461-463.
[13]周长青,王秀峰,李玉. 白灵菇生长发育过程中胞外酶活性的变化规律[J]. 食用菌学报,2008,15(2):64-68.
[14]潘迎捷,陈明杰,郑海歌,等.香菇和平菇生长发育中漆酶、酪氨酸酶和纤维素酶活性的变化[J]. 上海农业学报,1991(2):21-26.
[15]王玉万. 银耳及其伴生菌营养生理生态研究[J]. 应用生态学报,1993,4(1):59-64.
[16]李蕤,吴克,骆军,等. 金针菇固体培养几种胞外酶活力变化的研究[J]. 中国食用菌,2002,21(1):12-14.
[17]林新坚,江秀红,林戎斌,等. 姬松茸菌株的胞外酶活性及与产量的关系[J]. 食用菌学报,2007,14(3):24-28.
[18]高金权,刘朝贵,李成琼,等. 稻草秸秆栽培金针菇基质降解特性研究[J]. 中国农学通报,2005,21(12):260-264.

