猪M II期卵母细胞玻璃化冷冻后的凋亡途径研究
吴彩凤,戴建军,钮莹芳,张树山,陈亚宁,张德福
(上海市农业科学院畜牧兽医研究所,上海市农业遗传育种重点实验室动物遗传工程研究室,上海 201106)
猪M II期卵母细胞玻璃化冷冻后的凋亡途径研究
吴彩凤,戴建军*,钮莹芳,张树山,陈亚宁,张德福*
(上海市农业科学院畜牧兽医研究所,上海市农业遗传育种重点实验室动物遗传工程研究室,上海 201106)
为阐明猪卵母细胞玻璃化冷冻后的细胞凋亡模式,本试验利用原位荧光染色技术对冻后卵母细胞死亡受体介导的外源性凋亡途径和线粒体介导的内源性凋亡途径中的Caspase 3、Caspase 8、Caspase 9和总Caspase活性进行检测,用RT-PCR技术对不同途径中关键基因进行mRNA表达检测。结果显示:猪MII期卵母细胞冷冻后,死亡受体外源性凋亡途径的Caspase 8荧光强度值(32.03)和线粒体内源性凋亡途径的Caspase 9荧光强度值(16.56),以及两者共同途径中的Caspase 3和总Caspase荧光强度值(16.70和8.43)均显著高于新鲜卵母细胞对照组所对应的荧光强度值(分别为4.02、4.83、4.23和3.08)。死亡受体外源性凋亡途径TNFα、FɑsL、CASP8和CASP3基因表达量也均有一定水平的提高,线粒体介导的内源性凋亡途径中CASP9、CASP3和P53基因表达水平呈上升趋势,而Bcl2、BAX、SOD1和survivin的基因表达水平显著下降。综上所述,死亡受体介导的外源性凋亡和线粒体介导的内源性凋亡共同参与了猪MII期卵母细胞冻后的凋亡过程。
猪;卵母细胞;玻璃化;细胞凋亡
卵母细胞冷冻保存可使其利用不受时间和空间的限制,最大限度提高卵母细胞的综合利用效率。然而由于猪卵母细胞脂肪含量高,对低温敏感等因素,导致其产生冷冻损伤[1-2]。在冷冻保存中,卵母细胞和胚胎的退化也初步被认为是由细胞凋亡过速引起的[3-5]。然而,目前关于猪卵母细胞的损伤机理的研究还很少。细胞凋亡是细胞在一定条件下接受刺激信号并受基因调控的一种自主性、程序性死亡过程[6]。死亡受体外源性凋亡途径和线粒体内源性凋亡途径是哺乳动物细胞凋亡的两个主要途径,也是卵母细胞和胚胎早期发育过程中细胞凋亡的主要途径[7]。然而关于冷冻影响卵母细胞和胚胎凋亡途径的研究还很少。
本研究对猪MII期卵母细胞进行冷冻解冻,并利用原位荧光染色的方法,对解冻后卵母细胞中线粒体内源性凋亡途径和死亡受体外源性凋亡途径中的Caspase 3、Caspase 8、Caspase 9和总Caspase水平进行检测,利用荧光定量PCR技术,检测线粒体内源性凋亡途径和死亡受体外源性凋亡途径中的关键基因mRNA表达水平,从而初步判断冻后猪卵母细胞的可能凋亡途径,为日后进一步提高猪卵母细胞冷冻效率提供理论指导。
1 材料与方法
1.1 材料
除特别说明外,所有化学试剂均购自Sigma公司,培养液和血清购自Gibco公司。玻璃化冷冻所用的OPS(Open Pulled Straw)管由本实验室自制,其由常规0.25 mL麦管拉长拉细而获得。
1.2 方法
1.2.1 猪卵母细胞体外成熟
猪卵巢采集于上海五丰上食有限公司屠宰场,置于38.5℃的生理盐水中1 h内运回实验室。使用18号针头注射器采集卵巢表面2—6 mm卵泡中卵丘-卵母细胞复合体。选择至少包裹3层颗粒细胞,且胞质均匀的卵母细胞用于成熟培养,每65枚卵丘卵母细胞复合体于500μL成熟培养液中成熟培养,培养条件:38.5℃44 h,饱和适度。成熟培养后用0.1%的透明质酸酶消化以去除卵丘细胞,选择胞质均匀,且排除第一极体的成熟卵母细胞用于后续试验。
1.2.2 卵母细胞玻璃化冷冻和解冻
玻璃化冷冻时,卵母细胞先在冷冻平衡液(TCM199+7.5%DMSO+7.5%EG+20%FBS)中处理5 min,再以微量体积移入玻璃化冷冻液(TCM199+15%DMSO+15%EG+20%FBS+0.5 mol/L蔗糖)中,15 s后开始用OPS管装载卵母细胞,30 s内投入液氮中冷冻保存。
解冻时,从液氮中取出OPS管,迅速投入38.5℃预热的0.5 mol/L蔗糖溶液中,使卵母细胞流出,5 min后移入0.25 mol/L的蔗糖溶液中,作用5 min,用TCM199洗涤3次,放入事先在CO2培养箱中平衡的卵母细胞恢复液(TCM199+10%FBS)中恢复2 h,选择形态正常的解冻卵母细胞用于后续试验。
1.2.3 卵母细胞Caspase原位荧光检测
Caspase 3、Caspase 8和Caspase 9原位荧光染色试剂盒购于碧云天(BioVision,中国),参照说明书,使用前先将各自用FITC标记的抑制剂用清洗缓冲液进行1∶300稀释,然后将卵母细胞移入染色液中,37℃孵育15 min后用清洗缓冲液洗涤2次,置于荧光显微镜下观察拍照。总Caspase原位荧光染色试剂盒购于BioVision(美国)公司,将FITC-VAD-FMK用TCM199稀释至10μmol/L,卵母细胞染色15 min后用TCM199洗涤2次,然后在荧光显微镜下观察拍照。荧光照片是用Image-Pro Plus6.0软件进行量化,记录其荧光信号强度值,结果用荧光平均相对密度表示。
1.2.4 卵母细胞凋亡相关基因的RT-PCR检测
每150枚猪MII期卵母细胞用于1次RNA提取。总RNA提取采用TIANGEN的RNApreo Pure微量样品总RNA提取试剂盒进行,反转录使用TIANGEN的FastQuant RT kit反转录试剂盒.
RT-PCR操作时,从NCBI中获得猪肿瘤坏死因子-α(Tumor necrosis factor-α,TNFα)、Fas配体(Fas ligand,FɑsL)、CASP8、CAS9、CASP3、Bcl2、BAX、SOD1、P53和survivin基因的cDNA序列并设计引物,GAPDH作为内参基因。引物信息如表1所示。使用TAKARA的SYBR Premix Ex TaqTM II kit试剂盒进行RT-PCR检测。反应体系为20μL,包括:cDNA模板2.0μL、SYBR Premix Ex Taq II 10μL、Forward Primer 0.8μL、Reverse Primer 0.8μL、ROX II0.4μL和加RNase-Free ddH2O补至20μL。反应条件:预变性95℃30 s,变性95℃5 s,退火34 s(Tm均为55℃),72℃延伸30 s,循环35次,退火处收集荧光。在ABI7500实时荧光定量PCR仪上运行,每个样品重复3次。基因的相对表达量采用2-△△Ct法计算比较[7]。
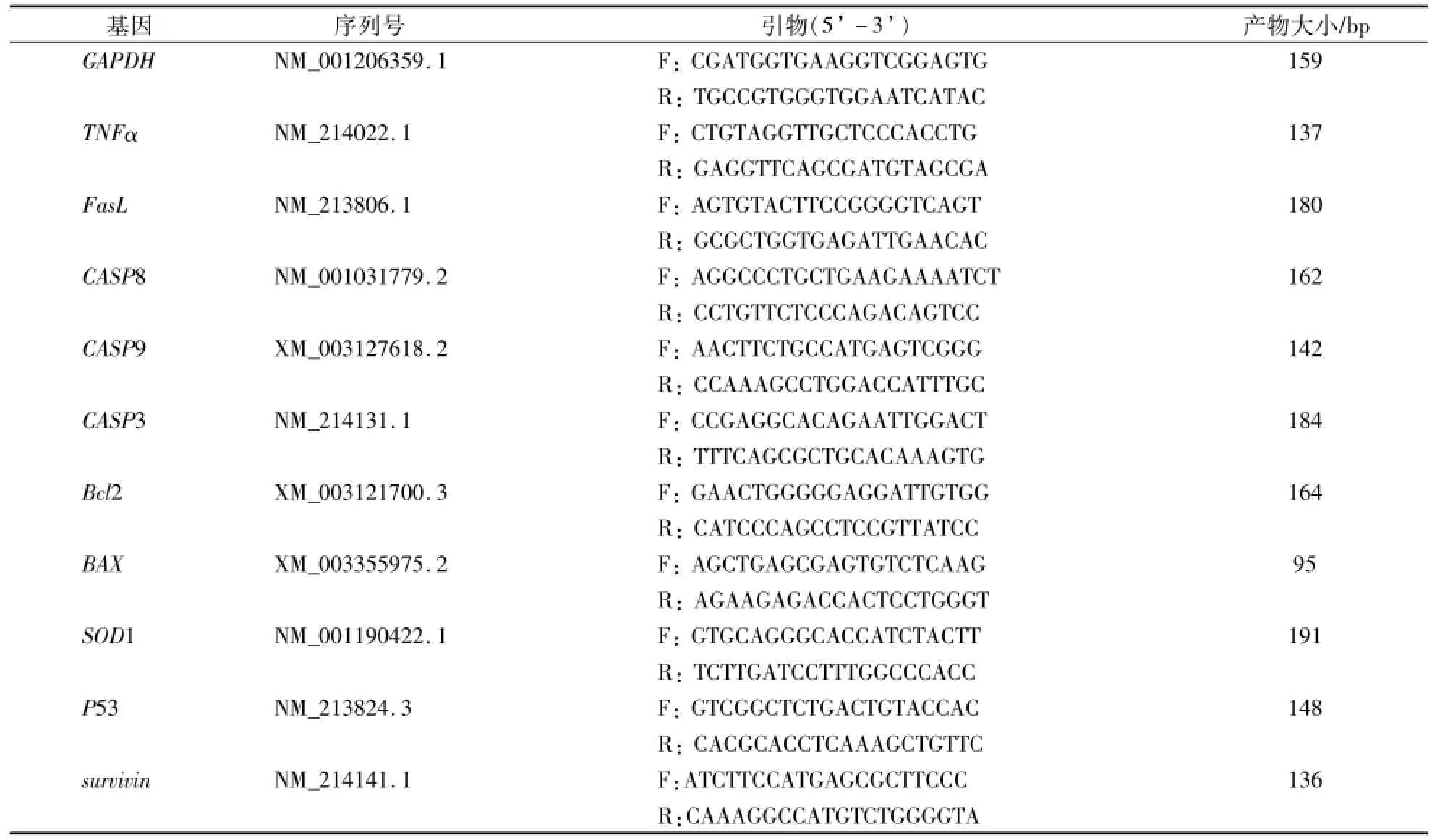
表1 RT-PCR引物信息Table 1 Primer information for RT-PCR
1.2.5 生物统计
测定结果采用SPSS 17.0进行数据分析,以P<0.05作为差异显著评判标准,以*表示。RT-PCR以GAPDH为内参基因。
2 结果与分析
2.1 OPS冷冻对猪M II期卵母细胞多种Caspase水平的影响
本试验分别利用Caspase 3、Caspase 8、Caspase 9和总Caspase原位免疫荧光染色试剂,分别对死亡受体外源性凋亡途径中的Caspase 8、线粒体内源性凋亡途径中的Caspase 9,以及两者共同作用途径中的Caspase 3与总Caspase进行原位荧光染色。结果如图1所示:无论是Caspase 8、Caspase 9,还是两者共同作用中的Caspase 3和总Caspase,冷冻后卵母细胞的原位荧光强度均显著高于未冷冻的新鲜组。
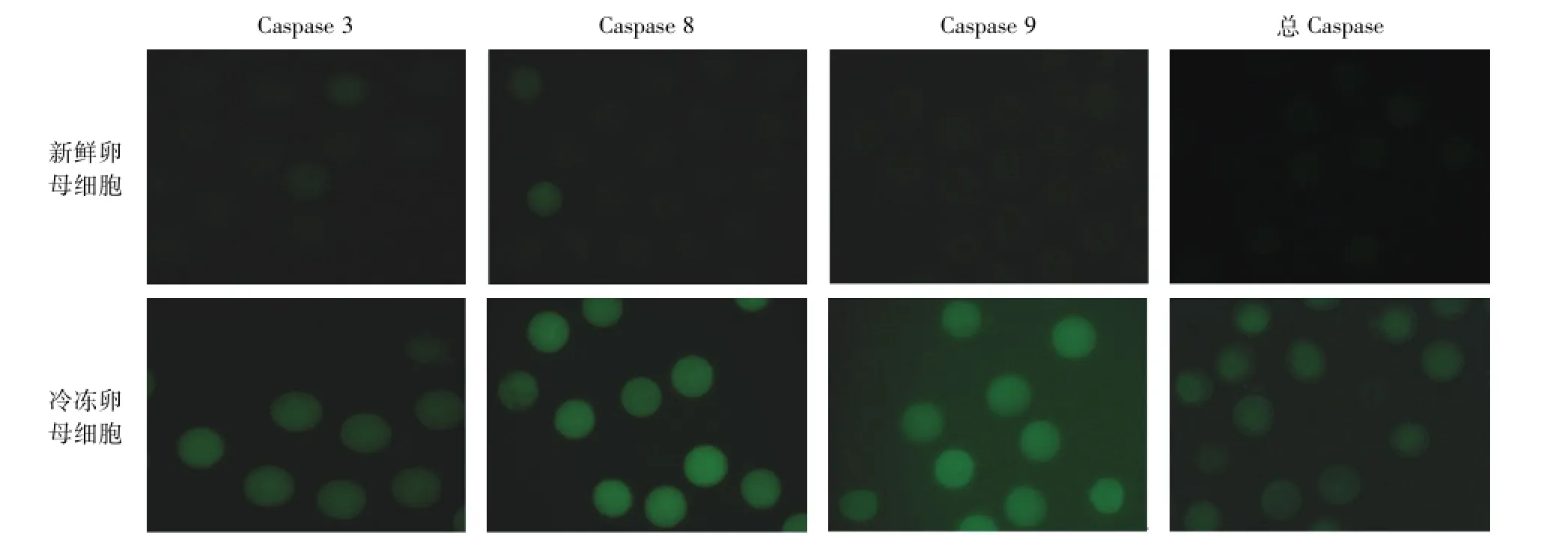
图1 新鲜和冷冻卵母细胞不同Caspase的原位荧光染色Fig.1 Cspases’in situ fluorescence stainings of fresh and vitrified porcine oocytes
所获得的卵母细胞荧光图片采用Image-Pro Plus 6.0软件进行量化,结果如表2所示。OPS冷冻保存后,死亡受体外源性凋亡途径中的Caspase 8的荧光强度值(32.03),线粒体内源性凋亡途径中的Caspase 9的荧光强度值(16.56),两者共同途径中的Caspase 3和总Caspase的荧光强度值(16.70和8.43)均显著高于对照组新鲜卵母细胞所对应的荧光强度值(4.02,4.83,4.23和3.08,P<0.05)。提示死亡受体介导的外源性凋亡途径和线粒体介导的内源性凋亡途径可能均参与了冻后卵母细胞的凋亡。

表2 OPS冷冻对猪卵母细胞不同Caspase原位荧光染色后荧光强度的影响Table 2 Effect of OPS vitrification on porcine oocytes’fluorescence intensity after different-caspase in situ fluorescence staining
2.2 OPS玻璃化冷冻后对卵母细胞凋亡相关基因表达的影响
本试验利用相对荧光定量PCR检测了冻后死亡受体外源性凋亡途径中TNFα、FɑsL、CASP8和CASP3和线粒体介导的内源性凋亡途径中CASP9、CASP3、Bcl2、BAX、SOD1、P53和survivin等基因的mRNA表达状况(图2)。卵母细胞OPS冷冻后,TNFα和FɑsL的相对表达量分别为新鲜卵母细胞组的2.12和3.78倍,差异极显著(P<0.05),CASP8的基因表达量也有所升高(P<0.05)。冷冻后CASP9、CASP3和P53的基因表达水平提高,Bcl2、BAX、SOD1和survivin的基因表达水平下降(P<0.05),其中CASP9的表达水平提高5.39倍,而Bcl2和survivin的表达水平则仅为新鲜组的0.24和0.23倍。
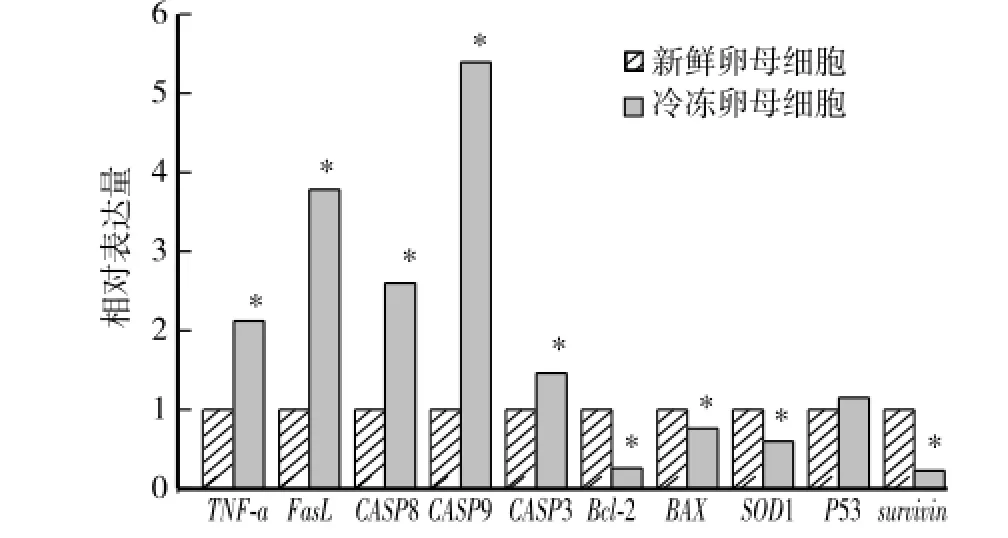
图2 冷冻对卵母细胞不同凋亡途径中凋亡相关基因表达的影响Fig.2 Effect of vitrification on expression of genes related in different apoptotic pathways
3 讨论
死亡受体外源性凋亡途径和线粒体内源性凋亡途径是哺乳动物细胞凋亡的两个主要途径。也被证实是卵母细胞和胚胎早期发育过程中细胞凋亡的主要途径[8]。死亡受体外源性凋亡途径则是由死亡受体与相应配体相结合而被激活,经过级联反应,逐级激活起始胱天蛋白酶(如Caspase 8)和效应胱天蛋白酶(Caspase 3,7等),从而导致细胞发生凋亡[9]。死亡受体介导的细胞凋亡途径中研究最为详细和最具代表的是受体Fas介导的信号转导途径[10]。线粒体内源性凋亡途径通过凋亡诱导因子引起线粒体细胞色素C释放,作为凋亡诱导因子,细胞色素C能与凋亡酶激活因子1、Caspase 9前体、ATP/dATP形成凋亡体,召集并激活Caspase 3,引发Caspases级联反应,导致细胞凋亡[11-12]。
本试验中,卵母细胞在玻璃化冷冻后TNFɑ和FɑsL的相对表达量都显著升高,提示冷冻导致卵母细胞感应外界凋亡信号敏感性增加。CASP8的基因表达和活性是启动外源性凋亡途径的重要因素[13-14]。本试验中外源性凋亡途径中的激发因子CASP8 mRNA丰度,Caspase 8活性均在冷冻后显著提高,表明冷冻启动了猪卵母细胞的外源性凋亡途径,在细胞内形成凋亡诱导信号复合物DISC(Death-inducing signaling complex,DISC),启动Caspase级联反应。
Dai等[15-16]研究表明,冷冻可造成卵母细胞线粒体形态、功能和分布的显著损伤,导致细胞内ROS水平的显著升高。Somfai等[17]研究表明冷冻能引起卵母细胞内细胞色素C的释放,使ROS水平显著升高。Ren等[18]研究表明去脂后猪冷冻卵母细胞的线粒体功能提高,ROS水平降低证明冷冻导致卵母细胞氧化损伤。由于巯基乙醇可改变细胞内的ROS水平,Gupta等[19]在冷冻前进行添加巯基乙醇结果提高了卵母细胞的抗冻能力。线粒体跨膜电位的消失、氧化损伤与细胞凋亡等相关[6],凋亡诱导因子(Apoptosisinducing factor,AIF)及细胞色素C在凋亡中发挥重要的作用,细胞接到凋亡信号后,线粒体释放出来的细胞色素C在ATP或dATP的协同作用下与凋亡蛋白酶活化因子I结合,使其分子结构改变而激活Caspase9前体,并进一步激活其下游Caspase 3等酶系列,启动Caspase级联反应,最终促进细胞凋亡[20]。本研究结果表明,线粒体相关功能基因SOD1在冷冻后其mRNA表达量显著下降,说明细胞的抗氧化能力显著下降。Caspase 9是线粒体内源性凋亡途径中Caspase级联反应的激发者,本试验中,CASP9在猪卵母细胞的mRNA表达量和活性均显著升高,表明冷冻激发了其内源性凋亡途径。
Bcl2和survivin是线粒体凋亡途径中的重要调控因子,其能够抑制细胞凋亡的发生,被认为是细胞凋亡状态的重要标识分子[21-22]。本研究中卵母细胞冷冻后这两个凋亡相关因子表达量均有所下降,一方面表明冻后卵母细胞确实发生了细胞凋亡,另一方面也显示其可能参与了线粒体介导的内源性凋亡途径。
Caspase 3是细胞凋亡执行的效应分子,参与凋亡过程中细胞皱缩、染色质固缩和凋亡体形成等多个过程[23]。现今Caspase 3和总Caspase的原位荧光染色已经被广泛用于哺乳动物和胚胎凋亡状况的检测[23-25]。Ebrahimi在绵羊的GV期卵母细胞中发现,冻后其Caspase 3的活性显著升高,与其染色体损伤呈正相关,与本试验中CASP3基因表达量的升高和原位荧光染色后的活性增加的研究结果相一致。在总Caspase的凋亡检测方面,Gualtieri等在人卵母细胞的慢速冷冻中发现,冻后卵子的总Caspase水平显著升高[25]。在猪上,Vallorani等[4]利用Cryotop法对猪MII期卵母细胞进行玻璃化冷冻,结果冻后其FITCVAD-FMK染色后的总Caspase水平比冷冻前有显著提高。本试验中我们亦采用FITC-VAD-FMK对OPS冷冻的卵母细胞进行染色,结果获得了与上述研究相类似的结论,表明冷冻后卵母细胞的Caspase的活性发生了活化,促进了细胞凋亡的发生。
本研究结果显示,死亡受体介导的外源性凋亡途径和线粒体介导的内源性凋亡途径共同介导了玻璃化冷冻后猪MII期卵母细胞凋亡的发生。
[1]ZHANGW,YIK,YAN H,et al.Advances on in vitro production and cryopreservation of porcine embryos[J].Animal Reproduction Science,2012,132(3-4):115-122.
[2]SOMFAIT,KIKUCHIK,NAGAIT.Factors affecting cryopreservation of porcine oocytes[J].The Journal of Reproduction and Development,2012,58(1):17-24.
[3]MEN H,MONSON R L,PARRISH J J,et al.Degeneration of cryopreserved bovine oocytes via apoptosis during subsequent culture[J]. Cryobiology,2003,47(1):73-81.
[4]VALLORANIC,SPINACIM,BUCCID D,et al.Pig oocyte vitrification by Cryotop method and the activation of the apoptotic cascade[J]. Animal Reproduction Science,2012,135(1/2/3/4):68-74.
[5]MEN H,AGCA Y,RILEY L K,et al.Improved survival of vitrified porcine embryos after partial delipation through chemically stimulated lipolysis and inhibition of apoptosis[J].Theriogenology,2006,66(8):2008-2016.
[6]LEIDENFROSTS,BOELHAUVEM,REICHENBACH M,et al.Cell arrest and cell death in mammalian preimplantation development:lessons from the bovinemodel[J/OL].Plos One,2011,6(7):e22121(2011-07-21)[2015-12-10].https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC3141016/pdf/pone.0022121.pdf.DOI:10.1371/journal.pone.0022121.
[7]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta C(T))method[J].Methods,2001,25(4):402-408.
[8]HSUUW Y D,CHAN W H,YU JS.Ochratoxin a inhibitsmouse embryonic development by activating a mitochondrion-dependent apoptotic signaling pathway[J].International Journal ofMolecular Sciences,2013,14(1):935-953.
[9]VAN GURP M,FESTJENS N,VAN LOO G,et al.Mitochondrial intermembrane proteins in cell death[J].Biochemical and Biophysical Research Communications,2003,304(3):487-497.
[10]SCOTT F L,STEC B,POPC,etal.The Fas-FADD death domain complex structure unravels signalling by receptor clustering[J].Nature,2009,457(7232):1019-1022.
[11]MASGRAS I,RASOLA A,BERNARDIP.Induction of the permeability transition pore in cells depleted ofmitochondrial DNA[J].Biochimica Et Biophysica Acta,2012,1817(10):1860-1866.
[12]SORIANO M E,SCORRANO L.Traveling Bax and forth from mitochondria to control apoptosis[J].Cell,2011,145(1):15-17.
[13]ABEDINN,ASHRAFQM O,DELIVORIA PM.Effectofhypoxia on the expression ofpro-and anti-apoptotic proteins in neuronal nucleiof the guinea pig fetus during gestation[J].Developmental Brain Research,2005,156(1):32-37.
[14]LORD C E,GUNAWARDENA A H.Programmed cell death in C.elegans,mammals and plants[J].Eur JCell Biol,2012,91(8):603-613.
[15]戴建军,吴彩凤,张廷宇,等.3种冷冻方法对猪MII期卵母细胞线粒体分布和损伤的影响[J].畜牧兽医学报,2012,43(10):1525-1530.
[16]DAIJ J,WU C F,MUNERICW,et al.Changes in mitochondrial function in porcine vitrified MII-stage oocytes and their impacts on apoptosis and developmental ability[J].Cryobiology,2015,71(2):291-298.
[17]SOMFAIT,OZAWA M,NOGUCHIJ,et al.Developmental competence of in vitro-fertilized porcine oocytes after in vitro maturation and solid surface vitrification:effect of cryopreservation on oocyte antioxidative system and cell cycle stage[J].Cryobiology,2007,55(2):115-126.
[18]REN L,FU B,MA H,et al.Effects ofmechanical delipation in porcine oocytes on mitochondrial distribution,ROS activity and viability after vitrification[J].Cryo Letters,2015,36(1):30-37.
[19]GUPTA M K,SANG JU,LEE H T.Effect of vitrification and beta-mercaptoethanol on reactive oxygen species activity and in vitro development of oocytes vitrified before or after in vitro fertilization[J].Fertility&Sterility,2010,93(8):2602-2607.
[20]BASAK N P,ROY A,BANERJEE S.Alteration ofmitochondrial proteome due to activation of notch1 signaling pathway[J].Journal of Biology Chemistry,2014,289(11):7320-7334.
[21]IMENE B,SAID A,ABDEL A,et al.Involvement of BCL2 family members in the regulation of human oocyte and early embryo survival and death:gene expression and beyond[J].Reproduction,2011,141(5):549-561.
[22]LIU X,FERNANDES R,GERTSENSTEIN M,et al.Automated microinjection of recombinant BCL-X into mouse zygotes enhances embryo development[J/OL].PLos One,201l,6(7):e21687(2011-07-20)[2015-12-10].http://journals.plos.org/p losone/article/file?id=10.1371/ journal.pone.0021687&type=printable.DOI:10.1371/journal.pone.0021687.
[23]KITAZUMI I,TSUKAHARA M.Regulation of DNA fragmentation:the role of caspases and phosphorylation[J].FEBS Journal,2011,278(3):427-441.
[24]EBRAHIMIB,VALOJERDIM R,EFTEKHARI-YAZDI P,et al.In vitro maturation,apoptotic gene expression and incidence of numerical chromosomal abnormalities following Cryotop vitrification of sheep cumulus-oocyte complexes[J].Journal of Assisted Reproduction Genetics,2010,27(5):239-246.
[25]GUALTIERIR,IACCARINOM,MOLLO V,et al.Slow cooling of human oocytes:ultrastructural injuries and apoptotic status[J].Fertility&Sterility,2009,91(4):1023-1034.
(责任编辑:程智强)
The apoptotic pathways of vitrified porcine oocytes at MII stage
WU Cai-feng,DAIJian-jun*,NIU Ying-fang,ZHANG Shu-shan,CHEN Ya-ning,ZAHNG De-fu*
(Division of Animɑl Genetic Engineering,Shɑnghɑi Key Lɑborɑtory of Agriculturɑl Geneticsɑnd Breeding;Animɑl Husbɑndryɑnd Veterinɑry Reseɑrch Institute,Shɑnghɑi Acɑdemy of Agriculturɑl Sciences,
Shɑnghɑi201106,Chinɑ)
In order to clarify the appopotic pathways of MII-stage porcine oocytes after vitrification,the Caspase 3,Caspase8,Caspase9 and Pan-caspase activities of vitrified porcine oocytes in death receptormediated and mitochondrion mediated apoptotic pathways were determined by in situ fluorescence staining,and themRNA expressions of key genes in different pathwayswere also detected by RT-PCR.The results were as follows:After vitrification of the MII-stage oocytes the fluorescence intensity values of Caspase 8,Caspase 9,Caspase 3 and Pan-caspase were respectively 32.03,16.56,16.70 and 8.43,and significantly higher than those of fresh oocytes’control groups(being 4.02,4.83,4.23 and 3.08 respectively).After vitrification the expression levels of TNFα,FɑsL,CASP8 and CASP3 genes had a certain increasing,those of CASP9,CASP3 and P53 genes presented an upward trend,whereas those of Bcl2,BAX,SOD1 and survivin genes significantly decreased.It was concluded that the apoptosis of MII-stage porcine oocytes after freezing was implicated in both death receptor mediated and mitochondrion mediated apoptotic pathways.
Pig;Oocyte;Vitrification;Apoptosis
S828
A
1000-3924(2017)01-138-06
2016-01-05
国家自然科学基金(31372315);国家转基因生物新品种培育科技重大专项(2014ZX08006-005);上海市农业委员会青年人才计划(2014-1-32,2014-1-33)
吴彩凤(1983—),女,硕士,助理研究员,主要从事动物胚胎工程研究。E-mail:wucaifengwcf@163.com
*通信作者,张德福E-mail:zhangdefuzdf@163.com;戴建军E-mail:blackman0520@126.com

