磁共振扩散加权成像ADC值测定评价脑梗死灶及周围缺血改变
杨慧强 曹志坚 岑林
磁共振扩散加权成像ADC值测定评价脑梗死灶及周围缺血改变
杨慧强 曹志坚 岑林
目的 利用磁共振扩散加权成像测定脑梗死核心区及周围组织表观扩散系数(ADC)值,评价脑梗死灶转归及周围组织缺血改变。方法 收集80例急性脑梗死患者作为观察对象,梗死24h内行MR检查,40例第3天行MR检查,梗死区域为基底节区18例,丘脑8例,侧脑室旁12例,额叶2例;40例第7天行MR检查,梗死区域为基底节区16例,丘脑8例,侧脑室旁11例,额叶3例,枕叶2例。测量首诊和复查的脑梗死患者病灶核心区及核心区周围2cm范围内和相应层面对侧镜像区ADC值,比较不同时间ADC值变化;按解剖部位分为基底节区组、丘脑组和侧脑室旁组,比较各组间ADC值变化。结果 80例急性脑梗死患者3d与7d复查组病灶核心区ADC值差值差异有统计学意义(P<0.001);病灶周围ADC值差异有统计学意义(P<0.001),ADC值变化与梗死解剖位置差异无统计学意义(P>0.05)。结论 ADC值能动态定量反映梗死核心区缺血与坏死的转归及周围脑组织缺血改变,有助于梗死灶的预后评价及疗效观察。
脑梗死 磁共振成像 扩散加权成像 ADC值
脑梗死是临床常见疾病,临床评价脑梗死最常用影像的检查方法是磁共振成像(MRI),磁共振不但能发现超急性期脑梗死,还能用于脑梗死病灶随访及预后预测。急性期脑梗死时细胞水肿,水分子扩散受限,MRI的DWI序列病灶呈高信号改变[1],其表观扩散系数(ADC)能定量的反映水分子扩散运动[2],从而反映细胞水肿及坏死状态。本资料中利用ADC值定量评价脑梗死后核心区脑组织转归及周围组织缺血改变特点,为临床脑梗死治疗及疗效预测提供参考。
1 临床资料
1.1 一般资料 收集2011年3月至2016年3月期间在义乌市中医院及浙江省中医院神经内科住院治疗的80例急性脑梗死患者作为观察对象。梗死24h内行MR检查。按MRI复查天数分3d组和7d组,每组各40例。3d复查组,其中男24例,女16例;年龄22~86岁,平均年龄(64.43±12.64)岁;梗死区域,基底节区18例,丘脑8例,侧脑室旁12例,额叶2例。梗死7d复查组,年龄51~82岁,平均年龄(63.93±8.48)岁;梗死区域,基底节区16例,丘脑8例,侧脑室旁11例,额叶3例,枕叶2例。按部位分为基底节区组,其中3d复查18例,7d复查16例;丘脑组,其中3d及7d复查各8例);侧脑室旁组,其中3d复查12例,7d复查11例;脑叶组病例数较少不计入部位分组。首诊患者多表现为言语不清、头晕、头痛、肢体乏力、肢体活动不利及口角歪斜等。所有患者无脑外伤、颅脑手术史,脑肿瘤、动静脉畸形病史、无严重肝、肾疾病、心脏起搏器等磁共振检查禁忌症。
1.2 MR检查 采用3T超导型磁共振扫描仪(德国)和1.5T超导型磁共振扫描仪(德国)。常规扫描横断面快速自旋回波序列(FSE)T1WI,FSE-T2WI;DWI扫描采用单次激发回波平面成像(SE-EPI)技术。
1.3 图像分析与数据测量 所有图像均使用SPIN(SVN Revision 2131)软件(MRI Institute for Biomedical Research,Detroit,MI)进行处理。由两位医生观察DWI图和ADC图,DWI高信号区为梗死核心区,选定DWI显示的病变最大层面进行ADC值测量,在病灶核心区及核心区周围2cm范围内和相应层面对侧影像区域分别确定三个感兴趣区,测量核心区及核心区周围2cm范围内的ADC值,相应层面对侧大脑半球的影像区域ADC值(见图1)。测量时尽量避开脑沟,取测量数据的平均值。
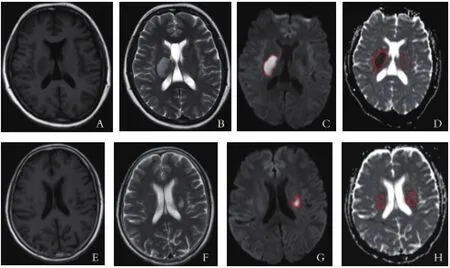
图1 急性脑梗死ADC值测定区域信号图[女56岁,右侧基底节区脑梗死3d(A~D),MR显示T1WI呈低信号(A),T2WI呈高信号(B),DWI呈明显高信号(C),ADC值明显减低(D),测量梗死核心区、病灶对侧(箭)及病灶周围组织(箭头)ADC值。女67岁,左侧基底节区脑梗死7d(E~H),MR显示T1WI呈低信号(E),T2WI呈高信号(F),DWI呈明显高信号(G),ADC值稍减低(H),测量方法同上。]
1.4 统计学方法 采用SPSS 19.0统计软件。计量资料以(x±s)表示,采用配对t检验对卒中后不同时期ADC值反映梗死区、周围组织改变的一致性及与解剖部位相关性进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 脑梗死组首诊与复查病灶ADC值 80例急性脑梗死患者,发现91处梗死灶。3d组48个病灶,7d组43个病灶。见表1。

表1 脑梗死组首诊与复查病灶ADC值[×10-6mm2/s,(x±s)]
2.2 基底节区组、丘脑组及侧脑室旁三组间ADC值方差分析比较 73例急性脑梗死患者,共76个梗死灶,按解剖部位分基底节区组,3d复查18个病灶,7d复查16个病灶;丘脑组,3d和7d复查各8个病灶;侧脑室旁组,3d复查13个病灶,7d复查13个病灶,测量病灶核心区、周围脑组织ADC的改变,其与解剖部位无明显相关性,差异均无统计学意义(P>0.05)。
3 讨论
DWI成像理论基础是组织细胞间水分子存在布朗运动,脑梗死急性期细胞水肿,水分子布朗运动受限,DWI图像上呈高信号改变而改变,而这种改变会随着缺血组织脑组织细胞水肿与坏死状态而发生改变,其ADC图所测得的ADC值在一定程度上反映了水分子的扩散运动[2]。本资料发现ADC值能更敏感反映梗死后脑组织细胞水肿与坏死状态。
脑梗死缺血早期DWI 上表现为高信号[3],这是由于缺血早期,细胞毒性水肿造成神经元细胞肿胀,细胞外间隙减小,细胞外水分子扩散受阻;而细胞内水分子由于受到细胞膜、细胞器等的阻碍,扩散程度增加不明显,故缺血组织总的扩散程度减小,因而表现为高信号,而此时ADC值降低[4]。本资料发现急性脑梗死早期病灶核心区ADC值降低明显,核心区周围组织ADC值也相应减低,提示除病灶核心区缺血外,周围脑组织也存在缺血[5]。而脑梗死核心区及周围组织ADC值的演变具有一定规律性,病灶核心区ADC 值随着时间延长由逐渐降低转变为逐渐升高,符合脑组织细胞缺血梗死后水肿逐渐加重原理,水分子扩散受限更加明显,ADC值逐渐降低;细胞膜性结构崩解及血管性水肿逐渐加重,ADC值逐渐增高;组织液化坏死后ADC值明显增高的病理过程。梗死核心区的ADC值随着病变进展存在一个由低-更低-高的改变过程。因此临床观察缺血性卒中ADC值要注意时间窗的改变,在ADC值上升的过程中,有可能会出现假正常化的现象。虽然DWI高信号表现在2周内会逐渐降低,也能观察细胞水肿坏死状态,但这种变化不如ADC值敏感,作者观察到80例患者梗死灶DWI均为高信号,但3d组和7d组ADC值发生了改变,这种改变能更敏感定量分析梗死灶的转归。梗死核心区周围组织ADC值降低,与组织缺血低灌注有一定的关系,这种低灌注具有可变性和可逆性的特点,随着时间的推移,处于一个动态变化的过程,如果血流能够及时恢复,可恢复正常灌注,否则将会导致不可逆性脑损害。
本资料中病例经过治疗3d组和7d组病灶周围ADC值均有所恢复,提示病灶周围缺血状态得以恢复。核心区ADC值低-更低-高的改变预示着核心区细胞不可逆性的死亡,而周围缺血组织ADC值随着血流灌注改善可以逐渐恢复正常,这种改变可以在一定程度上反映组织缺血状态,为指导临床的治疗及预后评价提供一定参考。作者观察基底节区、丘脑和侧脑室旁脑梗死ADC值的变化,发现梗死核心区与周围组织ADC值变化与上述解剖部位无明确相关性,这可能是由于患者均为深部脑组织梗死患者,其ADC值变化尚无显著性差异。但本资料患者中脑叶表面梗死相对较少,统计意义不明显,深部脑组织与浅表脑组织梗死间ADC值变化是否存在差异还需要进一步观察。另外,由于临床研究的局限性,难以在1周内对患者进行多次MR检查,因此选取了两组不同患者在不同时间点进行观察,但所得数据能在一定程度上反映脑梗死后核心区及周围组织ADC值的变化规律。
[1] Padhani AR, Koh DM, Collins DJ. Whole-body diffusionweighted MR imaging in cancer:current status and research directions. Radiology, 2011,261(3):700-718.
[2] Schwamm LH,Koroshetz WJ,Sorensen AG,et al.Time course of lesion development in patients with acute stroke serial diffusionand hemodynamic-weighted magnetic resonance imaging.Stroke, 1998, 29(11):2268-2276.
[3] Qiao M, Malisza KL, Del Bigio MR, et al. Transient Hypoxia-Ischemia in Rats: Changes in Diffusion-Sensitive MR Imaging Findings, Extracellular Space, and Na+-K+-Adenosine Triphosphatase and Cytochrome Oxidase Activity1. Radiology, 2002, 223(1): 65-75.
[4] Rohl L, Ostergaard L, Simonsen CZ, et al. Viability thresholds of ischemic penumbra of hyperacute stroke defined by perfusionweighted MRI and apparent diffusion coefficient. Stroke, 2001, 32(5): 1140-1146.
[5] Hermier M, Nighoghossian N. Contribution of susceptibilityweighted imaging to acute stroke assessment. Stroke, 2004, 35(8): 1989-1994.
Objective To utilize diffusion weighted imaging to measure ADC values of cerebral infarction core and surrounding tissues,evaluate the outcome of cerebral infarction. Methods 80 cases of acute cerebral infarction patients were collected as the research object,MRI scans were performed at initial diagnosis in 24 hours,40 cases were reviewed with MR scan after 3 days,and others cases were reviewed with MRI scans after 7days. ADC values of infarction core and the tissues to around the core within 2 cm in the initial diagnosis were measured and patients were reviewed,and then ADC values of the corresponding level to the side mirror area were measured. To compare ADC values changes of different time. According to the anatomical site, they were divided into basal ganglia,thalamus and lateral ventricle group and comparison between groups of ADC values change. Results 80 cases of acute cerebral infarction patients ADC values had significant difference in 3 days and 7 days when reviewing the lesion core,with statistical significance(P<0.001). The ADC values was of great difference in surrounding tissues with statistical significance(P<0.001). The ADC values change with infarction of anatomical differences had no statistical significance(P>0.05). Conclusions ADC value can quantitative and dynamic reflect the outcome of Ischemia and necrosis in the infarction area and the surrounding tissues,Could help us to evaluation the infarcts prognosis and curative effect observation.
Cerebral infarction Magnetic resonance imaging Diffusion weighted imaging ADC values
322000 浙江省义乌市中医院(杨慧强)
310006 浙江省中医院(曹志坚 岑林)

