BDE-47和BDE-209对乙酰胆碱酯酶(AChE)活性的抑制特性及分子作用力研究
巫川, 王树涛, 朱婧, 尤宏
哈尔滨工业大学城市水资源与水环境国家重点实验室, 哈尔滨 150090
作为一种溴系阻燃剂,多溴联苯醚(PBDEs)曾被广泛用于电子产品、纺织、石油开采等领域中,其在生产及使用过程中,不可避免地会进入环境中[1-2]。PBDEs在大气、水体、土壤、动物及人体等环境介质中均被检出[3-6],其对动物及人体的影响引起了广泛关注。PBDEs能够影响一些蛋白质的生理功能,如雌/雄激素效应[3-4]、甲状腺激素效应[5]、芳香烃受体效应[6]等,同时PBDEs能够导致生殖毒性、肝肾毒性、神经毒性[7-10]等,其中神经毒性尤其受到关注。由于PBDEs能够导致这一系列的毒性,2009年的《斯德哥尔摩公约》中部分PBDEs被列入了持久性有机污染物的受控名单中[11],而目前环境中仍存在着一定量的BDE-47与BDE-209[12],因此有必要对其进行毒性评估。BDE-47与BDE-209能够以不同的方式导致神经毒性。Lucio等[13]的研究表明,BDE-47能够在体外诱导小鼠小脑颗粒神经元中的氧化应激和凋亡细胞死亡;Zhang等[14]通过培养大鼠神经干细胞(NSCs)进行体外研究,考察BDE-209的神经毒性,发现BDE-209在体外能够抑制NSCs增殖,并能诱导其凋亡,这可能与nF-κB途径的激活有关。然而,BDE-47与BDE-209对AChE活性的影响所引起的神经毒性却很少被报道。
AChE与神经细胞的发育和成熟密切相关,其能够促进神经元的发育和神经再生[15]。在人体中,主要分布在神经系统组织中的AChE可以快速催化神经递质乙酰胆碱的水解,并导致神经冲动传递的终止,从而保证人体的正常生理功能[16]。AChE是神经系统中最重要的酶之一,任何影响AChE活性的物质都可能导致神经毒性[17]。刑厚娟等[18]研究了硝基苯对大鼠神经系统AChE的影响,发现大鼠具有明显的神经毒性。在研究甲醛对该过程的神经毒性方面,Rezvan等[19]发现AChE活性和神经毒性是不可分割的。
BDE-47和BDE-209因与AChE之间的相互作用而导致的神经毒性的研究鲜见报道,且AChE活性变化的神经毒性分子机制还不清楚。动物实验不仅耗时耗力,也很难从小分子与生物大分子相互作用的角度解释毒性机制。荧光光谱可用作研究小分子和蛋白质大分子之间的相互作用的有用和快速的方法[20],可以在更深层次上揭示毒性机制。本文研究了BDE-47与BDE-209对AChE的活性影响,利用荧光光谱的手段研究了BDE-47和BDE-209与AChE相互作用的分子作用力类型,旨在揭示PBDEs导致神经毒性的致毒通路。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 实验试剂及配制
Tris-HCl缓冲溶液的配制:用0.2 mol·L-1的Tris和0.1 mol·L-1的HCl配制,其pH值至7.4;AChE溶液的配制:使用pH值为7.4的Tris-HCl缓冲溶液作为溶剂,配制成浓度为100 U·L-1的AChE溶液;碘化硫代乙酰胆碱(ATChI)溶液的配制:称取ATChI 434 mg,溶于100 mL pH值为7.4的Tris-HCl缓冲溶液中;DTNB溶液的配制:称取DTNB 595 mg,溶于100 mL pH值为7.4的Tris-HCl缓冲溶液,配制成浓度为0.015 mol·L-1的DTNB溶液;终止剂十二烷基磺酸钠(SDS)溶液的配制:称取SDS 0.4 g,溶于一级水中,配制成浓度为0.4%的SDS溶液;BDE-47溶液的配制:称取48.6 mg的 BDE-47溶于二甲基亚砜(DMSO)溶液中,配制成浓度为1 000 μmol·L-1的BDE-47母液,实验时用DMSO稀释成不同浓度的BDE-47样液;BDE-209溶液的配制:称取96 mg的BDE-209溶于DMSO溶液中,配制成浓度为1 000 μmol·L-1的BDE-209母液,实验时用DMSO稀释成不同浓度的BDE-209样液;NaCl的配制:称取5.844 g NaCl溶于100 mL的蒸馏水中得到1 mol·L-1的NaCl溶液。以上所有试剂均为化学纯,BDE-47和BDE-209购于武汉凯美克化学科技有限公司,AChE购买于上海源叶生物科技有限公司,其余试剂均购买于上海麦克林生化科技有限公司。
1.1.2 实验仪器
主要仪器为分光光度计(普析通用仪器公司,T6-1650F)和荧光光谱仪(日本JASCO,FP-6500)。
1.2 实验方法
1.2.1 AChE活性抑制实验方法
取多个10 mL的试管,洗净烘干后加入7.65 mL的pH值为7.4的Tris-HCl缓冲溶液,再加入50 μL的AChE溶液和100 μL DTNB溶液,同时加入样品溶液100 μL,每种样品均用样品母液稀释成一系列的不同浓度的样液,摇匀后放入37 ℃的水浴锅中预热30 min,预热结束后加入100 μL的ATChI溶液,接着在37 ℃的水浴锅中反应60 min,反应结束后迅速加入1 mL的0.4%的终止剂SDS溶液来终止反应,然后立即在紫外分光光度计412 nm出测得光度吸收值,并根据下列公式计算出不同浓度的样品溶液下的抑制率。
I%=[A对照-(A样品-A样品空白)]/A对照×100
(1)式中,I指BDE-47或BDE-209对AChE的抑制率,%;A对照指样品溶液中没有加入样品时的吸光值;A样品指样品溶液中加入不同浓度的样品时的吸光值;A样品空白指样品溶液中加入了不同浓度的样品但没有加入底物ATChI时的吸光值。为了避免误差,每个不同浓度的样品溶液同时做3个平行测试,取其平均值,作为各不同浓度的样品溶液的平均抑制率。
1.2.2 光谱实验方法
移取1mL的NaCl溶液、一定量的AChE溶液及样品溶液与10 mL的比色管中,用Tris-HCl缓冲溶液定容,在37 ℃的水浴锅中反应60 min,在F-7000荧光光谱仪上扫描测得荧光强度,荧光强度的变化可根据Stern-Volmer方程[21]判别其猝灭类型。
(2)
式中,F指存在BDE-47和BDE-209时的荧光强度;F0指不存在BDE-47和BDE-209时的荧光强度;Q指BDE-47和BDE-209的浓度,mol·L-1;Ksv指Stern-Volmer猝灭常数,L·mol-1;Kq指猝灭速率常数,mol·L-1·s-1;τ0指蛋白质的平均寿命(10-8s)[22]。同时,根据改进的Scatchard方程[23]计算出BDE-47和BDE-209与AChE相互作用的结合常数和结合位点数。
ΔF/F0/Q=nK-(ΔF/F0)K
(3)
式中,ΔF指加入BDE-47或BDE-209前后的荧光强度的变化;F0指不存在BDE-47和BDE-209时的荧光强度;Q指BDE-47和BDE-209的浓度,mol·L-1;n指结合位点数;K指结合常数,L·mol-1。计算所得的结合常数可用于BDE-47和BDE-209与AChE相互作用的热力学参数的计算,其计算公式[24]如下:
ln(K2/K1) = ΔH/R(1/T1-1/T2)
(4)
ΔG = -RTlnK
(5)
ΔS = -(ΔG-ΔH)/T
(6)
2 结果与讨论(Results and discussion)
2.1 BDE-47和BDE-209对AChE的抑制作用
BDE-47和BDE-209对AChE的抑制作用根据Ellman法[25]测定,其原理是在pH值为7.4的Tris-HCl缓冲溶液中,用ATChI作为底物,此物质在AChE作用下可分解成乙酰胆碱,乙酰胆碱可与显色剂DTNB快速反应生成一种黄色阴离子物质5-巯基-2-硝基苯乙酸,5-巯基-2-硝基苯乙酸在紫外分光光度计412 nm外有光吸收。

图1 不同浓度下BDE-47和BDE-209对AChE的抑制影响Fig. 1 Inhibition of BDE-47 and BDE-209 on the AChE activity at different concentrations
如图1所示,BDE-47与BDE-209在一定浓度范围内均能够抑制AChE分解乙酰胆碱,随着BDE-47与BDE-209浓度的增加,两者的抑制效率均呈现出先增加后降低的趋势。其中BDE-47浓度从50 μmol·L-1增加到400 μmol·L-1时,BDE-47对AChE的抑制率从8.6%逐步升高到最大值22.3%;当浓度进一步增大,从400 μmol·L-1增加到800 μmol·L-1时,BDE-47对AChE的抑制率不增反减,从22.3%降低到9.2%;BDE-209浓度从50 μmol·L-1升高到200 μmol·L-1时,BDE-209对AChE的抑制率从5.8%逐步升高到最大值11.2%;当浓度进一步增大,从400 μmol·L-1增加到800 μmol·L-1时,BDE-209对AChE的抑制率不增反减,从11.2%降低到0.4%;这说明BDE-47与BDE-209对AChE具有一定的抑制作用,抑制作用的强弱与BDE-47和BDE-209的浓度有一定的关系,由于AChE的活性中心位于球形表面形成的凹陷结构的底部,这个凹陷俗称为峡谷[26],而这个峡谷区并不是平滑的,它还有一个如同瓶颈一般的收缩区域[27],在低浓度条件下,BDE-47和BDE-209分子可能顺利的通过这个峡谷与AChE的活性中心相结合从而抑制了AChE的活性,而在高浓度条件下,BDE-47和BDE-209分子可能因相互碰撞不能顺利的通过这个区域与活性中心相结合,从而达不到抑制AChE活性的作用。相同浓度下,BDE-47对AChE的抑制率始终大于BDE-209,说明AChE对BDE-47更加敏感。
温度不仅可以影响酶的活性,也可能影响小分子物质与蛋白质的结合。图2结果表明,不同温度下的BDE-47和BDE-209对AChE活性的抑制均有一定影响。在300 K条件下,BDE-47和BDE-209对AChE活性抑制的影响规律与310 K条件下的规律一致,但在300 K条件下,BDE-47和BDE-209在每种浓度条件下对AChE活性抑制率均出现了一定的增强作用,这表明温度的增加不利于BDE-47和BDE-209与AChE的结合。
2.2 BDE-47和BDE-209与AChE相互作用的荧光光谱分析
BDE-47和BDE-209对AChE的活性实验表明BDE-47和BDE-209对AChE具有一定的抑制作用,即BDE-47和BDE-209能够与AChE相互作用。BDE-47和BDE-209与AChE相互作用的荧光光谱图如图3所示。可见,BDE-47和BDE-209对AChE的荧光性均有一定的猝灭作用,随着BDE-47和BDE-209浓度的增加,猝灭作用增强;同时,随着BDE-47和BDE-209浓度的增加,在BDE-47-AChE和BDE-209-AChE体系中,其最大吸收峰的位置均产生了一定的蓝移。在BDE-47-AChE体系中,BDE-47的浓度从0 μmol·L-1升高到50 μmol·L-1,最大吸收峰的位置从336 nm蓝移到了333 nm;在BDE-209-AChE体系中,BDE-209的浓度从0 μmol·L-1升高到50 μmol·L-1,最大吸收峰的位置从336 nm蓝移到了334 nm。这表示在加入BDE-47和BDE-209后,BDE-47和BDE-209与AChE的相互作用使AChE的发色团的微环境发生了变化,从而变得更加疏水,即疏水作用变强[23]。
BDE-47和BDE-209能够猝灭AChE的荧光,而荧光的猝灭类型有静态猝灭和动态猝灭[28],通过Stern-Volmer方程可以确定BDE-47和BDE-209对AChE荧光的猝灭类型。在300 K和310 K稳定条件下,根据线性回归方程分别求得了Kq、Ksv。由图4可以看出,在BDE-47和BDE-209选定的浓度范围内,根据线性回归方程,随着温度的升高,猝灭曲线的斜率降低,各个温度下的猝灭常数随着温度的升高而降低,这表明BDE-47和BDE-209对AChE的荧光猝灭类型为静态猝灭[23]。

图2 不同温度下BDE-47与BDE-209对AChE活性抑制的影响Fig. 2 Inhibition of BDE-47 and BDE-209 on the AChE activity at different temperatures
根据图4的线性方程可以求出Kq、Ksv值,在300 K和310 K条件下,BDE-47对AChE的Kq、Ksv值分别为1.04×1012和0.91×1012L·mol-1·s-1、1.04×104和0.91×104L·mol-1;在300 K和310 K条件下,BDE-209对AChE的Kq、Ksv值分别3.5×1012和3.5×1012L·mol-1·s-1、3.5×104和3.3×104L·mol-1。小分子与蛋白质作用的最大碰撞猝灭速率常数(Kq)为2.0×1010L·mol-1·s-1,大于这个值时小分子对蛋白质的荧光猝灭类型为静态猝灭,反之则为动态猝灭[29]。BDE-47和BDE-209对AChE的Kq值远大于2.0×1010L·mol-1·s-1,因此,BDE-47和BDE-209对AChE的荧光猝灭类型为静态猝灭。
BDE-47和BDE-209对AChE的荧光猝灭类型确定后,根据改进的Scatchard方程来计算出BDE-47和BDE-209与AChE相互作用的结合常数和结合位点数。由表1得,BDE-47与AChE在300 K、310 K下的结合常数分别为4.26×104L·mol-1和3.68×104L·mol-1,BDE-209与AChE在300 K、310 K下的结合常数分别为4.23×104L·mol-1和3.66×104L·mol-1。BDE-47和BDE-209与AChE的结合常数随着温度的增加而减小,这表明升高温度可能减弱了BDE-47和BDE-209与AChE的结合作用;2个温度下的BDE-47与AChE的结合常数均大于BDE-209与AChE的结合常数,这表明BDE-47更易与AChE相互作用,同时阐明了BDE-47对AChE的抑制率始终大于BDE-209的原因。2个温度下,BDE-47和BDE-209与AChE的结合位点数均接近于1,表示BDE-47和BDE-209与AChE的只有一个结合位点。
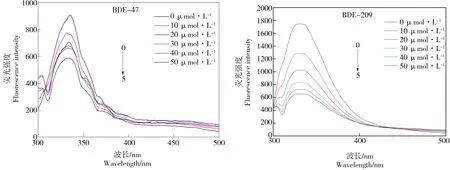
图3 不同浓度下BDE-47和BDE-209与AChE相互作用的荧光光谱注: [AChE]=10 U·L-1, [BDE-47]=0, 1, 2, 3, 4, 5×10-5 mol·L-1, T=300 K, pH=7.4, λex=280 nm。Fig. 3 Fluorescence spectra of BDE-47 and BDE-209 interacting with AChE at different concentrationsNote: [AChE]=10 U·L-1, [BDE-47]=0, 1, 2, 3, 4, 5×10-5 mol·L-1, T=300 K, pH=7.4, λex=280 nm.
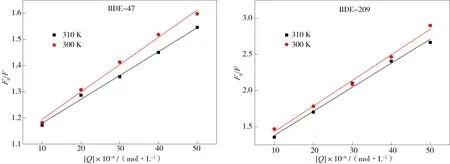
图4 不同温度下BDE-47和BDE-209与AChE相互作用的Stern-Volmer方程Fig. 4 Stern-Volmer equation for the interaction of BDE-47 and BDE-209 with AChE at different temperatures
小分子物质与大分子蛋白质之间的相互作用通常分为疏水作用力、范德华引力、氢键作用和静电作用力[30-31]。根据不同温度下的结合常数可以计算出BDE-47和BDE-209与AChE之间的热力学参数,依据热力学学参数的正负值可以判断出BDE-47和BDE-209与AChE之间作用力类型,其计算结果如表2所示。其中,ΔH在温度相差不大时可以被认为是不变的,ΔG<0说明BDE-47和BDE-209与AChE的作用过程是一个自发进行的过程;ΔH<0,说明二者的反应过程是放热反应,升高温度不利于BDE-47和BDE-209与AChE的结合;ΔS>0是大分子与小分子物质之间的作用力为疏水作用力的特征[31, 32]。有表2可知,ΔG<0、ΔH<0和ΔS>0,说明BDE-47和BDE-209与AChE主要存在着疏水相互作用,但因纯粹的疏水作用不仅表现为ΔS>0,而且ΔH≌0,而本实验中ΔH<0,因此它们之间的作用力不能用单一的疏水作用力解释,可能存在其他作用力。相对于范德华引力,ΔS和ΔH均为负值,因此BDE-47和BDE-209与AChE与反应体系中不应存在范德华引力。
综上所述,BDE-47与BDE-209在一定浓度范围内均能够抑制AChE的活性,随着浓度的增加,两者的抑制效率均呈现出先增加后降低的规律,其中BDE-47浓度为400 μmol·L-1时抑制率达到最大,为22.3%;BDE-209浓度为200 μmol·L-1时抑制率达到最大,为11.2%。同种浓度下的BDE-47对AChE的抑制率始终大于BDE-209,这表明AChE对BDE-47更加敏感。BDE-47和BDE-209与AChE之间的相互作用力主要为疏水作用力,同时不存在范德华引力作用,表明BDE-47更易与AChE相互作用。温度是影响BDE-47和BDE-209与AChE的相互作用的重要因素,温度升高不利于二者与AChE的结合。BDE-47和BDE-209抑制AChE活性很可能是导致神经毒性通路之一。
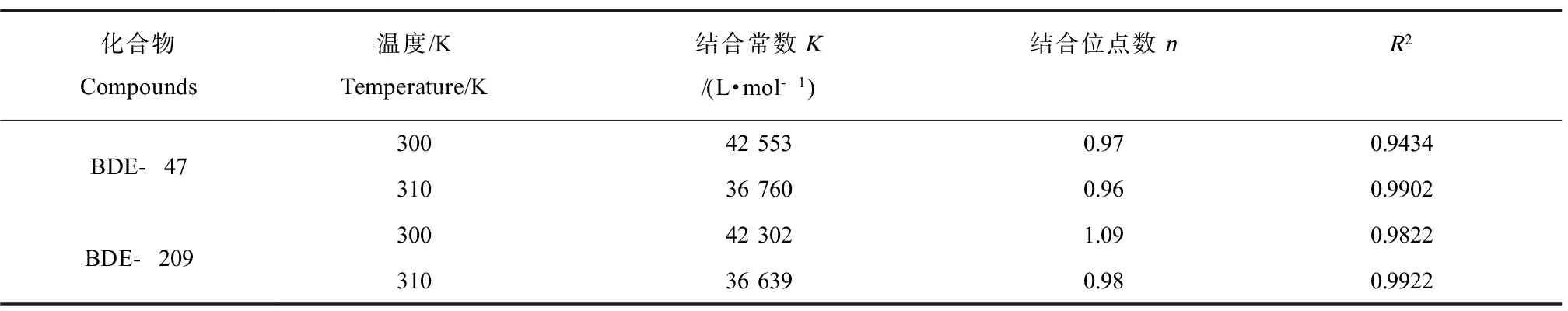
表1 不同温度下BDE-47和BDE-209与AChE的结合常数及结合位点数Table 1 The binding constants and binding sites of BDE-47 and BDE-209 with AChE at different temperatures

表2 不同温度下 BDE-47和BDE-209与AChE相互作用的热力学参数Table 2 Thermodynamic parameters of the interaction of BDE-47 and BDE-209 with AChE at different temperatures
[1] Wit C A D. An overview of brominated flame retardants in the environment [J]. Chemosphere, 2002, 46(5): 583-624
[2] Alaee M, Arias P, Sjödin A, et al. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release [J]. Environment International, 2003, 29(6): 683-689
[3] Stoker T E, Cooper R L, Lambright C S, et al. In vivo and in vitro anti-androgenic effects of DE-71, a commercial polybrominated diphenyl ether (PBDE) mixture [J]. Toxicology and Applied Pharmacology, 2005, 207(1): 78-88
[4] Ceccatelli R, Faass O, Schlumpf M, et al. Gene expression and estrogen sensitivity in rat uterus after developmental exposure to the polybrominated diphenylether PBDE 99 and PCB [J]. Toxicology, 2006, 220(23): 104-116
[5] Zhou T, Taylor M M, DeVito M J, et al. Developmental exposure to brominated diphenyl ethers results in thyroid hormone disruption [J]. Toxicological Sciences, 2002, 66(1): 105-116
[6] Wahl M, Guenther R, Yang L, et al. Polybrominated diphenyl ethers and arylhydrocarbon receptor agonists: Different toxicity and target gene expression [J]. Toxicology Letters, 2010, 198(2): 119-126
[7] Peters A K, Sanderson J T, Bergman Å, et al. Antagonism of TCDD-induced ethoxyresorufin-O-deethylation activity by polybrominated diphenyl ethers (PBDEs) in primary cynomolgus monkey (Macaca fascicularis) hepatocytes [J]. Toxicology Letters, 2006, 164(2): 123-132
[8] Yu L, Liu C, Chen Q, et al. Endocrine disruption and reproduction impairment in zebrafish after long-term exposure to DE-71 [J]. Environmental Toxicology and Chemistry, 2014, 33(6): 1354-1362
[9] Huang Y, Zhu G, Peng L, et al. Effect of 2,2′,4,4′-tetrabromodiphenyl ether (BDE-47) on sexual behaviors and reproductive function in male zebrafish (Danio rerio) [J]. Ecotoxicology and Environmental Safety, 2015, 111:102-108
[10] Costa L G, de Laat R, Tagliaferri S, et al. A mechanistic view of polybrominated diphenyl ether (PBDE) developmental neurotoxicity [J]. Toxicology Letters, 2014, 230(2): 282-294
[11] 程吟文, 谷成刚, 刘总堂, 等. PBDEs好氧微生物降解动力学过程及热力学机制研究[J]. 土壤, 2017, 49(1): 104-110
Cheng Y W, Gu C G, Lu Z T, et al. Research on aerobic biodegradation kinetics process and thermodynamic mechanism of PBDEs [J]. Soils, 2017, 49(1): 104-110 (in Chinese)
[12] Fromme H, Albrecht M, Appel M, et al. PCBs, PCDD/Fs, and PBDEs in blood samples of a rural population in South Germany [J]. International Journal of Hygiene and Environmental Health, 2015, 218(1): 41-46
[13] Costa L G, Pellacani C, Dao K, et al. The brominated flame retardant BDE-47 causes oxidative stress and apoptotic cell death in vitro and in vivo in mice [J]. Neuro Toxicology, 2015, 48: 68-76
[14] Zhang C, Chen D, Liu X, et al. Role of brominated diphenyl ether-209 in the proliferation and apoptosis of rat cultured neural stem cells in vitro [J]. Molecular and Cellular Toxicology, 2016, 12(1): 45-52
[15] Wei S, Chen W, Qin J, et al. Multitarget-directed oxoisoaporphine derivatives: Anti-acetylcholinesterase, anti-β-amyloid aggregation and enhanced autophagy activity against Alzheimer's Disease [J]. Bioorganic and Medicinal Chemistry, 2016, 24(22): 6031-6039
[16] Peng L, Rong Z, Wang H, et al. A novel assay to determine acetylcholinesterase activity: The application potential for screening of drugs against Alzheimer's Disease [J]. Biomedical Chromatography BMC, 2017, 31(10): 3971-3976
[18] 邢厚娟, 王敏, 徐世文. 乙酰胆碱酯酶在硝基苯致小鼠神经毒性中的作用[J]. 中国畜牧兽医, 2007, 34(5): 46-48
Xing H J, Wang M, Xu S W. The effect of cholinesterase on nitrobenzene induced neurotoxicity in mouse [J]. China Animal Husbandry and Veterinary Medicine, 2007, 34(5): 46-48 (in Chinese)
[19] Zendehdel R, Fazli Z, Mazinani M. Neurotoxicity effect of formaldehyde on occupational exposure and influence of individual susceptibility to some metabolism parameters [J]. Environmental Monitoring and Assessment, 2016, 188(11): 648-654
[20] Nair M S. Spectroscopic study on the interaction of resveratrol and pterostilbene with human serum albumin [J]. Journal of Photochemistry and Photobiology B Biology, 2015, 149: 58-67
[21] Lehrer S. Corrections - solute perturbation of protein fluorescence. The quenching of the tryptophyl fluorescence of model compounds and lysozyme by iodide ion [J]. Biochemistry, 1971, 10(17): 32-54
[22] Lakowicz J R, Weber G. Quenching of fluorescence by oxygen. Probe for structural fluctuations in macromolecules [J]. Biochemistry, 1973, 12(21): 4161-4170
[23] 何文英, 舒火明, 胡之德. 小分子与蛋白质作用的谱学及应用[M]. 北京: 科学出版社, 2012: 261-262
[24] Nemethy G, Scheraga H. The structure of water and hydrophobic bonding in proteins III. The thermodynamic properties of hydrophobic bonding in proteins - correction [J]. Journal of Physical Chemistry, 1962, 66(10):1773-1789
[25] Ellman G L, Courtney K D, Andres Jr V, et al. A new and rapid colorimetric determination of acetylcholinesterase activity[J]. Biochemical Pharmacology, 1961, 7(2): 88-95
[26] Koellner G, Kryger G, Millard C B, et al. Active-site gorge and buried water molecules in crystal structures of acetylcholinesterase from Torpedo californica [J]. Journal of Molecular Biology, 2000, 296(2): 713-735
[27] 张明, 李盾, 陈仪本, 等. 乙酰胆碱酯酶分子生物学研究进展[J]. 农药, 2006, 45(1): 8-11
Zhang M, Li D, Chen Y B, et al. Research progress in acetylcholinesterase molecular biology [J]. Agrochemicals, 2006, 45(1): 8-11 (in Chinese)
[28] Li Q, Wei Q, Yuan E, et al. Interaction between four flavonoids and trypsin: Effect on the characteristics of trypsin and antioxidant activity of flavonoids [J]. International Journal of Food Science and Technology, 2014, 49(4): 1063-1069
[29] Zeng H J, You J, Liang H L, et al. Investigation on the binding interaction between silybin and pepsin by spectral and molecular docking [J]. International Journal of Biological Macromolecules, 2014, 67(6): 105-111
[30] Qu P, Lu H, Ding X, et al. Study on the interaction of 6-thioguanine with bovine serum albumin by spectroscopic techniques [J]. Journal of Molecular Structure, 2009, 920(1-3): 172-177
[31] Khan S N, Islam B, Yennamalli R, et al. Interaction of mitoxantrone with human serum albumin: Spectroscopic and molecular modeling studies [J]. European Journal of Pharmaceutical Sciences, 2008, 35(5): 371-382
[32] Nan G, Wang P, Sun J, et al. Spectroscopy and molecular docking study on the interaction of daidzein and genistein with pepsin [J]. Luminescence, 2016, 31(8): 15-24

