褶牡蛎氨肽酶B的分离纯化和性质研究
唐 逸, 颜龙杰, 钟 婵, 张凌晶,2, 翁 凌,2, 曹敏杰,2,*
(1.集美大学 食品与生物工程学院, 福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心, 福建 厦门 361021)

褶牡蛎氨肽酶B的分离纯化和性质研究
唐 逸1, 颜龙杰1, 钟 婵1, 张凌晶1,2, 翁 凌1,2, 曹敏杰1,2,*
(1.集美大学 食品与生物工程学院, 福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心, 福建 厦门 361021)
氨肽酶是一类能特异水解蛋白质N端氨基酸残基的外切酶,在食品行业有着广阔的应用前景。以褶牡蛎(Alectryonellaplicatula)为原料,通过硫酸铵盐析,DEAE-sepharose,phenyl-sepharose及羟基磷灰石柱层析,分离纯化得到了一种高效水解碱性氨基酸的氨肽酶,其活性能被氨肽酶特异性抑制剂bestatin有效抑制。双向电泳结果显示该酶的分子质量约为100 ku,pI约为5.8。通过肽质量指纹图谱对其进行鉴定得到12个肽段,共含138个氨基酸残基,这些氨基酸序列与太平洋牡蛎中嘌呤霉素敏感性氨肽酶一致,表明纯化的酶为氨肽酶B。褶牡蛎氨肽酶B的二级结构以无规卷曲与反向平行为主,其中无规卷曲占42.6%,反向平行占32.0%。动力学研究获得其Km和kcat值分别为1.5 μmol/L和117.5 s-1,kcat/Km为78.3 L/(μmol·s)-1。在35 ℃,pH值 7.0的条件下,该酶具有最大催化活性,能高效水解氨肽酶底物Lys-MCA和Arg-MCA,释放出游离态的Lys和Arg,推测与牡蛎呈味相关。
牡蛎; 氨肽酶; 纯化; MALDI-TOF/TOF质谱
我国是牡蛎生产大国,2014年产量达435万t,其中,福建省的产量达160多万t,位居全国首位[1]。牡蛎富含糖原、锌、维生素及各种游离态氨基酸,营养价值高。牡蛎中的游离氨基酸作为营养物质的同时,还影响牡蛎风味,赋予其特有的鲜味。由于游离氨基酸的释放与调控需要酶的催化水解作用,因而这些酶的研究受到广泛关注。
氨肽酶(aminopeptidase, AP)是一类从多肽链N端由外向内选择性切割氨基酸残基的蛋白酶的统称。目前对氨肽酶的研究涉及广泛,在机体免疫代谢方面,植物花粉中的氨肽酶能够降解神经肽,从而参与花粉过敏反应[2]。脂肪细胞中的氨肽酶种类繁多,其中的3种氨肽酶(AspAP、PSA、MetAP)与机体的能量代谢密切相关[3]。氨肽酶B(aminopepti-dase B, APB,EC 3.4.11.6)参与血压调节,还直接参与脑啡肽、缓激肽等神经肽的分泌与合成[4]。由于氨肽酶的酶解产物为游离氨基酸及小肽,氨肽酶被广泛应用于食品工业中。在食品加工煮制过程中,氨肽酶的降解产物能与糖原共同作用,通过美拉德反应使食物表现出强烈的香味及鲜味[5]。在蛋白肽的制备过程中,氨肽酶对N端疏水性氨基酸的切除可以降低小肽的苦味[6]。
相比哺乳动物、植物及微生物,对水生动物中氨肽酶的研究还较少。在前期的研究中,对来源于牙鲆[7]、真鲷[8]及青鱼肌肉[9]中的氨肽酶已有了报道,对氨肽酶参与这些水产品的风味形成机制也进行了讨论。在此基础之上,本研究对贝类褶牡蛎中的氨肽酶进行研究,探讨其与风味氨基酸形成的关系,以期对牡蛎制品的生产加工提供理论参考。
1 材料与方法
1.1 实验材料
1.1.1 样品
新鲜牡蛎(Alectryonellaplicatula),购于厦门市集美菜市场。
1.1.2 试剂
DEAE-sepharose琼脂糖凝胶阴离子交换层析树脂、phenyl-sepharose 6-fast flow苯基琼脂糖凝胶疏水层析树脂,美国GE Healthcare公司;羟基磷灰石层析预装柱、Protein Marker、SDS、DTT,美国Bio-Rad公司;PMSF、EDTA、EGTA、bestatin,美国Sigma公司;Lys-MCA、Arg-MCA和其他荧光合成底物,日本Peptide Institute公司;pepstatin A,德国Roche公司;E-64,美国Amresco公司。其他试剂为分析纯。
1.2 实验方法
1.2.1 酶活力测定
酶活力测定参照Umetsu等[10]并作适当修改。先将50 μL酶液与900 μL 25 mmol/L磷酸缓冲液(缓冲液 A,pH值7.0,含质量分数0.02 % NaN3和10 mmol/L β-巯基乙醇)混匀,再加入50 μL 10 μmol/L Lys-MCA荧光底物,在35 ℃反应15 min后立即加入1.5 mL终止液(V(甲醇)∶V(异丙醇)∶V(水)=35∶30∶35)终止反应。用荧光分光光度计测定反应释放产物7-氨基-4-甲基香豆素(AMC)的荧光强度。测定的激发光波长为380 nm,发射光波长为450 nm。活力单位(U)定义为每min释放1 nmol AMC时需要的酶量。以同样的反应体系但不加酶液的样品为空白对照组。
1.2.2 蛋白质浓度测定
酶纯化过程中,用紫外分光光度计测定280 nm处的吸光值,推测蛋白质含量。
1.2.3 酶的纯化
新鲜牡蛎去内脏,洗净、切碎。取350 g,与3倍体积含10 mmol/L β-巯基乙醇的冰冷缓冲液A混匀,用组织捣碎机捣碎。将捣碎后的粗酶液以12 000 r/min离心15 min,取上清液进行硫酸铵分级沉淀,质量分数60%~80%,离心得沉淀,对缓冲液A进行充分透析。将透析过的酶液上样于以缓冲液A平衡好的DEAE-sepharose阴离子交换层析柱(2.5 cm×10 cm)。上样结束后,先用缓冲液A流洗除去未吸附的杂蛋白质,再用0~0.3 mol/L NaCl作线性洗脱。测定A280,检测并收集酶活性较高的组分。
将活性部分边搅拌边加入硫酸铵至终浓度为1.5 mol/L,上样于以1.5 mol/L(NH4)2SO4和含10 mmol/L β-巯基乙醇的缓冲液A平衡的phenyl sepharose 6-fast flow疏水层析柱(2.5 cm×7 cm)。待流洗去除杂蛋白质后,用(NH4)2SO4(1.5至0 mol/L)进行线形梯度洗脱。将样品进行A280检测和酶活测定后,收集活性部分并以缓冲液A为外液进行透析。
将透析充分的样品上样于以缓冲液A平衡好的羟基磷灰石预装柱(5 mL),流洗除去杂蛋白质。用 20~200 mmol/L 缓冲液A作线性梯度洗脱。测定A280和酶活力,得到的活性部分进行电泳检测。
1.2.4 分子质量的确定和肽质量指纹图谱测定
结合Superdex G-200凝胶过滤和SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)对纯化的蛋白质进行分子质量测定。对SDS-PAGE上呈现的纯化蛋白质条带切胶回收,进行质谱分析并在NCBI蛋白质数据库中进行氨基酸序列比对。
1.2.5 最适底物测定
1.2.6 动力学参数测定
将酶稀释成合适的浓度,以Lys-MCA为底物,在不同底物终浓度的条件下测定酶活性,计算不同浓度下酶催化底物反应的平均速率。按照Lineweaver-Burk双倒数法,求得酶催化底物水解的米氏常数Km及相应的动力学参数kcat和kcat/Km。
1.2.7 最适温度及热稳定性测定
在20~60 ℃,不改变上述酶活测定方法的其他条件,测定酶的最适作用温度。热稳定性分析是将酶液分别于上述温度下孵育30 min后,立即冰浴冷却到对应温度,再参照酶活测定方法在35 ℃测定其剩余活力。
1.2.8 最适pH值及pH稳定性
实验在以下缓冲液(浓度均为50 mmol/L)中进行:乙酸钠(pH值5.0~5.5)、磷酸钠(pH值6.0~7.0)、Tris-HCl(pH值7.5~8.5)和Na2CO3-NaHCO3(pH值9.0),其他测定条件不变。pH稳定性分析是将酶液分别于上述不同pH值条件下,4 ℃孵育4 h后,再参照酶活测定方法在pH值7.0时,测定其剩余活力。
1.2.9 抑制剂对酶活性影响的测定
将酶液置于缓冲液A中,分别加入各种蛋白酶抑制剂至相应的终浓度,在室温下放置30 min后,立即加入50 μL荧光底物,于35 ℃反应10 min,加入1.5 mL终止液后测定。以不添加抑制剂的样品为对照。
1.2.10 圆二色谱分析
制度是学校管理必不可少的利器,正所谓“没有规矩,不成方圆”。为此,农村学校必须要完善寄宿制的管理制度,制定详细的可执行的制度,比如《宿舍管理制度》《文明宿舍评比制度》等,这些制度能够一定程度上保证住宿生行为有章可循。
在室温条件下,利用Chirascan圆二色谱仪对纯化的牡蛎氨肽酶B进行二级结构的测定,所使用的比色皿厚度为0.1 cm,测定参数为:扫描波长180~260 nm,扫描速度1 nm/s,光谱间隔1 nm,反应时间2 s。利用CDNN软件对样品的二级结构进行分析。
1.2.11 双向电泳
1.2.11.1 等电聚焦
浓缩后的氨肽酶样品与水合液(7 mol/L尿素,2 mol/L硫脲和质量浓度2 g/mL CHAPS)、1 mol/L
DTT、两性电解质和溴酚蓝以合适的比例混合,配置成150 μL的样品溶液,混合均匀。将125 μL的样品溶液连续加样于干燥的电泳槽两级间并用甘油覆盖,设定程序,进行等电聚焦。
1.2.11.2 SDS-PAGE
聚焦结束后,将胶条洗净,吸去多余水分,依次在含有质量浓度2 g/mL DTT和质量浓度2.5 g/mL IAA的缓冲液中平衡。平衡完毕后,推入SDS-PAGE凝胶电泳胶板缝隙中,封胶凝固后进行电泳。电泳完毕后进行银染色,观察结果并完成凝胶成像分析。
2 结果与讨论
2.1 纯化结果
DEAE-sepharose阴离子交换层析及羟基磷灰石柱层析图谱见图1。纯化结果见表1,最终产物的比活力为416.0 U/mg。
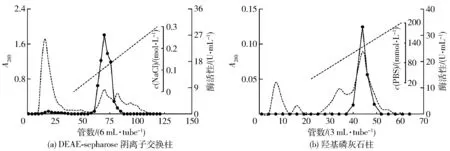
图1 氨肽酶纯化柱层析图Fig.1 Column chromatography purification of AP

表1 褶牡蛎氨肽酶分离纯化结果
2.2 分子质量和肽质量指纹图谱分析
2D-PAGE由等电聚焦和SDS-PAGE凝胶电泳两个过程组成,可以从等电点和分子质量上对蛋白质进行分析。纯化的氨肽酶在双向电泳上呈现单一的点,其等电点约为5.8,分子质量约为100 ku(见图2),与牙鲆肌肉中的赖氨酸氨肽酶(100 ku)[7]、青鱼肌肉中的嘌呤霉素敏感性氨肽酶(100 ku)[9]的分子质量相当,比阿拉斯加鳕鱼中提取的丙氨酸氨肽酶(125 ku)[11]的分子质量小,而比菜豆叶中的5种氨肽酶(37~80 ku)[12]的分子质量大。这些结果表明,不同生物来源的氨肽酶分子质量不同。

图2 氨肽酶分子质量与等电点鉴定Fig.2 Identification of molecular weight and pI of purified AP
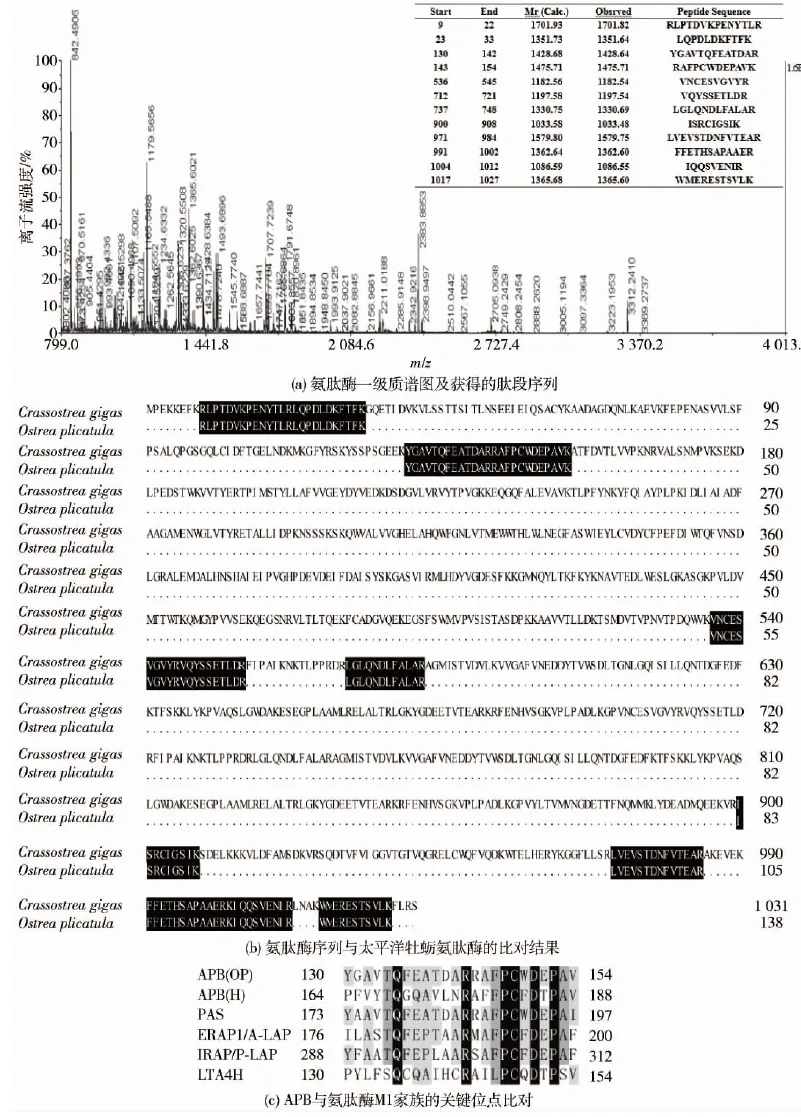
图3 褶牡蛎氨肽酶B肽质量指纹图谱Fig.3 Peptide mass fingerprinting of APB
褶牡蛎氨肽酶肽质量指纹图谱见图3。将纯化的单一目的蛋白质切胶用于质谱分析,在质荷比800~4 000 u获得12个肽段共计138个氨基酸残基(见图3(a))。将获得的片段与NCBI软体动物数据库比对,发现与太平洋牡蛎的嘌呤敏感性氨肽酶(gi|405977525)序列相似性为100%(138/138),结果如图3(b)。该结果充分说明纯化的酶为氨肽酶。Ogawa等[13]通过模拟催化口袋及定点突变的方式确定了Gln169是决定人APB切割碱性氨基酸偏好性的关键位点,同时M1家族中ERAP1的Gln181赋予酶对碱性氨基酸的偏好性。但是,目前还没有关于水产贝类氨肽酶氨基酸偏好性关键位点的研究。通过已有序列比对,预测褶牡蛎氨肽酶的Gln135为影响其底物特异性的关键位点(见图3(c))。因此,后期可通过定点突变实验进行验证。
2.3 最适温度和热稳定性、最适pH值和 pH稳定性分析
氨肽酶催化Lys-MCA水解反应的最适温度为35 ℃,见图4(a)。当温度高于50 ℃时,酶活力迅速降低;而低温下,酶仍具有较高的活性,如在20 ℃下,APB有 50%左右的酶活力。热稳定性表现为,该酶在40 ℃下放置30 min,活力基本保持不变;而酶在55 ℃下放置10 min,酶活几乎全部丧失,说明其热稳定性较差。褶牡蛎氨肽酶的热稳定性与从其他鱼中得到的氨肽酶的特性相似,但与哺乳动物相比有明显不同,如从牛骨骼肌肉中得到的一种氨肽酶,在 60 ℃温度下放置 20 min,酶活力仍较稳定[14]。该氨肽酶热稳定性较差与牡蛎正常栖息水温为10~25 ℃相关。酶催化Lys-MCA水解反应最适pH值为 7.0(见图4(b))。在pH值6.0~8.0,酶活性能保持良好,而当pH值低于6.0或高于8.0时,酶活力迅速下降直至完全丧失,表明该氨肽酶是中性或弱碱性酶。褶牡蛎氨肽酶在中性条件下活性较强,且在pH值6.0~8.0稳定,这种特性与鱼类及牛[14]肌肉中纯化的氨肽酶相似。
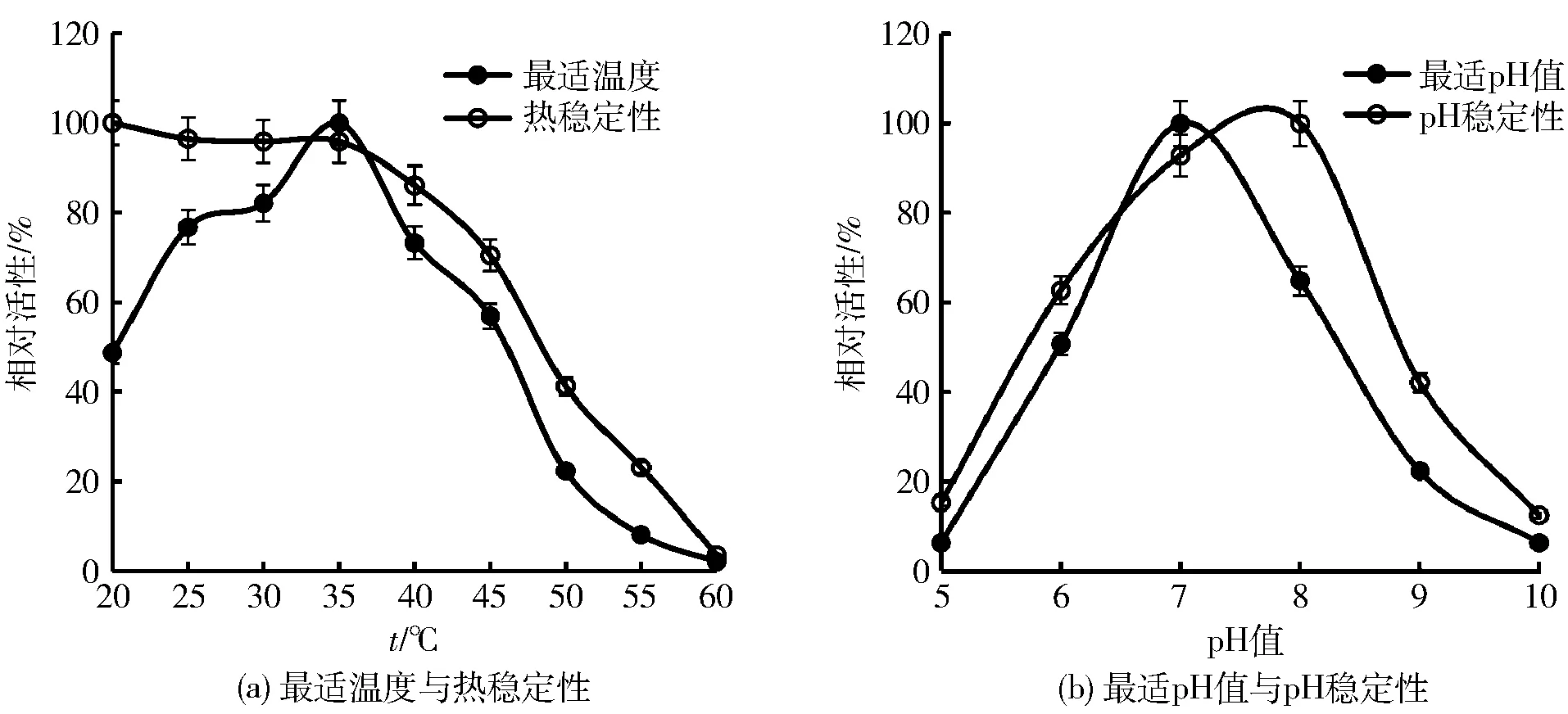
图4 褶牡蛎氨肽酶的最适条件Fig.4 Optimum condition of AP
2.4 底物特异性
褶牡蛎氨肽酶对不同底物作用的相对活性见表2,该酶最易分解碱性氨基酸底物Lys-MCA和Arg-MCA,对Leu-MCA也有一定的分解作用,但对Pro-MCA、Gly-MCA几乎不分解。根据其对碱性氨基酸的偏好,将其命名为氨肽酶B。同时,该APB对Boc-Phe-Ser-Arg-MCA和Boc-Leu-Gly-Arg-MCA等内切酶底物没有分解作用,表明该酶属于外肽酶。在前期研究中发现,海洋贝类的呈味物质浓度与季节变化关系密切[15]。另有研究表明,精氨酸等对贝类的特有风味有贡献,含量越高,醇厚感越浓厚[16],同时可增强鲜味和口感的复杂性[17]。所以,推测 APB在牡蛎风味的形成中有重要的作用。
2.5 酶动力学分析
分别以Lys-MCA、Arg-MCA、Ala-MCA、Leu-MCA为底物,用双倒数法测定褶牡蛎APB的动力学参数,结果如表3。
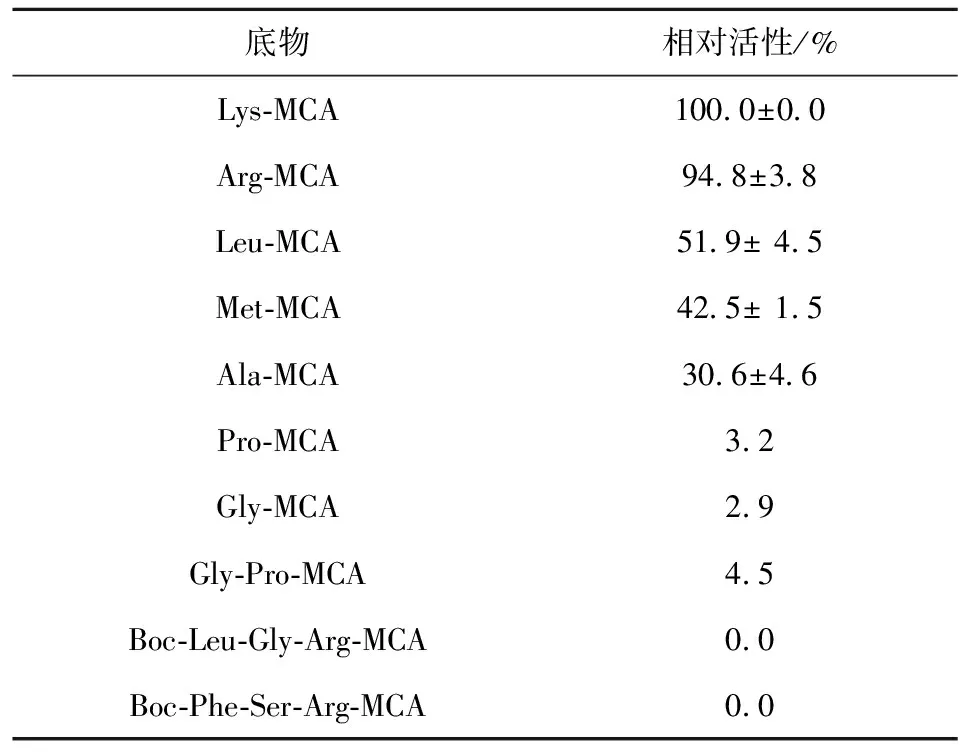
表2 褶牡蛎氨肽酶的底物特异性分析

表3 褶牡蛎氨肽酶B的动力学参数分析
由表3可知,该酶对Arg-MCA的亲和能力最强,而对Lys-MCA和Arg-MCA的水解效率最高,再次验证了该酶对于碱性氨基酸的偏好性。
2.6 蛋白酶抑制剂对酶活性的影响
各种蛋白酶抑制剂对褶牡蛎APB活性的影响如表4。氨肽酶特异性抑制剂bestatin、天冬氨酸蛋白酶抑制剂pepstatin A和金属蛋白酶抑制剂1,10-phenathroline能有效抑制该酶活性,EGTA、EDTA则部分抑制其活性。因此,推测在该酶的活性基团附近存在天冬氨酸残基,是一种金属蛋白酶类的氨肽酶。

表4 蛋白酶抑制剂对褶牡蛎氨肽酶B活性的影响
2.7 金属离子对酶活性的影响
金属蛋白酶分为两大类,一类仅需要一个Zn2+,另一类需要两个金属离子共同起催化作用[18]。为探明褶牡蛎APB活性中心的金属离子,用含有终浓度为1 mmol/L EDTA的缓冲液对APB样品进行透析,测得透析后样品的活性比未透析时损失近70%(见图5)。透析后,样品中分别添加0.1 mmol/L的二价金属离子Ca2+、Mn2+、Fe2+,其活性有不同程度的恢复,分别可恢复到未透析前的62.8%,54.8%和48.3%。Zn2+对于褶牡蛎APB没有激活作用反而显示出轻微抑制作用,该结果与来源于其他水产动物的氨肽酶不同,但与小鼠APB的结果相似,即0.01 mmol/L的Zn2+作用于小鼠APB 45 min后也能抑制60%的酶活[19]。不同氨肽酶对金属离子的需求比较多样,这可能与氨肽酶的类型有关。对于褶牡蛎APB,Ca2+、Mn2+可能是维持其活性的2种重要金属离子。
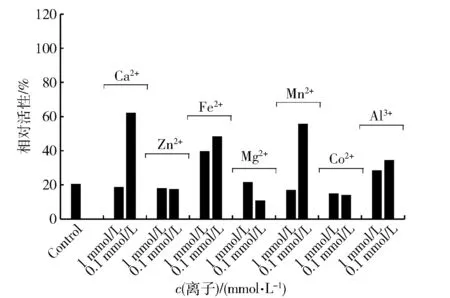
图5 金属离子对EDTA充分透析后APB活性的影响Fig.5 Effect of metal ions on activity of APB after dialysis by EDTA
2.8 酶的二级结构
采用圆二色光谱研究褶牡蛎APB的二级结构特征(见图6)。结果显示:APB在195 nm处有一处正峰,在220 nm处出现一个负峰,综合分析显示APB二级结构中以无规卷曲与反向平行为主,其中无规卷曲占42.6%,反向平行占32.0%。
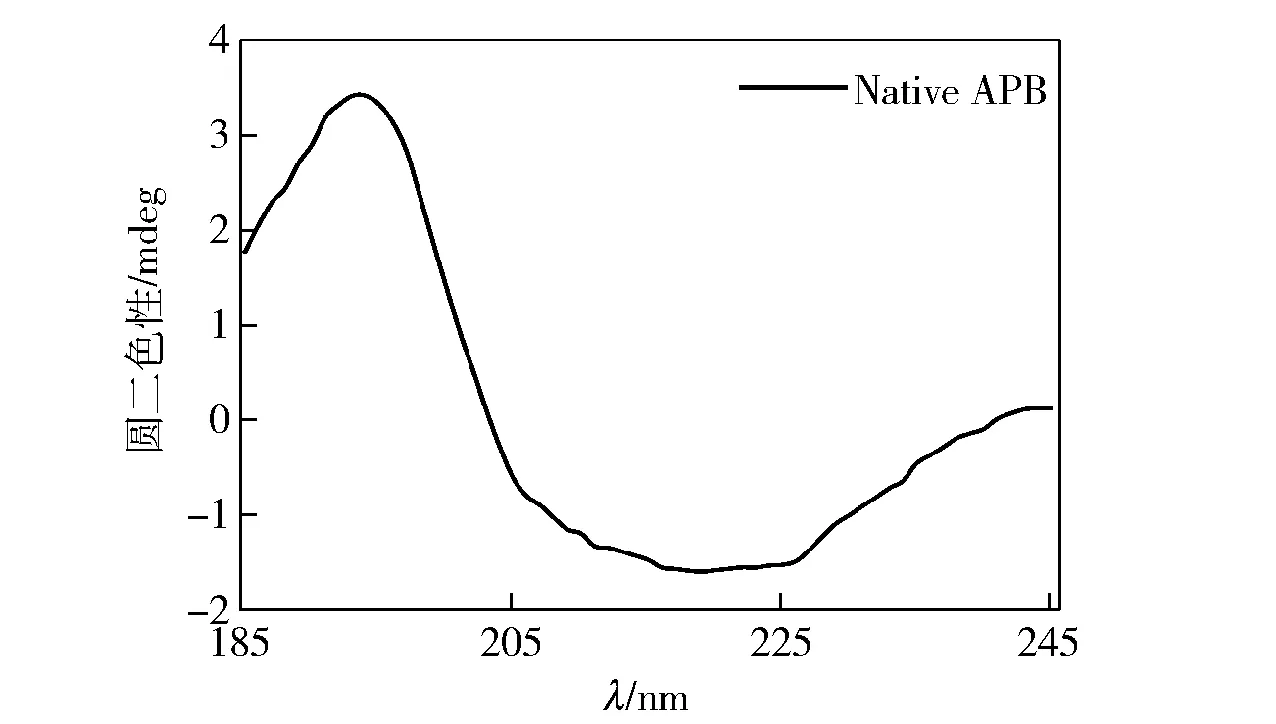
图6 褶牡蛎氨肽酶B的二级结构Fig.6 Secondary structures of APB
2.9 氨基酸调控
褶牡蛎APB与其产物的相互作用的研究结果如图7, 赖氨酸及精氨酸对氨肽酶B具有反馈调节作用,抑制效果明显,且两者共同作用具有拮抗效果,三者位于机体内呈现出动态平衡,以适应各种生理功能的需要。游离氨基酸含量增加的同时氨肽酶仍具有活性[4],而游离氨基酸含量的增加对氨肽酶活性也有反馈抑制作用,这一结果与游离氨基酸反馈调节人与猪的精氨酸氨肽酶[20]的情况相符。

图7 赖氨酸和精氨酸对氨肽酶B的反馈调节作用Fig.7 Feedback regulation of lysine and arginine on APB
3 结 论
研究从褶牡蛎中分离纯化得到一种氨肽酶B,分子质量约100 ku,等电点约为5.8。肽质量指纹质谱结果显示,褶牡蛎氨肽酶B与太平洋牡蛎的嘌呤敏感性氨肽酶具有高度的同源性。其催化Lys-MCA水解反应的最适温度为35 ℃,最适pH值为7.0。该酶能高效水解蛋白质肽链N端赖氨酸和精氨酸残基。
赖氨酸及精氨酸的形成,使得牡蛎醇厚味感更加浓厚,而后两者协同反馈调节APB、游离氨基酸和氨肽酶形成动态平衡,共同赋予牡蛎特有的风味。
褶牡蛎APB分离纯化方法及生化性质分析,为今后研究氨肽酶及在食品加工中的应用和新功能的探究提供了依据。
[1] 农业部渔业局. 中国渔业年鉴2015 [M]. 北京: 中国农业出版社,2016:222.
[2] LUISA C, ANA L C, PAULA V, et al. Purification of a novel aminopeptidase from the pollen ofParietariajudaicathat alters epithelial integrity and degrades neuropeptides [J]. Journal of Allergy and Clinical Immunology, 2006, 118(4):878-884.
[3] ALPONTI R F, SILVEIRA D F. Adipocyte aminopeptidases in obesity and fasting [J].Molecular and Cellular Endocrinology, 2015,415:24.
[4] PRIETO I, MARTNEZ J M, RAMREZ M J, et al. Aminopeptidase activities after water deprivation in male and female rats [J]. Regulatory Peptides, 2001, 101(1/3):189-194.
[5] LIU P, HUANG M, SONG S, et al. Sensory characteristics and antioxidant activities of Maillard reaction products from soy protein hydrolysates with different molecular weight distribution [J]. Food Bioprocess Technology, 2012, 5(5):1775-1789.
[6] BADAL C S, KIYOSHI H. Debittering of protein hydrolyzates [J]. Biotechnology Advances, 2001, 5(19):355-370.
[7] 陈曦,蔡秋凤,曹敏杰.牙鲆肌肉赖氨酸氨肽酶的分离纯化与性质研究[J].中国食品学报,2012, 12(6):22-29. CHEN X, CAI Q F, CAO M J.Purification and characterization of an aminopeptidase with highest preference for lysine fromParalichthysolivaceusskeletal muscle[J]. Journal of Chinese Institute of Food Science and Tech-nology,2012,12(6):22-29.
[8] WU G P, CAO M J, CHEN Y, et al. Leucine aminopeptidase from red sea bream (Pagrusmajor) skeletal muscle: purification, characterization, cellular location, and tissue distribution [J]. Journal of Agricultural and Food Chemistry, 2008, 56(20):9653-9660.
[9] LI S W, LIN L P, WU G P, et al. Purification and biochemical characterization of a puromycin-sensitive amino-peptidase from black carp muscle [J].Process Biochemi-stry, 2015, 50(7):1061-1067.
[10] UMETSU H, ARAI M, OTA T, et al. Purification and properties of an aminopeptidase from the mid-gut gland of scallop (Patinopectenyessoensis) [J].Comp Biochem Physiol, 2003, 136(4):935-942.
[11] CHIOU T K,MATSUI T,KONOSU S. Purification and properties of an aminopeptidase from alaska pollack,Theragrachalcogramma,roe [J]. Journal of Biochemi-stry, 1989, 105(4):505-509.
[13] OGAWA Y, OHNISHI A, GOTO Y, et al. Role of glutamine-169 in the substrate recognition of human amino-peptidase B [J]. Biochimica et Biophysica Acta, 2014, 1840(6):1872-1881.
[14] YE X J, NG T B. Purification and characterisation of an alanine aminopeptidase from bovine skeletal muscle [J]. Food Chemistry, 2011, 124(2):634-639.
[15] 孙莎,钟婵,章骞,等.四种海产贝类中主要呈味物质含量与季节变化的关系[J].集美大学学报(自然科学版),2016,21(6):420-427. SUN S, ZHONG C, ZHANG Q, et al. Seasonal variation of taste-active component contents in four species of marine shellfish[J]. Journal of Jimei University( Natural Science),2016,21(6):420-427.
[16] CHEN D W, ZHANG M. Non-volatile taste active compounds in the meat of Chinese mitten crab (EriocheirSinensis) [J]. Food Chemistry, 2007, 104(3):1200-1205.
[17] KOHYAMA K. Oral sensing of food properties [J]. Journal of Texture Studies, 2015, 46(3):138-151.
[18] BOTELHO T, TIBISAY G, ANIEBRYS M, et al. Structural and functional analyses reveals thatStaphylococcusaureusantibiotic resistance factor HmrA is a zinc-dependent endopeptidase [J]. Journal of Biological Chemistry, 2011, 286(29):25697-25709.
[19] HWANGA S R, HOOK V. Zinc regulation of aminopeptidase B involved in neuropeptide production [J]. Febs Letters, 2008, 582(17): 2527-2531.
[20] TOLDRA F, FLORES M, MANTLE D. Comparison of aminopeptidase inhibition by amino acids in human and porcine skeletal muscle tissuesinvitro[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1996, 115(4):445-450.
(责任编辑:檀彩莲)
Purification and Characterization of Aminopeptidase B from Oysters (Alectryonellaplicatula)
TANG Yi1, YAN Longjie1, ZHONG Chan1, ZHANG Lingjing1,2, WENG Ling1,2, CAO Minjie1,2,*
(1.CollegeofFoodandBiologicalEngineering,JimeiUniversity,Xiamen361021,China; 2.NationalandLocalJointEngineeringResearchCenterofDeepProcessingforAquaticProducts,Xiamen361021,China)
Aminopeptidase is a kind of exopeptidases that specifically cleaves amino acids from the N-terminal of proteins, and thus has wild applications in food industry. In this study, an aminopeptidase was isolated to homogeneity from oysters (Alectryonellaplicatula) by ammonium sulfate fractionation and a series of chromatographic steps including DEAE-sepharose, phenyl-sepharose and hydroxyapatite. The aminopeptidase was strongly suppressed by bestatin, a specific aminopeptidase inhibitor. The 2D-PAGE results showed that molecular weight andpIvalue was approximately 100 ku and 5.8. By MALDI-TOF/TOF mass spectrometry analysis, 12 peptide fragments with 138 amino acid residues in total were obtained and these peptide fragments were identical to a puromycin-sensitive aminopeptidase fromCrassostreagigas, which confirmed that the purified enzyme was an aminopeptidase B. Circular dichroism spectroscopy analysis indicated that the secondary structure of aminopeptidase B (APB) was mainly random coil (42.6%) and reverse parallel (32.0%). TheKmandkcatwas 1.5 μmol/L and 117.5 s-1and thekcat/Kmwas 78.3 L/(μmol·s)-1. The optimum temperature and pH of APB was 35 ℃ and 7.0. Under these conditions, APB could hydrolyze Lys-MCA and Arg-MCA to release Lys and Arg, which had the oyster’s flavor.
oyster; aminopeptidase; purification; MALDI-TOF/TOF mass spectrometry
2017-01-02
国家自然科学基金资助项目(31471640); 厦门南方海洋研究中心项目(14CZP030HJ04)。
唐 逸,女,硕士研究生,研究方向为水产品加工;
10.3969/j.issn.2095-6002.2017.01.006
2095-6002(2017)01-0035-08
唐逸,颜龙杰,钟婵,等. 褶牡蛎氨肽酶B的分离纯化和性质研究[J]. 食品科学技术学报,2017,35(1):35-42. TANG Yi, YAN Longjie, ZHONG Chan, et al. Purification and characterization of aminopeptidase B from oysters (Alectryonellaplicatula)[J]. Journal of Food Science and Technology, 2017,35(1):35-42.
TS254.1
A
*曹敏杰,男,教授,博士,主要从事蛋白质化学、酶学、水产品深加工方面的研究,通信作者。

