纳米鱼骨增强鱼肉肌动球蛋白凝胶强度的机制研究
尹 涛, 刘 庆, 熊善柏, 刘 茹, 尤 娟, 胡 杨
(华中农业大学 食品科学技术学院/国家大宗淡水鱼加工技术研发分中心(武汉), 湖北 武汉 430070)

纳米鱼骨增强鱼肉肌动球蛋白凝胶强度的机制研究
尹 涛, 刘 庆, 熊善柏*, 刘 茹, 尤 娟, 胡 杨
(华中农业大学 食品科学技术学院/国家大宗淡水鱼加工技术研发分中心(武汉), 湖北 武汉 430070)
比较研究了添加CaCl2、纳米鱼骨(NFB)、纳米羟基磷灰石(HAP)和纳米羟基磷灰石+胶原蛋白(HAP+CLG)对白鲢肌动球蛋白胶凝特性的影响,以探究NFB增强鱼肉蛋白凝胶强度的影响机制。NFB和CaCl2组钙离子浓度相同,NFB和HAP粒径相同。NFB组肌动球蛋白凝胶的破断力与CaCl2组无显著性差异(p>0.05),但是显著高于HAP组和HAP+CLG组(p<0.05)。5组肌动球蛋白凝胶的表面疏水性、总巯基含量和微观结构无显著性差异(p>0.05)。在SDS-PAGE图谱中,对照组的肌球蛋白重链二聚体(MHC2)条带不显著,HAP和HAP+CLG组的MHC2条带较显著,CaCl2组和NFB组MHC2条带的强度显著高于HAP组和HAP+CLG组。结果表明,纳米鱼骨增强肌动球蛋白凝胶强度的主要机制是通过激活内源性TGase,促进肌球蛋白重链共价交联形成二聚体。
白鲢; 肌球蛋白; 纳米鱼骨; TGase; 共价交联; 扫描电镜
鱼骨是鱼糜等水产制品加工过程中产生的主要固态副产物之一,占到鱼体总重量的10%~15%[1]。鱼骨富含钙,鱼骨钙生物利用率高[2],但是在工业上鱼骨主要是作为原料用于加工饲料,其经济价值低。鱼骨可用于加工高附加值的功能性产品,例如可食用超微细鱼骨粉[3]、生物活性羟基磷灰石[4]和胶原蛋白[5]等。Yin等[6]报道了以高能湿法球磨制备纳米鱼骨的方法,并发现添加纳米鱼骨到鱼糜制品中可以起到增强鱼糜凝胶强度和强化钙的双重作用[7]。但是,目前关于纳米鱼骨增强鱼糜胶凝强度的机制还不清楚。
降低鱼骨粒径到纳米尺度可显著增加钙离子的释放率[8]。在低温凝胶化过程中,钙离子可激活鱼糜中内源性的转谷氨酸酰胺酶(TGase),催化肌原纤维蛋白的谷氨酸残基和赖氨酸残基共价交联,形成分子间异肽交联键,显著增强鱼糜凝胶强度[9]。在霍夫梅斯特序列中,钙离子是一种变性盐,其与蛋白质结合后会降低蛋白质分子内的氢键和疏水相互作用,导致蛋白质二级和高级结构展开[10]。Jia等[11]报道钙离子诱导白鲢肌球蛋白α螺旋结构解旋,从而暴露包埋于分子内部的疏水性基团和巯基,有利于增强肌球蛋白分子在聚集过程中形成的相互作用力(疏水键、二硫键和钙桥)。另一方面,纳米鱼骨颗粒填充到鱼糜蛋白网络中是否可通过粒度效应起到增强凝胶强度有待验证。
纳米鱼骨可能通过释放钙离子和粒径效应等增强鱼糜凝胶强度。因此,本课题以钙离子和纳米羟基磷灰石等为对照,研究纳米鱼骨对白鲢肌动球蛋白凝胶物化特性和微观结构的影响,以期揭示纳米鱼骨对鱼肉蛋白热诱导胶凝的影响机制。
1 材料与方法
1.1 材料与试剂
氯化钙、三羟甲基氨基甲烷(Tris-base)、戊二醛、8-苯胺基-1-萘磺酸(ANS)、苯甲基磺酰氟(PMSF)和牛血清蛋白标品(分析纯),美国 Sigma 公司;二硫苏糖醇 (DTT)、乙二胺四乙酸 (EDTA)和5.5’-二硫双(2-硝基苯甲酸)(DTNB)(分析纯),瑞士Fluka公司;电泳试剂(电泳纯),美国Bio-Rad公司;羟基磷灰石(HAP)(分析纯),中国Aladdin公司;Ⅰ型胶原蛋白(CLG)(分析纯),叶生物技术有限公司;琼脂(LGT)(电泳纯),科瑞生物技术有限公司。
1.2 仪器与设备
MiniZeta 03E型高能湿法球磨机,德国Netzsch公司;Nano ZS90型激光粒度仪,英国Malvem公司;AA- 6300c型原子吸收分光光度计,日本Shimadzu公司;5500型原子力显微镜,美国安捷伦公司;TA- XT plus型质构仪,英国Stable Micro System公司; Mini- PROTEAN Tetra型电泳槽,美国Bio- Rad公司;RF- 1501型荧光光度计,日本Shimadzu公司;721型分光光度计,上海精密科学仪器有限公司;AVANTI J- 26型高速冷冻离心机,美国贝克曼公司;FRA 106/S型傅立叶拉曼光谱仪,德国Bruker公司;ULTRA PLUS- 43- 13型扫描电镜(SEM),德国 Zeiss公司。
1.3 实验方法
1.3.1 纳米鱼骨(NFB)和纳米羟基磷灰石(HAP)的制备
纳米鱼骨的制备参照Yin等[6]的方法,工艺流程如下:冷冻原料骨→常温解冻→加水漂洗除去血污和部分脂肪→高温蒸煮(120 ℃,60 min)→倾倒蒸煮液并再次漂洗→绞肉机粗破碎(筛板孔径为3 mm)→骨泥机破碎(转速2 000 r/min,磨盘间隙0.3 mm)→加水调整骨泥总固形物质量分数为5%→湿法高能球磨机纳米化粉碎(搅拌转速3 000r/min,磨球填充率85%,磨球直径0.5 mm)6 h→纳米骨液。羟基磷灰石加去离子水调整固形物质量分数为5%后,在相同的湿法球磨工艺条件下粉碎2 h。用激光粒度仪测得的纳米鱼骨颗粒和纳米羟基磷灰石的平均粒径分别为115.29 nm和120.27 nm。
1.3.2 纳米鱼骨(NFB)的微观形貌
纳米鱼骨液加去离子水稀释固形物质量浓度到10-5g/mL,滴在云母片上,空气中干燥,采用轻敲模式获得纳米鱼骨颗粒图像。
1.3.3 肌动球蛋白的提取
参考Yongsawatdigul等[12]的方法,先向白鲢鱼肉中加入低盐缓冲液(50 mmol/L NaCl,20 mmol/L Tris- HCl,0.03 mmol/L PMSF,pH值为7.0),均质,离心,去除血液和水溶性蛋白;然后用10倍体积的高盐缓冲液(0.6 mmol/L NaCl,20 mmol/L Tris- HCl,pH值为7.0)溶解肌动球蛋白;再向肌动球蛋白溶解液中加入3倍体积的去离子水,离心,得到的沉淀即为肌动球蛋白。以Lowry等[13]的方法测得浓缩后的蛋白质质量浓度为73.17 mg/mL。
1.3.4 肌动球蛋白凝胶的制备
参考Yongsawatdigul等[14]的方法,向浓缩后的肌动球蛋白中分别加入5组缓冲液(4∶1),用100 mL的研钵研磨10 min,转入离心管中后在4 000 g离心力下离心3 min以排除气泡,先在40 ℃温度下水浴30 min,接着在90 ℃温度下加热30 min,放入冰水中冷却15 min,最后置于4 ℃冰箱中过夜保存。5组缓冲液分别为:对照组,1.4 mol/L NaCl,20 mmol/L Tris- HCl,pH值为7.0;CaCl2组,在空白组的基础上添加15 mmol/L CaCl2;NFB组,在空白组的基础上添加5% NFB;HAP组,在空白组的基础上添加3.5% HAP;HAP+CLG组,在空白组的基础上添加3.5% HAP和1.5% CLG。经测定,5组缓冲液中钙离子的浓度分别为0.01,15.00,15.34,6.60,6.40 mmol/L。
1.3.5 凝胶强度的测定
蛋白凝胶切成长度为20 mm的圆柱,其破断力和破断距离的测定采用穿刺的方法,用TA- XT 质构仪测定(stable micro systems, Surrey, UK) ,穿刺球的直径为2.5 cm,穿刺速度为60 mm/min。
1.3.6 表面疏水性的测定
参考Yongsawatdigul等[14],向蛋白凝胶加入4倍质量的缓冲液(0.6 mol/L KCl,20 mmol/L Tris- HCl,pH值为7.0),于5 000 r/min转速下均质1 min,接着在10 000 g离心力下离心30 min,测定上清液中蛋白质的浓度[13]。用缓冲液(0.6 mol/L KCl, 20 mmol/L Tris- HCl, pH值为7.0)调整蛋白质质量浓度为0,0.05,0.1,0.15,0.2 mg/mL,向4 mL蛋白样品中加20 μL荧光显色剂ANS,放置10 min。最后测定390 nm激发波长和470 nm发射波长下的吸光值。
1.3.7 总巯基含量的测定
总巯基含量的测定参考Hemung等[15]的方法,如1.3.6中相同的方法提取蛋白,并调整蛋白质质量浓度为0.5 mg/mL。取0.5 mL样品加入2 mL尿素(8 mol/L)和50 μm DTNB(10 mmol/L)后混匀,置于40 ℃温度下水浴15 min,用流水冷却到室温后,测定412 nm下的吸光值。
1.3.8 SDS- PAGE电泳
非连续性电泳参考Laemmli[16]的方法,用5%的SDS溶解蛋白,分离胶和浓缩胶中丙烯酰胺的质量浓度分别为0.05 g/mL和0.10 g/mL ,蛋白上样量为20 μg,电泳结束后用0.125%考马斯亮蓝R- 250染色,用50%甲醇和10%冰乙酸脱色。连续型电泳参考王金余等[17]的方法,用SDS- UM缓冲液(8 mol/L 尿素,2% SDS,2% 2-巯基乙醇,20 mmol/L Tris- HCl,pH值为7.5)溶解蛋白,聚丙烯酰胺的质量浓度为0.03 g/mL,添加0.5%的琼脂以增加胶的强度,上样量为50 μg蛋白,电泳结束后采用如上相同的染色和脱色程序。
1.3.9 微观结构分析
蛋白凝胶用刀片切成小块,先用25 mL/L 的戊二醛(磷酸缓冲液,pH值为7.2)固定2 h,然后用梯度体积分数的乙醇脱水,再用乙酸异戊酯置换乙醇,最后在临界点干燥;干燥的样品喷金,然后在加速电压为3.0 kV条件下观测。参考朱玉安等[18]的方法,用IMAGE J软件的Frac- Lac 2.5插件对扫描电镜图进行分形维数(fractional dimension)和不均匀性(lacunarity)分析。
1.4 数据分析
采用SAS (V8, Institute Inc, Carry, NC, USA)进行方差分析,显著性水平设置为p<0.05。
2 结果与分析
2.1 纳米鱼骨的微观形貌
纳米鱼骨的微观形貌如图1。纳米鱼骨颗粒为近似圆球的形状,部分颗粒团聚在一起形成不规则的聚集体。纳米鱼骨颗粒直径约为100 nm,这与激光光散射测定的结果相一致。从图1中还可见到丝状的蛋白纤维。
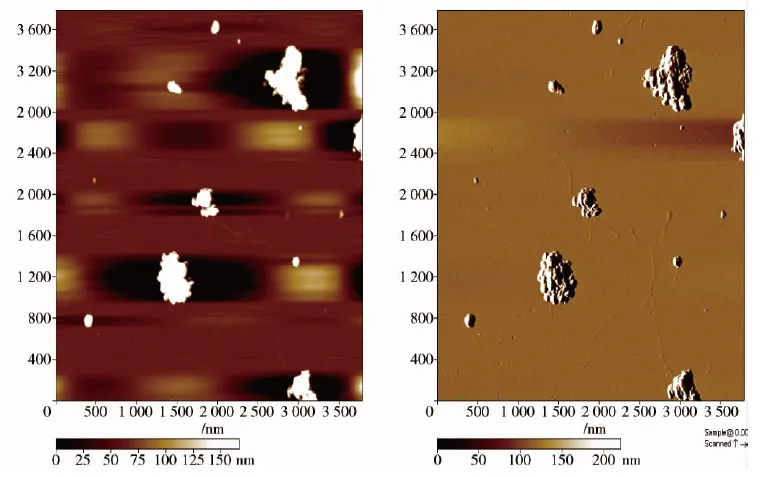
图1 纳米鱼骨颗粒的微观形貌Fig.1 Morphology of nano fish bone particles
2.2 凝胶强度
5组(空白组、CaCl2、NFB、HAP和HAP+CLG)白鲢肌动球蛋白凝胶的破断力和破断距离如图2。NFB组蛋白凝胶的破断力显著高于空白对照组、HAP组和HAP+CLG组(p<0.05),与CaCl2组的无显著性差异(p>0.05)。HAP组蛋白凝胶的破断力与空白组相比无显著性差异。HAP+CLG组蛋白凝胶的破断力略低于空白组,但是无显著性差异。5组蛋白凝胶的破断距离无显著性差异。
2.3 表面疏水性和总巯基含量
5组(空白组、CaCl2、NFB、HAP和HAP+CLG)白鲢肌动球蛋白凝胶的表面疏水性和总巯基含量如图3。CaCl2、NFB、HAP和HAP+CLG组的白鲢肌动球蛋白的表面疏水性和总巯基含量与对照组相比无均显著性差异(p>0.05)。
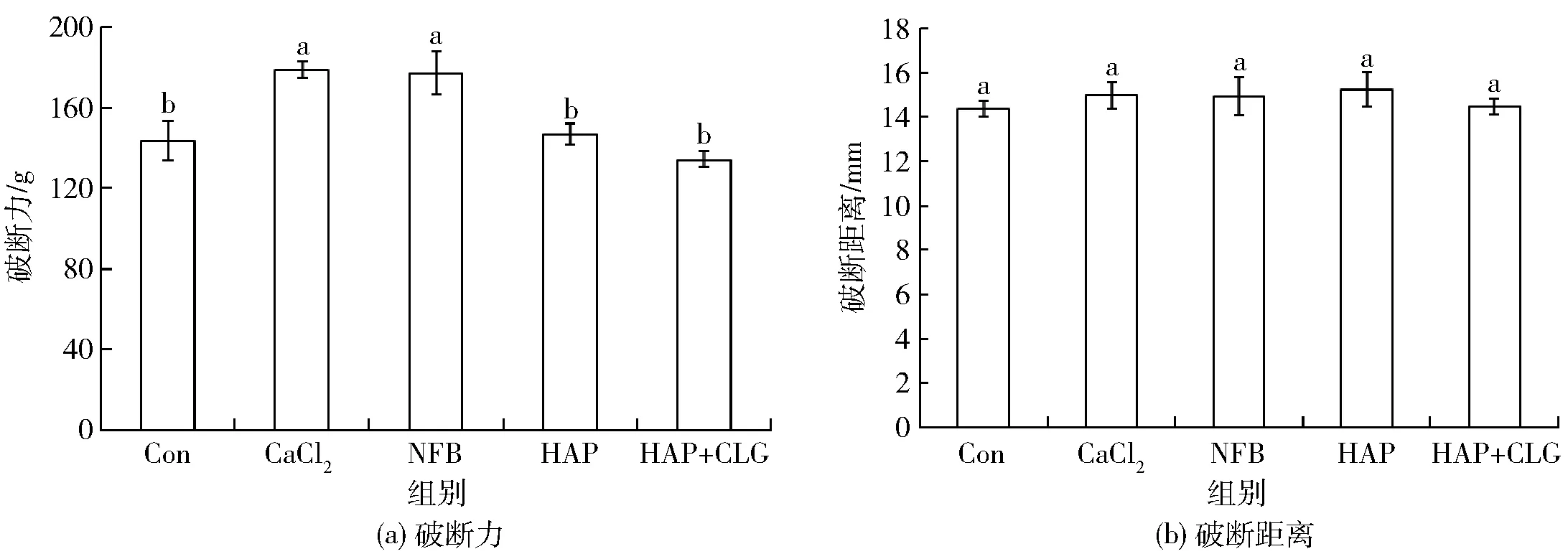
图2 肌动球蛋白凝胶的破断力和破断距离Fig.2 Breaking force and penetration distance of actomyosin gels
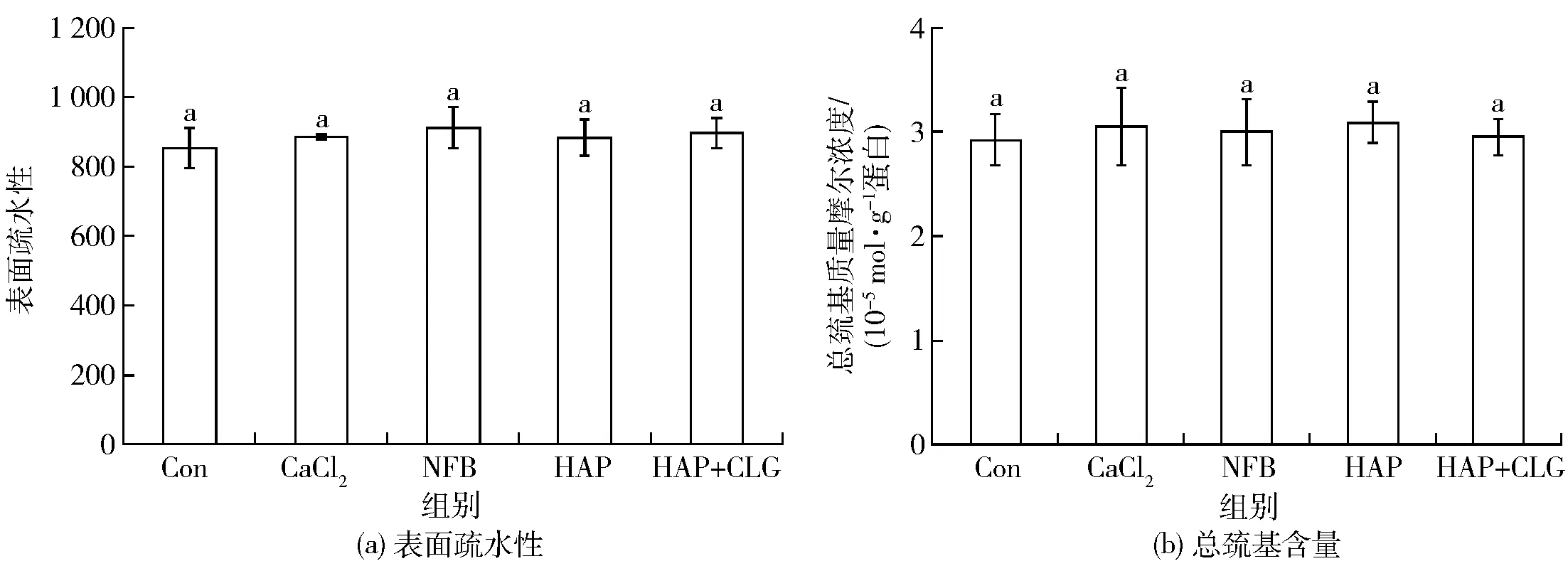
图3 肌动球蛋白凝胶的表面疏水性和总巯基含量Fig.3 Hydrophobicity and total SH groups of actomyosin gels
2.4 蛋白质模式
5组(空白组、CaCl2、NFB、HAP和HAP+CLG)白鲢肌动球蛋白凝胶的蛋白质模式如图4。在图4(a)中,肌球蛋白重链(MHC)、肌动蛋白(AC)、原肌球蛋白(TM)、肌钙蛋白T(TN T)和肌球蛋白轻链(MLC)为主要的蛋白条带,MHC和AC蛋白条带强度高,TM、TN T和MLC蛋白条带强度相对较低,5组样品间这些条带的强度无明显差异。在图4(b)中, CaCl2和NFB组肌球蛋白重链二聚体(MHC2)条带强度明显高于HAP和HAP+CLG组,空白组的MHC2条带不明显。
2.5 微观结构
5组(空白组、CaCl2、NFB、HAP和HAP+CLG)白鲢肌动球蛋白凝胶的网络结构如图5。5组肌动球蛋白凝胶均形成连续的网络结构。5组蛋白凝胶微观结构图的分形维数和不均匀性系数均无显著性差异(p>0.05)(见表1)。
3 结 论
鱼肉蛋白的热诱导聚集是一个复杂的物化过程,涉及到蛋白结构和功能特性的变化。低温凝胶化和随后高温加热过程中,包埋于肌动球蛋白分子内部的疏水性氨基酸残基和巯基等功能性基团暴露出来,这些功能性基团通过分子间的相互作用力形成蛋白质的三维网络结构。分子之间的疏水相互作用力和二硫键是形成和稳定蛋白凝胶网络结构的两类重要化学作用力,与蛋白凝胶强度密切相关。另外,在低温凝胶化过程中,内源性TGase催化肌动球蛋白的谷氨酸残基和赖氨酸残基共价交联形成ε-(γ-glutamyl) lysine多聚体,可显著增加蛋白凝胶强度[19]。NFB组蛋白凝胶的破断力显著高于空白对照组、HAP组和HAP+CLG组(p<0.05),与CaCl2组无显著性差异(p>0.05)。HAP和HAP+CLG组蛋白凝胶的破断力与空白组相比无显著性差异(p>0.05)。空白组、CaCl2、NFB、HAP和HAP+CLG组蛋白样品中钙离子浓度分别为0.01,15.00,15.34,6.60,6.40 mmol/L。肌动球蛋白凝胶的破断力与钙离子的浓度基本一致。钙离子可降低非极性氨基酸残基溶于水中的自由能,因此降低蛋白质分子内的疏水相互作用力,导致蛋白质展开[20]。Yongsawatdigul等[14]报道钙离子(10~100 mmol/L)促进罗非鱼肌动球蛋白的高级结构在低温凝胶化过程中展开,暴露疏水性基团和巯基,进而增强形成的疏水性相互作用力和增加二硫键含量。本课题研究中,5组样品的表面疏水性和巯基含量无显著性差异(p>0.05)。其原因可能是与NFB中释放的钙离子低于添加的钙离子浓度有关。另一方面,在Yongsawatdigul等[14]的研究中,低浓度的肌动球蛋白和钙离子在稀溶液中作用,更有利于蛋白质高级结构展开。肌球蛋白重链二聚体(MHC2)是白鲢肌动球蛋白热诱导后形成的主要交联形式,这与Maruyama等[21]报道的结果相一致。在图4(b)中,未观察到对照组凝胶形成的肌动球蛋白二聚体,但是明显观察到HAP和HAP+CLG凝胶形成的二聚体,另外CaCl2和NFB组凝胶形成的二聚体强度明显高于HAP和HAP+CLG组,形成的二聚体的强度与缓冲液中钙离子的浓度相一致。因此,可初步推断NFB增强鱼肉蛋白凝胶强度的主要作用方式是通过钙离子激活内源性TGase,催化肌动球蛋白的谷氨酸残基和赖氨酸残基共价交联,形成ε-(γ-glutamyl) lysine二聚体。

STD—蛋白质标品,MHC—肌球蛋白重链,AC—肌动蛋白,MHCXL—肌球蛋白重链交联,MHC2—肌球蛋白重链二聚体,Co—β-肌联蛋白,TM—原肌球蛋白,TN T—肌钙蛋白T,MLC—肌球蛋白轻链
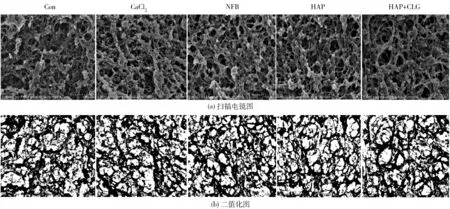
图5 肌动球蛋白凝胶的微观结构Fig.5 Microstructure of actomyosin gels

表1 肌动球蛋白凝胶的分形维数和不均匀系数
对蛋白质凝胶的电镜图二值化处理后进行分形维数和不均匀系数分析,可以有效地比较不同处理方式对蛋白质网络结构的影响。分形维数反映了体系复杂程度,当体系越复杂时,分形维数也越大,表明曲线的复杂度越大,越趋于填满一定范围内的平面。对鱼糜凝胶体来说,当分形维数越高时,凝胶聚集体细碎、紧凑、致密地分布于鱼糜凝胶体中。不均匀性系数是反映蛋白质网络中网孔分布均匀性的一个指数,系数越低网络的均匀性越好[22]。5组蛋白凝胶的分形维数不均匀系数无显著性差异(p>0.05),NFB和HAP的粒径基本相同。与空白组相比,NFB显著增强蛋白凝胶的破断力(p<0.05),而HAP对破断力无显著性影响(p>0.05)。以上结果说明纳米鱼骨增强凝胶强度的作用与纳米颗粒的填充效果无关。
无机盐和胶原蛋白是鱼骨的主要成分,其质量分数分别约为70%和30%[15]。HAP+CLG组凝胶的破断力和破断距离略低于HAP和对照组(p>0.05),说明胶原蛋白不是影响NFB中凝胶强度的主要因素。这与Hernández-Briones 等[23]报道的结果相一致,即添加低质量分数的胶原蛋白(<0.5%)对鱼肉蛋白凝胶的破断力和破断距离无显著影响(p>0.05)。
综上所述,纳米鱼骨对肌动球蛋白凝胶的表面疏水性、总二硫键含量和微观结构均无显著性影响(P>0.05),其增强蛋白凝胶强度的主要作用机制是通过释放的钙离子激活内源性TGase,催化形成更多的肌球蛋白重链共价交联二聚体。
[1] TOPPE J, ALBREKTSEN S, HOPE B, et al. Chemical composition, mineral content and amino acid and lipid profiles in bones from various fish species[J]. Comparative Biochemistry and Physiology B, 2007, 146(3): 395-401.
[2] 谢雯雯, 尹涛, 张晋, 等. 鱼骨粉粒径对鱼骨粉- 鱼蛋白酶解物混合物中钙生物利用率的影响[J]. 食品科学, 2014, 35(7): 211-216.
[3] YIN T, DU H Y, ZHANG J, et al. Preparation and characterization of ultrafine fish bone powder[J]. Journal of Aquatic Food Product Technology, 2016, 25(7): 1045-1055.
[4] BOUTINGUIZA M, POU J, COMESAA R, et al. Biological hydroxyapatite obtained from fish bones[J]. Materials Science and Engineering: C, 2012, 32(3): 478-486.
[5] LI Z R, WANG B, CHI C F, et al. Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel (Scomberomorousniphonius)[J]. Food Hydrocolloids, 2013, 31: 103-113.
[6] YIN T, PARK J W, XIONG S B. Physicochemical properties of nano fish bone prepared by wet media milling[J]. LWT- Food Science and Technology, 2015, 64: 367-373.
[7] YIN T, PARK J W. Effects of nano-scaled fish bone on the gelation properties of Alaska pollock surimi[J]. Food Chemistry, 2014, 150: 463-468.
[8] ZHANG J, YIN T, XIONG S B, et al. Thermal treatments affect breakage kinetics and calcium release of fish bone particles during high-energy wet ball milling[J]. Journal of Food Engineering, 2016, 183: 74-80.
[9] PARK J W. Surimi and surimi seafood [M]. 3rd ed. Boca Raton, Fla: CRC Press, 2014:101-131.
[10] ARAKAWA T, TIMASHEFF S N. Mechanism of protein salting in and salting out by divalent cation salts: ba-lance between hydration and salt binding[J]. Biochemistry, 1984, 23: 5912-5923.
[11] JIA D, YOU J, HU Y, et al. Effect of CaCl2on denaturation and aggregation of silver carp myosin during setting[J]. Food Chemistry, 2015, 185: 212-218.
[12] YONGSAWATDIGUL J, PARK J W. Thermal denaturation and aggregation of threadfin bream actomyosin[J]. Food Chemistry, 2003, 83(3): 409-416.
[13] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193: 256-275.
[14] YONGSAWATDIGUL J, SINSUWAN S. Aggregation and conformational changes of tilapia actomyosin as affected by calcium ion during setting[J]. Food Hydrocolloids, 2007, 21(3): 359-367.
[15] HEMUNG B O, YONGSAWATDIGUL J. Ca2+affects physicochemical and conformational changes of threadfin bream myosin and actin in a setting model[J]. Journal of Food Science, 2005, 70(8): 455-460.
[16] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage[J]. Nature, 1970, 227: 680-685.
[17] 王金余, 刘承初, 赵善贞, 等. 白鲢鱼糜肌球蛋白交联反应和凝胶化最适条件的研究[J]. 食品科学, 2008, 29(11): 223-227.
[18] 朱玉安, 刘友明, 张秋亮, 等. 加热方式对鱼糜凝胶特性的影响[J]. 食品科学, 2011, 32(23): 107-110.
[19] LIU R, ZHAO S M, XIE B J, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids, 2011, 25: 898-906.
[20] VON HIPPEL P H, WONG K Y. On the conformational stability of globular proteins, the effects of various electrolytes and nonelectrolytes on the thermal ribonuclease transition[J]. Journal of Biological Chemistry, 1965, 240: 3909-3923.
[21] MARUYAMA N, NOZAWA H, KIMURA I, et al. Transglutaminase-induced polymerization of a mixture of different fish myosin[J]. Fish Science, 1995, 61(3): 495-500.
[22] DAVILA E, PARES D. Structure of heat-induced plasma protein gels studied by fractal and lacunarity analysis[J]. Food Hydrocolloids, 2007, 21(2): 147-153.
(责任编辑:檀彩莲)
Mechanism on Nano Fish Bone Improving Gel Strength of Fish Atomyosin
YIN Tao, LIU Qing, XIONG Shanbai*, LIU Ru, YOU Juan, HU Yang
(CollegeofFoodScienceandTechnology,HuazhongAgriculturalUniversity/NationalR&DBranchCenterForConventionalFreshwaterFishProcessing(Wuhan),Wuhan430070,China)
In order to explore the mechanism on nano fish bone (NFB) improving gel strength of fish protein, effects of CaCl2, NFB, nano hydroxyapatite (HAP) and nano hydroxyapatite and collagen (HAP and CLG) on the gelation properties of silver carp actomyosin were comparatively investigated in this study. Calcium ion concentration was the same between the CaCl2and NFB groups. And the particle sizes of the NFB and HAP were the same. Breaking force of the NFB actomyosin gel was the same as that of the CaCl2group (p>0.05), and significantly higher than that of HAP and HAP and CLG groups. Hydrophobicity, total sulfydryl group sulfydry group, and microstructure were not significantly different among the five group of actomyosin gels (p>0.05). The SDS-PAGE gel results showed that gel of myosin heave chain dimer (MHC2) was not visible and the gels of HAP and HAP and CLG groups had a higher intensity. Meanwhile, the CaCl2and NFB groups had the higher intensity gels. The results indicated that NFB increased the gel strength of actomyosin gel by the means of activating endogenous TGase, which catalyzed the formation of MHC2.
silver carp; actomyosin; nano fish bone; TGase; cross-linking; SEM
2017-01-05
国家自然科学基金资助项目(31601501);现代农业产业技术体系专项基金资助项目(CARS- 46- 23)。
尹 涛,男,讲师,博士,主要从事水产加工与贮藏工程方面的研究;
10.3969/j.issn.2095-6002.2017.01.005
2095-6002(2017)01-0028-07
尹涛,刘庆,熊善柏,等. 纳米鱼骨增强鱼肉肌动球蛋白凝胶强度的机制研究[J]. 食品科学技术学报,2017,35(1):28-34. YIN Tao,LIU Qing,XIONG Shanbai, et al. Mechanism on nano fish bone improving gel strength of fish atomyosin[J]. Journal of Food Science and Technology, 2017,35(1):28-34.
TS201.2; TS254.9
A
*熊善柏,男,教授,主要从事水产加工与贮藏工程方面的研究,通信作者。

