熟地黄多糖诱导肝癌细胞凋亡及对STAT3信号通路的影响
董 静, 孙 阳, 吴勃岩, 王 雪
熟地黄为生地黄的炮制品,始载于《神农本草经》,列为上品,具有滋阴补血、填精益髓的功效。临床上主要用于治疗肝肾阴虚、腰膝酸软、血虚萎黄等病症,并对免疫功能损伤有较好的疗效。熟地黄多糖(rehmannia glutinosa polysaccharide, RGP)作为熟地黄的有效成分之一,具有多方面药理作用,包括增强机体的造血功能、降血压、降血糖、抗氧化等,并且具有保护肝、肾等主要脏器的作用[1]。Huang等发现,RGP能有效促进淋巴结中抗原的暴露,达到诱导保护和长期免疫的作用[2]。Xu等证实,RGP可促进自然杀伤细胞(natural killer cell, NK)活化并抑制小鼠体内肿瘤[3]。本课题组前期基础工作发现,RGP可调节肿瘤细胞中bcl-2,cyt-c及caspase-3的表达,从而促进细胞凋亡[4]。本研究以H22荷瘤小鼠作为体内抗肿瘤的实验模型,探究RGP对细胞凋亡关键因子[信号转导及转录活化因子(signal transducers and activators of transcription, STAT3)]和凋亡抑制基因生存素(Survivin)的影响,为RGP的临床应用提供实验依据。
1 材料与方法
1.1材料
1.1.1动物 ICR种小鼠50只,雌雄各半,清洁级,体质量18~22 g(许可证号:SCXK黑2013004,由黑龙江中医药大学GLP中心提供)。
1.1.2瘤株与主要试剂 H22肝癌腹水型瘤株(北京肿瘤研究所),由ICR小鼠腹水传代。熟地黄(河南同仁堂公司);RGP(黑龙江中医药大学药学院提取);环磷酰胺(cytoxan,CY)(批号:131011,上海如吉生物科技发展有限公司);Survivin试剂盒(批号:BA1420-1)、STAT3试剂盒(批号:BA0621)、TUNEL试剂盒(批号:MK1023)及BCA蛋白定量试剂盒(批号:AR0146)(武汉博士德生物工程有限公司);STAT3(批号:TA347058)及Survivin(批号:TA301427)多克隆抗体(北京中杉金桥生物技术有限公司)。
1.1.3仪器 显微镜(日本尼康公司);石蜡切片机(HM355s,美国Thermo公司);透射电镜(Tecnai-G2,荷兰Philips公司);图像采集系统显微镜(BH2-RFCA,日本Olympus公司)。
1.2方法
1.2.1RGP的制备 利用水提醇沉法提取,沉淀经无水乙醇、丙酮、无水乙醚依次洗涤后,再经过三氯乙酸溶液脱蛋白后进行烘干,制备RGP。用纯净水分别配制不同质量浓度(1 000,500,250 mg/mL)的RGP溶液,置于4 ℃冰箱保存,用时混匀。
1.2.2实体瘤造模 无菌环境下,将小鼠肝癌H22瘤株接种于小鼠腹腔,待7 d后小鼠腹部丰润时处死,消毒后抽取腹水,生理盐水1∶1混匀,台盼蓝染色后计算活细胞数>95%,制备密度为1×107mL-1的细胞悬液,每只0.2 mL皮下接种于小鼠右侧腋窝[5]。
1.2.3RGP对小鼠移植型肿瘤生长的抑制作用 将50只造模小鼠随机均分为5组,称体质量,分为模型组、CY组及高、中、低剂量RGP组。接种24 h后首次给药,模型组以90 mg/kg生理盐水灌胃;CY组采用40 mg/kg的CY隔日腹腔注射,共3次;高、中、低剂量RGP组分别以1 000,500,250 mg/kg的RGP灌胃。连续给药10 d,末次给药后于小鼠腹部注射6%淀粉溶液1 mL,24 h后注射新鲜配制的1%鸡红细胞悬液2 mL,30 min后以PBS溶液2 mL腹腔注射,轻揉腹部2 min,断髓法处死小鼠,称体质量,剥离瘤组织、胸腺及脾脏。瘤组织固定,酒精消毒后抽取腹腔液涂于载玻片上,固定晾干后经Giemsa染色,油镜下观察巨噬细胞吞噬鸡红细胞的情况。
1.2.4计算抑瘤率、胸腺(脾脏)指数、吞噬指数及吞噬百分率 各指标按以下公式计算:
抑瘤率(%)=[(模型组平均瘤质量-用药组平均瘤质量)/模型组平均瘤质量]×100%
胸腺(脾脏)指数=胸腺(脾脏)质量(mg)/体质量(g)×100%
吞噬百分率(%)=吞噬红细胞的巨噬细胞数/观察记录的吞噬细胞总数×100%
吞噬指数=被吞噬的红细胞总数/观察记录的吞噬细胞总数×100%
1.2.5对凋亡指数的影响 肿瘤组织常规石蜡切片并行H-E染色,采用经典原位末端标记法进行测定,具体方法参照试剂盒说明书进行。经试剂盒处理后,测定凋亡指数(apoptosis index, AI),每张切片分别选取5个阳性细胞密度高的高倍镜视野,记录凋亡(阳性)细胞数和总细胞数,二者的比值即为AI。阳性表达的细胞以细胞核出现棕黄(褐)色细微颗粒为标志。
1.2.6对STAT3及Survivin表达的影响 采用PV二步免疫组织化学法将经甲醛固定的标本常规脱水,石蜡包埋,切片,PBS冲洗3次;3% H2O2孵育10 min,消除内源性过氧化物酶的活性,PBS冲洗;滴加一抗,4 ℃孵育过夜,PBS冲洗3次;滴加二抗,37 ℃孵育30 min,PBS冲洗;DAB室温显色,蒸馏水清洗;苏木精复染,脱水,二甲苯透明封片,光学显微镜下观察,测定STAT3及Survivin的表达情况(按试剂盒说明书操作进行)。STAT3表达的阳性信号是以胞质出现棕褐(黄)色细颗粒为标志;Survivin表达的阳性信号是以细胞质或细胞核出现棕黄色细颗粒为标志。应用Image-proplus 6.0分析软件测定各组中的STAT3及Survivin阳性细胞,统计分析阳性表达的积分吸光度。所有免疫组织化学切片均采用双盲法、由2名病理科教师独立观察,细胞计数测定时均不显示组别等资料。
1.2.7Western-blot法检测STAT3及Survivin蛋白表达 连续给药10 d,末次给药24 h后断髓法将小鼠处死,立即剥离瘤组织,称体质量,细胞裂解液提取蛋白,BCA法测定蛋白浓度。模型组、CY组及中剂量RGP组各取样品20 μg上样,SDS-聚丙烯酰胺电泳分离蛋白并转至PVDF膜上,封闭液室温密封10 min,再用抗体反应液处理后的一抗4 ℃孵育过夜,洗膜。经洗涤3次,进行ECL发光显影液显影,应用软件Image J进行分析处理。采用STAT3和Survivin的条带灰度值与β-actin条带灰度值的比值(相对灰度值)表示肿瘤组织中STAT3和Survivin的表达水平。
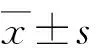
2 结 果
2.1药物对H22荷瘤小鼠抑瘤率、免疫器官指数及巨噬细胞功能的影响
2.1.1对H22荷瘤小鼠抑瘤率的影响 高、中、低剂量RGP组均能抑制H22荷瘤小鼠肿瘤细胞的生长,以中剂量组的抑瘤效果最明显,抑瘤率为45.69%,而CY组的抑瘤率为58.12%,高于RGP各剂量组(表1)。
2.1.2对H22荷瘤小鼠免疫器官指数的影响 各剂量RGP组小鼠的胸腺指数与模型组比较,差别均有统计学意义(P<0.05);CY组小鼠胸腺指数及脾脏指数与模型组比较均降低,差别有统计学意义(P<0.01);中剂量RGP组小鼠脾脏指数与模型组比较明显升高,差别有统计学意义(P<0.05),但低、高剂量RGP组脾脏指数与模型组比较,差别无统计学意义(表1)。
2.1.3对H22荷瘤小鼠巨噬细胞功能的影响 与模型组比较,各剂量RGP组均可提升小鼠的腹腔吞噬指数和吞噬百分率,差别有统计学意义(P<0.05),而CY组小鼠的腹腔吞噬指数和吞噬百分率则明显降低(P<0.01,表1)。
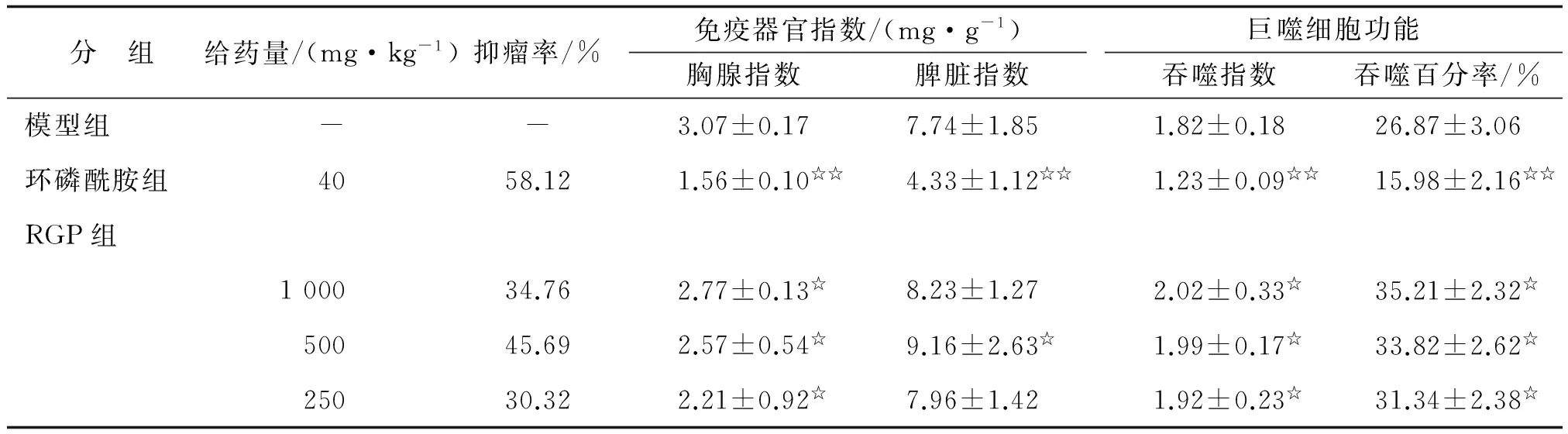
表1 药物对H22荷瘤小鼠抑瘤率、免疫器官指数及巨噬细胞功能的影响
n=10. RGP:熟地黄多糖. 与模型组比较,☆:P<0.05,☆☆:P<0.01.
2.2对瘤体内细胞形态及凋亡指数的影响 瘤组织经H-E染色后,光学显微镜观察显示,模型组肿瘤中血管丰富,核分裂像较多;CY组及RGP组肿瘤中血管数量少,细胞排列疏松。高、中、低剂量RGP组的凋亡指数分别为(11.2±0.95),(12.9±0.74)及(9.80±1.03),与模型组比较,均显著升高(P<0.01,表2,图1),以中剂量组最高。
RGP: 熟地黄多糖. A:模型组;B:环磷酰胺组;C:高剂量RGP组;D:中剂量RGP组;E:低剂量RGP组.图1 模型组、环磷酰胺组及RGP各组肿瘤组织中凋亡指数的变化(H-E ×200)Fig 1 Changes of apoptosis index in tumor tissue of model group、cytoxan group and RGP group(H-E ×200)
2.3RGP对H22荷瘤小鼠瘤体内STAT3和Survivin表达水平的影响
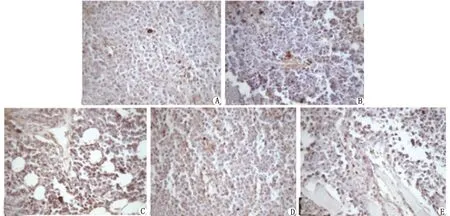
2.3.1对瘤体内STAT3表达的影响 STAT3蛋白的表达主要是在细胞质出现棕褐(黄)色细颗粒(图2)。积分光密度值(integrated optical density,IOD)结果比较显示,高、中、低剂量RGP组的STAT3的IOD分别为(17 241±2 024),(16 094±2 297)及(18 066±1 214),表现为中剂量RGP组对STAT3蛋白表达的抑制作用最强,与模型组比较,差别有统计学意义(P<0.01);高、低剂量RGP组的STAT3的IOD均比模型组低,差别均有统计学意义(P<0.05,表2)。
2.3.2对瘤体内Survivin表达的影响 Survivin蛋白的表达主要表现为在细胞质或细胞核出现棕黄色细颗粒(图3)。比较IOD结果显示,高、中、低剂量RGP组的Survivin的IOD分别(20 619±3 158),(18 531±2 652)及(20 555±4 263),与模型组比较,差别均有统计学意义(P<0.05,表2)。
2.3.3Western-blot法检测STAT3及Survivin蛋白表达量 各组均有STAT3或Survivin蛋白表达(图4),CY组和中剂量RGP组明显低于模型组,差别有统计学意义(P<0.01,表3)。

RGP: 熟地黄多糖. A:模型组;B:环磷酰胺组;C:高剂量RGP组;D:中剂量RGP组;E:低剂量RGP组.图2 模型组、环磷酰胺组及RGP各组瘤体内STAT3表达水平( ×200)Fig 2 Expression of STAT3 in the model group、cytoxan group and RGP group( ×200)

分 组给药量/(mg·kg-1)STAT3/IOD Survivin/IOD AI/%模型组-21184±317126129±42184.20±1.48环磷酰胺组4016785±873.4☆☆18229±628.8☆☆14.9±0.99☆☆RGP组100017241±2024☆20619±3158☆11.2±0.95☆☆50016094±2297☆☆18531±2652☆☆12.9±0.74☆☆25018066±1214☆20555±4263☆9.80±1.03☆☆
n=10. RGP:熟地黄多糖; STAT3:信号转导和转录活化因子; Survivin:生存素; AI:凋亡指数; IOD:积分光密度. 与模型组比较,☆:P<0.05,☆☆:P<0.01.
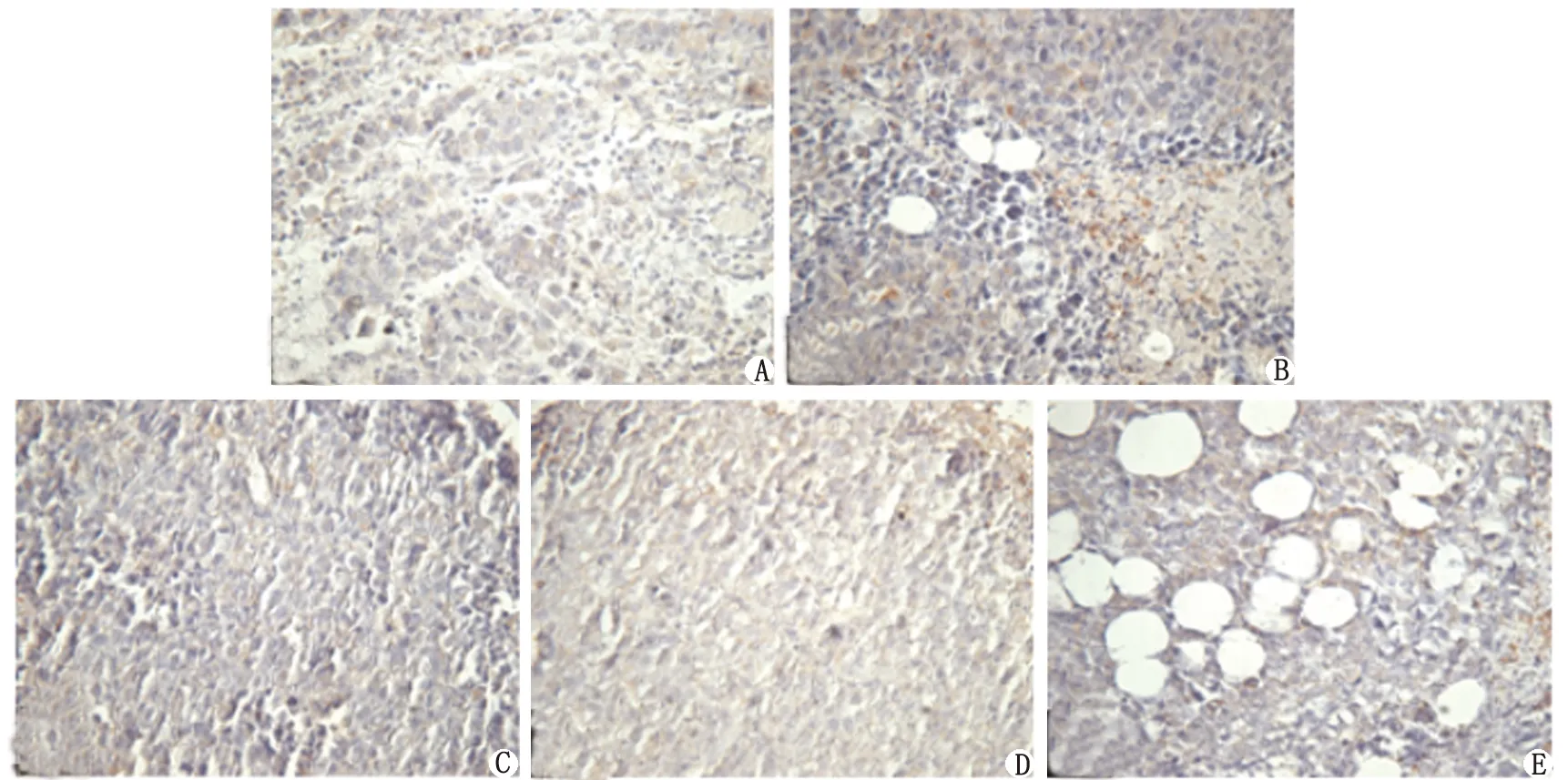
RGP: 熟地黄多糖. A:模型组;B:环磷酰胺组;C:高剂量RGP组;D:中剂量RGP组;E:低剂量RGP组.图3 模型组、环磷酰胺组及RGP各组瘤体内Survivin表达水平( ×200)Fig 3 Expression of Survivin in the model group, cytoxan group and RGP group( ×200)
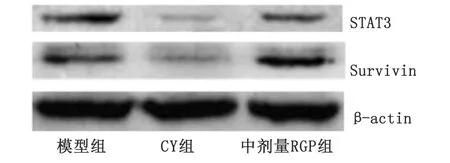
CY:环磷酰胺; RGP: 熟地黄多糖.图4 RGP对肿瘤组织中STAT3及Survivin蛋白表达量的影响Fig 4 Effect of RGP on STAT3 and Survivin protein expression in tumor tissue
Tab3Expression of STAT3 protein and Survivin protein in tumor tissue of each group
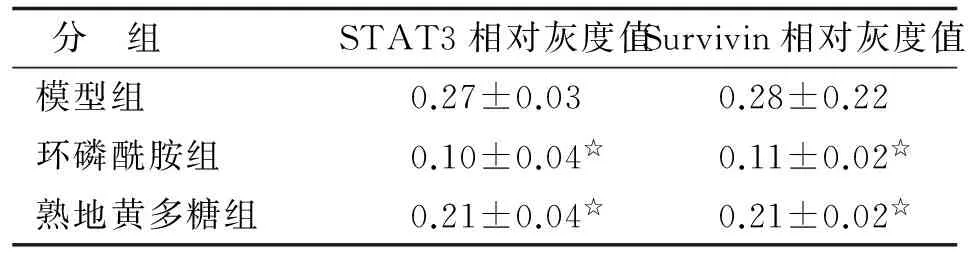
分 组STAT3相对灰度值Survivin相对灰度值模型组0.27±0.030.28±0.22环磷酰胺组0.10±0.04☆0.11±0.02☆熟地黄多糖组0.21±0.04☆0.21±0.02☆
与模型组比较,☆:P<0.01.
3 讨 论
熟地黄被称为“壮水之主,补血之君”,是优良的补益延寿中药。现代药理学研究也表明,熟地黄具有提高免疫、造血、抗肿瘤等诸多作用,其主要成分RGP可升高荷瘤小鼠的免疫器官指数(胸腺指数和脾脏指数),从而发挥免疫功能。胸腺和脾脏属于外周免疫系统,是产生抗体的重要器官,二者功能和结构的异常将直接影响机体的免疫能力。胸腺是T淋巴细胞分化和成熟的场所,成熟的T细胞亚群再经由血液及淋巴到达各外周免疫器官,发挥免疫作用。脾脏作为体内最大的淋巴器官,不仅具有造血、过滤等功能,还具有接受免疫应激、产生免疫应答的作用,是细胞免疫和体液免疫中心。因此胸腺指数和脾脏指数是衡量人体免疫功能的重要指征。巨噬细胞是机体重要的免疫细胞,在抗肿瘤免疫中起着关键作用。张芮琪等发现,植物多糖可激活巨噬细胞,提高吞噬功能,提高非特异性细胞免疫,促进淋巴细胞转化[6]。本实验研究了RGP对荷瘤小鼠免疫器官指数和巨噬细胞功能的影响,推测RGP可能通过激活巨噬细胞而加强吞噬活动、刺激T淋巴细胞发挥免疫功能,从而提高小鼠的免疫能力。Huang等发现,RGP不仅具有免疫刺激作用,还可增强树突细胞的功能,具有成为疫苗佐剂的潜力,RGP在免疫方面的研究前景可观[7]。
凋亡细胞的形态学改变是最直接、最可靠的指标。原位末端标记法作为一种敏感性高、特异性强的细胞凋亡检测技术,能够在组织切片上对凋亡细胞进行精准定位,从形态上更直观地显示细胞的凋亡情况[8]。光学显微镜观察发现,RGP可使肿瘤组织中血管数量减少,肿瘤细胞排列疏松,促进细胞凋亡。
细胞凋亡涉及一系列基因的激活、表达及调控。线粒体作为主要的场所在细胞凋亡过程中发挥着重要的作用,当收到凋亡信号指示时,线粒体会释放多种死亡促进因子,如cyt-c,caspase-3级联反应,导致细胞结构蛋白被切割而凋亡。Survivin是抑制细胞凋亡蛋白家族的成员,经常在肿瘤组织中过量表达,在正常分化组织中少见,因此Survivin被认为是肿瘤治疗中的一个重要靶点[9-10]。Survivin可与细胞凋亡通路中的caspase特异性结合,抑制其活性,而caspase级联反应作为凋亡推进的核心环节,被抑制后将阻碍细胞凋亡[11-13]。Mita等证实,Survivin不仅可抑制细胞凋亡,还可调节细胞周期,参与有丝分裂中纺锤体微管的形成,还与肿瘤干细胞相关,推测Survivin是抑制肿瘤干细胞增殖的潜在靶点[14-15]。本研究发现,模型组Survivin的表达明显升高,RGP组Survivin的表达下降,推测RGP可能具有通过抑制Survivin的表达而起到促进细胞凋亡的作用。
STAT3是STAT信号通路的重要成员,可参与JAK/STAT信号通路,与各种配体结合并激活白细胞介素6、肿瘤坏死因子和血管内皮生长因子等,参与细胞凋亡、肿瘤细胞增殖、分化、血管形成及转移侵袭等相关基因的表达,与肿瘤的发生发展关系密切[16-17]。在多种肿瘤组织中均发现STAT3过度异常表达,已广泛报道于血液学和肿瘤学的相关研究中[18]。STAT3可由不同的生长因子、激素和细胞因子激活,活化的STAT3形成二聚体并转移到细胞核,作为转录因子与特定DNA结合,直接作用于下游靶基因Survivin的启动子,行使基因转录调控功能,促进Survivin激活[19-20]。激活的Survivin直接抑制细胞凋亡中的最重要环节,即caspase级联反应及cyt-c的释放,阻碍了细胞凋亡进程,促使肿瘤细胞逃避凋亡而增殖[21-23]。在正常细胞中,STAT3的激活状态仅能保持数分钟至几小时,持续活化、异常高表达的STAT3在肿瘤的发生发展中发挥关键作用。Panni等发现,STAT3不仅作用于癌基因的表达,在免疫调节功能方面也有着关键作用[24]。
本研究证实,RGP有诱导肿瘤细胞凋亡的作用,可使凋亡指数明显上升,可抑制STAT3活化,下调STAT3蛋白表达,并进一步抑制Survivin基因的表达,阻碍细胞凋亡caspase进程,说明RGP可能通过抑制STAT3信号转导通路而促进细胞凋亡。本研究还发现,中剂量RGP组对抑制STAT3和Survivin蛋白表达更有利,促进肿瘤细胞凋亡的作用更强,高剂量RGP组促凋亡效果反而略低,其原因可能是当RGP超过一定浓度时,体内的代谢副产物和原药本身产生竞争抑制而不利于发挥药物活性。RGP抗肿瘤的最佳剂量还需摸索,其促细胞凋亡的分子机制仍需进一步实验加以明确。
[1] 王志江,魏国栋,马思缇.地黄多糖的化学和药理作用研究进展[J].实验方剂学杂志, 2015,21(16):231-234.
[2] Huang Y,Qin T,Huang Y F,etal. Rehmannia glutinosa polysaccharide liposome as a novel strategy for stimulating an efficient immune response and their effects on dendritic cells[J].IntJNanomedicine, 2016,11:6795-808.
[3] Xu L,Zhang,W,Zeng L,etal.Rehmannia glutinosa polysaccharide induced an anti-cancer effect by activating natural killer cells[J/OL].IntJBiolMacromol, [2017-07-15]. https://doi.org/10.1016/j.ijbiomac.2017.07.090.
[4] 董 静,吴勃岩,车艳新,等.熟地黄多糖诱导H22荷瘤小鼠细胞凋亡作用的研究[J].中医药信息,2015,32(4):32-34.
[5] 孙 阳,吴勃岩,车艳新,等.鳖甲煎丸诱导肝癌细胞凋亡及对STAT信号通路的影响[J].时珍国医国药,2016,27(4):849-851.
[6] 张芮琪,陈正礼,罗启慧.黄芪多糖干预环磷酰胺所致免疫抑制小鼠的免疫功能[J].中国实验动物学报,2015,23(4):389-394.
[7] Huang Y,Liu Z G,Bo R N,etal.The enhanced immune response of PCV-2 vaccine using Rehmannia glutinosa polysaccharide liposome as an adjuvant[J].IntJBiolMacromol, 2016,5(86):929-936.
[8] 佟俊杰,苗 清,王志国.TUNEL法和Annexin V-FITC流式细胞分析法检测成纤维细胞凋亡的对比研究[J].口腔医学,2014,34(1):12-15.
[9] Liu J L,Gao W,Kang Q,etal.Prognostic value of survivin in patients with gastric cancer:a systematic review with meta-analysis[J].PLoSOne,2013,8(8):71930.
[10] Altieri D C.New wirings in the survivin networks[J].Oncogene,2008,27(48):6276-6284.
[11] Bao W,Zhu F,Duan Y,etal.HtrA1 resensitizes multidrug-resistant hepatocellular carcinoma cells by targeting XIAP[J].BiomedPharmacother,2015,70:97-102.
[12] Wu W Y,Kim H,Zhang C L,etal.Clinical significance of autophagic protein LC3 levels and its correlation with XIAP expression in hepatocellular carcinoma[J].MedOncol,2014,31(8):1-6.
[13] Caja L,Bertran E,Campbell J,etal.The transforming growth factor-beta (TGF-β) mediates acquisition of a mesenchymal stem cell-like phenotype in human liver cells[J].JCellPhysiol,2011,226(5):1214-1223.
[14] Mita A C,Mita M M,Nawrocki S T,etal.Survivin: key regulator of mitosis and apoptosis and novel target for cancer therapeutics[J].ClinCancerRes,2008,14(16):5000-5005.
[15] Evans J,Essex A,Hong X,etal.Wnt activity defines colon cancer stem cells and is regulated by the microenvironment[J].NatCellBiol,2015,12(5),468-476.
[16] Xiong A,Yang Z,Shen Y,etal.Transcription factor STAT3 as a novel molecular target for cancer prevention[J].Cancers(Basel), 2014,6(2):926-957.
[17] 高安定,林宝顺,兰小鹏.STAT3与肿瘤[J].中国生物化学与分子生物学报,2013,29(5):397-403.
[18] 韩春生.STAT3在肿瘤形成中的作用[J].中国实验血液学杂志,2013,21(2):517-520.
[19] Carpenter R L,Lo H W.STAT3 target genes relevant to human cancers[J].Cancers(Basel),2014,6(2):897-925.
[20] Zhang M,Zhang X,Zhao S,etal.Prognostic value of survivin and EGFR protein expression in triple-negative breast cancer (TNBC) patients[J].TargetOncol,2014,9(4):349.
[21] Haura E B,Turkson J,Jove R. Mechanisms of disease:Insights into the emerging role of signal transducers and acti-vators of transcription in cancer[J].NatClinPractOncol,2005,2(6):315-320.
[22] 邵红玲,许学亮.信号转导与转录活化因子5和Bax在非小细胞肺癌中表达的相关性研究[J].山西医药杂志,2012,41(8):762-764.
[23] 徐长华,邹明花,张献全. 3,3′-二吲哚甲烷阻断STAT3通路影响卵巢癌细胞增殖、凋亡的实验研究[J].第三军医大学学报,2014,36(16):1674-1678.
[24] Panni R Z,Sanford D E,Bellt B A,etal.Tumor-induced STAT3 activation in monocytic myeloid-derived suppressor cells enhances stemness and mesenchymal properties in human pancreatic cancer[J].CancerImmunolImmun, 2014,63(5):513-528.

