塞来昔布胶囊体外溶出度研究
(河南省人民医院,河南 郑州 450003)
塞来昔布胶囊是由Pfizer Pharmaceuticals LLC(辉瑞)开发,于2003年8月获CFDA批准在中国进口注册上市。主要用于缓解骨关节炎、成人类风湿关节炎、强直性脊柱炎的症状和体征及治疗成人急性疼痛。
查阅相关标准和文献资料[1-7],塞来昔布在生理pH值范围内的水性介质中几乎不溶,溶出度检查采用桨法、50 rpm,但选择了非生理pH12.0的0.04 mol/L磷酸三钠溶液为溶出介质,并添加1%十二烷基硫酸钠(SLS)。因此,本文在pH12.0的磷酸三钠溶液的溶出介质中,考察不同溶出条件对塞来昔布胶囊(200 mg)体外溶出曲线的影响,包括桨法(或加沉降篮)、篮法、表面活性剂SLS的浓度等。
1 材料与方法
1.1 材料
磷酸三钠(国药集团化学试剂有限公司);氢氧化钠(国药集团化学试剂有限公司);微孔滤膜(混合膜0.45μm,上海市新亚净化器件厂);一水乳糖(Foremost Farms,USA);交联羧甲基纤维素钠(FMC公司);聚维酮K30(BASF公司);硬脂酸镁(安徽山河药用辅料股份有限公司);十二烷基硫酸钠(国药集团化学试剂有限公司);西乐葆(辉瑞制药有限公司,M07166);塞来昔布对照品(深圳健兴医药科技有限公司,TLC,99.9%);纯化水。
溶出试验仪(RCZ-8M,天大天发科技有限公司);紫外分光光度计(UV-2550,岛津中国)。
1.2 测定方法
1.2.1 波长的选择 分别配制辅料和胶囊壳空白溶液及对照品溶液,在200~400 nm波长范围内扫描各配制溶液,并记录光谱图。
辅料空白溶液:称取乳糖50 mg、交联羧甲基纤维素钠10 mg、聚维酮K30 10 mg、硬脂酸镁10 mg和十二烷基硫酸钠10 mg至1 000 mL量瓶中,加适量溶出介质超声10 min后稀释至刻度,滤过,即得。
胶囊壳空白溶液:按照《中国药典》2015版通则中“0931溶出度与释放度测定法”,取6粒胶囊,除尽胶囊内容物,置一个溶出杯中,溶出介质1 000 mL,搅拌、溶解后,滤过,即得。
对照品溶液:取塞来昔布对照品约20 mg,精密称定,至100 mL量瓶中,加溶出介质溶解后稀释至刻度,作为对照品储备液。精密量取5 mL对照品储备液至100 mL量瓶中,配制成约10μg/mL对照品溶液。
1.2.2 检测方法的验证 采用配制的对照品溶液或储备液,分别进行滤膜吸附、精密度、溶液稳定性和回收率等试验。
1.2.3 线性、范围 分别精密量取对照品储备液0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL至10 mL量瓶中,加溶出介质稀释至刻度,配制一系列浓度的对照品溶液,在选定波长处测定吸光度值A,以吸光度A为纵坐标、浓度C为横坐标,做线性回归,并记录线性方程和回归系数。
1.2.4 溶出曲线的测定 参考FDA药物溶出数据库收载的溶出方法,按照《中国药典》2015版通则0931溶出度与释放度测定法和“普通口服固体制剂溶出曲线测定与比较指导原则”,采用RCZ-8M溶出仪,1 000 mL溶出介质,在10、20、30、45、60、120 min时间点各取5 mL,滤过,测定吸光度,按外标法计算各时间点溶出量;考察不同溶出介质(介质1:含0%SLS;介质2:含1%SLS)、溶出方法(即:桨法、50 rpm、1%SLS;桨法、50 rpm、0%SLS;桨法、50 rpm、0%SLS、沉降篮;篮法、75 rpm、0%SLS)对塞来昔布胶囊溶出度的影响。
2 结果
2.1 检测波长的确定(见图1)
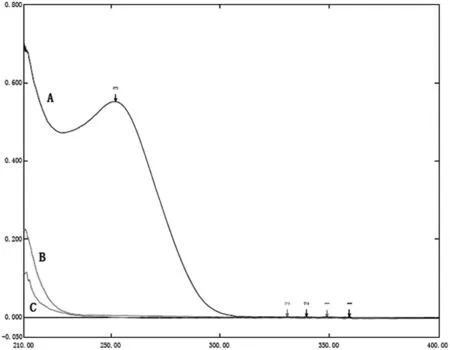
图1 各样品溶液在200~400 nm之间的光谱图(A:对照品;B:辅料空白;C:胶囊壳空白)
由光谱图1可知,塞来昔布在252 nm处有吸收峰,而辅料和胶囊壳空白溶液在该波长处几乎无吸收。结果表明,辅料和胶囊壳不干扰塞来昔布的溶出度测定。
2.2 滤膜吸附
对照品溶液滤过前和滤过不同体积续滤液的吸光度值的相对标准偏差为0.53%,表明滤膜几乎对塞来昔布不吸附,对塞来昔布测定的影响不显著。
2.3 精密度
对照品溶液,连续测定6次的吸光度值的相对标准偏差为0.66%,表明紫外可见分光光度仪的精密度良好。
2.4 稳定性
对照品溶液在0、1、2、4、6、24 h吸光度测定值的相对标准偏差(RSD)为0.42%,表明塞来昔布在pH12.0介质中24 h内是稳定的。
2.5 回收率
采用桨法、50 rpm、1 000 mL的溶出介质,投入塞来昔布胶囊1粒,搅拌2 h后停止,即得塞来昔布胶囊溶液。精密量取该溶液4 mL至10 mL量瓶,9份,分别加入精密量取的对照品储备液3、3.5、4.5 mL,充分摇匀,滤过,精密量取续滤液0.5 mL至10 mL量瓶中,配制成低、中、高3个浓度的样品溶液。依法测定,计算回收率(见表1)。由表1中结果可知本方法准确度良好。

表1 溶出度回收率试验测定结果
2.6 线性范围(见图2、3)
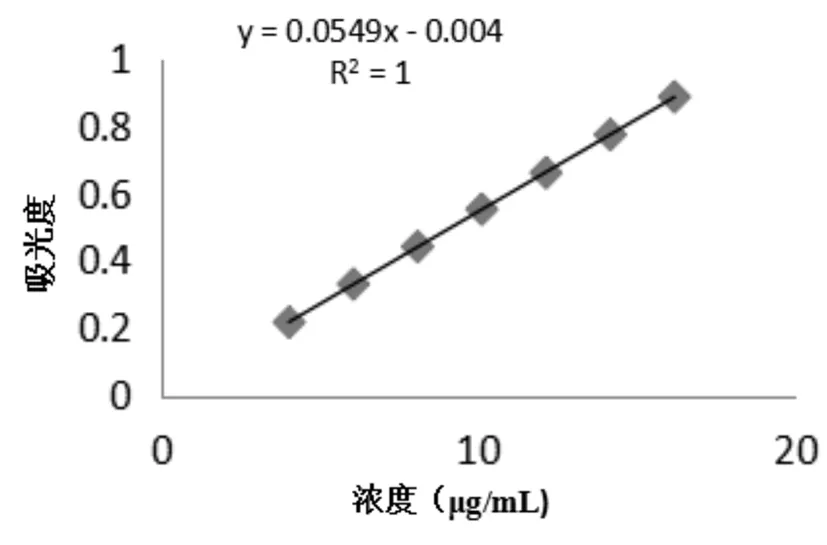
图2 塞来昔布在pH12.0、0%SLS介质中对照品溶液线性关系图

图3 塞来昔布在pH12.0、1%SLS介质中对照品溶液线性关系图
由图2、3可知,溶出介质中添加0%或1%的十二烷基硫酸钠(SLS),塞来昔布在4~16μg/mL浓度范围内与吸光度的线性关系良好。
2.7 溶出曲线结果(见图4)
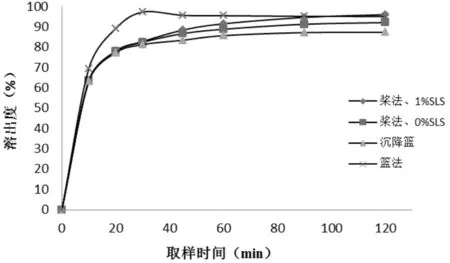
图4 不同溶出条件下塞来昔布胶囊体外溶出曲线图
由图4可知,塞来昔布胶囊采用桨法时,表面活性剂(SLS)对溶出行为影响不大,加用沉降篮后溶出反而稍有降低;采用篮法时,溶出变快。所考察溶出方法的溶出快慢顺序依次是篮法>桨法、1%SLS ≈桨法、0%SLS>沉降篮。
3讨论
研究发现,在pH12.0的溶出介质中,由于胶囊壳自身的因素,如囊壳的漂浮等,篮法更易于塞来昔布胶囊的溶出,分析原因主要是胶囊壳在溶解过程中不会致使颗粒粘附并堆积于溶出杯底部,造成溶出变慢或溶出时间延长的现象。在使用沉降篮时,并不能改善颗粒在溶出杯底部的堆积,反而溶出度最慢。
本研究使用紫外分光光度法测定塞来昔布胶囊体外溶出度,结果表明,辅料和胶囊壳不干扰溶出度测定;在4~16μg/mL范围内塞来昔布浓度与吸光度呈良好线性关系;样品平均回收率为99.64%,RSD值<1%,方法准确度良好,可方便、快速、准确的测定塞来昔布胶囊的体外溶出曲线。FDA溶出数据库及文献中使用到的溶出介质是pH12.0的磷酸三钠溶液,文献报道,塞来昔布在pH12.0溶出介质中溶解度为322.5 mg/mL[2,8],而其为非生理pH值,并且添加了表面活性剂SLS(1%、m/v)以达到药物溶出漏槽条件;由于塞来昔布在生理相关介质中的溶解度非常低,无法建立临床上有意义的体内外相关性[2,9]。因此,FDA溶出数据库和文献中使用到的pH12.0磷酸三钠溶液(1%SLS、m/v)为溶出介质,应是西乐葆生产质量控制的溶出方法,且可以降低SLS的浓度。
[1] FDA药物溶出度方法数据库[O/L].http://ww.accessdata.fda.gov/scripts/cder/dissolution/dsp_Search Results.cfm.
[2] 张小辛.难溶性药物塞来昔布胶囊的制备及质量研究[D].石家庄:河北医科大学,2015.
[3] 郑江萍,李 鹂,黄良永.塞来昔布分散片的制备及其体外溶出度研究[J].儿科药学杂志,2014,20(4):39-42.
[4] 史红霞,曹晓琳.塞来昔布胶囊处方工艺研究[J].中国实用医药,2013,8(35):235-236.
[5] 郑家晴,董 旭,王冬青,等.塞来昔布胶囊的处方工艺筛选及稳定性研究[J].中国卫生产业,2016(4):168-171.
[6] 滕 奇,陈文静,王崇益.塞来昔布胶囊溶出度测定方法的研究[J].淮阴工学院学报,2014,23(1):52-56.
[7] 闫 蒙,任武贤.塞来昔布粒径对其胶囊剂体外溶出度的影响[J].中国药物与临床,2016,16(6):827-829.
[8] Andrej Dolenc,JulijanaKristl,Sa aBaumgartner,et al.Advantages of Celecoxibnanosuspension Formulation and Transformation into Tablets[J].Int J Pharm,2009,376(1):204-212.
[9] 付莉娜,郑金琪,郑国钢,等.生物相关性溶出介质的研究进展[J].中国药学杂志,2013,48(24):2084-2088.

