槲皮素对骨髓间充质干细胞移植联合肾移植所诱导的免疫耐受的影响
杨军 陈花 石韶华 马永文 王振兴 武小桐
·论著·
槲皮素对骨髓间充质干细胞移植联合肾移植所诱导的免疫耐受的影响
杨军 陈花 石韶华 马永文 王振兴 武小桐
目的 探讨槲皮素对骨髓间充质干细胞(BMSCs)诱导肾移植免疫耐受的影响。方法 在对肾移植后的大鼠给予BMSCs治疗的基础上,同时给予不同剂量的槲皮素,观察其诱导免疫耐受的效果。建立大鼠肾移植模型,随机分为4 组:对照组、BMSC组、MSC+高/低剂量槲皮素干预组。Western blot检测各组肾组织中Janus激活激酶(JAK)、信号转导子和转录激活子3(STAT3)、p-STAT3的蛋白表达水平,ELISA检测血清中转化生长因子β1(TGF-β1)水平。收集BMSC组肾小管上皮细胞,干扰及过表达STAT3的同时予以槲皮素干预,使用Western blot检测JAK、STAT3、p-STAT3及TGF-β1表达。采用单因素方差分析比较各组间数据差异,组间数据两两比较采用SNK-q检验。结果 大鼠经肾移植后,对照组血清中TGF-β1蛋白表达(19 162±223)pg/ml高于其他组,BMSC组(12 106±163)pg/ml、MSC+高槲皮素干预组(9 113±110)pg/ml、MSC+低槲皮素干预组(9 024±133)pg/ml。3组分别与对照组比较P均< 0.01。对照组肾组织中JAK、p-STAT3的蛋白相对表达量(1.5±0.2,10.7±0.5)均高于其他各组[MSC组(0.9±0.3,8.5±0.2;P均< 0.01)、MSC+高槲皮素干预组(0.7±0.2,6.1±0.3;P均< 0.01)、MSC+低槲皮素干预组(0.7±0.3,5.8±0.1;P均< 0.01)]。干扰STAT3后肾小管上皮细胞中p-STAT3和TGF-β1蛋白相对表达量(0.7±0.1,0.3±0.1)均少于其他各组[对照组(8.2±0.4,7.1±0.5;P均< 0.01)、槲皮素干预组(5.6±0.3,4.8±0.4;P均< 0.01)、空白对照组(5.7±0.3,4.5±0.4;P均< 0.01)]。过表达STAT3后中p-STAT3和TGF-β1蛋白相对表达量(10.5±0.6,8.4±0.5)高于槲皮素干预组[(5.7±0.3,5.4±0.3);P均< 0.01]和空白对照组[(6.1±0.1,5.6±0.4);P均< 0.01]。结论 大鼠肾移植时在给予BMSCs注射的同时给予槲皮素干预,可有效地抑制免疫排斥反应,改善肾功能;JAK/STAT3/TGF-β1可能参与了槲皮素诱导的免疫调节。
槲皮素; 骨髓; 间充质干细胞; 肾移植; 免疫耐受
器官移植后需要机体长期呈现免疫抑制状态,以保证移植器官的存活。免疫抑制剂可抑制机体对移植器官的免疫反应,因此广泛应用于临床。然而,传统的免疫抑制剂可导致机体非特异性免疫抑制,长期使用可引起感染、肿瘤等并发症,严重时危及生命[1]。目前临床中普遍使用的免疫抑制方案并不能解决慢性排斥反应导致的移植物功能进行性丧失。除此之外,长期使用免疫抑制剂时患者常由于药物毒性耐受性较差,影响了患者的依存性。由此可见,为了进一步提高器官移植的治疗效果,需要不断寻求新的治疗方案,以避免长期应用免疫抑制所引起的副反应、器官移植后的急性排斥反应和慢性移植物失功。因此,如何诱导移植后的免疫耐受,以期进一步提高器官移植的治疗效果,正逐渐得到广泛关注。
免疫排斥反应主要由T细胞介导,成年受体中含有大量的成熟T细胞,若要成功形成混合嵌合体,达到免疫耐受的目的,则必须首先清除受体中成熟的T细胞[2]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是骨髓中的非造血细胞集落,具有低免疫原性、免疫抑制的特性[3-4]。研究发现,人肾移植供者来源的脂肪间充质干细胞在体外能显著抑制受体—供体的混合淋巴细胞反应,显著抑制肾移植受体移植前和移植后T细胞的增殖。已有研究表明,联合肾—骨髓联合移植可诱导大鼠免疫耐受:在大鼠肾移植时连续给予1× 107个细胞浓度的BMSCs可诱导受体免疫耐受[1]。近10年来,非清髓性干细胞移植已在临床中广泛应用,该方法能够通过建立混合嵌合体,使受体产生特异性免疫耐受的同时,保留自身免疫功能[2]。
槲皮素(quercetin,Que)是一类广泛分布于被子植物花叶部分的黄酮类化合物,研究发现槲皮素具有包括免疫调节在内的多方面作用。活化T淋巴细胞产生的IL-2的免疫放大效应是急性免疫排斥反应发生的重要机制,槲皮素能够抑制T细胞的增殖,从而减少IL-2产生[5]。TGF-β1是重要的免疫调节因子,参与多个生物过程,其过度表达可在多种肾病下引起不可逆的肾间质纤维化[6-9]。移植肾后肾功能进行性丧失的患者,TGF-β1表达明显升高[6]。JAK是STAT的上游共有激酶,STAT3是一条重要的跨膜信号转导途径,STAT3异常活化可引起多种下游基因的异常表达,引起肾脏病变[7]。JAK-STAT信号通路可转导多种其他细胞因子、甚至非免疫介质的细胞内信号,涉及免疫、细胞凋亡、炎症等多种病理生理过程[7]。已有研究表明,槲皮素能够明显降低血液中STAT3及TGF-β1蛋白表达水平,改善缺血肾、肝、脑等多器官的功能,但目前对槲皮素影响BMSCs诱导肾移植免疫耐受的作用尚未有研究[10-11]。基于槲皮素药理作用广泛,本研究以肾移植大鼠作为研究对象,研究槲皮素通过调节JAK/STAT3及TGF-β1信号通路对BMSCs诱导肾移植免疫耐受的影响,深入研究槲皮素调节肾移植免疫功能的作用机制。
材料与方法
一、材料
SD大鼠20只,9~11周龄,体质量240~280 g,作为供体;另取成年雄性Wistar大鼠20只,9~11周龄,体质量250~300 g,作为受体。另外5只5周龄雄性SD大鼠用作提取BMSCs。实验动物由山西医科大学实验动物中心提供。主要试剂包括低糖DMEM培养基(美国Hyclone公司),胎牛血清(美国Gibco公司),lipofectamine 2000(lipo2000,美国Invitrogen公司),STAT3的干扰RNA(si-STAT3,广州锐博公司),STAT3的过表达质粒(吉凯基因公司)。
二、方法
1.分组:将20只大鼠随机分为 4 组,每组5只。对照组,仅进行单纯肾移植,未给予药物治疗;BMSC组:关腹前左骼静脉注射1×107/kg BMSCs,第2天起尾静脉注射等量细胞,治疗共持续10 d;MSC+高/低槲皮素干预组:除给予BMSCs外,以100或50 mg/kg槲皮素溶液灌胃,共10 d。
2.大鼠BMSCs的分离与培养:将SD大鼠颈椎脱臼处死后无菌条件下取胫骨和股骨,保持骨髓腔无菌封闭状态置于体积分数75﹪乙醇浸泡3 min,洗去多余的组织,用注射器抽取4 ml DMEM培养液,穿刺入骨髓腔,反复冲洗骨髓3~5次,收集至15 ml离心管,制成细胞悬液,离心半径8 cm,1 000 r/min,离心5 min,弃去上清液;用含体积分数20﹪胎牛血清培养基重悬细胞,以1× 107个接种于培养瓶中,置于37 ℃,体积分数5﹪的CO2饱和湿度的培养箱培养。取第3代生长状态良好的细胞进行实验。
3.建立大鼠肾移植模型:麻醉大鼠后,游离左右肾,腹主动脉插入灌注针,匀速灌注含肝素钠的肾保养液,分离出双肾,置于4 ℃生理盐水保存,将双肾移植至肾脏已被切除的大鼠体内,缝合血管。
4.肾移植后大鼠肾小管上皮细胞原代细胞分离与培养[12-13]:采用肾小管节段贴块法分离肾小管上皮细胞原代细胞,可观察到上皮样细胞从节段周边长出。待细胞呈指数性增长达到80﹪~ 90﹪融合时,进行传代,取第3代生长状态良好的细胞进行实验。
5.肾移植后大鼠肾小管上皮细胞原代细胞转染及分组:(1)干扰RNA转染:细胞生长至30﹪即可进行转染。无血清DMEM培养基稀释1 μg siRNA,室温孵育5 min,无血清DEME培养基稀释3 μl lipofectamine 2 000,室温孵育5 min,上述液体轻柔混匀并于室温孵育15 min,培养细胞6~8 h后使用10﹪胎牛血清的培养基给细胞换液,继续培养过夜后加入适当刺激条件。实验分组:正常对照组,槲皮素干预组,空白对照组,si-STAT3组;(2)过表达STAT3转染:细胞生长至30﹪即可进行转染。无血清DMEM培养基稀释1 μg质粒,室温孵育5 min,无血清DEME培养基稀释3 μl lipofectamine 2 000,室温孵育5 min,上述液体轻柔混匀并于室温孵育15 min,培养细胞6~8 h后使用10﹪胎牛血清的培养基给细胞换液,继续培养过夜后加入适当刺激条件。实验分组:正常对照组,槲皮素干预组,空白对照组,过表达STAT3组。
6.主要观察指标:使用Western blot检测大鼠肾组织中JAK、STAT3,以及原代肾小管上皮细胞中JAK、STAT3、p-STAT3、TGF-β1的蛋白相对表达量。酶联免疫吸附法检测大鼠血清中TGF-β1水平。
三、统计学分析方法
使用SPSS 19.0软件进行数据分析,大鼠血清中ELISA测定TGF-β1蛋白表达水平,大鼠肾组织中各蛋白及细胞实验部分各蛋白相对表达量均符合正态分布、方差齐性,以±s表示,采用单因素方差分析比较各组间数据差异,组间数据两两比较采用SNK-q检验,以P < 0.05为差异有统计学意义。
结 果
1.实验动物数量分析:纳入大鼠23只,成功率为87﹪,建模成功20只,建模失败3只,最终进入结果分析20只。
2.分离培养的大鼠BMSCs形态:原代细胞培养1周后,细胞由圆形逐渐变为多角形,梭形,形成细胞集落。培养2周时,梭形细胞逐渐变长,增多,呈漩涡状生长,细胞边界逐渐联合不清,浓度达到80﹪~ 90﹪融合,此为原代细胞(P0)。第3代(P3)时多以梭形细胞为主,细胞形态均一。
3.肾移植后大鼠血清中TGF-β1蛋白的表达:采用ELISA法检测肾移植后大鼠血清中TGF-β1蛋白表达水平。结果显示,对照组中TGF-β1明显高于其他各组(P < 0.01);两种剂量的槲皮素干预组中TGF-β1明显低于BMSC组(P < 0.01);槲皮素剂量高低并未明显影响TGF-β1表达(P = 0.28,表1)。

表1 肾移植后大鼠血清中TGF-β1蛋白的表达
4.肾移植后大鼠肾脏中JAK/STAT3的蛋白表达水平:采用Western blot法检测肾移植后大鼠肾脏中JAK/STAT3的蛋白表达水平,结果显示,对照组肾组织中JAK、p-STAT3的蛋白相对表达量(1.5±0.2,10.7±0.5)均高于其他各组[BMSC组(0.9±0.3,8.5±0.2;q = 5.262,q = 15.75;P均< 0.01)、MSC+高槲皮素干预组(0.7±0.2,6.1±0.3;q = 7.016,q = 32.94;P均< 0.01)、MSC+低槲皮素干预组(0.7± 0.3,5.8±0.1;q = 7.016,q = 35.09;P均 < 0.01)]。MSC+高/低槲皮素干预组p-STAT3蛋白表达均低于BMSC组(q = 17.19,q = 19.34;P均< 0.01),JAK蛋白表达与BMSC组相比差异无统计学意义(q = 1.745,q = 1.745;P均> 0.05);在分别联合不同剂量槲皮素干预后,两组间JAK、p-STAT3蛋白表达水平差异无统计学意义(q = 0,q = 2.148;P均> 0.05)。各组间STAT3蛋白表达差异无统计学意义(F = 0.7901,P > 0.05,图1)。

图1 肾移植后大鼠肾脏中JAK/STAT3的蛋白表达(n = 4)
5. BMSCs联合肾移植大鼠肾小管上皮细胞中抑制JAK/STAT3后TGF-β1的表达:使用STAT3的干扰RNA转染肾小管上皮细胞,予以槲皮素干预后,检测细胞中JAK和TGF-β1表达。结果显示,转染si-STAT3后,si-STAT3组中STAT3表达减少70﹪,p-STAT3表达减少91﹪。转染si-STAT3后,si-STAT3组与槲皮素干预组和空白对照组相比,JAK表达差异无统计学意义;干扰STAT3组中p-STAT3和TGF-β1蛋白相对表达量(0.7±0.1,0.3±0.1)均少于其他各组[对照组(8.2±0.4,7.1± 0.5;q = 50.71,q = 35.72;P均< 0.01)、槲皮素干预组(5.6±0.3,4.8±0.4;q = 33.13,q = 23.64;P均 < 0.01)、空白对照组(5.7±0.3,4.5±0.4;q = 33.81,q = 22.06;P均< 0.01),图2]。
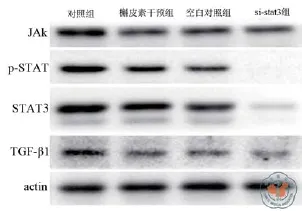
图2 骨髓间充质干细胞联合肾移植大鼠肾小管上皮细胞中抑制JAK/STAT3后TGF-β1的表达(n = 4)
6. BMSCs联合肾移植大鼠肾小管上皮细胞中过表达JAK/STAT3后TGF-β1的表达:使用STAT3的过表达质粒转染肾小管上皮细胞后,再予以槲皮素干预,检测细胞中JAK和TGF-β1表达。结果显示,过表达STAT3时,过表达STAT3组中p-STAT3和TGF-β1蛋白相对表达量(10.5± 0.6,8.4±0.5)高于槲皮素刺激组[(5.7±0.3,5.4± 0.3);q = 27.59,q = 14.70;P均< 0.01]和空白对照组 [(6.1±0.1,5.6±0.4);q = 25.29,q = 13.72;P均< 0.01,图3]。
讨 论
间充质干细胞主要存在于骨髓组织中,具有自我更新、横向分化和免疫调节功能。近年来在各种创伤修复、组织功能重建的研究领域中,BMSCs具有广泛的应用前景。器官移植后需要机体长期呈现免疫抑制状态,以保证移植器官的存活。移植具有低免疫原性、免疫抑制特性的BMSCs能够通过建立混合嵌合体,使受体产生特异性免疫耐受的同时,保留自身免疫功能[14]。

图3 骨髓间充质干细胞联合肾移植大鼠肾小管上皮细胞中过表达JAK/STAT3后TGF-β1的表达(n = 4)
槲皮素具有包括免疫调节在内的多方面作用,能够通过减少IL-2从而抑制急性免疫排斥反应的发生[5]。TGF-β1是肾脏中表达最多的一种TGF-β异构体,由肾小球和肾小管的上皮细胞分泌,是TGF-β家族中最具特征性的分子。TGF-β1是重要的免疫调节因子,参与多个生物过程,特别是其过度表达与组织纤维化密切相关;当肾出现氧化应激损伤时,TGF-β1表达也明显增加。TGF-β1是各种肾病肾小球硬化和肾间质纤维化发生发展的必要因子[6]。
本次研究发现,在实验中肾移植后的大鼠给予BMSCs治疗后,TGF-β1的蛋白表达显著低于对照组,提示BMSCs在肾移植大鼠体内可下调大鼠体内TGF-β1的表达,推测其原因可能是BMSCs移植诱导了免疫耐受。实验同时给予BMSCs和槲皮素后,TGF-β1的蛋白表达明显低于单给予BMSCs的大鼠,提示槲皮素能够进一步促进BMSCs移植引起的免疫耐受。
JAK激酶与其下游的 STAT组成了重要的信号途径。在肾脏损伤中可有 STAT3蛋白的异常激活[7]。STAT3蛋白主要通过酪氨酸磷酸化被激活,是JAK的底物,能够诱导某些与免疫、细胞凋亡、炎症等多种生理、病理生理过程密切相关的关键基因产物的表达,通过各种途径影响肾脏的功能。
研究结果显示,肾-BMSCs联合移植后肾组织中JAK、p-STAT3表达较对照组减低,提示BMSCs可能通过影响JAK蛋白的表达水平进而影响JAK/ STAT3信号通路发挥诱导免疫耐受的作用。予以槲皮素处理后,肾组织中p-STAT3表达进一步减低,而JAK和STAT3蛋白表达未受影响,这一结果提示槲皮素刺激可能通过抑制STAT3蛋白激酶的活化起到抑制JAK/STAT3信号通路的作用,而槲皮素对JAK的表达并无影响。
为了进一步探讨槲皮素作用靶点,明确是否通过作用于STAT3影响其信号通路,分离BMSCs联合肾移植后大鼠肾小管上皮细胞进行细胞学实验。发现槲皮素刺激可抑制STAT3蛋白的磷酸化,以及TGF-β1的表达减少,而对JAK蛋白表达无影响;在干扰STAT3蛋白表达后予以槲皮素刺激时,TGF-β1的表达呈现进一步减少;当STAT3蛋白过表达时,予以槲皮素刺激后发现TGF-β1表达有所增加。综合这一结果考虑,认为在BMSCs联合肾移植后,槲皮素诱导免疫耐受主要是通过抑制STAT3蛋白激酶的活化进行的。这一结果与动物实验观察结果相一致。Li等[15]发现,在克罗恩病中,STAT3能够与被IL-6激活,引起TGF-β1表达增加,提示克罗恩病中,由于免疫异常可能出现多种分子调控网络。Kinjyo等[16]发现激活的STAT3能够结合于TGF-β1启动子,当STAT3激活后,促进了TGF-β1的表达。本次研究中发现,磷酸化STAT3表达水平与TGF-β1表达水平相一致,提示在BMSCs治疗肾移植后的肾小管上皮细胞中,TGF-β1表达水平可能受到STAT3的调控。是否STAT3能够直接影响TGF-β1表达,仍需进一步研究。
总之,本次实验首次对槲皮素联合BMSCs治疗肾移植后的免疫排斥反应进行研究,发现槲皮素能促进BMSCs更有效地进行免疫调节,达到免疫耐受,减少肾慢性损伤的发生,保护肾功能。
1 Sykes M. Immune tolerance in recipients of combined haploidentical bone marrow and kidney transplantation[J]. Bone Marrow Transplant, 2015, 50(2):S82-S86.
2 Casiraghi F, Cortinovis M, Perico NA. Recent advances in immunosuppression and acquired immune tolerance in renal transplants [J]. Am J Physiol Renal Physiol, 2016, 310(6):F446-F453.
3 陈选才, 李建军. 免疫耐受的研究现况及在肾移植中的应用[J]. 社区医学杂志, 2014, 12(23):20-23.
4 陈正. BM-MSC诱导移植免疫耐受和修复慢性移植肾损伤的初步研究[D]. 长沙: 中南大学, 2013.
5 骆明旭, 罗丹, 赵万红. 槲皮素药理作用研究进展[J]. 中国民族民间医药, 2014 (17):12-14.
6 罗皓. TGFβ1-ILK下游信号分子及C-C类趋化因子在慢性移植肾失功发病机制中的作用及其意义的研究[D]. 广州: 南方医科大学,2013.
7 郭虹,马宏,殷爱云.肾间质损伤早期信号蛋白JAK-2/STAT-3与TGF-β-1表达趋势及相关性[J].临床医药实践杂志, 2008, 17(12): 963-965.
8 王平贤, 方丽, 黄赤兵, 等. 移植肾TGF-β1表达与远期肾功能关系的临床研究[J]. 医学临床研究, 2005, 22(1):1-4.
9 王平贤, 黄秀英, 王安静, 等. 移植肾转化生长因子β1与远期肾功能的关系[J]. 中南大学学报(医学版), 2004, 29(6):700-703.
10 陈娇, 张蔚, 敖良飞, 等. 槲皮素对宫颈癌HeLa 细胞STAT3的表达及其信号通路的影响[J/CD]. 中华临床医师杂志:电子版, 2011, 5(19):5656-5661.
11 郝惠惠, 邵珠民, 杜倩, 等. 槲皮素对糖尿病大鼠氧化应激及TGF-β1/ CTGF的影响[J]. 中国医院药学杂志, 2012, 32(13): 1012-1016.
12 杜胜华, 唐德燊, 刘华锋. SD大鼠肾小管上皮细胞两种原代培养及传代方法的比较[J]. 广东医学院学报, 2005, 23(1):10-13.
13 王光兰, 陈爽, 张丽红, 等. 大鼠近端肾小管上皮细胞的原代培养和鉴定[J]. 中国老年学杂志, 2010, 30(3):334-336.
14 王耘川. BMSCs联合骨髓移植建立嵌合体并诱导免疫耐受形成的机制研究[D]. 西安: 第四军医大学, 2012.
15 Li C, Iness A, Yoon J, et al. Noncanonical STAT3 activation regulates excess TGF-β1 and collagen I expression in muscle of stricturing Crohn's disease[J]. J Immunol, 2015 194 (7):3422-3431.
16 Kinjyo I, Inoue H, Hamano S, et al. Loss of SOCS3 in T helper cells resulted in reduced immune responses and hyperproduction of interleukin 10 and transforming growth factor-beta 1[J]. J Exp Med, 2006, 203(4):1021-1031.
杨军,陈花,石韶华,等. 槲皮素对骨髓间充质干细胞移植联合肾移植所诱导的免疫耐受的影响[J/CD].中华细胞与干细胞杂志(电子版), 2017, 7(1):23-28.
Effects of quercetin on immune tolerance induced by bone marrow mesenchymal stem cells in kidney transplantation
Yang Jun, Chen Hua, Shi Shaohua, Ma Y ongwen, Wang Zhenxing, Wu Xiaotong. Kidney Tranplant Center of the Second People's Hospital of Shanxi Pr ovince, Taiyuan 030012, China
Yang jun, Email: yj240026293@163.com
ObjectiveThe study was to investigate the effects of different concentrations of quercetin on bone marrow mesenchymal stem cells(BMSCs)-induced immune tolerance in rats after kidney transplantation.Methodshe rats were randomly divided into four groups after kidney transplantation: control group, BMSCs group, MSC+ low-dosage quercetin group and MSC+ high-dosage quercetin group. Janus-activated kinase(JAK), Signal transducer and activator of transcription 3(STAT3), p-STAT3 protein expression in kidney tissue were detected by Western blot. Serum transforming growth factor-β1(TGF-β1)was detected by ELISA assay. We collected the proximal tubule epithelial cells from the MSC group, and cultured them with or without stimulation of quercetin. Expressions of JAK, STAT3, p-STAT3, and TGF-β1 were detected by Western blotafter STAT3 was inhibited and overexpressed in these cells, respectively.ResultsAfter kidney transplantation, TGF-β1 in serum in the control group(19 162±223)pg/ml was higher than any of other groups(BMSC group, 12 106±163 pg/ml; MSC+ high dosage of quercetin groups, 9 113±110 pg/ml; MSC+ low dosage of quercetin groups, 9 024±133 pg/ml). When compared to the control group, the q values of these groups were 96.88, 138.0, 139.2, respectively(P < 0.01). Protein expression of JAK and p-STAT3 in the kidney tissue(1.5±0.2, 10.7±0.5)were significantly higher in control group than in the other groups: BMSC group(0.9±0.3, 8.5±0.2; P = 0.0059), MSC+ high dosage of quercetin groups(0.7±0.2, 6.1±0.3; P = 0.0002), and MSC+ low dosage of quercetin groups(0.7±0.3, 5.8±0.1; P = 0.0011). In group with inhibition of STAT3, relative protein expression of p-STAT3 and TGF-β1(0.7±0.1, 0.3±0.1)in the proximal tubule epithelial cells were significantly reduced compared to the other groups: control group(8.2±0.4, 7.1±0.5; P < 0.0001, P < 0.0001), quercetin group(5.6±0.3, 4.8±0.4; P < 0.0001, P < 0.0001), and si-control group(5.7±0.3, 4.5±0.4; P < 0.0001, P < 0.0001). In group with overexpression of STAT3, relative protein expression of p-STAT3 and TGF-β1(10.5±0.6, 8.4±0.5)were significantly higher than those in the quercetin group(5.7±0.3,5.4±0.3; P < 0.0001, P < 0.0001)and vector plasmid group(6.1±0.1, 5.6±0.4; P < 0.0001, P = 0.0001).ConclusionSimultaneous administration of quercetin and transplantation of bone marrow mesenchymal stem cells can effectively inhibit rejection and improve renal function in rats with kidney transplantation. Quercetin may regulate immune function through JAK/STAT3/ TGF-β1 pathway.
Quercetin; Bone marrow; Mesenchymal stem cells; Kidney transplantation; Immune tolerance
10.3877/cma.j.issn.2095-1221.2017.01.005
030012 太原,山西省第二人民医院肾移植中心
杨军,Email:yj240026293@163.com

