骨髓间充质干细胞上清液对肾移植术后切口愈合不良的疗效观察
林琴 徐艳 林丽丽 陈书尚 杨顺良
·论著·
骨髓间充质干细胞上清液对肾移植术后切口愈合不良的疗效观察
林琴 徐艳 林丽丽 陈书尚 杨顺良
目的 观察间充质干细胞(BMSCs)上清液治疗肾移植术后切口愈合不良的临床疗效。方法 选择2012年6月至2015年6月南京军区福州总医院泌尿外科异体肾移植术后发生切口愈合不良的患者28例,随机分为观察组和对照组,对照组予抗感染、换药等常规处理;观察组在对照组所采取治疗措施的基础上,采用BMSCs上清液喷涂创面。记录并比较两组患者的总VAS疼痛评分、换药次数、创面新鲜时间和切口愈合时间,统计学方法分别采用成组t检验、秩和检验或卡方检验。结果 两组患者切口均完全愈合,观察组平均VAS疼痛评分(3.1±1.8 vs 4.6±1.9)、换药次数(10.6±3.2 vs 15.1±3.9)、创面新鲜时间[(7.2±1.8)d vs(9.1±2.1)d]和切口愈合时间[(16.6±1.4)d vs(19.1±2.1)d]均明显低于对照组(P均< 0.05)。观察组液化切口创面新鲜时间[(6.3±0.7)d vs(8.3±1.1)d]和切口愈合时间[(15.9±1.0)d vs(18.3±1.1)d]、感染切口的创面新鲜时间[(8.5±2.1)d vs(12.3±1.5)d]和切口愈合时间[(17.7±1.2)d vs(22.3±1.5)d]也明显短于对照组(P均< 0.05)。结论 BMSCs上清液喷涂创面可减少切口渗液,促进肉芽生长,缩短切口愈合时间,减轻患者痛苦,是治疗肾移植术后切口愈合不良的有效方法,值得临床推广应用。
骨髓; 间质干细胞; 伤口愈合; 肾移植
肾移植术后切口感染和愈合不良发生率较高[1]。切口愈合不良既延长了患者住院时间,增加了患者痛苦和医疗费用,也增加了医生的治疗压力。2012年6月至2015年6月,南京军区福州总医院泌尿外科采用体外培养的人骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)上清液喷涂创面治疗肾移植术后切口愈合不良,收到良好效果,现报告如下。
资料与方法
一、一般资料
选择于2012年6月至2015年6月南京军区福州总医院泌尿外科行异体肾移植、术后发生切口愈合不良的患者共28例,年龄24~61岁,中位年龄(36.0±10.9)岁。女11例,男17例。尿毒症病程1~9年,平均(4.8±2.9)年。原发病为肾小球肾炎12例,肾病综合征8例,糖尿病肾病3例,高血压肾病3例,多囊肾2例。手术方式均为右侧腹直肌旁切口,术后免疫抑制方案为吗替麦考酚酯(骁悉)+他克莫司(普乐可复)+醋酸泼尼松。切口愈合不良具体为:发生切口脂肪液化19例,表现为切口有较多淡黄色液体渗出,皮下渗液中含有漂浮脂肪滴;发生切口感染9例,表现为切口及周围红肿、局部有压痛,切口处有脓液或淡黄色液体渗出。28例患者按完全随机法分为观察组和对照组(每组各14例),两组患者在尿毒症病程、年龄、性别、体重指数和手术时间等方面比较差异均无统计学意义(P均> 0.05,表1)。
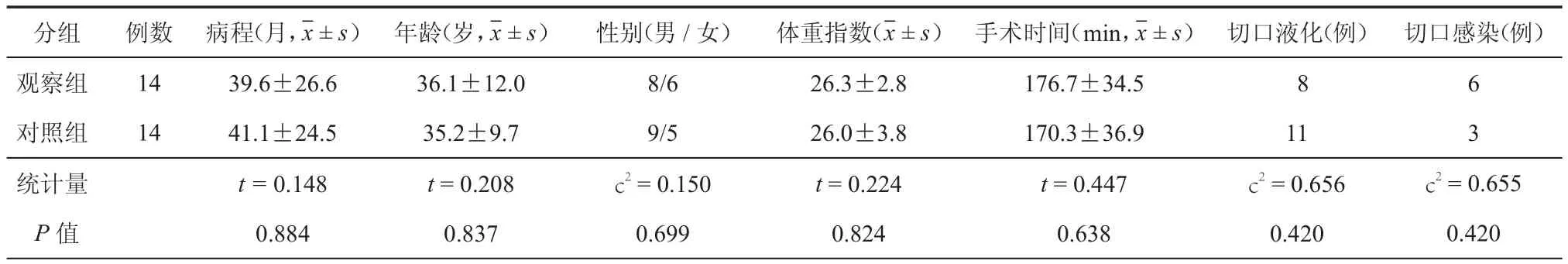
表1 两组肾移植术后发生切口愈合不良患者一般情况的比较
二、方法
1. BMSCs上清液收集:本研究采用的BMSCs上清液由我科实验室提供[2]。BMSCs按常规方法体外培养、传代。取第4代BMSCs,当细胞长到90﹪融合时,将细胞培养瓶中上清液收集于无菌瓶中,至于4 ℃冰箱保存待用。保存时间不超过12 h。
2.治疗方法:对照组:先拆除其全部或部分皮内及皮下缝线,清除坏死组织,使用3﹪双氧水和生理盐水清洗伤口,覆盖无菌敷料。以后每天评估切口,外层敷料湿透时给予及时更换敷料。同时使用广谱抗生素或选择敏感抗生素防治感染。待创面新鲜、肉芽组织生长良好后,再进行2次缝合。观察组:在对照组所采取治疗措施的基础上,每日无菌换药时,将10 ml体外培养的第4代BMSCs上清液混匀后,均匀喷涂于创面,再覆盖无菌敷料。
3.观察指标:记录并比较两组患者的如下指标:(1)患者总疼痛评分:从切口敞开到2次缝合前,每天固定时间采用视觉模拟VAS评分评估患者切口疼痛程度:0分为无痛,10分为最痛,1~3为轻度疼痛,4~6为中度疼痛,7~10为重度疼痛;(2)换药次数:从切口敞开到2次缝合前的总换药次数;(3)创面新鲜时间:从切口敞开到创面新鲜、肉芽组织生长良好,可开始进行2次缝合的时间;(4)切口愈合时间:从切口敞开到切口完全愈合的时间。
三、统计学分析方法
应用SPSS 16.0统计软件进行数据的统计处理。两组间病程、年龄、体重指数、手术时间VAS评分、换药次数、创面新鲜时间和切口愈合时间用±s表示,采用成组t检验,两组患者的性别、切口液化和切口感染发生率的比较采用卡方检验,以P < 0.05为差异有统计学意义。
结 果
一、总体治疗效果
两组患者治疗后,切口都完全愈合后出院。观察组患者在使用BMSCs上清液后,其切口渗出减少速度和肉芽生长速度较快。如表2所示,观察组平均VAS疼痛评分、换药次数、创面新鲜时间和切口愈合时间均明显低于对照组,差异有统计学意义(P均< 0.05)。
表2 两组肾移植术后发生切口愈合不良的患者治疗结果比较(±s)
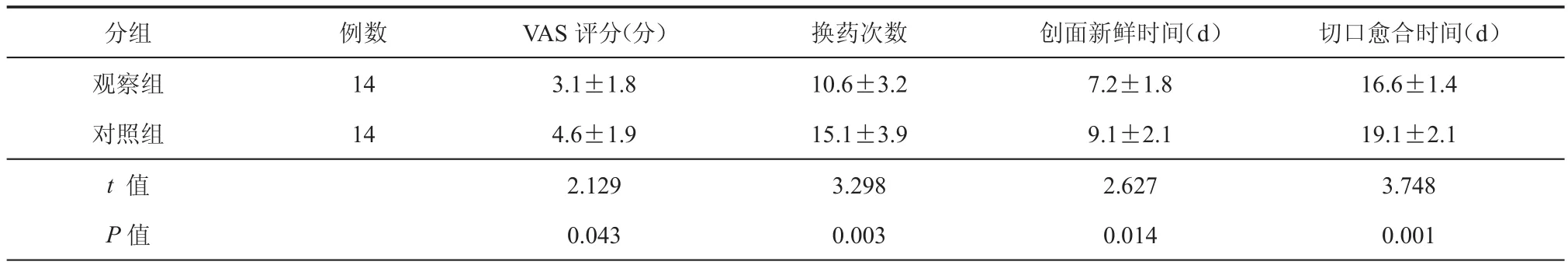
表2 两组肾移植术后发生切口愈合不良的患者治疗结果比较(±s)
分组 例数 VAS评分(分) 换药次数 创面新鲜时间(d) 切口愈合时间(d)观察组 14 3.1±1.8 10.6±3.2 7.2±1.8 16.6±1.4对照组 14 4.6±1.9 15.1±3.9 9.1±2.1 19.1±2.1 t 值 2.129 3.298 2.627 3.748 P值 0.043 0.003 0.014 0.001
二、液化切口治疗效果
如图1所示,观察组液化切口的创面新鲜时间[(6.3±0.7)d vs(8.3±1.1)d]和切口愈合时间[(15.9±1.0)d vs(18.3±1.1)d]均明显短于对照组(P均< 0.01)。
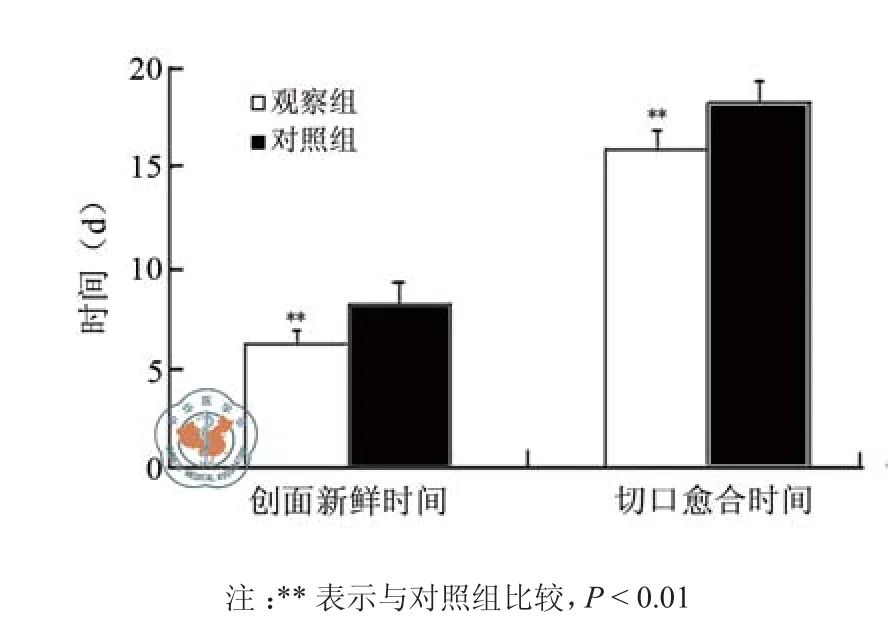
图1 两组肾移植术患者脂肪液化切口愈合情况比较
三、感染切口治疗效果
如图2所示,观察组感染切口的创面新鲜时间(8.5±2.1)d vs(12.3±1.5)d和切口愈合时间(17.7±1.2)d vs(22.3±1.5)d也明显短于对照组(P均< 0.05)。
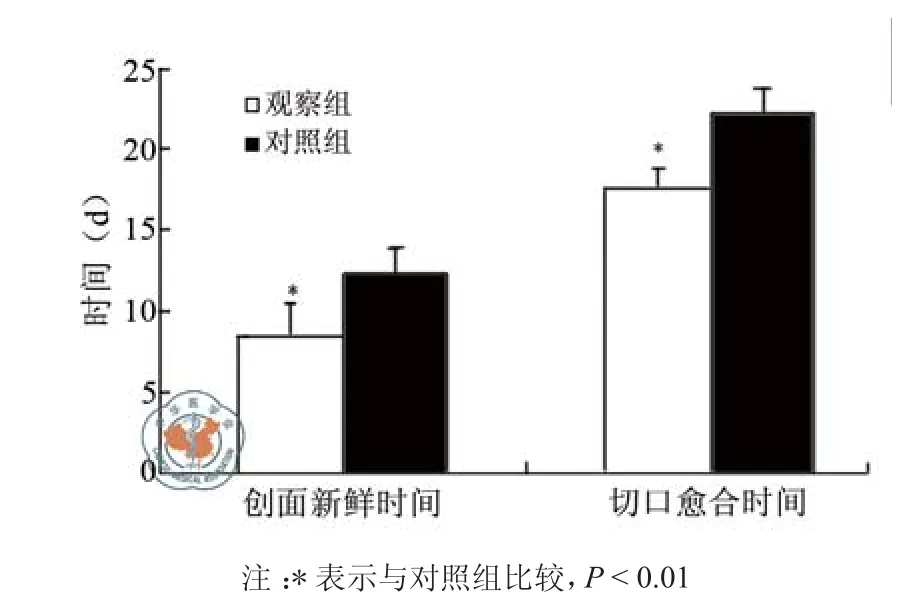
图2 两组肾移植术患者感染切口愈合情况比较
讨 论
切口愈合不良是肾移植术后的常见并发症之一,极易引发医患纠纷[1,3]。造成肾移植术后切口不良的主要原因包括[3-6]:尿毒症患者营养状况差、血清白蛋白普遍低下,组织细胞再生不良或缓慢,肉芽组织生长缓慢,切口愈合能力差;手术时间长,创伤大,术中肝素的使用致创面容易渗血,特别是止血不彻底时,术后易发生皮下渗血,影响愈合甚至引起感染;术后激素等免疫抑制剂导致切口组织生长缓慢;免疫功能低下,抵抗力减弱,易发生感染,影响切口愈合;部分患者肥胖,皮下脂肪组织多,血液供应相对较少,创面局部的血液循环差,且脂肪组织易发生氧化分解,导致切口脂肪液化。
由于肾移植术后切口愈合能力差,一旦出现切口愈合不良,处理较为棘手。研究已经证实,BMSCs具有促进创面愈合的作用[7-8]。其机制除了BMSCs能在伤口愈合中分化为其他细胞外[9-10],更重要的是,BMSCs旁分泌的一些可溶性因子可调控局部细胞反应,在促进创面愈合方面可能发挥了更大作用[11-12]。研究发现,BMSCs分泌的与血管形成有关的细胞因子很多,包括VEGF、FGF、TGF-β、促红细胞生成素等。这些生长因子可刺激内皮祖细胞的动员、扩增及分化,促进新生血管形成。其中VEGF还可诱导内皮细胞表达蛋白水解酶、间质胶原酶及组织因子而促进血管形成。此外,BMSCs还可分泌基质金属蛋白酶,后者在细胞迁移和组织重塑方面具有重要作用[11-12]。这些研究表明,单独使用BMSCs上清液而不是BMSCs,也可能修复受损组织,促进切口愈合。冯鹏等[13]研究证实了这一推论。但目前临床上采用BMSCs上清液来治疗切口愈合不良的研究甚少。
本研究所采用的BMSCs上清液来自体外培养的第4代异体人BMSCs,此时细胞已纯化且增殖旺盛,推测具有较高浓度的可溶性细胞因子[14-15]。本研究结果表明,BMSCs上清液可减少切口渗液,促进肉芽生长,因而观察组切口愈合时间明显短于对照组;相应的总患者VAS疼痛评分和换药次数明显低于对照组。本研究还发现,观察组液化切口与感染切口的创面新鲜时间、切口愈合时间均明显短于对照组,说明BMSCs上清液对于液化切口和感染切口均适用,能显著促进切口愈合。此外,与采用BMSCs移植相比,上清液取材方便,没有伦理道德以及法律上的限制,且使用简便,减轻患者痛苦,是治疗肾移植术后切口愈合不良的有效方法,值得临床推广应用。
1 刘航, 梁思敏, 吴小候. 0.2T永磁速愈贴促进肾移植术后切口愈合的疗效观察[J]. 重庆医科大学学报, 2009, 34(5):656.
2 Tan J, Wu W, Xu X, et al. Induction therapy with autologous mesenchymal stem cells in living-related kidney transplants:a randomized controlled trial[J]. JAMA, 2012, 307(11):1169-1177.
3 宋金华. 肾移植术后切口脂肪液化的护理[J]. 中国医药指南, 2013, 11(21):359-360.
4 李丹. 浅谈普外科手术患者发生术后切口愈合不良的原因及处理方法[J]. 当代医药论丛, 2015, 13(1):189-190.
5 Knight RJ, Villa M, Laskey R, et al. Risk factors for impaired wound healing in sirolimus-treated renal transplant recipients[J]. Clin Transplant, 2007, 21(4):460-465.
6 Filocamo MT, Zanazzi M, Marzi VL, et al. The approach by midline incision for extraperitoneal kidney transplantation[J]. Transplant Proc, 2007, 39(10):3077-3080.
7 Wu Yaojiong, Zhao C, Tredget E. Concise review: bone marrowderived stem/progenitor cells in cutaneous repair and regeneration[J]. Stem Cells, 2010, 28(5):905-915.
8 胡冰, 王春芳, 雷晋, 等. 骨髓间充质干细胞与皮肤组织块共培养影响创面愈合的研究[J/CD]. 中华临床医师杂志(电子版), 2015, 9(10):115-119.
9 钟晓红, 王明刚, 赵李平, 等. 骨髓间充质干细胞在糖尿病创面中向皮肤腺上皮的分化[J]. 中国组织工程研究与临床康复, 2010, 14(6):1019-1022.
10 周伟, 徐艳华, 吴小翎, 等. 大鼠骨髓间充质干细胞向肌成纤维母细胞的体内诱导[J]. 中国生物制品学杂志, 2011, 24(5):561-565.
11 Moreau JE, Chen J, Bramono DS, et al. Growth factor induced fibroblast differentiation from human bone marrow stromal cells in vitro[J]. J Orthop Res, 2005, 23(1):164-174.
12 Kim Han, Lee Hyun, Won Ho, et al. Mesenchymal stem cells improve wound healing in vivo via early activation of matrix metalloproteinase-9 and vascular endothelial growth factor[J]. J Korean Med Sci, 2011, 26(6):726-733.
13 冯鹏, 李光来, 王飞. 骨髓间充质干细胞上清液治疗大鼠脑缺血的作用机制[J]. 中西医结合心脑血管病杂志, 2008, 6(3):292-294.
14 许键炜, 申长清, 赵芳芳, 等. 同源异体间充质干细胞上清液干预大鼠佐剂性关节炎[J]. 贵阳医学院学报, 2013, 38(4):339-343.
15 Ma ling, Liu ding, Li chun, et al. Human mesenchymal stem cells increases expression of α-tubulin and angiopoietin 1 and 2 in focal cerebral ischemia and reperfusion[J]. Curr Neurovasc Res, 2013, 10(2):103-111.
Human bone marrow mesenchymal stem cell supernatant promotes surgical incision healing in patients receiving renal transplantation
Lin Qin, Xu Yan, Lin Lili, Chen shushang, Yangshunliang. Department of Urology, Fuzhou General Hospital, Fuzhou 350025,China Corresponding author: Lin Qin, Email:841739771@qq.com
ObjectiveTo evaluate the effect of human bone marrow mesenchymal stem cell(BMSC) supernatant on healing of incision in patients receiving renal transplantation.MethodsFrom June 2012 to June 2015, a total of 28 patients with wound healing after renal transplantation in the Department of Urology in Fuzhou General Hospital were enrolled and randomized into two groups(n =14 both). The patients in the control group received standard treatment, including anti-infection and change of dressing. The patients in the BMSC group received additional treatment with the supernatant of BMSC. The total VAS pain scores, times of dressing change, time of returning fresh of incision surface and incision healing time were compared between groups.ResultsAll incisions in both groups healed after the treatment. Compared with the control group, the BMSC group had significant lower total VAS pain scores(3.1±1.8 vs 4.6±1.9, P < 0.05), fewer dressing changes(15.1±3.9 vs 10.6±3.2, P < 0.05), shorter time of returning fresh of incision surface[(7.2±1.8)d vs(9.1±2.1)d, P < 0.05]and incision healing time[(16.6±1.4)d vs (19.1±2.1)d, P < 0.05]. The observation group also had shorter time of returning fresh of incision surface [(6.3±0.7)d vs(8.3±1.1)d, P < 0.05] and incision healing time[(15.9±1.0)d vs(18.3±1.1)d, P < 0.05] for the liquefied incisions, as well as shorter time of returning fresh of incision surface[(8.5±2.1)d vs(12.3±1.5)d, P < 0.05] and incision healing time[(17.7±1.2)d vs(22.3± 1.5)d, P < 0.05]for the infected incisions.ConclusionThe supernatant of BMSC can decrease incision effusion, promote the growth of granulation, shorten thetime of incision healing and reduce pain in patients receiving renal transplantation.
Bone marrow; Mesenchymal stem cells; Wound healing; Renal transplantation
2016-03-10)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2017.01.008
350025 福州,南京军区福州总医院泌尿外科
林琴,Email:841739771@qq.com
林琴,徐艳,林丽丽,等.骨髓间充质干细胞上清液对肾移植术后切口愈合不良的疗效观察[J/CD].中华细胞与干细胞杂志(电子版), 2017, 7(1):45-48.

