γδT细胞及其在肿瘤免疫治疗中的研究进展
肖凌 张钦 陈虎 张斌
·综述·
γδT细胞及其在肿瘤免疫治疗中的研究进展
肖凌 张钦 陈虎 张斌
γδT细胞是T细胞的一个亚群,其TCR由γ链和δ链组成,为主要组织相容性复合体非限制性细胞。外周血γδT细胞大部分表达TCR Vγ9和Vδ2,能杀伤多种肿瘤细胞。本文将对γδT细胞的免疫学特性包括识别杀伤肿瘤细胞的机制及γδT细胞在肿瘤免疫治疗中的研究作一综述。
T淋巴细胞; 受体, 抗原, T细胞, γ-δ; 肿瘤; 免疫疗法
根据T细胞抗原受体(T cell receptor,TCR)类型,T细胞可分为αβT细胞和γδT细胞。1986年,Brenner等[1]在应用T细胞抗原受体γ基因序列编码肽段所制备抗体中首先发现了γδT细胞。在健康的成年人,γδT细胞占外周血T淋巴细胞的1﹪~ 5﹪,主要分布在黏膜和上皮组织,其作用介于适应性免疫和固有免疫之间[2]。
γδT细胞受体TCRγδ是由γ链和δ链组成的异二聚体,γ链和δ链分别由γ基因和δ基因编码。每条肽链都有2个免疫球蛋白样结构域:氨基末端可变区(V区)结构域和1个羧基末端稳恒定区(C区)结构域。γ链含有10个V基因片段、2个D基因片段和2个J基因片段,δ链含有7个V基因片段和2个J基因片段,VJD/VJ基因片段重排后表达多种γ链和δ链[3]。但由于γδT细胞亚群往往只使用特定的VγVδ和连接区(J区)序列的组合,便导致了TCR γδ多样性不及TCR αβ。
根据TCRγδ链表达的不同,γδ细胞可以分为2个亚群:Vδ1T细胞和Vδ2T细胞。Vδ1T细胞带有不同的Vγ,主要分布在上皮和黏膜。Vδ2T细胞主要存在于外周血中,占外周γδT细胞总数的50﹪~ 75﹪,在TCRγδ重组过程中,几乎只和Vγ9共表达。与αβT细胞类似,γδT细胞可以根据CD27和CD45RA表达水平分为4个亚群:幼稚型细胞(CD27+CD45RA+)、中央记忆型细胞(CD27+CD45RA-)、效应记忆型细胞(CD27-CD45RA-)和终末分化型细胞(CD27-CD45RA+)[4]。其中幼稚型细胞和中央记忆型细胞主要分布在次级淋巴组织,不具有直接效应功能,受到抗原刺激后,中央记忆型细胞较幼稚型细胞增殖更显著。而效应记忆型细胞和终末分化型细胞主要分布于感染部位和肿瘤部位,具有直接效应功能,效应记忆型细胞的增殖水平低,但能分泌细胞因子,如IFN-γ和TNF-α。外周血中的γδT细胞,可被募集至炎症部位后迅速增殖、分泌细胞因子,并分化成细胞毒性细胞,杀伤受感染细胞或肿瘤细胞[5]。
一、γδT细胞识别肿瘤细胞和激活的机制
肿瘤的监测是免疫监视的重要组成部分,γδT细胞能识别肿瘤抗原的变化。大多数的肿瘤出现p53基因突变,癌细胞中甲羟戊酸途径活性显著上调,使异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)及其异构体二甲基烯丙基焦磷酸在肿瘤细胞内积聚,从而被TCRγδ识别,γδT细胞识别肿瘤细胞,并激活[6-7]。
虽然磷酸抗原通过TCR依赖的方式激活γδT细胞,但具体机制目前尚不清楚。早期的研究表明,磷酸抗原识别依赖于抗原提呈细胞,但不需要抗原呈递分子如HLAⅠ类分子、HLA Ⅱ类分子和CD1。最近的研究发现BTN3A1(CD277)在磷酸抗原介导γδT细胞激活中关键作用[8]。BTN3A1属于跨膜蛋白免疫球蛋白超家族成员,其胞外结构域与B7家族的序列具有同源性。Decaup等[9]将Vδ2细胞TCRs与磷酸抗原结合BTN3A1的复合物相互作用时发现BTN3A1是磷酸抗原的呈递分子。
此外,Vγ9Vδ2 TCRs与表达在肿瘤细胞表面F1-ATPase相互作用,γδT细胞也可以NKG2D受体以MHC非限制性方式识别表达在不同类型上皮肿瘤细胞的MICB、ULBP 1-4和MICA[10]。因此,γδT细胞可以直接识别表达于肿瘤细胞的分子而不需要抗原处理和提呈;在MHCⅠ类分子减少或缺失的情况下,γδT细胞对靶细胞仍有抗肿瘤作用。
含 氮 双 磷 酸 盐 类 药 物(nitrogen-containing bisphosphonates,N-BPs)有直接抗肿瘤活性,如抑制肿瘤细胞的增殖,诱导肿瘤细胞凋亡,临床上用于治疗骨质疏松和骨转移性恶性肿瘤疾病如多发性骨髓瘤、乳腺癌和前列腺癌。N-BPs通过阻断类异戊二烯的合成,使肿瘤细胞对γδT的杀伤敏感性提高[11]。N-BPs抑制甲羟戊酸途径的法尼基焦磷酸合成酶,导致细胞内IPP蓄积,包括IPP的同分异构体二甲基烯丙基焦磷酸和ApppI(图1)。有体外实验的结果表明经N-BPs预处理的肿瘤细胞对γδT的杀伤更敏感[6]。
二、γδT细胞杀伤肿瘤细胞的机制
γδT细胞激活后具有抗多种肿瘤细胞的细胞毒活性。γδT细胞以MHC非限制性的方式识别多种肿瘤相关抗原,通过以下方式杀伤肿瘤细胞:(1)通过凋亡诱导蛋白配体途径Fas-FasL和相关凋亡诱导配体受体诱导肿瘤细胞凋亡;(2)分泌大量的细胞因子,如IFN-γ、TNF-α和IL-2,作用于肿瘤细胞及其微环境,其中IFN-γ是主要细胞因子,具有多种抗肿瘤作用如直接抑制肿瘤生长、阻断血管生成和刺激的巨噬细胞。IFN-γ成为在γδT细胞介导的抗肿瘤反应中的关键细胞因子[7];(3)通过经抗体依赖的细胞介导的细胞毒性作用和穿孔素-颗粒酶B杀伤肿瘤细胞;(4)通过某些膜表面受体如FcγR,经抗体依赖的细胞介导的细胞毒性作用发挥细胞毒作用[7];(5)作为抗原提呈细胞(antigen-presenting cells,APC),发挥提呈抗原作用[12]。
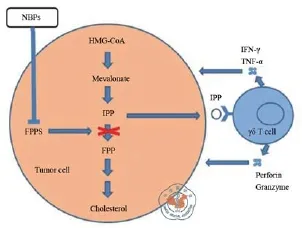
图1 γδT细胞的激活

表1 应用γδT细胞过继输注的临床试验
三、γδT细胞在肿瘤免疫治疗中的途径
目前,应用γδT细胞抗肿瘤活性的肿瘤免疫治疗有2种途径:一是体外扩增途径(表1),即γδT细胞的过继输注;二是体内扩增途径(表2),给予患者静脉注射N-BPs和IL-2,扩增患者体内和肿瘤组织内的γδT细胞。γδT细胞也作为细胞疫苗应用于肿瘤的治疗。
1.体外扩增途径:在体外试验中,N-BPs联合IL-2能迅速扩增外周血中的γδT细胞。N-BPs也可以提高肿瘤细胞对γδT细胞的杀伤作用的敏感性[6]。基于这些的发现,可以应用γδT细胞的过继输注来治疗肿瘤。目前,γδT细胞过继输注有两种方式:一是采集肿瘤患者的PBMC,分离得到γδT细胞,用N-BPs和IL-2扩增活化后,再回输给患者,利用γδT细胞抗肿瘤活性来治疗肿瘤;二是采集肿瘤患者的PBMC分离得到αβT细胞,将TCRγδ DNA转入αβT细胞,使αβT细胞表达TCRγδ,经体外扩增后回输给患者[13]。γδT细胞体外扩增数量大于1.0×109就可回输给患者,用于肿瘤治疗,如肾癌、肺癌、乳腺癌[14]。γδT细胞过继输注治疗患者耐受性好。在输注γδT细胞前也可以先输注唑来磷酸,以提高γδT细胞识别杀伤患者体内肿瘤细胞的能力。

表2 应用Zoledronate和IL-2体内扩增γδT细胞的治疗方案
四、γδT细胞在肿瘤免疫治疗中的有效性和安全性
1.肾癌:Bennouna等[18]报道了用自体Vγ9Vδ2T细胞联合低剂量的IL-2治疗晚期肾癌的一期临床研究,不良反应包括胃肠道功能紊乱、流感样症状、低血压和心动过速。仅1例患者出现了剂量限制性不良反应,6例患者达到SD。一项联合IL-2和唑来磷酸的γδT细胞过继输注治疗肺转移肾癌的1期和2期临床研究结果显示所有患者的肿瘤倍增时间均延长,其中1例患者达到CR,5例患者达到SD,5例患者为PD[19]。
2.非小细胞肺癌:Nakajima等[20]报道了用自体Vγ9Vδ2T细胞过继性免疫治疗治疗10例非小细胞肺癌复发患者的1期临床研究。将患者自体γδT细胞体外用IL-2和唑来磷酸扩增后,每两周回输给患者3~12次。随访240~850 d后,根据实体瘤疗效评价标准,尽管没有患者达到CR和PR,但其中4例达到SD。不良反应有肺部感染和寒战,但与细胞免疫治疗没有相关性。
3.结直肠癌:一项应用治疗6位接受过肺转移瘤切除术的结直肠癌患者临床试验,将患者自体γδT细胞体外用IL-2和唑来磷酸扩增后,每周一次回输给患者,总共回输8次[21]。治疗后5例患者达到PR,1例患者为SD。
4.多发性骨髓瘤:Abe等[22]设计了一项试验性研究,用唑来磷酸活化的Vγ9Vδ2T LAK细胞来治疗多发性骨髓瘤。在研究期间未发现治疗相关的严重不良反应,所有患者均发现在PBMC中Vγ9Vδ2T细胞的比例和外周血中Vγ9Vδ2T细胞的数量上升,特别是TEM Vγ9Vδ2T细胞数量增加,在骨髓中也发现Vγ9Vδ2T细胞和TEM Vγ9Vδ2T细胞数量增加。6例患者中4例患者血清M蛋白保持在基线水平,2例患者升高。
5.乳腺癌:一项应用唑来磷酸和低剂量IL-2治疗10例晚期转移性乳腺癌患者的一期临床研究显示,治疗的耐受性很好,促进患者体内的Vγ9Vδ2T细胞活化成熟。并且发现临床结果和患者外周血中Vγ9Vδ2T细胞的数量显著相关,
2.体内扩增途径:N-BPs通过皮下注射或静脉注射,使肿瘤患者外周血中的γδT细胞扩增同时使肿瘤细胞对γδT细胞的杀伤作用的敏感性增高。Wilhelm等[15]开展了一个临床试验,给予4位晚期血液恶性肿瘤的患者预处理(氟达拉滨 20~25 mg/m2治疗前6天至治疗前2天、环磷酰胺 30~60 mg/kg治疗前6天至治疗前5天),后给予供者去除CD4+和CD8+的淋巴细胞输注,Zol 4 mg 治疗当天和IL-2 1.0×106IU/m2治疗后1天至治疗后6天输注。Wada等[16]用体外扩增的患者自体Vγ9Vδ2T细胞和唑来磷酸腹腔注射治疗胃癌引起的恶性腹水。采集患者的PBMC,用唑来磷酸和IL-2体外培养Vγ9Vδ2T细胞,14 d后收集。给予患者每周1次腹腔注射Vγ9Vδ2T细胞,共4周,每次注射细胞量平均为5.9×109,腹腔注射Vγ9Vδ2T细胞前1天给予1 mg Zol。
3.细胞疫苗:Knan等[17]开发了在临床级的条件下体外大量扩增γδT-APC的流程,用于肿瘤治疗。从患者采集外周血分离PBMC,加入唑来磷酸、IL-2和IL-15体外培养14天,加入从患者肿瘤细胞提取的肿瘤抗原来制备肿瘤抗原负载γδT-APC细胞。肿瘤抗原负载γδT-APC细胞可置于液氮中保存运输。在肿瘤抗原负载γδT-APC细胞回输给患者之前,可给予静脉输注唑来磷酸,以刺激γδT细胞分泌细胞因子(如TNF-α、IFN-γ)[17]。其中7例外周血中Vγ9Vδ2T细胞数量下降的患者病情逐渐恶化,而3例外周血中Vγ9Vδ2T细胞数量稳定的患者其中1例达到PR,2例为SD[23]。
6.血液肿瘤:Wilhelm等[15]开展Zol体内刺激人半相合γδT细胞活化增殖治疗的临床试验结果发现治疗后3例患者达到CR,没有发现GVHD。
7.恶性腹水:Ikuo等[16]开展的研究显示在整个治疗过程中没有发现严重的不良反应,患者腹水显著减少,腹水中胃癌细胞数量显著下降。
五、总结
γδT细胞作为T细胞的一个特殊亚群,主要以MHC非限制性方式识别抗原,不受MHC分子和相关抗原肽配体的限制,可不依赖抗原的处理和呈递的过程直接识别抗原,通过分泌IFN-γ、TNF-α、IL-2等细胞因子和穿孔素、颗粒酶B、Fas/FasL途径等杀伤肿瘤细胞。γδT细胞虽在体内数量较少,但不管在体外还是在体内都能在磷酸盐的刺激下大量扩增,在机体抗肿瘤免疫中具有重要作用[30]。以γδT细胞为基础的免疫治疗已应用于多个临床试验,在治疗乳腺癌、肾癌、结直肠癌等实体肿瘤和一些血液肿瘤中,已取得明显疗效,在治疗过程中常见不良反应为发热、乏力、流感样症状等,没有严重不良反应发生,因此以γδT细胞为基础的肿瘤免疫治疗是有效的,安全的。
γδT细胞作为体内免疫系统的一部分,与其他免疫细胞一样,其杀伤活性和功能受很多因素的调控,如调节性T细胞和PD-1。而Coffelt等[31]人发现分泌IL-17的γδT细胞与中性粒细胞共同作用可促进乳腺癌的转移;Zhong等[32]人发现分泌IL-17A的γδT细胞能加快胃癌的进展。而实际上,IL-2和IL-15促使幼稚γδT细胞分化并分泌IFN-γ,而不分泌IL-17A[33]。γδT细胞也存在一些局限性,Deng等[34]人通过体外实验证实γδT细胞的杀伤活性不如NK细胞,Niu等[35]发现肿瘤患者的NK细胞抗肿瘤能力强于γδT细胞。
磷酸抗原和双磷酸盐虽能有效扩增γδT细胞,但不能很好地提高γδT细胞介导的肿瘤细胞的杀伤能力。而双特异性抗体HER2/Vγ9抗体和[(Her2)2×Vγ9]三聚体能够增强γδT细胞杀伤肿瘤细胞的能力。Oberg等[36]设计双特异性抗体HER2/Vγ9抗体,能将γδT细胞上的CD3或Vγ9结合到胰腺肿瘤细胞上的HER2/neu(ERBB2),增强了γδT细胞的细胞毒性。动物实验中将γδT细胞和HER2/Vγ9 抗体输注给SCID小鼠,结果发现胰腺肿瘤移植物的生长减慢,体积缩小。随后Oberg等[37]又构建了[(Her2)2×Vγ9]三聚体。[(Her2)2×Vγ9]三聚体能明显提高γδT细胞杀伤表达Her2肿瘤细胞的能力。
以γδT细胞为基础的肿瘤免疫治疗过程中,如何增强γδT细胞的抗肿瘤的能力,如同时抑制γδT细胞表达IL-17和其他的一些负调控,如抑制调节性T细胞的功能和下调PD-1的表达,是未来研究的一个重要领域。
1 Brenner MB, Mclean J, Dialynas DP, et al. Identi fi cation of a putative second T-cell receptor[J]. Nature, 1986, 322(675):145-149.
2 Van Acker HH, Anguille S, Van Tendeloo VF, et al. Empowering gamma delta T cells with antitumor immunity by dendritic cell-based immunotherapy[J]. Oncoimmunology, 2015, 4(8):e1021538.
3 Legut M, Cole DK, Sewell AK. The promise of gamma delta T cells and the gamma delta T cell receptor for cancer immunotherapy[J]. Cell Mol Immunol, 2015, 12(6):656-668.
4 Toia F, Buccheri S, Anfosso A, et al. Skewed differentiation of circulating V gamma 9V delta 2 T lymphocytes in melanoma and impact on clinical outcome[J]. PLoS One, 2016, 11(2):e0149570.
5 Fowler DW, Bodman-Smith MD. Harnessing the power of Vδ2 cells in cancer immunotherapy [J]. Clin Exp Immunol, 2015, 180(1):1-10.
6 Sugai S, Yoshikawa T, Iwama T, et al. Hepatocellular carcinoma cell sensitivity to V gamma 9V delta 2 T lym-phocyte-mediated killing is increased by zoledronate[J]. Int J Oncol, 2016, 48(5):1794-1804.
7 Silva SB, Serre K, Norell H. γδ T cells in cancer[J]. Nat Rev Immunol, 2015, 15(11):683-691.
8 Harly C, Peigné CM, Scotet E. Molecules and mechanisms implicated in the peculiar antigenic activation process of human Vγ9Vδ2 T Cells [J]. Front Immunol, 2015, 5: 657.
9 Decaup E, Duault C, Bezombes C, et al. Phosphoantigens and butyrophilin 3A1 induce similar intracellular activation signaling in human TCRV gamma 9(+) gamma delta T lymphocytes[J]. Immunol Lett, 2014, 161(1):133-137.
10 Lanier LL. NKG2D receptor and its ligands in host defense[J]. Cancer Immunol Res, 2015, 3(6):575-582.
11 Van Acker HH, Anguille S, Willemen Y, et al. Bisphosphonates for cancer treatment: Mechanisms of action and lessons from clinical trials[J]. Pharmacol Ther, 2016, 158: 24-40.
12 Tyler CJ, Doherty DG, Moser BA. Human V gamma 9/V delta 2 T cells: innate adaptors of the immune system[J]. Cell Immunol, 2015, 296(1):10-21.
13 Paul S, Lal G. Regulatory and effector functions of gamma-delta (gammadelta) T cells and their therapeutic potential in adoptive cellular therapy for cancer[J]. Int J Cancer, 2016, 139(5):976-985.
14 Li K, Zhang Q, Zhang Y, et al. T-cell-associated cellular immunotherapy for lung cancer[J]. J Cancer Res Clin Oncol, 2015, 141(7):1249-1258.
15 Wilhelm M, Smetak M, Schaefer-Eckart K, et al. Successful adoptive transfer and in vi-vo expansion of haploidentical γδ T cells[J]. J Transl Med, 2014, 12:45.
16 Wada I, Matsushita H, Noji S, et al. Intraperitoneal injection of in vitro expanded V gamma 9V delta 2 T cells together with zoledronate for the treatment of malignant ascites due to gastric cancer[J]. Cancer Med, 2014, 3(2):362-375.
17 Khan MW, Eberl M, Moser B. Potential use of γδ T cell-based vaccines in cancer immunotherapy[J]. Front Immunol, 2014, 5:512.
18 Bennouna J, Bompas E, Neidhardt EM, et al. Phase-i study of innacell gammadelta,an autologous cell-therapy product highly enriched in gamma9delta2 T lymphocytes,in combination with il-2, in patients withmetastatic renal cell carcinoma[J]. Cancer Immunol Immunother, 2008, 57(11):1599-1609.
19 Kobayashi H, Tanaka Y, Shimmura HA, et al. Complete remission of lung metastasis following adoptive im-munotherapy using activated autologous gamma delta T-cells in a patient with renal cell carcinoma[J]. Anticancer Res, 2010, 30(2):575-579.
20 Nakajima J, Murakawa T, Fukami T, et al. A phase I study of adoptive immunotherapy for recurrent non-small-cell lung cancer patients with autologous gamma delta T cells[J]. Eur J Cardiothorac Surg, 2010, 37(5):1191-1197.
21 Izumi T, Kondo M, Takahashi T, et al. Ex vivo characterization of gamma delta T-cell repertoire in patients after adoptive transfer of V gamma 9V delta 2 T cells expressing the interleukin-2 receptor beta-chain and the common gamma-chain[J]. Cytotherapy, 2013, 15(4):481-491.
22 Abe Y, Muto M, Nieda M, et al. Clinical and immunological evaluation of zoledronate-activated V gamma 9 gamma delta T-cell-based immunotherapy for patients with multiple myeloma[J]. Exp Hematol, 2009, 37(8):956-968.
23 Meraviglia S, Eberl M, Vermijlen D, et al. In vivo manipulation of V gamma 9V delta 2 T cells with zoledronate and low-dose interleukin-2 for immunotherapy of advanced breast cancer patients[J]. Clin Exp Immunol, 2010, 161(2):290-297.
24 Kobayashi H, Tanaka Y, Yagi J, et al. Phase I/II study of adoptive transfer of γδ T cells in combination with zoledronic acid and IL-2 to patientswith advanced renal cell carcinoma[J]. Cancer Immunol Immunother, 2011, 60(8):1075-84.
25 Sakamoto M, Nakajima J, Murakawa T, et al. Adop-tive immunotherapy for advanced non-small cell lung cancer using zoledronate-expanded γδTcells: aphase I clinical study[J]. J Immunother, 2011, 34(2):202-211. 26 Abe Y, Muto M, Nieda M, et al. Clinical and immunological evaluation of zoledronate-activated Vgamma9gammadelta T-cell-based immunotherapy for patients with multiple myeloma[J]. Exp Hematol, 2009, 37(8):956-968.
27 Nicol AJ, Tokuyama H, Mattarollo SR, et al. Clinical evaluation of autologous gamma delta T cell-based im-munotherapy for metastatic solid tumours[J]. Br J Cancer, 2011, 105(6):778-786.
28 Kunzmann V, Smetak M, Kimmel B, et al. Tumor-promoting versus tumor-antagonizing roles of γδ T cells in cancer immunotherapy: results from aprospective phase I/II trial[J]. J Immunother, 2012, 35(2):205-213.
29 Lang JM, Kaikobad MR, Wallace M, et al. Pi-lot trial of interleukin-2 and zoledronic acid to augment γδ T cells as treatment for patients with refractoryrenal cell carcinoma[J]. Cancer Immunol Immunother, 2011, 60(10):1447-1460.
30 Kobayashi H, Tanaka Y. γδ T cell Immunotherapy-A review[J]. Pharmaceuticals(Basel), 2015, 8(1):40-61.
31 Coffelt SB, Kersten K, Doornebal CW, et al. IL-17-producing γδ T cells and neutrophils conspire to promote breast cancer metastasis[J]. Nature, 2015, 522(7556):345-348.
32 Zhong FY, Cui DW, Tao H, et al. IL-17A-producing T cells and associated cytokines are involved in the pro-gression of gastric cancer[J]. Oncol Rep, 2015, 34(5):2365-2374.
33 Ribot JC, Ribeiro ST, Correia DV, et al. Hu-man γδ thymocytes are functionally immature and differentiate into cytotoxic type 1 effector T cells uponIL-2/IL-15 signaling[J]. J Immunol, 2014, 192(5):2237-2243. 34 Deng X, Terunuma H, Terunuma A, et al. Ex vivo-expanded natural killer cells kill cancer cells more effectively than ex vivo-expanded γδ t cells or αβ t cells[J]. Int Immunopharmacol, 2014, 22(2):486-491.
35 Niu C, Jin HF, Li M, et al. In vitro analysis of the proliferative capacity and cytotoxic effects of ex vivo induced natural killer cells, cytokineinduced killer cells, and gamma-delta T cells[J]. BMC Immunol, 2015, 16:61.
36 Oberg HH, Peipp M, Kellner C, et al. Nov-el bispecific antibodies increase γδ T-cell cytotoxicity against pancreatic cancer cells[J]. Cancer Res, 2014, 74(5):1349-1360.
37 Oberg HH, Kellner C, Gonnermann D, et al. γδ T cell activation by bispeci fi c antibodies[J]. Cellular Immunol, 2015, 2961(1):41-49.
Development of gammadelta T cells in tumor immunotherapy
Xiao Ling, Zhang Qin, Chen Hu, Zhang Bin. Department of Hematopoietic Stem Cell T ransplantation, the 307th Hospital of Chinese People's Liberation Army, Beijing 100071, China
Zhang Bin, Email: zb307ctc@163.com
Gammadelta T cells are a small subset of T lymphocytes expressing γ-and δ-chain T cell receptors. Gammadelta T cells are main MHC-unrestrictive cells. The majority of human peripheral blood Gammadelta T cells express Vγ9 and Vδ2 T cell receptor and show cytotoxicity against a wide spectrum of tumor cells. Here, we review the immunological properties of gammadelta T cells including the recognition and killing mechanism against tumor cells, and summarize the results of gammadelta T cell-based cancer immunotherapy.
T-lymphocytes; Receptors, antigen, T-cell, gamma-delta; Neoplasms; Immunotherapy
2016-05-18)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2017.01.010
北京市科技计划课题(Z161100000516184)
100071 北京,解放军307医院造血干细胞移植科 全军造血干细胞研究所
张斌,Email:zb307ctc@163.com
肖凌,张钦,陈虎,等. γδT细胞及其在肿瘤免疫治疗中的研究进展[J/CD].中华细胞与干细胞杂志(电子版), 2017, 7(1):54-58.

