同源过表达mhr2基因可提高嗜热毁丝霉纤维素酶活性
龚艳芬, 谢志臻, 赵胜明, 王 娟*
(1.深圳大学 生命与海洋科学学院 深圳市微生物基因工程重点实验室,广东 深圳 518060;2.深圳市海洋生物资源与生态环境重点实验室,广东 深圳 518060)
木质纤维素是植物细胞壁的主要组成成分之一,是最为丰富的可再生碳源。降解纤维素成单糖再转化为生物燃料,已成为科学研究的重要课题之一[1]。许多微生物所产生的纤维素酶都能有效地降解木质纤维素,目前工业上主要用木霉、青霉等中温真菌来生产纤维素酶。与中温真菌相比,嗜热真菌可耐高温环境,培养过程中不易受中温真菌污染,所产纤维素酶具有更好的热稳定性,可加快降解速度,有着广阔的应用前景[2]。 嗜热毁丝霉 (Myceliophthorathermophile)是一种丝状子囊真菌,适宜在45~50 ℃下生长。嗜热毁丝霉 (M.thermophilaATCC42464)已于2011年完成基因组测序,研究表明该菌能产生热稳定性良好的纤维素酶类,具有水解生物质大部分多糖的能力,是潜在的高效中高温酶库[3]。近几年,本实验室对该菌木聚糖酶调控基因xyr1进行同源过表达,发现在诱导与非诱导条件下,过表达该调控因子的转化子中木聚糖酶活性分别比野生菌高出9.04和25.19倍,该调控因子MtXyr1与丝状真菌的转录调控因子XlnR(Xlr1/Xyr1)有着相似的功能[4-5]。对阻遏因子Cre1进行RNA干扰,发现干扰阻遏因子的转化子滤纸酶活比野生菌提高3.76倍,且主要纤维素酶基因cbh1、egl1等的表达量均显著提高[6-7]。可见,在其他丝状真菌中起转录调控作用的因子在嗜热真菌中发挥相同功能[8-9]。另外,本实验室应用基于新一代Solexa测序的RNA-Seq分析技术[10],对嗜热毁丝霉在葡萄糖和微晶纤维素培养条件下的基因表达差异进行分析,并应用NOIseq方法筛选出可能的转录调控因子[11]。选择可能的转录因子Mhr2,该蛋白由293个氨基酸组成,其中163~260氨基酸区段为真菌转录因子同源区序列,查询NCBI数据库获得mhr2的基因全长序列(GenBank 序列号: AEO57671.1),构建过表达载体,经原生质体转化、潮霉素平板筛选、PCR鉴定获得阳性过表达转化子,研究了mhr2基因过表达对嗜热毁丝霉纤维素酶活性、酶基因表达及胞外蛋白含量的影响。
1 材料与方法
1.1 材料
1.1.1 菌种、质粒 大肠埃希菌(Escherichiacoli) JM107由深圳大学生命与海洋科学学院苟德明教授馈赠;嗜热毁丝霉(M.thermophilaATCC42464) 购自美国菌种收藏中心(ATCC)。质粒pAN7-1带有真菌筛选标记潮霉素抗性基因hph;质粒pUC19-M用于构建过表达载体,是本实验室对质粒pUC19改良并保存的pUC19-MtPpdc-MtTpdc[4-5]。
1.1.2 培养基 ①LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L;用于固体平板培养时,加入18 g/L的琼脂;用于重组质粒氨苄抗性筛选时,加入氨苄青霉素(Invitrogen,美国),使其终浓度为100 μg/mL。②PDA培养基:用于筛选过表达转化子时加入潮霉素B,终浓度为50 μg/mL。③液体种子培养基(或非诱导培养基):Mandels营养液浓缩液100 mL/L,Mandels微量元素浓缩液1.0 mL/L,蛋白胨1.0 g/L,无水葡萄糖20 g/L,1 mol/L的柠檬酸缓冲液(pH 4.5)50 mL/L,吐温-80 1.0 mL/L。④诱导培养基:含Mandels营养盐浓缩液100 mL/L,Mandels微量元素浓缩液1.0 mL/L,蛋白胨1.0 g/L,无水葡萄糖2.0 g/L,1 mol/L的柠檬酸缓冲液(pH 4.5)50 mL/L,吐温-80 1.0 mL/L,麦秸秆粉30 g/L。
1.1.3 试剂 限制性内切酶购自美国ThermoFisher公司;DNA Marker、DNA聚合酶、反转录试剂盒、实时荧光定量PCR试剂盒购自日本TaKaRa公司;质粒提取试剂盒、切胶回收试剂盒购自美国OMEGA公司;总RNA提取试剂盒、Bradford法蛋白浓度测定试剂盒购自上海生工公司。
1.1.4 仪器 高压灭菌锅(ASTELL,AMA240);全温振荡培养箱(Biotech,CERTOMAT S II);多功能酶标仪(Thermo,Varioskan flash);实时荧光定量PCR仪(ABI,Step One plus)。
1.2 方法
1.2.1mhr2基因过表达载体的构建 通过NCBI获得mhr2基因全序列(序列号:AEO57671.1),设计含NotI和XbaI位点的引物Mt-mhr2-F和Mt-mhr2-R(见表1),扩增出mhr2基因全长序列。将质粒pUC19-M经NotI和Xba I双酶切回收,与同样酶切过的mhr2基因进行连接,并转化入大肠埃希菌JM107。经氨苄抗性筛选,以Mt-Ppdc-F和Mt-Tpdc-R为上下游引物进行PCR验证,并将PCR产物送检测序以确认mhr2基因的完整性和准确性(所用引物见表1)。
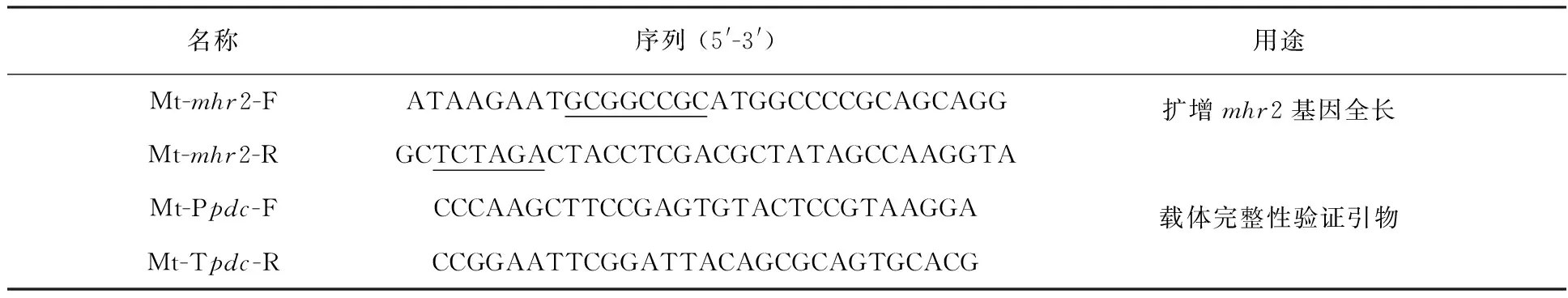
表1 用于扩增mhr2基因和验证载体完整性的引物序列
注:限制酶切位点用下划线标出
1.2.2 原生质体的制备与转化 嗜热毁丝霉原生质体的制备转化方法参照里氏木霉原生质体转化方法并进行了优化[4,12]。
1.2.3 嗜热毁丝霉总RNA的提取与RT-qPCR 取15 mL菌液进行抽滤,刮取滤纸表面的菌体,用液氮研磨,再用总RNA提取试剂盒提取总RNA。对所得RNA去除基因组DNA,并进行反转录获得cDNA,具体操作步骤参照试剂盒的说明书。以cDNA为模板,所需引物序列见表2,使用SYBR Green I嵌合荧光定量PCR方法(qPCR)进行实验并分析目的基因的相对表达量[7]。

表2 用于RT-qPCR的引物
1.2.4 酶活测定与胞外蛋白浓度测定 将少许保种孢子接种于PDA平板中,45 ℃倒置培养7 d。刮取孢子,用孢子洗涤液(0.1%的吐温-80溶液)制备浓度为108个/mL的孢子悬液。取1 mL孢子液加入液体种子培养基中,45 ℃、250 r/min培养48 h,分别取1 mL菌液转接至非诱导培养基和诱导培养基中,45 ℃、250 r/min继续培养。非诱导培养的菌液从培养第96小时开始,每隔24 h取1次菌液,离心后留上清进行酶活和胞外蛋白浓度的测定,连续5次。滤纸酶活(FPA)、内切葡聚糖酶酶活(EGase)参照国标QB 2583-2003及 Douglas E Eveleigh和Ghose等的酶活测定方法并加以修改测定[13-14]。胞外蛋白浓度使用改良型Bradford法蛋白浓度测定试剂盒(上海生工)进行测量。诱导培养的菌液则从培养的第48小时开始收集,每隔24 h取1次菌液,连续5次,测定方法同上。
2 结果与分析
2.1 mhr2过表达质粒的构建
运用PCR技术,以嗜热毁丝霉基因组DNA为模板,使用引物Mt-mhr2-F和Mt-mhr2-R扩增得到两端分别带有NotI和XbaI限制性酶切位点的mhr2基因全长,约1 170 bp,如图1所示。
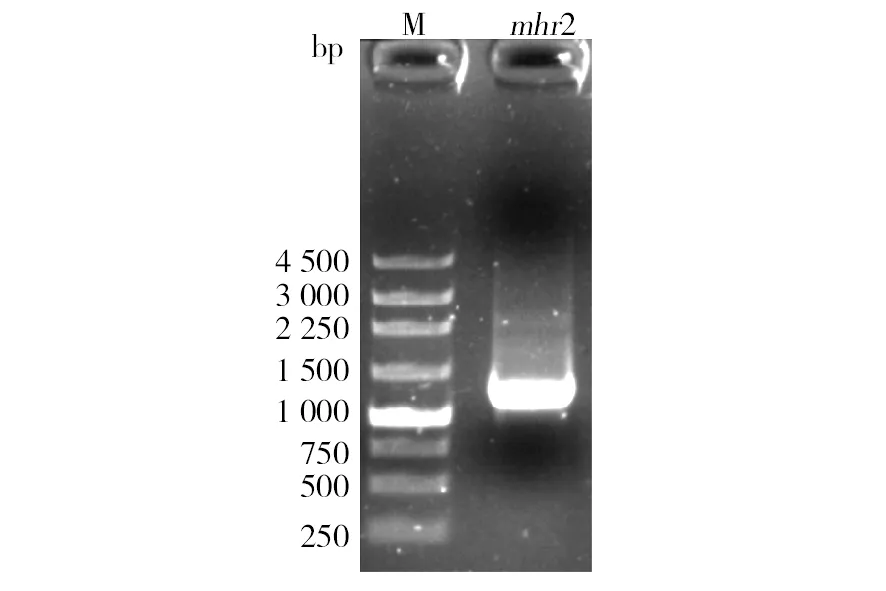
图1 凝胶电泳分析mhr2基因Fig.1 Electrophorestic analysis of gene mhr2M: 250 bp DNA Marker;mhr2:mhr2基因全长,约1 170 bpM: 250 bp DNA Marker;mhr2:the full sequence of mhr2, about 1 170 bp
通过质粒双酶切、连接目的基因、转化入E.coli,于含100 μg/mL氨苄的抗性LB平板上培养,12 h后挑选单一菌落。用同浓度的氨苄抗性液态LB培养基培养4 h,再选用引物Mt-Ppdc-F和Mt-Tpdc-R,通过菌液PCR检验菌株是否为阳性克隆子,如图2所示,4号为阳性克隆子,包含mhr2基因片段,其余均为阴性。选取4号菌体送检测序,测序结果显示4号转化子序列正确,重组质粒结构见图3。

图2 阳性质粒的PCR验证Fig.2 PCR verification of the positive plasmidM:250 bp DNA Marker; 4:约2 130 bp,为阳性; 1~3,5:约1 000 bp,是空质粒,为阴性M:250 bp DNA Marker; 4: about 2 130 bp, the positive plasmid; 1~3,5:about 1 000 bp, the negative plasmids

图3 pUC19-mhr2质粒结构图Fig.3 The structure of pUC19-mhr2
2.2 mhr2过表达转化子株的获得与筛选
经含潮霉素(浓度50 mg/L)抗性PDA平板筛选、提取基因组DNA、用引物Mt-Ppdc-F和Mt-Tpdc-R进行PCR验证,如图4所示,转化子有两条电泳带,其中一条较亮的电泳带为过表达目的带,与质粒载体pUC19-mhr2的电泳条带大小一致;另一条非常暗的电泳带与野生菌的电泳带大小一致,为野生菌中pdc基因大小。由基因测序确认,成功获得5株过表达转化子,命名为MtO21、MtO22、MtO23、MtO24、MtO25。分别刮取野生菌和各转化子等量的孢子(约1×107个)于液体基本种子培养基中45 ℃、250 r/min培养48 h后,提取各菌体总RNA,电泳检测总RNA完整性见图5。经RT-qPCR检测,mhr2基因的表达情况如图6所示,转化子MtO24中mhr2基因量最高,约为野生菌中表达量的204倍,故选取转化子MtO24进行后续实验。

图4 转化子的PCR验证Fig.4 PCR verification of transformantsM:250 bp DNA Marker; B:空白对照; WT:野生菌; P:阳性质粒; 1~5:转化子M:250 bp DNA Marker; B: the blank control; WT: the wild-type strain; 1-5: transformants
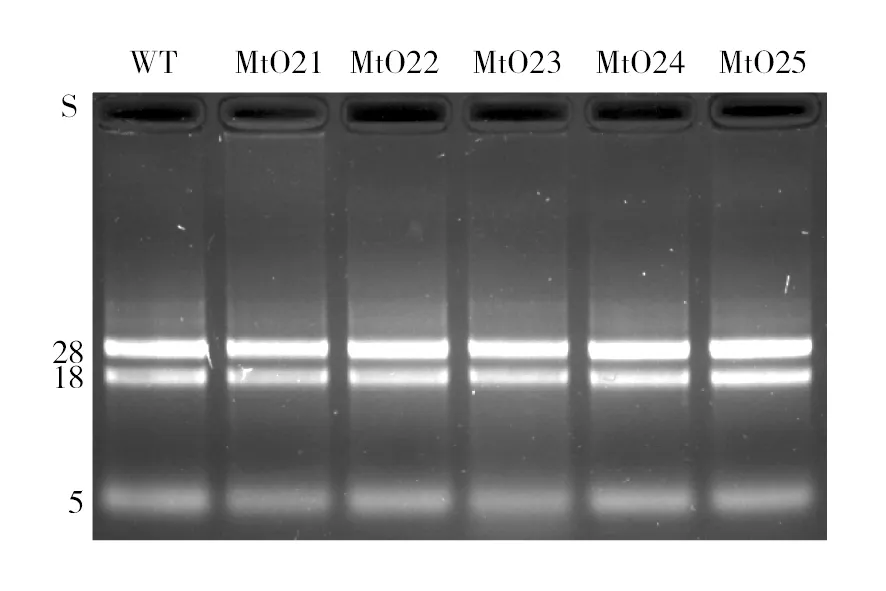
图5 野生菌与转化子的总RNAFig.5 The total RNA of WT and transformantsWT:野生菌; MtO21~MtO25:转化子WT: The RNA band of wild-type strain; MtO21-MtO25: the RNA bands of transformants

图6 mhr2基因表达的荧光定量分析Fig.6 Quantitative reverse transcription polymerase chain reaction analysis of mhr2
2.3 非诱导条件下胞外蛋白浓度与纤维素酶活性分析
非诱导培养条件下,转化子MtO24相比于野生菌WT,胞外蛋白浓度与滤纸酶活、内切葡聚糖酶酶活(EG)均有明显提高,如图7所示。其中,培养144 h(6 d)时差异最大,胞外蛋白浓度为野生菌的1.87倍,滤纸酶活提高为野生菌的1.49倍,内切葡聚糖酶酶活提高为野生菌的1.33倍。

图7 非诱导条件下重组子MtO24与野生菌WT的胞外蛋白浓度和纤维素酶活性Fig.7 The extracellular protein concentration, FPA and EGase activities in MtO24 and WT under the non-inducing conditionsA:体外蛋白浓度;B:滤纸酶活;C:内切葡聚糖酶酶活,图9同A: Extracellular protein concentration; B: FPA; C: EGase activity,same figure 9
2.4 非诱导条件下主要纤维素酶基因的表达量分析
由图7可知,非诱导培养144 h时,过表达转化子MtO24与野生菌WT的胞外蛋白浓度和酶活均表现出明显差异。因此,分别提取WT和MtO24非诱导培养144 h的总RNA,对4种主要纤维素酶基因cbh1、cbh2、egl1、egl3的表达水平进行分析。经内参基因beta-tubulin定量校正,设定野生菌WT各基因的表达量为1,计算出转化子MtO24中各基因的相对表达量,结果如图8所示,基因cbh1与egl1的表达量约为野生菌的3倍,基因cbh2的表达量比野生菌提高63%,而egl3的表达量只比野生菌略有提高。

图8 非诱导条件下转化子MtO24中主要纤维素酶基因的表达水平Fig.8 Expression of main cellulase genes of MtO24 under non-inducing conditions
2.5 诱导条件下胞外蛋白浓度与纤维素酶活性分析
如图9所示,诱导条件(30 g/L麦秸秆粉)培养72 h时,胞外蛋白浓度和酶活均达到峰值,相比于非诱导培养,峰值提前了72 h,且峰值也高出10~20倍。可见,诱导条件下,更有利于嗜热毁丝霉产酶。诱导培养72 h时,转化子MtO24与野生 菌WT的酶活均达到最大值,且两者之间差异显著。其中,MtO24胞外蛋白浓度是WT的1.58倍,滤纸酶活与内切纤维素酶酶活(EGase)分别为1.30和1.24倍。
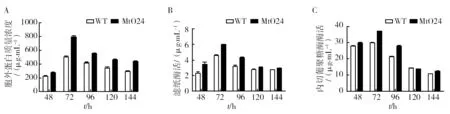
图9 诱导条件下重组子MtO24与野生菌WT的体外蛋白浓度和纤维素酶活性Fig.9 The extracellular protein concentration & FPA and EGase activity in MtO24 and WT under the inducing conditions
2.6 诱导条件下主要纤维素酶基因的表达量分析
提取诱导培养72 h菌株的总RNA,并对4种主要纤维素酶基因cbh1、cbh2、egl1、egl3的表达水平进行分析,结果如图10所示,转化子MtO24中基因cbh1的表达量约为野生菌WT的5倍,基因cbh2的表达量约为野生菌WT的9倍,基因egl1约为野生菌WT的3倍,基因egl3约为野生菌WT的8倍。转化子MtO24中4种纤维素酶相关基因的表达水平均有明显提升,且提高幅度比非诱导条件下明显。

图10 诱导条件下转化子MtO24中主要纤维素酶基因的表达水平Fig.10 Expression of main cellulase genes of MtO24 under inducing conditions
3 讨 论
以葡萄糖为主要碳源的非诱导培养条件(阻遏条件)与以麦秸秆粉为碳源的诱导条件相比,差别明显。诱导条件下,酶活峰值提前,野生菌及重组转化菌株酶活均比非诱导培养有显著提高。同理,诱导条件下,因野生菌酶活大幅提升,而非诱导条件下野生菌酶活基础值偏低,故非诱导培养的转化子与野生菌相比,提高倍数略高于诱导条件下的提高倍数。另外,两种培养条件下,酶活与胞外蛋白浓度的变化趋势基本一致。
从基因表达量来看,诱导条件下,与野生菌相比转化子4种主要的纤维素酶基因表达量升幅均高于非诱导条件。该结果显示,主要纤维素酶基因表达量与酶活性表现一致。纤维素酶活性的增加,是多种纤维素酶相关基因综合作用的结果,但基因表达量的高低与酶活性之间并不一定呈现正比关系。酶活性的增加除与基因表达有关之外,还受多种因素的影响。有些基因表达量大幅上升,但因在转录后及翻译过程中涉及众多分子生物学过程,最终不一定导致酶活性的大幅增加[6-11]。最近有研究者发现各类转录因子调控靶基因的部位不同也会影响靶基因从mRNA至蛋白量的表达[15]。综上所述,mhr2基因过表达对嗜热毁丝霉纤维素酶活性、胞外蛋白浓度、主要纤维素酶基因表达量均有一定的促进作用。
针对纤维素酶基因表达调控的研究,特别是针对糖代谢阻遏因子的研究,可有效提高菌株的纤维素酶产量,是一种改造工业菌株的高效的遗传操作方法。因此,发现更多嗜热毁丝霉中存在的纤维素酶相关新型转录调控因子十分重要,可以为更深入地了解嗜热毁丝霉纤维素酶基因诱导表达调控的各种机制奠定基础。
[1] Wilson DB. Cellulases and biofuels[J]. Current Opinion in Biotechnology, 2009, 20(3): 295-299.
[2] Li DC, Li AN, Papageorgiou AC. Cellulases from thermophilic fungi: recent insights and biotechnological potential[J]. Enzyme Res, 2011, 30(8):730-738.
[3] Berka R, MGrigoriev IV, Otillar R, et al. Comparative genomic analysis of the thermophilic biomass-degrading fungiMyceliophthorathermophilaandThielaviaterrestris[J].Nat Biotechnol, 2011, 29(10): 922-927.
[4] Wang J, Wu YN, Gong YF, et al. Enhancing xylanase production in the thermophilic fungusMyceliophthorathermophilaby homologous overexpression of Mtxyr1[J]. J Ind Microbiol Biotechnol, 2015, 42(9): 1233-1241.
[5] Klaubauf S, Narang HM, Post H, et al. Similar is not the same : Differences in the function of the (hemi-)cellulolytic regulator XlnR (Xlr1/Xyr1) in filamentous fungi[J]. Fungal Genet Biol, 2014, 72(9): 73-81.
[6] Yang F, Gong YF, Liu G, et al. Enhancing Cellulase Production in Thermophilic FungusMyceliophthorathermophilaATCC42464 by RNA Interference of cre1 Gene Expression[J]. J Microbiol Biotechnol, 2015, 25(7): 1101-1107.
[7] 杨帆. 转录因子CRE1及ACE1在嗜热毁丝霉纤维素酶基因表达调控中的作用[D].深圳:深圳大学, 2015.
[8] Amore A, Giacobbe S, Faraco V. Regulation of cellulase and hemicellulase gene expression in fungi[J]. Curr Genomics, 2013, 14(4): 230-249.
[9] Portnoy T, Margeot A, Seidl-Seiboth V, et al. Differential regulation of the cellulase transcription factors XYR1, ACE2, and ACE1 inTrichodermareeseistrains producing high and low levels of cellulase[J]. Eukaryot Cell, 2011, 10(2): 262-271.
[10]Lockhart DJ, Winzeler EA. Genomics, gene expression and DNA arrays[J]. Nature, 2000, 405(6788): 827-836.
[11]赵胜明. 嗜热毁丝霉新调控因子在纤维素酶基因表达调控中的功能研究[D]. 深圳:深圳大学, 2016.
[12]Wang SW, Xing M, Liu G, et al. Enhancing cellulase production inTrichodermareeseiRUT C30 through combined manipulation of activating and repressing genes[J]. J Ind Microbiol Biotechnol, 2013, 40(6): 633-641.
[13]Bai C, Tesker M, Engelberg D. The yeast Hot1 transcription factor is critical for activating a single target gene, STL1[J]. Mol Biol Cell, 2015, 26(12): 2357-2374.
[14]Wang JY, Liu W, Ding WT, et al. Increasing ethanol titer and yield in a gpd1Δ gpd2Δ strain by simultaneous overexpression of GLT1 and STL1 inSaccharomycescerevisiae[J]. Biotechnol Lett, 2013, 35(11): 1859-1864.
[15]Battle A, Khan Z, Wang SH. Impact of regulatory variation from RNA to protein[J]. Science, 2014, 347(6222): 664-667.
·写作常识·
本刊常用的计量单位
为了更好地执行国务院发布的《关于在我国统一实行法定计量单位的命令》的规定,根据国标(GB3100~3102-93)标准,单位符号一般用英文小写(正体),来源于人名的单位,其符号的首字母大写,只有体积单位升例外,它的符号用“L,(l)”,推荐采用L。现将本刊常用计量单位符号及与之容易混淆的符号介绍如下,希望作者参照执行。
时间:年用a,不用y,yr;星期、周(无符号),不用wk;月(无符号),不用mo;日用d,不用day;小时用h,不用hr;分钟用min,不用m;秒用s,不用sec表示。
溶液浓度:用mol/L,不用M(克分子浓度)和N(当量浓度)等非许用单位表示。
百分浓度:务必注明是重量百分浓度,还是体积百分浓度。
面积:公顷用hm2,不用ha,亩或公亩,换算因数为 1hm2=15亩。
旋转速度:用r/min,×g,不用rpm。
蒸汽压力:用Pa或kPa、MPa表示,不用大气压at,kg/m2或kg/cm2等。
光密度:用OD(斜体)表示。
生物大分子的分子量:蛋白质用u或ku,核酸用bp或kb表示。

