L-丝氨酸/壳聚糖/石墨烯/纳米金修饰电极的制备及应用
高宝平,郭满栋,李 玲
(1.山西师范大学 化学与材料科学学院,山西 临汾 041004;2.吕梁学院 汾阳师范分校,山西 汾阳 032200)
L-丝氨酸/壳聚糖/石墨烯/纳米金修饰电极的制备及应用
高宝平1,2,郭满栋1,李 玲1
(1.山西师范大学 化学与材料科学学院,山西 临汾 041004;2.吕梁学院 汾阳师范分校,山西 汾阳 032200)
将L-丝氨酸(L-Serine)电聚合到裸金电极表面,再将壳聚糖(CS)、纳米金(Nano-Au)、石墨烯(GO)混合液滴涂在L-丝氨酸修饰的金电极上,制成L-Serine/GO/Nano-Au/CS/Au/CME电化学传感器.考察了胞嘧啶在该传感器上的电化学行为,优化了实验条件.结果表明,该传感器对胞嘧啶有良好的选择性和灵敏度,胞嘧啶的浓度在1.0×10-7~1.0×10-3mol/L范围内与峰电流的减小量呈现良好的线性关系,检出限为3.2×10-8mol/L(S/N= 3).将该传感器应用于实际样品中测定胞嘧啶,结果令人满意.
胞嘧啶;石墨烯;纳米金;L-丝氨酸;壳聚糖;电化学
胞嘧啶(Cytosine, C),是构成核酸的嘧啶类碱基之一,是生物体中参与DNA和RNA合成的重要活性原料,在生物的遗传、变异、免疫、发育等生命活动中扮演着重要角色,是一种重要的药品,也是精细化工、农药和医药的重要中间体[1-6].胞嘧啶在化学化工和药物化学领域应用前景十分广泛,特别在医药领域,主要用于合成抗艾滋病药物及抗乙肝药物拉米夫定,抗癌药物吉西他宾、依诺他宾以及5-氟胞嘧啶等[7].检测胞嘧啶常用的方法有高效液相色谱法[8]、拉曼光谱法[9]等,关于胞嘧啶的电化学[10]测定方面的文献还不多见.高效液相色谱法检测结果准确、精度高,但成本高、步骤繁琐、耗时长.拉曼光谱法操作简便、耗时短、灵敏度高,但干扰因素较多,抗干扰能力不强.因而有必要寻求一种简单、快速、廉价且有效的检测方法.
本文作者将L-丝氨酸(L-Serine)电聚合到裸金电极表面,再将壳聚糖(CS)、纳米金(Nano-Au)、石墨烯(GO)混合液滴涂在L-丝氨酸修饰的金电极上,制成L-Serine/GO/Nano-Au/CS/Au/CME电化学传感器.该传感器不仅识别性能好,灵敏度高,制备方法简单,且成本较低,有望在实际应用中快速测定胞嘧啶.
1 实验部分
1.1 仪器与试剂
LK2005A型电化学工作站(天津兰力科化学电子高技术有限公司);三电极体系:以d=2 mm的金电极为工作电极,Ag/AgCl(饱和KCl)电极为参比电极,铂丝电极为辅助电极;JSM-7500F型扫描电子显微镜(日本电子);KQ-250B型超声波清洗仪(昆山市超声波仪器制造厂).
胞嘧啶(上海源聚生物科技有限公司,超纯),L-丝氨酸、壳聚糖(国药集团化学试剂有限公司,分析纯),鳞片石墨粉(天津光复精细化工研究所,化学纯),氯金酸(武汉鑫思锐科技有限公司,分析纯),铁氰化钾、亚铁氰化钾(天津光复精细化工研究所,分析纯),其余试剂均为分析纯.实验用水为二次蒸馏水.
1.2 实验方法
1.2.1 金电极的预处理及纳米金、石墨烯的制备
参照文献[11]对金电极预处理及制备实验所需纳米金,参照文献[12-13]用改进Hummers法制备实验所用的氧化石墨烯,并用扫描电镜与透射电镜进行表征,如图1所示.
1.2.2L-Serine/Au电极的制备
将处理好的金电极置于10.0 mL 1.5×10-3mol/LL-丝氨酸溶液的电解池中,用循环伏安法扫描10次(电位区间:-0.6~2.6 V,扫速:0.05 V/s),使L-丝氨酸电聚合在裸金电极的表面上,在室温下避光保存、晾干24 h后使用.
1.2.3L-Serine/GO/Nano-Au/CS/Au/CME电极的制备
准确称取4 mg壳聚糖(CS)置于0.2 mL冰乙酸进行溶解,然后稀释至1 mL,在超声波中超声至壳聚糖完全溶解,制成壳聚糖(CS)储备液.于新配制的壳聚糖溶液中加入400.0 μL新制备的纳米金溶胶,之后加入200.0 μL 0.06 g/L的氧化石墨烯储备液继续超声至三者混合均匀.用微型进样器将5.0 μL混合液滴涂在L-丝氨酸修饰的金电极上,在室温下避光、晾干24 h后使用.制备流程如图2所示.


图1 氧化石墨烯的SEM图(A)TEM图(B)Fig.1 SEM image of graphite oxide (A) and TEM image of GO film (B)

图2 修饰电极的制备过程Fig.2 Schematic for the preparation of the modified electrode
2 结果与讨论
2.1L-Serine的电化学性质表征
图3为将裸金电极置于1.5×10-3mol/L的L-Serine中电聚合过程的循环伏安曲线,由图3可知,L-Serine在聚合过程中,随着扫描圈数的增加,L-Serine的还原峰电流逐渐增大,表明聚L-Serine膜导电.
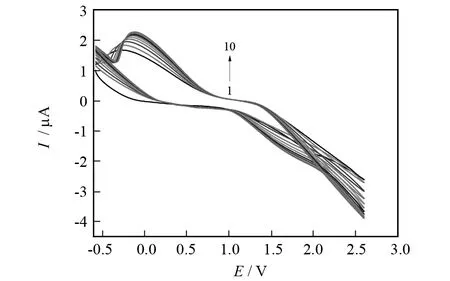
聚合底液:1×10-3 mol/L L-Serine, scan rate:50 mV/s,sweep cycle:10.图3 L-Serine聚合循环伏安图Fig.3 Cyclic voltammograms for the electropolymerization of 1 m mol/L L-Serine at bare Au electrode
2.2 修饰电极的电化学表征
用循环伏安法在扫速为0.1 V/s的条件下,以Fe(CN)63-/4-作为分子探针对修饰过程中电极表面的变化进行表征.图4是裸金电极与各种修饰电极在含2.5×10-3mol/L K3Fe(CN)6液溶中的循环伏安图.裸金电极在Fe(CN)63-/4-溶液中出现一对较弱的氧化还原峰(曲线a).当在裸金电极表面电聚合一层L-Serine薄膜后(曲线b),峰位置发生明显偏移,说明L-Serine聚合在了电极表面.把CS与纳米金(Nano-Au)的混合物滴涂在L-Serine修饰的裸金电极上后(曲线c),峰电流增加不明显,原因可能是加有CS的缘故,CS本身的导电性差,阻碍了电极表面电子的传递,同时纳米金溶胶有较大的比表面积和优良的导电性和化学稳定性,固峰电流增加不明显.把GO、Nano-Au、CS混合液滴涂在L-Serine修饰的裸金电极上后(曲线d)峰型和峰位置同曲线c相比未发生明显偏移,峰高明显增加,说明GO良好的导电性促进了电极表面电子的传递.

图4 a.裸金电极;b.L-Serine/Au/CME;c.L-Serine/Nano-Au/CS/Au/CME;d.L-Serine/GO/Nano-Au/CS/Au/CME在Fe(CN)6 3-/4- 溶液中的循环伏安图(扫速:0.1 V/s)Fig.4 Cyclic voltammograms of different the electrodes in Fe(CN)6 3-/4- (a) Bare gold electrode; (b) L-Serine/Au/CME; (c) L-Serine/Nano-Au/CS/Au/CME; (d) L-Serine/GO/Nano-Au/CS/Au/CME (scan rate:0.1 V/s)
2.3 胞嘧啶循环伏安行为的研究
以K3[Fe(CN)6]作为电化学探针,对Cytosine在该修饰电极进行循环伏安检测.如图5所示,L-Serine/GO/Nano-Au/CS/Au/CME修饰电极在空白缓冲溶液(a)中进行循环伏安扫描时,在0.526 V处出现一个灵敏的还原峰p1(Ip1=40.607 7 μA)和一个不太灵敏的氧化峰p2,当把该修饰电极放在含有1.0×10-6的Cytosine的pH=5.4的柠檬酸-柠檬酸钠缓冲溶液(b)中进行循环伏安扫描时,p1峰电流明显下降(Ip1=33.851 3 μA)峰电位几乎不变,而p2峰电流也有明显变化.说明修饰电极对Cytosine有明显的响应,Cytosine的加入抑制了修饰电极的活性,导致还原峰电流较空白溶液中的峰电流明显降低.
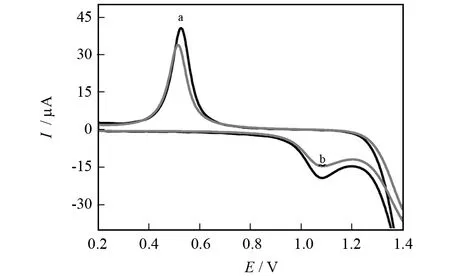
图5 L-Serine/GO/Nano-Au/CS/Au/CME在柠檬酸-柠檬酸钠缓冲溶液(a)和含Cytosine (1.0×10-6 mol/L)的缓冲溶液中(b)的循环伏安图Fig.5 Cyclic voltammogram of (a)in blank buffer solution; (b)L-Serine/GO/Nano-Au/CS/Au/CME with Cy-tosine in the buffer solution(scan rate:0.1 V/s)
2.4 实验条件的优化
2.4.1 缓冲溶液的选择
分别在PBS(pH=7.15)、HAc-NaAc(pH=4.37)、KH2PO4-硼砂(pH=7.53)、硼砂-NaOH(pH=9.80)、柠檬酸-柠檬酸钠(pH=5.4)等缓冲溶液中用循环伏安法测定Cytosine在L-Serine/GO/Nano-Au/CS/Au/CME的电化学行为.实验结果表明:该电极在柠檬酸-柠檬酸钠缓冲溶液中CV曲线峰型良好,峰电流差较高且干扰和背景电流较小,所以本实验选用柠檬酸-柠檬酸钠缓冲溶液为底液.
2.4.2 pH的选择
用柠檬酸-柠檬酸钠缓冲溶液为底液,考察了1×10-5mol/L Cytosine在不同pH的缓冲溶液中L-Serine/GO/Nano-Au/CS/Au/CME的电化学行为.如图6所示,当pH≤5.4时,Cytosine加入前后峰电流差随着pH增加而增加;当pH>5.4时,随着pH的增加峰电流差反而减小.在pH=5.4的柠檬酸-柠檬酸钠缓冲溶液中,L-Serine/GO/Nano-Au/CS/Au/CME对Cytosine的响应最好,响应的峰电流差最高,且峰型也最好,所以本实验选用pH=5.4的柠檬酸-柠檬酸钠缓冲溶液作为底液.
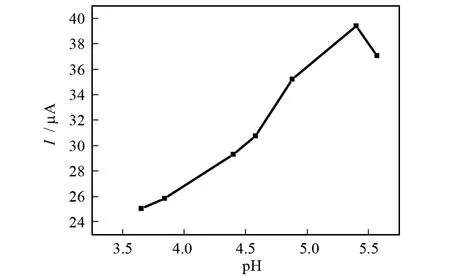
图6 pH对峰电流的影响Fig.6 Influence of pH to peak current
2.4.3 扫速的影响
研究了Cytosine在L-Serine/GO/Nano-Au/CS/Au/CME上不同扫描速率下峰电流的变化.随着扫描速率的增加,还原峰电流减小量也逐渐增加,还原峰电位发生负移.在50~250 mV/s的扫速范围内,还原峰电流减小量随着扫速ν的增大而增加,说明Cytosine在L-Serine/GO/Nano-Au/CS/Au/CME的电极反应过程主要受表面吸附控制.
2.4.4 线性范围、检出限
实验配置了一系列不同浓度的Cytosine标准溶液,采用循环伏安法对其电化学响应进行测定.如图7所示,随着Cytosine浓度的不断增大,还原峰和氧化峰电流逐渐减小.实验表明,胞嘧啶浓度在1.0×10-7~1.0×10-3mol/L范围内与还原峰电流的减小量呈良好的线性关系.其线性方程为:
I=-213.958 73c+42.888 83,R2=0.998 52
检出限为3.2×10-8mol/L(S/N=3),说明此方法对Cytosine的检测有较高的灵敏度.
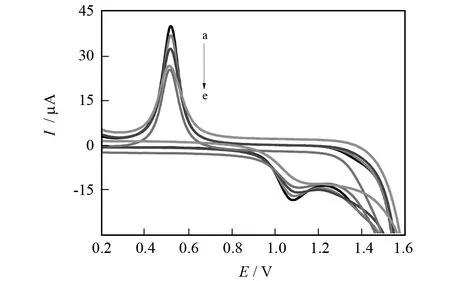
图7 不同浓度的循环伏安图Fig.7 CV of different concentration
2.4.5 共存离子的干扰
在最佳实验条件下,分别加入50倍的尿嘧啶、尿酸、抗坏血酸、葡萄糖、鸟嘌呤、L-半胱氨酸以及30倍的葡萄糖、巴比妥、肾上腺素、多巴胺,用L-Serine/GO/Nano-Au/CS/Au/CME对 1×10-6mol/L的胞嘧啶进行测定,结果表明这些物质的加入对胞嘧啶的测定几乎不产生干扰.
2.4.6 稳定性、重现性
新制备5根L-Serine/GO/Nano-Au/CS/Au/CME修饰电极,连续使用1 w,电流响应基本保持不变,说明该修饰电极很稳定.用同一根电极对1×10-5mol/L的Cytosine平行测定5次,电流响应RSD为2.3125%,说明该修饰电极有良好的重现性.
2.4.7 回收率的测定
准确称取一定量胞嘧啶,用二次蒸馏水溶解后定容至100 mL容量瓶中,用差分脉冲伏安法进行电化学测量.然后加入一定量的标准品进行回收率测定,测定结果如表2,回收率为94.0%~106.0%,表明此方法有望在实际应用中测定胞嘧啶.

表1 平行测定胞嘧啶电流响应(1.0×10-5 mol/L)Table 1 Cytosine parallel determination and the peak current(1.0×10-5 mol/L)

表2 胞嘧啶的回收率测定Table 2 Determmation results of cytosine
3 结论
将L-丝氨酸聚合到裸金电极表面,并将CS、Nano-Au、GO混合物修饰在L-丝氨酸修饰的金电极上,制成L-Serine/GO/Nano-Au/CS/Au/CME修饰电极,通过实验条件的优化,获得了测定胞嘧啶的最佳条件,并采用循环伏安法、差分脉冲伏安法研究了胞嘧啶在该修饰电极上的电化学行为,胞嘧啶浓度在1.0×10-7~1.0×10-3mol/L浓度范围内与峰电流的减小量呈良好的线性关系,检出限为3.2×10-8mol/L(S/N=3),该修饰电极制备方法简单、廉价,有望在实际应用中测定胞嘧啶.
[1] 郭琳娜,李欣倩,毛武涛.嘧啶的合成工艺改进[J].合成化学,2015,23(9):858-860.
GUO L N,LI X Q,MAO W T.Process improvement on the synthesis of cytosine [J].Chinese Journal of Synthetic Chemistry,2015,23(9):858-860.
[2] 陈华鹏,张淑琴,董俊国,等.质子化胞嘧啶碰撞诱导解离的实验和理论研究[J].质谱学报,2015,36(5):385-393.
CHEN H P,ZHANG S Q,DONG J G,et al.Experimental and theoretical study of collision-induced dissociation of protonated cytosine [J].Journal of Chinese Mass Spectro-metry Society,2015,36(5):385-393.
[3] WANG P,WU H,DAI Z,et al.Simultaneous detection of guanine,adenine,thymine andcytosine at choline monolayer supported multiwalled carbon nanotubes film [J].Biosensors and Bioelectronics,2011,26:3339-3345.
[4] SHEN Q,WANG X.Simultaneous determination of adenine,guanine and thymine based onβ-cyclodextrin/MWNTs modified electrode [J].Electroanalytical Chemistry,2009,632:149-153.
[5] CEKAN P,SIGURDSSON S T.Identification of single-base mismatches in duplex DNA by EPR spectroscopy [J].Journal of the American Chemical Society,2009,131:18054-18056.
[6] PIETRZYK A,SURIYANARAYANAN S,KUTNER W,et al.Molecularlyimprinted polymer (MIP) based piezoelectric microgravimetry chemosensor for selective determination of adenine [J].Biosensors and Bioelectronics,2010,25(1):2522-2529.
[7] ABBASPOUR A,GHAFFARINEJAD A.Preparation of a sol-gel-derived carbon nanotube ceramic electrode by microwave irradiation and its application for the determination of adenine and guanine [J].Electrochimica Acta,2010,55(3):1090-1096.
[8] 邓大君.用变性高效液相色谱检测CpG岛胞嘧啶甲基化[J].南昌大学学报,2001,43(2):1-3.
DENG D J.Analysis of the methylation in CpG island by denaturing high-performance liquid chromatography [J].Journal of Nanchang University,2001,43(2):1-3.
[9] 王贺陶,陈茂笃,赵万利,等.胞嘧啶分子拉曼光谱研究[J].光散射学报,2008,20(1):7-12.
WANG H T,CHEN M D,ZHAO W L,et al.A study of Raman spectroscopy on cytosine [J].The Journal of Light Scattering,2008,20(1):7-12.
[10] 赵明,汪正浩,胡志彬.胞嘧啶电化学还原的ESR研究[J].化学学报,1987(45):731-736.
ZHAO M,WANG Z H,HU Z B.An ESR study on electrochemical reduction of cytosine [J].Acta Chimica Sinica,1987(45):731-736.
[11] 蔡志芳,刘计敏,郑崇涛,等.葡萄糖氧化酶在纳米金/壳聚糖/离子液体[BMIM]PF6修饰电极上的直接电化学及其应用[J].分析科学学报,2015,31(1):17-22.
CAI Z F,LIU J M,ZHEN C T,et al.Direct electrochemistry of glucose oxidase on nano-Au/chitosan/ionic liguid BMIMPF6 modified electrode and its application [J].Journal of Analytical Science,2015,31(1):17-22.
[12] HUANG K J,WANG L,WANG H B,et al.Electrochemical biosensor based on silver nanoparticles-polydopamine-graphene nanocomposite for sensitive determination of adenine and guanine [J].Talanta,2013,114(114):43-48.
[13] 洪菲,周立群,黄莹,等.改进Hummers法化学合成石墨烯及其表征[J].化学与生物工程,2012,29(5):31-33.
HONG F,ZHOU L Q,HUANG Y,et al.Synthesis and characterization of graphene by improved Hummers method [J].Chemistry & Bioengineering,2012,29(5):31-33.
[责任编辑:吴文鹏]
Preparation and application ofL-serine/chitosan/graphene/nano-Au modified electrode
GAO Baoping1,2, GUO Mandong1*, LI Ling1
(1.DepartmentofChemistry,ShanxiNormalUniversity,Linfen041004,Shanxi,China; 2.LüliangCollegeFenyangTeachers’SchoolBranch,Fenyang032200,Shanxi,China)
A modified electrode(L-serine/chitosan/graphene/nano-Au/Au/CME)was successfully prepared using theL-Serine modified gold electrode modified with quantitative chitosan,graphene and nano gold by a drop-coating method.The electrochemical behavior of cytosine at the modified electrode was investigated by cyclic voltammetry (CV) and different pulse voltammetry (DPV).The results showed that the modified electrode ethibited a good selectivity and sensitivity to cytosine.Under the optimum experimental condition,a linear relationship between decrease of the peak current and the concentration of cytosine was obtained in the range of 1.0×10-7-1.0×10-3mol/L and the determination limit of cytosine was 3.2×10-8mol/L (S/N= 3).The modified electrode was applied to the determination of cytosine in practical samples with satisfactory results.
cytosine; graphene; nanogold;L-serine; chitosan; electrochemistry
2016-07-19.
山西省自然科学基金(20001057).
高宝平(1976-),男,讲师,主要从事电分析化学研究.*
,E-mail:guomd123@163.com.
O657.1
A
1008-1011(2017)01-0102-06

