一氧化氮供体纳米复合物的合成与性质研究
王丽颖,杨彦萍,王 丽,王 兵,孙 捷*
(1.山东省电力中心医院,山东 济南 250001;2.青岛经济技术开发区第一人民医院,山东 青岛 266555;3.山东省医学科学院药物研究所,山东 济南 250062)
一氧化氮供体纳米复合物的合成与性质研究
王丽颖1*,杨彦萍2,王 丽1,王 兵3,孙 捷3*
(1.山东省电力中心医院,山东 济南 250001;2.青岛经济技术开发区第一人民医院,山东 青岛 266555;3.山东省医学科学院药物研究所,山东 济南 250062)
一氧化氮供体纳米复合物由谷胱甘肽(GSH)包覆的Mn掺杂的ZnSe量子点和一氧化氮(NO)光敏供体复合而成.它通过双光子激发诱导RBS分解释放NO可以实现NO的可控释放.本方法顺利实现了静电自组装,合成的纳米复合材料作为智能药物载体具有很大的开发潜力.该量子点纳米复合材料对NO释放采用双光子激发的可控释放,释放的一氧化氮表现出显著的癌症细胞杀伤活性.
量子点;一氧化氮;肿瘤
量子点因为其独特的光学性能和生物医学上的应用,在过去的五年中产生了广泛的关注[1-2].在应用中,量子点显示出可调的、高效的和长时间的光致发光能力,并有超过有机染料和荧光蛋白的灵敏度和分辨率[3].然而,量子点中的有毒重金属离子抑制了其在医学进一步的应用[4].过渡金属离子(如锰)掺杂量子点无重金属离子可以克服传统量子点以上问题.尽管锰离子也有一定的毒性,但相对而言它是可以接受的[4-5].
宽带隙量子点如Mn离子掺杂ZnSe量子点作为新一代发光纳米材料,引起了广泛的关注.但以往的研究主要致力于掺杂Mn离子的ZnSe量子点的合成和光致发光应用[5-8],关于它的双光子激发荧光(TPEF)特点及相关的应用几乎没有任何报道.双光子激发荧光量子点在化学和生物医学中的应用有其独特优势[9-11].掺杂Mn离子的ZnSe量子点双光子吸收行为在已有文献中有提及[12].但到目前为止,其引起药物释放并杀死癌细胞的报告还没有.
在这里,我们介绍一种多功能纳米复合材料,它是由谷胱甘肽(GSH)包覆的Mn掺杂的ZnSe量子点和一氧化氮(NO)光敏供体复合而成,顺利实现了静电自组装,它通过双光子激发诱导RBS光解释放NO可以实现NO的可控释放.作为智能药物载体具有很大的开发潜力.该量子点纳米复合材料对NO释放采用双光子激发的可控释放,且释放NO具有显著的癌症细胞杀伤活性,经我们的研究证明这归功于NO诱导的对癌细胞的细胞毒性.
作为光敏NO供体,RBS已经在早期的研究报告中报道,在紫外光或可见光波长的照射下RBS光解产生NO的释放[13-15].最近,谭连江等制备壳聚糖包覆掺杂锰的ZnS量子点,然后结合RBS形成量子点 RBS壳聚糖复合材料[16].这些复合材料可以在双光子激发下进行NO的释放,但复合材料的合成相对复杂.此外,此复合材料没有进一步应用于肿瘤治疗领域.相比之下,我们提出的量子点纳米复合材料双光子激发(1 130 nm激光)会引发NO释放.而且释放的NO有着显着的癌细胞毒性.该智能量子点纳米复合材料在双光子激发下有着多种用途,比如利用控制NO释放用于癌症治疗或心脑血管疾病的治疗,这在生物医学应用中有重要意义.
1 实验部分
1.1 试剂与仪器
氯化锰、亚硒酸钠、谷胱甘肽,麦克林试剂;硝酸锌,阿拉丁试剂;其他为常用分析纯试剂.
昆山舒美超声波清洗器KQ3200,昆山超声仪器有限公司;CW红外激光发射器,光纤通信技术有限公司;79-1磁力搅拌器,江苏省金坛市环宇科学仪器厂;深度制冷EMCCD-DU897,安道尔科技公司;紫外可见分光光度计U3000,日立有限公司.
1.2 谷胱甘肽包覆的掺杂锰离子的ZnSe量子点的合成
谷胱甘肽包覆的掺杂锰离子的ZnSe量子点的合成使用王超课题组[4]的合成方法.在100 mL三颈烧瓶中加入1 mL 12.5 mol/L的MnCl2溶液,然后通入N2脱气30 min.将新鲜制备的亚硒酸钠溶液加入到N2饱和的氯化锰溶液中,在谷胱甘肽(GSH)作为稳定剂的条件下调节pH至11.随后,反应在氮气保护下回流30 min,温度为95 ℃,然后加入10 mL 12.5 mol/L的Zn(NO3)2溶液继续回流5 h.反应中,锰、硒、锌、谷胱甘肽的物质的量比例为1∶25∶40∶1 200.5 h后,将混合物冷却至室温,再加入锰杂ZnSe量子点继续搅拌可得谷胱甘肽包覆的掺杂锰离子的ZnSe量子点.所得量子点可以采用乙醇沉淀纯化,沉淀物离心分离,用乙醇-水洗涤多次,然后真空干燥.取得的粉末进行表征研究.
1.3 谷胱甘肽包覆的掺杂锰离子的ZnSe量子点与一氧化氮供体纳米复合物的合成
RBS,[ Fe4S3(NO)7]-Roussin Black Salt(陆森黑盐),是一种一氧化氮供体,可释放NO.根据文献[17]所述的方法进行预处理,将RBS以固体形式放在惰性气体中避光保存.在搅拌和超声下,RBS水溶液10 mL缓慢滴加入量子点的水悬浮液形成量子点-RBS纳米复合材料.不需任何后处理,所得到的量子点-RBS纳米复合材料进行表征和发射光谱的吸收值测定.这些材料可以用乙醇沉淀来纯化,沉淀离心分离,用乙醇-水洗涤多次,然后干燥,在后续的实验中进一步研究.
2 结果与讨论
我们将谷胱甘肽包覆的掺杂锰离子的ZnSe量子点用透射电子显微镜(TEM)进行了表征.所制备的量子点平均粒径为6.7 nm且均匀分散.高分辨率TEM清晰显示了纳米晶体的晶格条纹,晶面间距为0.32 nm.选择性区域电子衍射(SAED)图像表明衍射环与ZnSe闪锌矿相晶格匹配.量子点和纳米复合物的电子自旋共振(ESR)光谱表明二者信号相似.
在静电相互作用下,带负电荷的RBS与带正电的GSH的氨基在量子点表面结合,使QDs-RBS 纳米复合材料形成.我们对量子点的光致发光进行了研究,光致发光的激发光谱在385 nm有最大吸收峰,并且在1 130 nm有一个宽的吸收峰.这两个典型的峰分别源于QDs-RBS 纳米复合材料单光子吸收(SPA)和双光子吸收(TPA)[18].此外,我们记录了QDs-RBS 纳米复合物的单和双光子激发发射光谱.在图1中,无论是单光子和双光子诱导的发射峰都在570 nm.385 nm激光激发的SPA介导发射应为锰离子状态改变产生的.ZnSe量子点的光致发光未观察到,表明锰离子掺杂在量子点内.
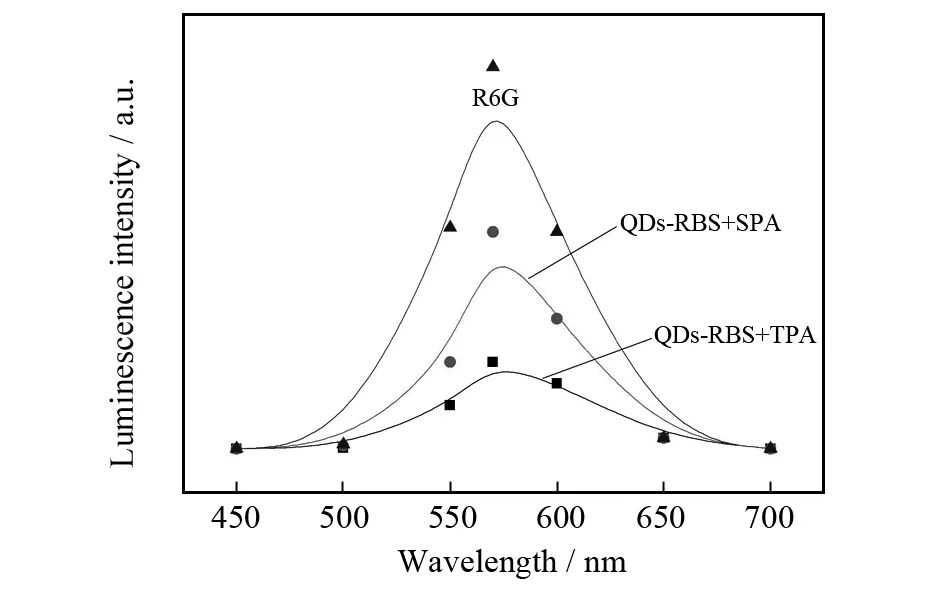
图1 QDs-RBS 纳米复合材料单和双光子激发发射光谱Fig.1 Single- and two-photon excited PL emission spectra of QDs-RBS
2.1 QDs-RBS 纳米复合物细胞毒性研究
为评价纳米复合物的细胞毒性,HeLa细胞在10%血清的基本培养液中培养,在细胞培养箱中含有5% 的CO2,温度37 ℃,Hela细胞用胰蛋白酶溶液表面分离,等分后接种到96孔板中.培养24 h后,在37 ℃下,用10 mL含有不同浓度(0,0.01,0.05,0.1,0.5,1 g/L)QDs-RBS和1 g/L的无血清细胞培养基代替原来的培养基.处理后的细胞孵育24 和48 h,在37 ℃下黑暗培养,或1 130 nm激光照射0~12.5 min,经照射的细胞与不照射的低细胞死亡组对比.最后,对HeLa细胞的死亡率,采用MTT法检测[18].
浓度为1 g/L下,相比阴性对照(HeLa细胞无QDs-RBS)超过88% (84%)的HeLa细胞无光照下存活24 h (48 h),如图2所示.在相同的条件下,不少于87%的HeLa细胞与量子点共培养后存活48 h,这些证明了在黑暗中此纳米复合物的毒性很小.在利用激光器输出的1 130 nm激光照射(0.5 W)后,我们发现HeLa细胞存活率明显降低,如图3所示.特别是12.5 min的连续激光照射导致几乎全部的(不少于98%)HeLa细胞死亡,其阴性对照细胞死亡小于15%.此外,无复合物存在下,在照射功率高达5 W和5 min的连续照射, HeLa细胞存活率为90%.这些结果显示,复合物没有激光照射本身不能诱导显著的细胞毒性,表明其低毒性不影响其在生物医学系统中的应用.

图2 黑暗中与不同浓度QDs-RBS复合物孵育的HeLa细胞的存活率Fig.2 Viabilities of HeLa cells incubated with QDs-RBS of different concentrations in dark
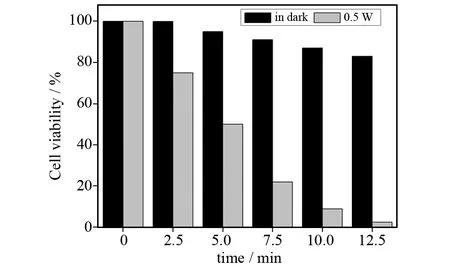
图3 黑暗中与1 130 nm激光照射(0.5 W)下与1.0 g/L的QDs-RBS复合物孵育的HeLa细胞存活率Fig.3 Viabilities of HeLa cells incubated with 1.0 g/L of QDs-RBS,in dark and under irradiation with a 1 130 nm laser of 0.5 W
2.2 QDs-RBS 纳米复合物稳定性研究
QDs-RBS纳米复合物稳定性研究需要记录TPEF光谱测量和相应的TPEF荧光强度.一个0~5 W可调连续波CW红外激光发射器(1 130 nm)作为激光源和一个 Andor DU897 EMCCD作为信号采集器.纳米复合材料的水悬浮液是由CW红外激光在1 130 nm聚焦照射,TPEF荧光强度在500~650 nm波段记录.具体来说,为探讨该量子点纳米复合物的稳定性,复合物的水悬浮液(50 g/L)是在1 mmol/L PBS溶液(pH 7.4)和胎牛血清(10%)中37 ℃孵育[19-20].用1 130 nm激光照射(0.5 W),记录在不同的时间间隔(0~72 h)下复合物的TPEF荧光强度.此外,QDs-RBS的水悬浮液(50 g/L)也用2.5 W的激光持续照射,在不同的时间间隔检测(0~2 h).
实验结果证明,当照射激光(2.5 W)达2 h,QDs-RBS的TPEF强度变为原始值的91%,这揭示了该材料低光漂白性能.QDs-RBS 复合材料在磷酸盐缓冲液(PBS)和胎牛血清(FBS)中孵育72 h后, TPEF没有显著的下降(小于12%),也没有明显的聚集或沉淀.上述结果说明了复合物的稳定性,从而意味着该纳米复合材料有潜在的生物医学应用前景.
2.3 NO浓度的研究方法
为确定水溶性介质(PBS,10 mmol/L,pH 7.4)中NO释放速度,我们使用格里斯比色反应来测量PBS中的亚硝酸盐或硝酸盐含量[21-26].测定方法是将含有复合物(1.0 g /L,5 mL) 的等量PBS溶液放入离心管在37 ℃水浴搅拌,分别用激光器输出的1 130 nm激光照射(用不同的0~2.5 W辐射功率以及不同照射时间).经过适当的时间,将PBS溶液离心10 min,取上清液(0.5 mL),加入适量PBS,然后加入格里斯试剂组合(I)和格里斯试剂(II).之后,所得到的混合物溶液在室温下避光孵育15 min,紫红色的颜色立即出现.用紫外可见光分光光度计在540 nm下记录每个样品溶液的吸光值.通过测定亚硝酸钠的吸光度测定的标准曲线(0~100 umol/L),计算NO的总释放量.
算法如下所示:
R1=c1×0.005;
R2=c2×0.005 +c1×0.001;
R3=c3×0.005 +(c2+c1)×0.001;
.......
Rn=cn×0.005 +(cn-1+cn-2+……+c1)× 0.001
Rn表示NO总量,cn表示NO浓度.
实验结果表明,照射的激光在不同功率的0.5~2.5 W下, NO释放浓度随激光功率的增加而增加,如图4所示.没有激光照射(0 W,在黑暗中),几乎没有检测到NO,表明无NO释放.在NO的达到最大浓度后,开始缓慢减少,在较低的功率照射下,减少是不太明显的.减少是由于NO的氧化.控制NO释放的“开关”是1 130 nm激光照射(0.5 W).连续照射2.5 min后,释放NO的浓度被记录.停止照射2.5 min后,RBS的量子点纳米复合材料再次连续照射2.5 min.如图5所示,NO释放曲线变为梯度,表示激光照射下该材料具有响应快、重复疲劳影响小的特点.

图4 不同照射功率下NO释放示意图Fig.4 Concentrations of NO released from QDs-RBS under irradiation of different irradiation powers

图5 激光照射下QDs-RBS复合物释放NO“开-关”示意图Fig.5 “On-off” release behavior of NO from QDs-RBS in PBS irradiated by the laser
3 结论
研究了1 130 nm激光连续照射下TPEF诱导的NO释放行为并进行了NO的定量检测,研究结果表明激光照射下QDs-RBS复合物具有响应快、可持续释放的特点.稳定性研究的结果说明了复合物的稳定性,从而意味着该纳米复合材料有潜在的生物医学应用前景,用MTT试验检查该纳米复合材料的细胞毒性.发现复合物在激光照射下具有很强的细胞毒性,而没有激光照射下其本身不能诱导显著的细胞毒性,这些实验结果表明上述细胞的死亡主要是由于光触发NO释放,其材料本身的低毒性不足以杀死细胞,故不影响其在生物医学系统中的应用.在1 130 nm激光辐照下,QDs-RBS复合物产生TPEF (约570 nm),导致TPEF介导的RBS光解和NO的释放,且产生的NO导致明显的细胞毒性.这说明所合成的材料可以实现NO光控释放和NO介导的癌症治疗.
综上所述,本文报道了通过静电相互作用的QDs-RBS的合成方法.并证明了该材料可以用于NO光控释放.对该材料对其他疾病的治疗作用,比如和NO有关的心脑血管疾病及炎症,将做进一步的研究.
[1] MICHALET X,PINAUD F F,BENTOLILA L A,et al.Quantum dots for live cells,in vivo imaging,and diagnostics [J].Science,2005,307(5709):538-544.
[2] ZRAZHEVSKIY P,SENA M,GAO X.Cheminform abstract:designing multifunctional quantum dots for bioimaging,detection,and drug delivery [J].Chemical Society Reviews,2011,42(6):4326-4354.
[3] FREEMAN R,WILLNER I.Cheminform abstract:optical molecular sensing with semiconductor quantum dots (QDs) [J].Chemical Society Reviews,2012,41(10):4067-4085.
[4] WANG C,GAO X,MA Q,et al.Aqueous synthesis of mercaptopropionic acid capped Mn2+-doped ZnSe quantum dots [J].Journal of Materials Chemistry,2009,19(38):7016-7022.
[5] WU P,YAN X P.Doped quantum dots for chemo/biosensing and bioimaging [J].Chemical Society Reviews,2013,42(12):5489-5521.
[6] PRADHAN N,BATTAGLIA D M,LIU Y,et al.Efficient,stable,small,and water-soluble doped ZnSe nanocrystal emitters as non-cadmium biomedical labels [J].Nano Letters,2007,7(2):312-317.
[7] PRADHAN N,SARMA D D.Advances in light-emitting doped semiconductor nanocrystals [J].The Journal of Physical Chemistry Letters,2011,2(21):2818-2826.
[8] XUE G,TANG G,YANG L,et al.A novel optical nanoprobe for trypsin detection and inhibitor screening based on Mn-doped ZnSe quantum dots [J].Analytica Chimica Acta,2012,743(3):131-136.
[9] SUBHA R,NALLA V,YU J H,et al.Efficient photoluminescence of Mn2+-doped ZnS quantum dots excited by two-photon absorption in near-infrared window II [J].The Journal of Physical Chemistry C,2013,117(40):20905-20911.
[10] GUI R,JIN H,LIU X,et al.Upconversion luminescent logic gates and turn-on sensing of glutathione based on two-photon excited quantum dots conjugated with dopamine [J].Chemical Communications,2014,50(94):14847-14850.
[11] JIN H,GUI R,WANG Z,et al.Two-photon excited quantum dots with compact surface coatings of polymer ligands used as an upconversion luminescent probe for dopamine detection in biological fluids [J].Analyst,2015,140(6):2037-2043.
[12] MORE D,RAJESH C,LAD A D,et al.Two photon absorption in Mn2+doped ZnSe quantum dots [J].Optics Communications,2010,283(10):2150-2154.
[13] GARCIA J V,YANG J,SHEN D,et al.Nir-triggered release of caged nitric oxide using upconverting nanostructured materials [J].Small,2012,24(24):3800-3805.
[14] TAN L,WAN A,ZHU X,et al.Visible light-triggered nitric oxide release from near-infrared fluorescent nanospheric vehicles [J].Analyst,2014,139(13):3398-3406.
[15] GUI R,WAN A,ZHANG Y,et al.Light-triggered nitric oxide release and targeted fluorescence imaging in tumor cells developed from folic acid-graft-carboxymethyl chitosan nanospheres [J].RSC Advances,2014,4(57):30129-30136.
[16] TAN L,WAN A,ZHU X,et al.Nitric oxide release triggered by two-photon excited photoluminescence of engineered nanomaterials [J].Chemical Communications,2014,50(43):5725-5728.
[17] SEYFERTH D,GALLAGHER M K,Cowie M.The bridging sulfide anion reactivity of Roussin’s red salt [J].Organometallics,2002,5(3):539-548.
[18] YU J H,KWON S H,PETRášEK Z,et al.High-resolution three-photon biomedical imaging using doped ZnS nanocrystals [J].Nature Materials,2013,12(4):359-366.
[19] GUI R,WANG Y,JIE S.Embedding fluorescent mesoporous silica nanoparticles into biocompatible nanogels for tumor cell imaging and thermo/pH-sensitive in vitro drug release [J].Colloids Surface B,2014,116C(14):518-525.
[20] GUI R,WAN A,LIU X,et al.Water-soluble multidentate polymers compactly coating Ag2S quantum dots with minimized hydrodynamic size and bright emission tunable from red to second near-infrared region [J].Nanoscale,2014,6(10):5467-5473.
[21] BUTLER A R,WILLIAMS D L H.The physiological role of nitric oxide [J].Chemical Society Reviews,1993,22(22):233-241.
[22] TAN L,WAN A,LI H,et al.Novel quantum dots-carboxymethyl chitosan nanocomposite nitric oxide donors capable of detecting release of nitric oxide in situ [J].Acta Biomaterialia,2012,8(10):3744-3753.
[23] TAN L,WAN A,LI H.Quantum dots-poly(N-isopropylacrylamide) hybrid nanogel diazeniumdiolates as donors and real-time probes of nitric oxide [J].Materials Chemistry and Physics,2013,138(2/3):956-962.
[24] KANDOTH N,MALANGA M,FRAIX A,et al.A host-guest supramolecular complex with photoregulated delivery of nitric oxide and fluorescence imaging capacity in cancer cells [J].Chemistry-An Asian Journal,2012,7(12):2888-2894.
[25] ZHENG Q,BONOIU A,OHULCHANSKYY T Y,et al.Water-soluble two-photon absorbing nitrosyl complex for light-activated therapy through nitric oxide release [J].Molecular Pharmacology,2008,5(3):389-398.
[26] BURKS P T,GARCIA J V,GONZALEZIRIAS R,et al.Nitric oxide releasing materials triggered by near-infrared excitation through tissue filters [J].Journal of the American Chemical Society,2013,135(48):18145-18152.
[责任编辑:刘红玲]
Synthesis and properties study of nitric oxide donor nanocomposites
WANG Liying1*,YANG Yanping2,WANG Li1,WANG Bing3,SUN Jie3*
(1.ShandongElectricPowerCentralHospital,Jinan250001,Shandong,China;2.TheFirstPeople’sHospitalofQingdaoEconomicandTechnologicalDevelopmentZone,Qingdao266555,Shandong,China;3.InstituteofMateriaMedica,ShandongAcademyofMedicalSciences,Jinan250062,Shandong,China)
A multi-functional nano-composite material was prepared by composing glutathione (GSH) coated Mn-doped ZnSe quantum dots,and nitric oxide (NO) donor photosensitive composite.RBS induced by two-photon excitation can decompose to release NO to a monageable size.This method successfully realized electrostatic self-assembly,and a smart drug carriers has great potential for development.The quantum dot nanocomposites with controlled release of NO release of two-photon excitation.The releasing nitric oxide exhibit significant cancer cell killing activity.
chitosan quantum dots; nitric oxide; tumor
2016-09-27.
山东省自然科学基金(ZR2015YL041).
王丽颖(1981-),女,硕士生,研究方向为心脑血管疾病.*
,E-mail:635775299@qq.com.
O62
A
1008-1011(2017)01-0108-05

