NH4Cl焙烧氯化Pr2O3及其动力学研究
时文中,徐启杰*,左春山,褚意新
(1.黄淮学院 化学化工系,河南 驻马店 463000; 2.河南中医药大学 药学院,河南 郑州 450008)
NH4Cl焙烧氯化Pr2O3及其动力学研究
时文中1,徐启杰1*,左春山1,褚意新2
(1.黄淮学院 化学化工系,河南 驻马店 463000; 2.河南中医药大学 药学院,河南 郑州 450008)
研究了NH4Cl(s)焙烧氯化Pr2O3(s)制备PrCl3(s)的热力学可行性、反应过程、适宜条件和动力学.结果表明:NH4Cl(s)焙烧氯化Pr2O3(s)制备PrCl3(s)在热力学上是可行的;氯化反应的过程为NH4Cl(s)先与Pr2O3(s)生成2NH4Cl·PrCl3(s),然后NH4Cl·PrCl3(s)渐渐分解为PrCl3(s);氯化反应的起始温度为457.35 K,497 K时反应进行完全;T≥ 643 K时PrCl3(s)开始水解为PrOCl(s);氯化焙烧温度理论上应控制在T≤ 643 K.制备PrCl3(s)的适宜条件为n(NH4Cl)∶n(Pr2O3)=12∶1、T=(623±10) K和t=40 min,氯化率为100%;氯化反应动力学符合Bagdasarrym模型,反应进度遵从Erofeev方程,氯化反应的表观活化能48.246 kJ·mol-1,频率因子A0为2.28×103,反应过程限制环节是界面化学反应控制.
氧化镨;氯化镨;氯化铵;反应过程;动力学
氯化铵焙烧氯化法提取稀土是清华大学独创的工艺,它是采用氯化铵焙烧氯化固氟焙砂中的稀土氧化物,然后用热水浸取氯化稀土.其核心是氯化铵氯化稀土氧化物和其他金属氧化物,并有较好的选择性[1-8].同时,氯化铵焙烧氯化法也可用于从低品位碳酸锰矿石中富集回收锰[9-10],从氧化铜钴矿中回收铜钴[11],从粉煤灰中回收锗[12],锌冶炼烟尘中锗的富集及锌的回收[13],从红土镍矿中分离提取镍[14].无水稀土氯化物是制备稀土金属有机化合物、稀土配合物、有机合成试剂和催化剂所必需的试剂,开发高纯无水稀土氯化物的制备方法并产业化,将增强我国稀土产业技术创新和稀土产业的国际竞争力.高纯度无水稀土氯化物的制备通常是采用CCl4氯化纯稀土氧化物、用金属氯化物氯化纯稀土氧化物、高纯稀土氯化物与有机溶剂复合物的减压蒸馏,纯稀土氯化物结晶水合物脱水等方法.但是,这些生产方法要么使用原料有毒,要么对设备的要求高,要么产品含杂质多而纯度达不到要求.因此,高纯无水稀土氯化物的制备技术已经成为稀土材料开发的关键问题[15].虽然用氯化铵焙烧氯化稀土氧化物制备无水稀土氯化物是绿色的方法[15-16],但关于氯化铵焙烧氯化稀土氧化物的系统研究较少[5-8,15-16].本文作者在前期研究氯化铵焙烧氯化法提取稀土和有色金属的基础上,开展NH4Cl(s)氯化Pr2O3(s)生成PrCl3(s)的热力学可行性、反应过程、适宜条件和动力学的研究,对于完善氯化铵焙烧法提取稀土的理论、开发制备高纯无水稀土氯化物工艺,具有一定的理论价值和应用前景.
1 试验部分
1.1 试验材料与仪器
氧化镨(含量≥99.99%,上海跃进化学试剂厂提供),氯化铵(AR),EDTA(AR),石英舟(定制),石英焙烧反应器(定制),SX2-4-13管式电阻炉(山东龙口电炉制造厂).
1.2 试验方法
称取1g Pr2O3(s)(含量≥99.99%,AR),按n(NH4Cl)∶n(Pr2O3)=12∶1配入研细的氯化铵(≤154m,AR),试样充分混匀后放入石英舟,在SX2-4-13管式电炉(控制温度±1 ℃)中进行不同温度和时间的氯化焙烧;以50 mL的90 ℃热水浸取氯化焙砂3~5 min,减压抽滤,然后用水洗涤5次,将滤液定容.在 pH为5左右,用六次甲基四胺为缓冲溶液,以二甲酚橙为指示剂,用 EDTA溶液滴定浸出液至溶液由紫红色变为亮黄色,即为终点.分析浸出液中Pr3+的含量,计算Pr2O3(s) 的氯化浸取率αRE(%),绘制氯化动力学曲线.
2 结果与讨论
2.1 NH4Cl(s)氯化Pr2O3(s)的热力学
NH4Cl(s)氯化Pr2O3(s)生成PrCl3(s)的反应为[16]:

TΔrS0T(J·K-1·mol-1)ΔrH0T(kJ·mol-1)ΔrG0T(kJ·mol-1)lgK0T298.15K1304.642582.066194.349-33.827300K1303.866581.831190.671-33.199400K1257.71566.04562.538-8.349500K1169.107525.835-58.8256.147600K1148.542514.392-174.37315.101700K1125.122499.152-288.43421.519800K1099.438479.865-399.68426.09

图1 氯化反应和关系图和

图2 NH4Cl氯化Pr2O3反应关系图

2.2 NH4Cl(s)氯化Pr2O3(s)的反应过程
根据对反应(1)的热力学分析和文献报道[6,16],反应(1)的反应过程为:
在低温下,NH4Cl(s)与Pr2O3(s)生成2NH4Cl·PrCl3(s);当T≥457.35 K时,2NH4Cl·PrCl3(s)渐渐分解为PrCl3(s);当T≥497 K时,氯化反应进行完全(K≥105);当T≥643 K,PrCl3(s)开始水解成PrOCl(s)[18-19],氯化铵能够有效地抑制PrCl3(s)的水解.因此,氯化焙烧温度理论上应控制在T≤643 K.
2.3 NH4Cl(s)氯化Pr2O3(s)的动力学曲线
按1.2所述的方法进行试验,以Pr2O3(s)的氯化浸出率αRE(%)为纵坐标,氯化反应时间t为横坐标,绘制Pr2O3(s)氯化反应的动力学曲线,结果见图3.
图3说明,氯化反应存在着诱导期、自动催化期和反应界面缩小期,是典型多相区域反应动力学曲线[3-8],符合Bagdasarrym模型.在空气气氛和n(NH4Cl)∶n(Pr2O3)=12∶1的条件下,升高氯化温度,有利于Pr2O3(s)的氯化率的提高;在340~360 ℃区间,当氯化反应进行至40 min时,Pr2O3(s)的氯化率接近100%,且氯化率不再随氯化时间的延长而改变,即反应业已完全;当T≥370 ℃且t≥20 min时,Pr2O3(s)的氯化率明显的下降.这是因为PrCl3(s)在370 ℃开始水解为PrOCl(s)[18-19],并且温度越高水解程度越大.因此,取用图3中220~360 ℃和氯化时间在0~30 min范围内Pr2O3(s)的氯化率进行Pr2O3(s)的氯化动力学研究.
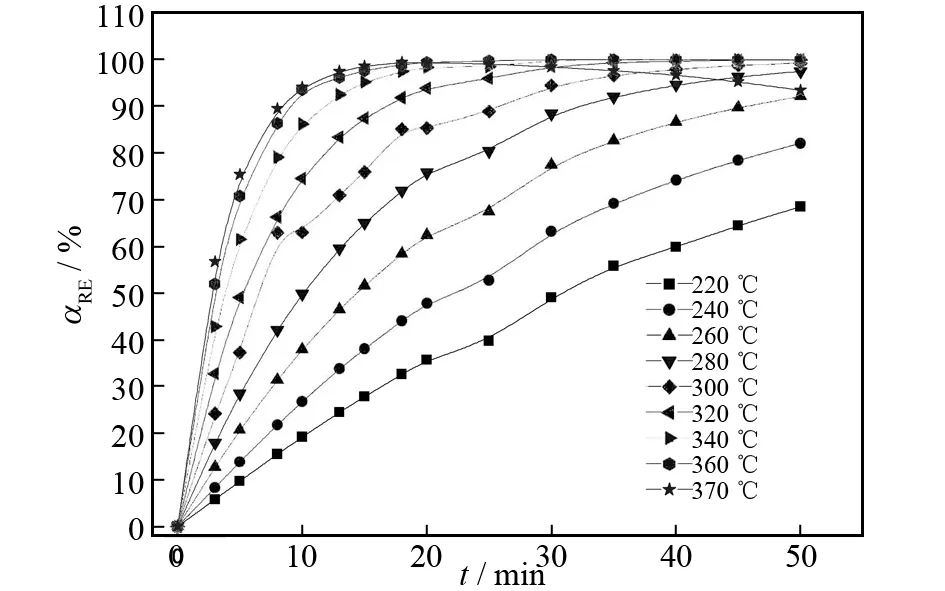
图3 Pr2O3氯化反应动力学曲线Fig.3 Reaction kinetics curve at different temperature
2.4 NH4Cl(s)氯化Pr2O3(s)的适宜条件
根据Pr2O3(s)的氯化动力学曲线可知,在空气气氛下,NH4Cl(s)焙烧氯化Pr2O3(s)制备PrCl3(s)的适宜条件为n(NH4Cl)∶n(Pr2O3)=12∶1、T=623 K±10 K和t=40 min,此时Pr2O3(s)的氯化率为100%.其中,采用n(NH4Cl)∶n(Pr2O3)≥12∶1的原料配比,是提高Pr2O3(s)氯化率和制备高纯PrCl3(s)的关键工艺参数[5,15].
2.5 NH4Cl(s)氯化Pr2O3(s)的动力学
NH4Cl(s)焙烧氯化Pr2O3(s)的动力学符合Bagdasarrym模型,反应进度遵从Erofeev方程[3-8].即
式(7)和(8)中:αRE―Pr2O3(s)的氯化浸出率(%),k―反应速率常数,t―反应时间,n―n=(δ+α),δ是串联反应步骤数,α是产物核的生长方向数,A0―频率因子,Ea―反应的表观活化能,T―反应温度,R―气体常数.
根据图3和式(8)计算Pr2O3(s)氯化反应的ln[-ln(1-αRE)],作ln[-ln(1-αRE)]-lnt图,结果见图4.从图4中各直线的斜率和截距,可求出n和反应速率常数k.其中n≈1,说明PrCl3(s)为无定形体(α=0),氯化反应是一步完成[6].

图4 Pr2O3氯化反应的ln[-ln(1-αRE)]-lntFig.4 Relationship between ln[-ln(1-αRE)] and lnt
以图4中各直线的截距lnk对103/T作图得图5.图5中直线的斜率为-5.803,截距为7.730.因此,氯化反应的表观活化能Ea为48.246 kJ·mol-1,频率因子A0为2.28×103,反应过程限制环节是界面化学反应控制,其动力学方程为:
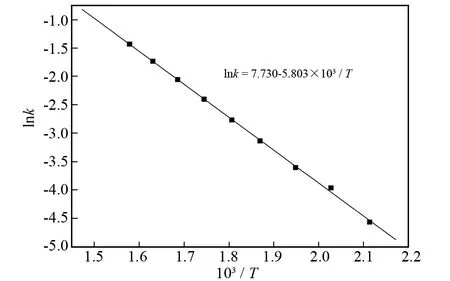
图5 Pr2O3氯化反应的lnk-103/T关系图Fig.5 Relationship between lnk and 103/T
3 结论
1) NH4Cl(s)焙烧氯化Pr2O3(s)制备PrCl3(s)在热力学上是可行的,氯化反应的起始温度为457.35 K,497 K时氯化反应基本进行完全(K≥105),T≥643 K时PrCl3(s)开始水解成PrOCl(s);氯化焙烧温度理论上应控制在T≤643 K.
2) NH4Cl(s)焙烧氯化Pr2O3(s)制备PrCl3(s)的适宜条件为n(NH4Cl)∶n(Pr2O3)=12∶1、T=623 K±10 K、氯化焙烧40 min,Pr2O3(s)的氯化率为100%;n(NH4Cl)∶n(Pr2O3)≥12∶1是提高Pr2O3(s)氯化率和制备高纯PrCl3(s)的关键工艺参数.
3) NH4Cl(s)焙烧氯化Pr2O3(s)制备PrCl3(s)的反应动力学符合Bagdasarrym模型,反应进度遵从Erofeev方程,反应的表观活化能Ea为48.246 kJ·mol-1,频率因子A0为2.28×103,反应过程限制环节是界面化学反应控制.
[1] SHI W Z,ZHU G C,HU J,et al.Recovery of Re from Baotou rare earth concentrate with chlorination roasting [J].Transacions of Nonferrous Metals Society of China,2003,13(2):438-442.
[2] 时文中,朱国才,张志庚,等.微山稀土精矿经固氟后采用氯化铵法回收稀土[J].过程工程学报,2002,2(6):523-528.
SHI W Z,ZHU G C,ZHANG Z G,et al.Recovery of Re from Weishan rare earth concentrate with chlorination roasting after fluorine-fixing treatment [J].The Chinese Journal of Process Engineering,2002,2(6):523-528.
[3] 时文中,朱国才.固氟氯化法从山东微山稀土精矿提取稀土的氯化率动力学[J].过程工程学报,2003,3(4):278-282.
SHI W Z,ZHU G C.Kinetics on chlorinating rare earth of Weishan mid-grade bastnasite in Shandong after fixed fluorine treatment [J].The Chinese Journal of Process Engineering,2003,3(4):278-282.
[4] 时文中,朱国才.固氟氯化铵焙烧法从包头稀土矿中回收稀土氯化动力学的研究[J].中国有色金属学报,2004,14(7):1254-1258.
SHI W Z,ZHU G C.Kinetics on chlorinating rare earth of Baotou mixed concentrate after fixed fluorine treatment [J].The Chinese Journal of Nonferrous Metals,2004,14(7):1254-1258.
[5] 时文中,张昕,赵永和,等.氯化铵氯化氧化镧(铈)的反应过程及其动力学[J].过程工程学报,2005,5(1):28.
SHI W Z,ZHANG X,ZHAO Y H,et al.Kinetics on chlorination process of La2O3and CeO2by ammonium chloride [J].The Chinese Journal of Process Engineering,2005,5(1):28.
[6] 时文中,张昕,王竞研,等.氯化铵氯化混合氧化稀土反应过程及其动力学的研究[J].稀有金属,2004,28(6):1019-1023.
SHI W Z,ZHANG X,WANG J Y,et al.Kinetics in chlorinating mixed rare earth oxides reaction process by ammonium chloride [J].Chinese Journal of Rare,2004,28(6):1019-1023.
[7] 时文中,李冠峰,赵永和,等.氯化铵氯化氧化镧氧化铈混合物及其动力学[J].信阳师范学院学报(自然科学版),2005,8(2):155-158.
SHI W Z,LI G F,ZHAO Y H,et al.Chlorinating reaction of the admixture of La2O3and CeO2by ammonium chloride and its kinetics [J].Journal of Xinyang Teachers College (Natural Science Edition),2005,8(2):155-158.
[8] 时文中,褚意新,左春山,等.氯化铵焙烧氯化氧化钕及其动力学研究[J].河南科学,2016,34(6):1001-1005.
SHI W Z,CHU Y X,ZUIO C S,et al.Kinetic and chloridizing roasting conditions of Nd2O3through ammonium chloride [J].Henan Science,2016,34(6):1001-1005.
[9] 杨仲平,靳晓珠,朱国才.铵盐焙烧法处理低品位锰矿的工艺研究[J].中国锰业,2006,24(3):12-14.
YANG Z P,QI X Z,ZHU G C.Process of techniques researches on low-grade manganese ore by roasting with ammonium salt [J].China’s Manganese Industry,2006,24(3):12-14.
[10] 李赋屏,朱国才,田君.从低品位碳酸锰矿石中富集回收锰的绿色化学工艺研究[J].矿产与地质,2005,19(1):93-96.
A green chemical process of enriching and recovering Mn from low grade ore of manganese carbonate [J].Mineral Resources and Geology,2005,19(1):93-96.
[11] 张明珠,朱国才.循环利用氯化铵从氧化铜钴矿中回收铜钴[J].金属矿山,2012(5):88-91.
ZHANG M Z,ZHU G C.Recovery of copper and cobalt from oxide copper-cobalt ore with ammonium chloride [J].Metal Mine,2012(5):88-91.
[12] 肖靖泉,朱国才.锌冶炼烟尘中锗的富集及锌的回收[J].金属矿山,2004(5):60-63.
XIAO J Q,ZHU G C.Enrichment of germanium and recovery of zinc from flue dust of zinc smelting [J].Metal Mine,2004(5):60-63.
[13] 时文中,朱国才.氯化铵氯化-二酰异羟肟酸萃取法从粉煤灰中提取锗的研究[J].河南大学学报(自然科学版),2007,37(2):147-151.
SHI W Z,ZHU G C.Study on extracting germanium from coal ash by chlorination with ammonium chloride and extraction with dihydroxamic acid as extractant [J].Journal of Henan University (Natural Science),2007,37(2):147-151.
[14] 符芳铭,胡启阳,李新海,等.氯化铵-氯化焙烧红土镍矿工艺及其热力学计算[J].中南大学学报(自然科学版),2010,41(6):2096-2102.
FU F M,HU Q Y,LI X H,et al.Thermodynamics and chloridizing roasting conditions of laterite through ammo-nium chloride [J].Journal of Central South University (Science and Technology),2010,41(6):2096-2102.
[15] 吴锦绣,李梅,柳召刚,等.无水稀土氯化铈制备工艺研究[J].过程工程学报,2011,11(1):103-106.
WU J X,LI M,LIU Z G,et al.Study on technological conditions in preparation of anhydrous cerium chloride [J].The Chinese Journal of Process Engineering,2011,11(1):103-106.
[16] 陈华妮,孙艳辉,符远翔.氯化铵氯化法制备无水稀土氯化物的反应机制[J].稀土,2008,29(2):54-59.
CHEN H N,SUN Y H,FU Y X.Direct preparation of anhydrous lanthanide chlorides from lanthanide oxides chlorinated by NH4Cl [J].Chinese Rare Earths,2008,29(2):54-59.
[17] CAI H,FAN J,ZUO T,et al.Microstructural characterization of TiB in-situ synthesized titanium matrix composites [J].Chinese Journal of Rare Metals,2006,30(6):808-812.
[18] 苏勉,裘炳毅.六水合氯化钇的脫水和无水氯化钇的气相水解的研究[J].金属学报,1966,9(2):142-147.
SU M,QIU B Y.The dehydration of hexahydratedyte dyttriumchloride and the vapor phase hydrolysis of anhtdroush [J].Acta Metallrugica Sinica,1966,9(2):142-147.
[19] 向丽.轻稀土氯化物静态焙烧制备稀土氧化物的研究[D].沈阳:东北大学,2010:5-6,34-37.
XIANG L.Study on the preparation of light rare earth oxide from rare earth chloride roasted statically [D].Shenyang:Northeastern University,2010:5-6,34-37.
[责任编辑:吴文鹏]
Studies on chlorination of Pr2O3by using NH4Cl-roasted method and its analytical dynamics
SHI Wenzhong1,XU Qijie1*,ZUO Chunshan1,CHU Yixin2
(1.DepartmentofChemistry&ChemicalEngineering,HuanghuaiUniversity,Zhumadian463000,Henan,China; 2.CollegeofPharmacy,HenanUniversityofTraditionalChineseMedicine,Zhengzhou450008,Henan,China)
Chlorination of Pr2O3was studied by using NH4Cl-roasted method using NH4Cl and Pr2O3as raw materials.The thermodynamics,the reaction process,suitable conditions and analytical dynamics of chlorination of Pr2O3were researched.The results showed that thermodynamics analysis of chlorination of Pr2O3was reasonable,and NH4Cl priored Pr2O3to producing 2NH4Cl·PrCl3,then decomposing into PrCl3.The spontaneous temperature of chlorination of Pr2O3was 457.35 K,and finished one was 497 K.A suitable reaction condition was the 12∶1 ofn(NH4Cl)∶n(Pr2O3),(623±10) K,40 min,and 100% chlorination rate.The analytical dynamics was agreement with corresponded to Bagdasarrym mold,the reaction progress conformed Erofeev equation,the apparent activation energy was 48.246 kJ·mol-1,and frequency factor (A0) was 2.28×103.The reaction process was an interface chemical reaction.
Pr2O3; PrCl3; NH4Cl; reaction process; analytical dynamics
2016-09-01.
河南省基础理论与前沿技术研究计划资助项目(092300410123).
时文中(1964-),男 ,教授,主要从事稀土研究.*
,E-mail:qijie001@163.com.
O643.1; TF111.13
A
1008-1011(2017)01-0097-05

