以对羟基苯甲酸和1,10菲啰啉为配体铜配合物的合成及与DNA的作用
李小芳,冯小强,常 慧,杨 声
(1.天水师范学院化学工程与技术学院,甘肃 天水 741001; 2.定西师范高等专科学校,甘肃 定西 743000)
以对羟基苯甲酸和1,10菲啰啉为配体铜配合物的合成及与DNA的作用
李小芳1,冯小强1,常 慧1,杨 声2
(1.天水师范学院化学工程与技术学院,甘肃 天水 741001; 2.定西师范高等专科学校,甘肃 定西 743000)
通过元素分析、红外光谱、紫外光谱及差热热重分析,对合成的一种新型铜配合物Cu(phen) (DPA)0.5·3H2O(phen=1,10菲啰啉,DPA=对羟基苯甲酸)进行了结构表征,并以鲱鱼精DNA为靶点,采用光谱法、DNA粘度滴定实验和循环伏安法,研究了该配合物与DNA的键合方式。结果发现:在加入DNA后,配合物的吸收峰出现减色和红移,荧光强度增强;DNA的相对粘度随配合物的加入而增大;配合物在加入DNA后的氧化还原峰电流减小,式量电位发生正移。这些实验结果表明配合物与DNA通过嵌插方式发生作用。
对羟基苯甲酸; 1,10菲啰啉; 配合物; 鲱鱼精DNA
1 前 言
铜作为一种生命体必需的元素,以有机酸等作为配体的Cu(Ⅱ)配合物广泛的存在于生物体内,并在化学和生物化学催化系统中起着很重要的作用,已报道了铜配合物和铜盐的混合物可以有效地抑制癌细胞增殖,并诱导癌细胞凋亡,并且铜配合物的抗癌药性优于顺铂类抗癌药物[1],有望成为防治辐射病、免疫性疾病、心血管疾病、癌症等疾患的药用酶[2]。近期仇晓阳[3]合成了一对中心对称的双核铜配合物[CuL1]2(1)和[CuL2]2(2),其中L1是双席夫碱配体N,N′-二(5-氟水杨基)-1,3-丙二胺(H2L1)的二价阴离子,L2是N,N′-二(5-氟水杨基)-1,2-乙二胺(H2L2)的二价阴离子,Cu原子都是四方椎配位构型。通过MTT法研究了这2个配合物的抗细菌(枯草芽孢杆菌,金黄色葡萄球菌,大肠杆菌和荧光假单胞菌)和抗真菌(白假丝酵母菌和黑曲霉菌)活性。叶行培等人[4]合成了扭曲的四方锥[Cu(L)2(THF](1)和平面正方形[Cu(L)(CH3OH)Cl](2)[HL=3,4-二甲基-2-乙氧羰基-吡咯-5-甲醛苯甲酰腙]酰腙铜配合物。配合物2对金黄色葡萄球菌有明显的抑制作用(MIC=1.98μg·mL-1),而配合物1则对肝癌细胞Hep G2展现出显著的抗肿瘤活性(IC50=9.1μmol·L-1)。
脱氧核糖核酸(DNA)不仅在生命的延续、生物物种遗传特性的保持和生长发育中起着重要的作用,而且与生物变异(如肿瘤、遗传病、代谢病等)密切相关。许多防癌、抗癌、治癌药物与DNA之间通过嵌插作用而发挥药理作用[5],因此,研究DNA与铜配合物的相互作用,对筛选新型抗癌药物、阐述其作用机理都有非常重要的理论意义。但是往往研究方法单一、不全面,研究结论不充分。近年来,金属配合物因对DNA具有良好的插入断裂作用使其有可能作为新型DNA结构探针、DNA 断裂剂、化学核酸酶和杀菌剂而引起人们的广泛关注。国外学者K.Mohanan以2-羟基苯乙酮和2-氨基嘧啶在乙醇中合成的三齿席夫碱,分别与稀土离子La3+和Nd3+形成的配合物能有效裂解PUC19DNA,并且抑菌性能强于席夫碱配体[6];T.F.Abbs Fen Reji以苯硫基乙酸和Eu3+和Nd3+配位合成的配合物可以完全裂解DNA,并且能有效抑制人宫颈癌(HeLa)和结肠癌细胞(HCT116)[7]。考虑到三元配合物与相似的二元配合物相比更稳定,而且有望同时获得多种效能,本文首次以1,10菲啰啉和对羟基苯甲酸为配体构筑三元铜配合物,同时,采用诸多研究方法如光谱法、循环伏安和DNA粘度滴定实验,从分子水平研究了三元铜配合物与鲱鱼精DNA的键合方式。
2 实 验
2.1 药品和仪器
鲱鱼精DNA(Sigma公司产品),其它试剂均为分析纯,实验用水为二次蒸馏水。TG-DTA分析仪(美国Perkin Elmere公司);Spectrum One傅立叶红外光谱仪(美国Perkin Elmere公司);UV-2450紫外可见光谱仪(日本岛津公司);RF-5301PC荧光光谱仪(日本岛津公司);CHI660B电化学工作站(上海辰华仪器有限公司)。
2.2 配合物的合成
称取DPA 0.37g溶于30mL无水乙醇溶液中,在搅拌下加入0.24g NaOH,75℃水浴加热回流10min,尔后加入0.595g 的phen,继续搅拌10min后,在上述溶液中逐次加入0.48g无水硫酸铜,即刻有淡绿色沉淀析出,50℃下继续反应6h。反应结束后,将沉淀抽滤,烘干。
2.3 配合物与鲱鱼精DNA的作用
2.3.1 紫外光谱测定 在参比池和样品池中分别加入3mL二甲亚砜(DMSO)和3mL铜配合物溶液,依次用DNA分别滴定样品池和参比池,混匀,放置10min,扫描紫外吸收光谱。
2.3.2 荧光光谱 在样品池中加入2.0mL 1.0g/L配合物溶液,加入一定体积的DNA溶液,使DNA与配合物的浓度比值不断增加,用适当波长激发光进行激发,测定配合物的发射光谱;设定激发波长为550nm,激发和发射光谱扫描狭缝宽度均为5.0nm。在比色皿中加入2mL DNA溶液和1mL NR的混合溶液,依次用配合物溶液进行滴定,扫描发射光谱。
2.3.3 粘度测定 固定DNA浓度为0.1mg/mL,以不同的R(C配合物/CDNA)加入配合物,温度恒定在25℃,作用30min进行测量,得到(η/η0)1/3与配合物浓度关系。η为DNA溶液在加入配合物时的粘度,η0为DNA溶液的粘度。
2.3.4 循环伏安 循环伏安测试扫描电位区间-1.2~1.2V,缓冲溶液为HAc-NaAc(pH 4.6),工作电极为玻碳电极,参比电极为饱和甘汞电极,对电极为铂丝电极。
3 结果与讨论
3.1 配合物组成的确定
配体对羟基苯甲酸、1,10菲啰啉及配合物的红外光谱如图1所示:对羟基苯甲酸中,δOH(面内)在1387cm-1的吸收峰在配合物中位移至1378cm-1,νAr-O(1291cm-1、1245cm-1)也分别位移至1272cm-1和1222cm-1处,表明酚羟基氧原子参与配位;-COOH的νC=O(1675cm-1)特征吸收峰也在配合物中消失,同时配合物还在1593cm-1和1433cm-1出现的新的强吸收峰,归属于羧基的对称伸缩振动吸收峰和反对称伸缩振动吸收峰,Δν(-COO-)<200cm-1,表明羧基脱掉质子以酸根的形式与铜离子双齿形式配位[8],配合物在3373cm-1的峰为水的吸收峰。邻菲啰啉在1579cm-1、1501cm-1和1353cm-1处出现的特征吸收峰,形成配合物后分别移动到1593cm-1、1519cm-1、1378cm-1,并且邻菲啰啉的νC=N(649cm-1)特征峰消失,表明邻菲啰啉以双齿螯合形式与铜(Ⅱ)离子配位。

图1 对羟基苯甲酸、1,10菲啰啉及配合物的红外光谱Fig.1 IR spectra of 4-hydroxybenzolate acid, 1,10-phenanthroline and complex
DMSO作为溶剂和参比,在190~500nm测定了游离配体及配合物的紫外光谱,数据列于表1。配体DPA在265nm有一紫外吸收,属于π-π*跃迁吸收光谱,phen在273.5nm有一个吸收谱带,属于π-π*跃迁,吸收远强于对羟基苯甲酸。两配体与铜离子作用后形成的配合物在269nm和297.2nm处出现两个谱带。配合物第二个谱带相对于DPA和phen的吸收峰均发生了较大程度的红移,说明配合物共平面性增大,稠环数目增多,π键共轭程度增大,降低了体系的能量。

表1 配体及配合物的紫外光谱数据(溶剂DMSO)
升温速率10℃/min,在氮气保护下,升温至1000℃,测定配合物的TG,如图2所示。TG曲线在200℃之前失重15.1 %,表明配合物中存在3分子结晶水,水分子也参与配位。200℃以后配合物继续氧化分解,对应TG曲线开始明显下滑,随着温度升高,TG曲线在200~500℃之间出现了一个幅度较大失重过程,总失重为49.3 %,这是配合物结构坍塌,配体氧化分解所致。当继续加热,失重不明显,到1000℃时配合物质量还有25.3 %的剩余,可归属为CuO。
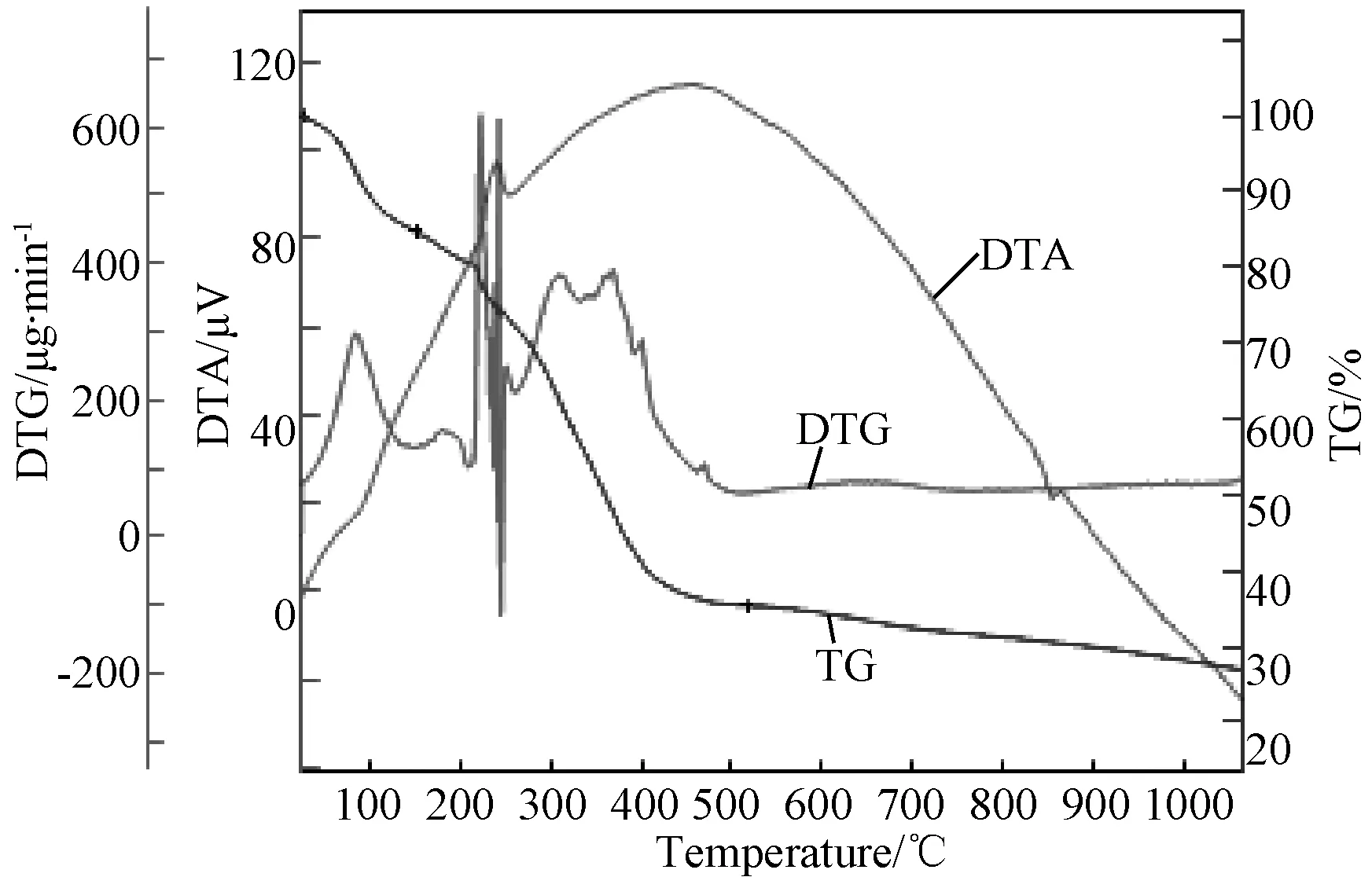
图2 配合物的TG-DTG-DTA曲线Fig.2 TG-DTG-DTA curves of complex
在25℃,浓度为1×10-3mol·L-1配合物的DMSO溶液中,测定了配合物的摩尔电导为14.5 s·cm2·mol-1,表明配合物在DMSO中不电离,以中性分子形式存在[9]。Cu2+含量采用EDTA滴定法测得Cu 21.89(19.39),元素分析结果 C 54.62(54.54),H 2.91(3.0),N 8.06(8.48)(括号内为理论值/%)。结合红外光谱、紫外光谱及TG结果的数据,确定三元铜配合物分子式为Cu(phen) (DPA)0.5·3H2O(phen=1,10菲啰啉,DPA=对羟基苯甲酸)。
3.2 配合物的电化学行为
在-1.2~1.2 V电位范围内扫描,配合物在玻碳电极表面有电化学响应,当扫描速率为1.4 V/s,中心铜离子在循环伏安图上在0.4 V/-0.1 V和0.05 V/-0.65V处呈现两对明显的氧化还原峰。通过改变扫描速度,发现氧化还原峰电流随着扫描速度的增大而增大,峰电位随扫描速度的增大而发生移动(图3)。以扫速υ对氧化峰电流Ipc作图,发现氧化峰电流与扫描速度间呈现良好的线性关系Ipc(10-5A)=-0.08-0.194 υ(R=0.998),表明中心Cu2+在电极上的反应过程主要由吸附过程控制。
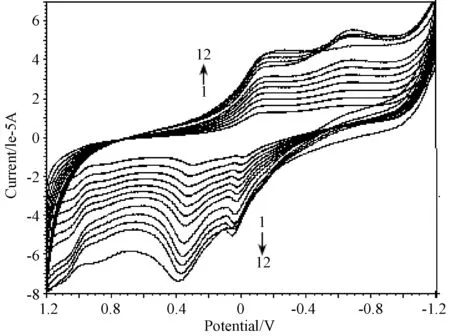
图3 扫速速率对配合物电化学影响(1-12,扫速为0.1, 0.2,0.3, 0.4, 0.5, 0.6, 0.7,0.8,1.0,1.2,1.3,1.4V/s)Fig.3 Effect of scan rate on the electrochemistry of complex
3.3 配合物与DNA的相互作用
3.3.1 紫外光谱分析 DNA的碱基及磷酸氧是许多药物的作用位点, 与药物作用后会导致其特征峰发生位移,增色、减色效应和等色点是DNA特有的与其双螺旋结构密切相关的光谱性质。在配合物溶液中加入DNA后,若配合物的吸收峰强度减少,波长红移,可认为是配合物插入DNA 的证据之一[10]。
配合物与DNA相互作用的吸收光谱滴定曲线如图4所示,配合物在272nm的吸收峰在加入DNA后发生了一定程度的减色效应,最大吸收波长也稍有红移(红移4nm),说明配合物可能以嵌入方式与DNA发生了相互作用。
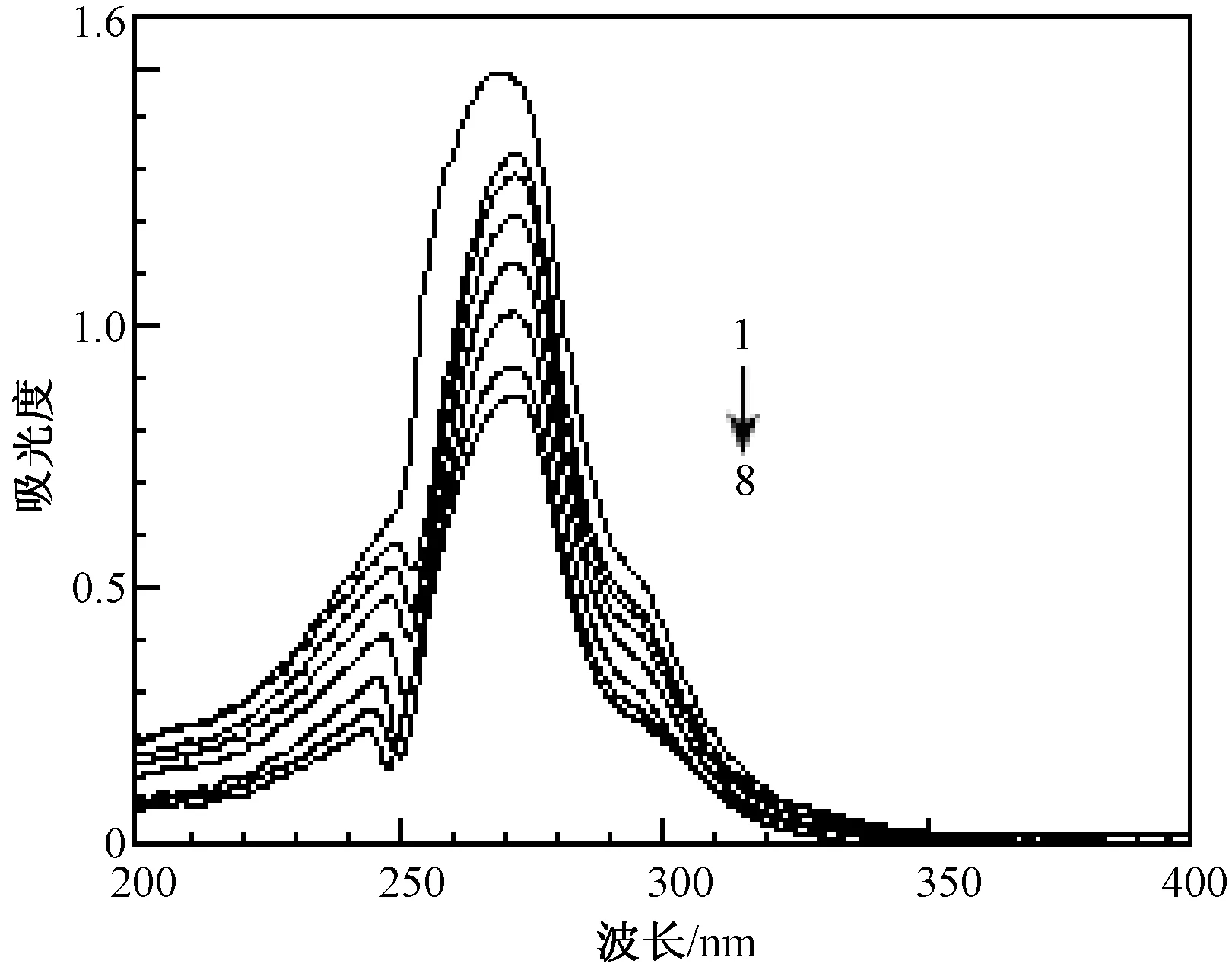
图4 DNA对配合物紫外吸收光谱的影响c(DNA)=1.3×10-3mol/L, 1~8,DNA体积为0~140 μLFig.4 Effect of DNA on the UV-Vis absorption spectra of complex
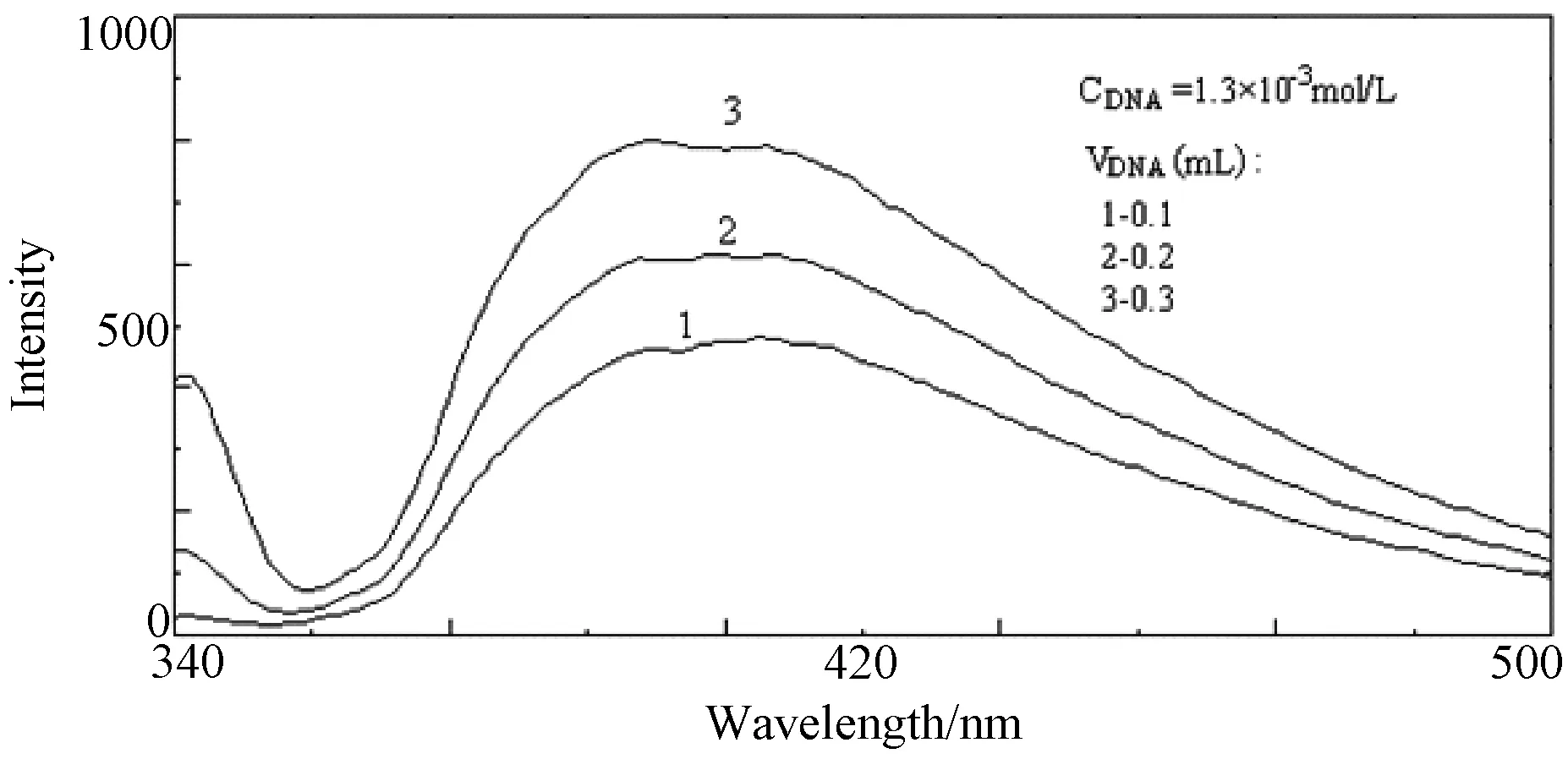
图5 DNA对配合物荧光光谱的影响Fig.5 Effect of DNA on the fluorescence spectra of complex
3.3.2 荧光光谱 原来发光的物质在DNA存在下发光光谱变化很小,可认为配合物与DNA没有明显的作用;如果配合物与DNA作用后出现了荧光增强或减弱现象,说明配合物与DNA发生了一定的作用,并且荧光变化幅度反映了配合物与DNA作用的强弱。因此DNA存在下配合物的发光较大幅度地增强或减弱都可能是配合物与DNA发生较强结合的证据。如图5所示,铜配合物在396nm出现较强的荧光发射峰,与DNA作用后,配合物的荧光显著增强。这是由于配合物中的配体插入到DNA的碱基对中,受到DNA的保护,使之免受水分子的淬灭,因而荧光增强。这进一步表明配合物与DNA作用较强,可能是插入结合。
游离态的中性红(NR)荧光强度较弱,但是与DNA以嵌插作用结合后,荧光强度大大增强。当固定DNA-NR体系的浓度,加入一定量的配合物后,NR-DNA体系在593nm处特征峰的荧光强度逐渐降低,但随着配合物浓度的增大,体系的荧光强度却又增强,如图6所示。这说明配合物与DNA之间存在嵌插作用,配合物能把NR从DNA结合位点上挤出,导致游离的NR含量增多,荧光强度便减弱。但是,配合物浓度增大到一定值后,由于配合物也具有荧光,从而体现出荧光增强的趋势。
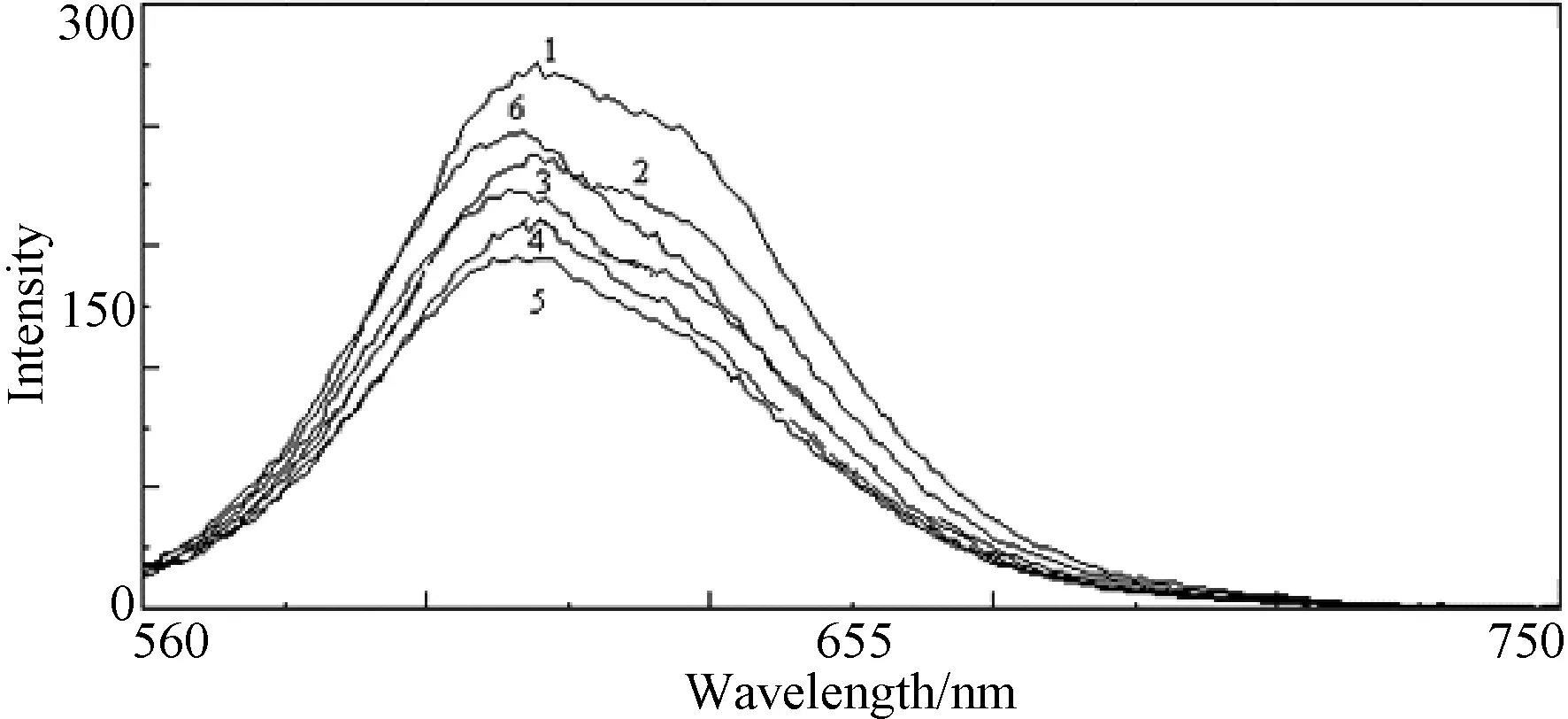
图6 配合物对DNA-NR体系荧光光谱的影响Fig.6 Effect of complex on the fluorescence spectra of DNA-NR

图7 不同浓度配合物对DNA粘度的影响Fig.7 Influence on DNA viscosity with different concentrations of complex
3.3.3 粘度测定 粘度法被认为是在缺乏晶体结构数据情况下确定配合物与DNA键合模式最有力的证据之一。已有报道[11],当配合物以静电、沟面结合等非插入方式与DNA作用时,DNA溶液的粘度无明显变化;以部分插入方式与DNA作用时,DNA溶液的粘度降低;而通过经典插入方式与DNA作用时,DNA溶液的粘度增加。在DNA溶液中加入配合物后,含DNA的溶液的相对比粘度呈增大趋势,如图7所示,这可能是因为配合物中共轭结构的苯环插入DNA双螺旋结构的内部,使得双链DNA的分子链长度增加,从而导致配合物对含DNA的溶液的粘度逐渐增大。由此推测配合物以插入方式与DNA作用,这与上述光谱学研究结果相一致。
3.3.4 循环伏安法 在配合物溶液中依次滴加DNA,发现氧化还原峰电流绝对值均急剧降低,没有新的氧化还原峰出现,且峰电位发生正移,当加入的配合物与DNA的摩尔浓度比为30时,峰电位由0.35 V移动至0.45 V,峰电流由-4.6×10-5A降低至-2.6×10-5A,峰电位由-0.1V移动至-0.2V,峰电流由3×10-5A降低至2×10-5A,在0.05 V处的氧化峰几乎消失,而在-0.65 V处的还原峰移动至-0.8 V处,即式量电位发生了明显的正移,如图8所示。峰电位的移动可以作为判断DNA与电化学活性分子作用模式的依据之一,根据文献报道,当小分子与DNA作用后峰电位负移,则结合方式为静电结合,相反,如果小分子与DNA作用后峰电位正移,则结合方式为嵌插[12]。电化学结果再次说明配合物与DNA的结合模式为嵌插作用,其抗肿瘤等活性有待进一步研究。
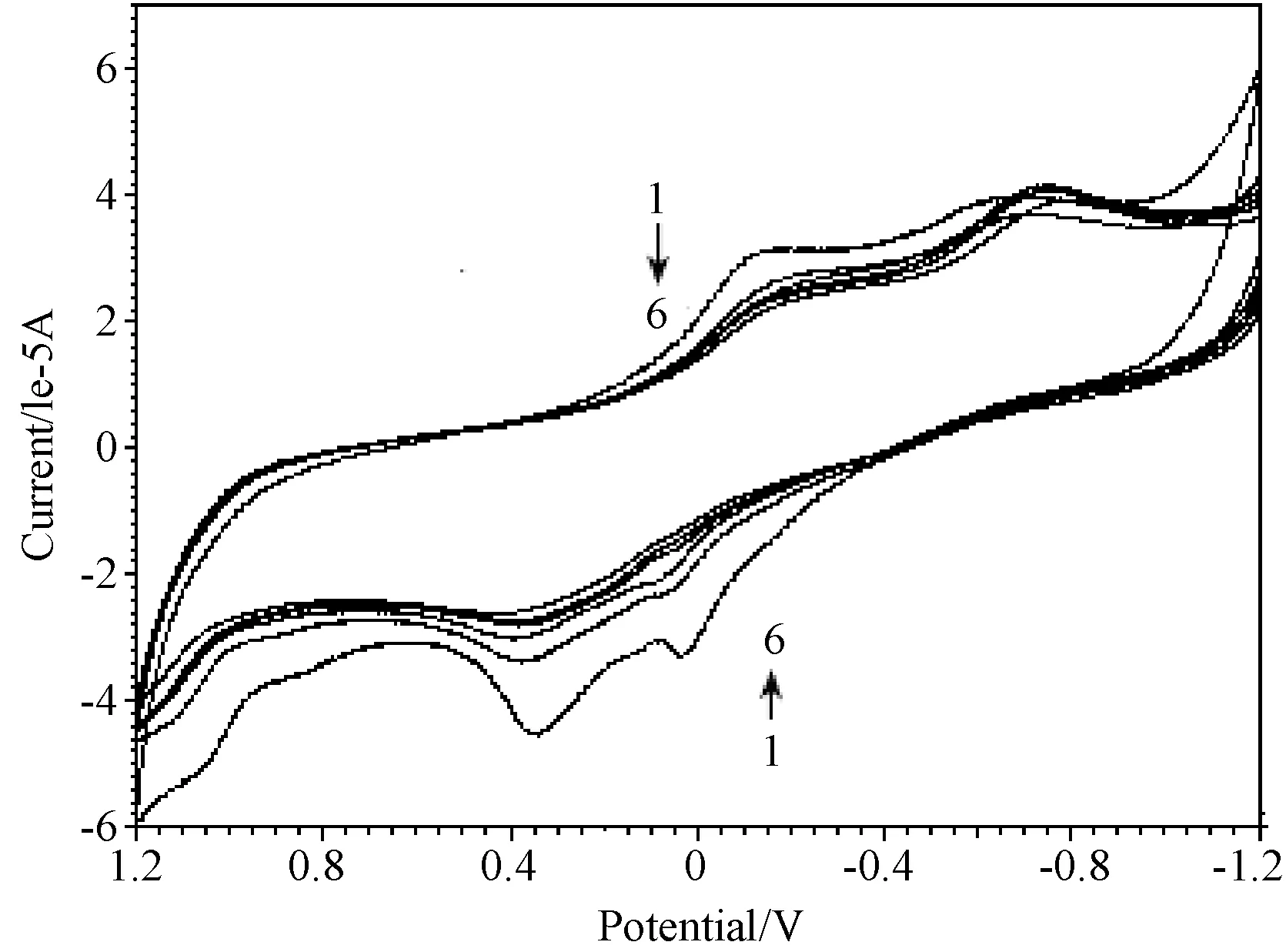
图8 配合物、配合物-DNA体系的循环伏安图(1-6,R=C配合物/CDNA分别为:0, 10, 15, 20, 25, 30)Fig.8 Cyclic voltametry of complex and complex-DNA system
4 结 论
合成了配合物Cu(phen) (DPA)0.5·3H2O(phen=1,10菲啰啉,DPA=对羟基苯甲酸)。此外,在配合物中加入DNA后,其吸收峰出现减色和红移,荧光强度增强,配合物的氧化还原峰电流减小,式量电位发生正移;DNA的相对粘度随配合物的加入而增大。实验结果证实了配合物与DNA之间存在插入结合。该研究工作对诊断并治疗与DNA有关疾病的药
物设计提供参考,深入的研究正在进行中。
[1] Pyle A.M., Rehmann J.P., Meshoyrer R., et al. Mixed-ligand complexes of ruthenium (II): factors governing binding to DNA[J]. J. Am. Chem. Soc., 1989, 111:3051~3058.
[2] 谢勇平,李清禄,郑新宇,等. 铜(Ⅱ)烟酸与L-α-丙氨酸三元配合物的固相合成和表征及抑菌活性[J].湖南农业大学学报(自然科学版), 2012, 38(1):117~120
[3] 仇晓阳.二核双席夫碱铜(Ⅱ)配合物的合成、晶体结构及抗菌活性研究[J].无机化学学报, 2014, 30(7): 1667~1672.
[4] 叶行培,王冠杰,潘鹏.两个含吡咯环酰腙配体的Cu(Ⅱ)配合物的合成、晶体结构和生物活性[J].无机化学学报, 2014, 30(12): 2789~2795.
[5] Sigman D S, Graham D R, Daurora V, et al. Oxygen dependent cleavage of DNA by the 1,10-phenanthroline cuprous complex inhibition ofEscherichiaColiDNA polymerase I[J]. J.Biol.Chem, 1979, 254(24):12269~12272.
[6] K.Mohanan, R.Aswathy, L.P.Nitha, et al. Synthesis, spectroscopic characterization, DNA cleavage and antibacterial studies of a novel tridentate Schiff base and some lanthanide(III) complexes[J]. Journal of rare earths, 2014, 32(4): 379~388.
[7] T. F. Abbs Fen Reji, A. Jeena Pearl, Bojaxa A. Rosy. Synthesis, characterization, cytotoxicity, DNA cleavage and antimicrobial activity of homodinuclear lanthanide complexes of phenylthioacetic acid[J]. Journal of rare earths, 2014, 31(10):1009~1016.
[8] Abuhijleh A L, Woods C. Mononuclear copper (II) salicylate imidazole complexes derived from copper (II) aspirinate. Crystallographic determination of three copper geometries in a unit cell[J]. Inorganic Chemistry Communications, 2001, 4(3):119~123.
[9] Geary W J. The use of conductivity measurements in organic solvents for the characterization compounds [J]. Coord.Chem.Rev., 1971, 7:81~122.
[10] 杨频, 周春琼. 两种新稀土双核配合物的合成、表征及其对磷酸二酯键模型物(BDNPP) 和DNA的作用研究[J]. 化学学报, 2003, 61(9):1455~1460.
[11] Satyanaryana S, Dabrowiak JC, Chairs JB. Tris(phenanthroline) ruthenium(II) enantiomer interaction with DNA: Mode and specificity of binding[J].Biochemistry, 1993, 32:2573~2584.
[12] Rodriguez M, Bard A.J. Electrochemical studies of the interaction of metal chelates with DNA. 4.Voltammetric and eletrogenerated chemilu-minescent studies of the interaction of tris(2,2-bipyridine) osmium(Ⅱ)with DNA[J]. Anal Chem, 1990, 62(64): 2658~2662.
Synthesis and Interaction with DNA of Copper Complex Constructed from 4-hydroxybenzolate Acid and 1,10-phenanthroline
LI Xiaofang1, FENG Xiaoqiang1, CHANG Hui1, YANG Sheng2
(1.College of chemical engineering and technology, Tianshui Normal University, Tianshui 741001, China; 2.Ding Xi Teachers’ College, Dingxi 743000, China)
A novel ternary complex of Cu(phen) (DPA)0.5·3H2O (Phen=1,10-phenanthroline, DPA=4-hydroxybenzolate acid) was synthesized and characterized by elemental analysis, IR spectroscope, UV-Vis spectroscope and TG-DTA methods. Using herring sperm DNA as biomolecular target, its interaction with the complex was studied by spectroscopy, CV method and DNA viscosity titration experiment. Results showed that the UV absorption peaks of the complex were red-shifted and the intensity was weakened, and the fluorescence intensity was enhanced by the addition of DNA. In addition, the peak current decreased significantly and the potential moved positively. Viscosity titration experiment verified that the complex increased the relative viscosity of DNA. All of the above illustrated that the complex and DNA bond by the mode of intercalation.
4-hydroxybenzolate acid; 1,10-phenanthroline; complex; herring sperm DNA
1673-2812(2017)01-0129-05
2015-10-09;
2016-01-04
甘肃省青年科技基金资助项目(1606RJYE247)和天水师范学院“中青年”教师科研资助项目(TSA1508)
李小芳(1983-),女,高级实验师,硕士,甘肃甘谷人,主要从事多元有机稀土配位研究。E-mail:tslxffxq@163.com。
冯小强(1979-),男,副教授,硕士,甘肃华亭人,主要从事天然产物功能活性研究。E-mail:fengxiaoqiang1979@163.com。
O629.74
A
10.14136/j.cnki.issn 1673-2812.2017.01.026

