核-壳结构硅灰石/磷酸钙多孔陶瓷微球的制备及表征
柳丽敏,张 雷,杨贤燕,壮 琛,柯秀荣,杨国敬,苟中入
(1.浙江加州国际纳米技术研究院,浙江大学,浙江 杭州 310058; 2.温州医科大学附属第三医院,浙江 瑞安 325200)
核-壳结构硅灰石/磷酸钙多孔陶瓷微球的制备及表征
柳丽敏1,张 雷2,杨贤燕1,壮 琛1,柯秀荣2,杨国敬2,苟中入1
(1.浙江加州国际纳米技术研究院,浙江大学,浙江 杭州 310058; 2.温州医科大学附属第三医院,浙江 瑞安 325200)
本文研究了双壳层型核-壳结构β-硅灰石/β-磷酸三钙(β-CaSiO3/β-TCP)生物活性复相陶瓷微球的制备及表征;利用添加有机微球造孔剂工艺,在内、外壳层分别构建出孔径10μm左右的多孔结构,并对其体外降解行为进行了分析。结果显示,运用自制同轴喷头微流控系统制备的生物活性复相陶瓷微球的工艺简单,微球尺寸均一,球形形态良好,经干燥、煅烧处理后陶瓷微球发生明显收缩,颗粒度维持在2.2±0.1mm。通过改变组分分布、烧结温度制度以及双壳层内部结构等实现复相陶瓷体外降解的可调节性。以上研究结果表明,该方法制备的多孔双壳层型核-壳结构复相陶瓷微球解决了组分降解速率调控问题,以及由此堆砌颗粒形成三维网络孔道演化可调可控性能,势必将在研究骨缺损修复和微球载药领域具有重要意义。
β-磷酸三钙; β-硅酸钙; 双壳层核-壳结构; 多孔结构; 复相陶瓷微球
1 前 言
磷酸钙类生物陶瓷材料,如羟基磷灰石(Hydroxyapatite;HA)、β-磷酸三钙(Tricalcium phosphate;β-TCP)及其两相复合的双相磷酸钙陶瓷(Biphasic calcium phosphate;BCP)材料,因其与骨骼无机矿物相的组成相似,在骨修复材料领域得到应用[1-4]。大量研究证实这类材料具有良好的生物相容性及骨传导性能,能够与宿主骨形成牢固键合。但是,经过高温烧结处理,这类生物陶瓷的降解速率较为缓慢,生物活性较差,因而磷酸钙人工骨陶瓷的研究和应用尚未达到理想效果。
近些年的一系列研究表明,钙-硅基生物活性玻璃、玻璃-陶瓷和生物陶瓷具有优良的体内外生物活性,在模拟人体环境中该类材料的表面能够快速诱导沉积类骨羟基磷灰石[5-6];同时溶出的钙、硅等离子还具有促进细胞增殖、刺激与骨再生密切相关的基因、蛋白高效表达等功效[7-8]。但是,有研究显示,纯硅灰石(β-CaSiO3)多孔陶瓷材料在动物颅骨骨缺损内降解过快,难以与骨损伤再生修复速率形成最佳匹配[9-10]。同时,一些研究还发现,通过离子掺杂能改善硅灰石陶瓷的生物活性和降解性,譬如掺镁、锶能改变其降解速率,并提高其体外成骨细胞活性[11-13]。Zhu等[14]研究表明锶掺杂硅灰石提高了生物活性离子释放水平,浸泡液(SBF)的pH也有所降低,扫描电镜观察发现掺锶硅酸钙诱导沉积羟基磷灰石能力不受影响。其次,硅灰石与β-TCP的复合材料研究也显示,适量β-TCP不仅能适度缓解多孔陶瓷的降解速率,避免支架过快降解,同时也有利于体内成骨效率的改善[15]。
另一方面,为满足骨再生医学应用的要求,多孔性生物活性材料的构建可为加快原位骨再生效率提供条件[16]。球形颗粒生物陶瓷材料因其易于塑形(既可以作为骨修复单独制品,也可以制成微球堆积体组成三维多孔支架)、植入方便而广泛应用于骨缺损填充修复[17]。对于球形颗粒而言,因其具有其它不规则形状颗粒物所没有的良好性能,如流动性好、堆积密度大、质量轻和填充性能好等,势必在原位骨再生修复领域获得更大的应用[18-19]。
据此,本文利用自制的同轴多喷头系统,试图构建一类具有组分分布可调、内部微结构可控以及生物活性、降解性可阶段剪裁的新型复相陶瓷微球体系,实现颗粒材料的无机离子释放剂量水平和颗粒尺度阶段性可调控等功能,为原位骨再生修复构建更有利于细胞迁移、血管化发生以及新骨再生与骨重建协同匹配的新型多孔生物活性材料。
2 实验方法
本文通过实验室自主搭建的生物活性陶瓷微球制备系统,通过一步法制备出具有双壳层结构的核-壳结构多孔陶瓷微球材料,并通过改变壳层微结构探讨其离子释放和降解速率。
2.1 材料
致孔剂选用聚苯乙烯(Polystyrene)微球,粒径在15μm左右;海藻酸钠(NaAlg)为分析纯。
按β-Ca3(PO4)2的化学计量比分别配制相应成分的Ca(NO3)2和(NH4)2HPO4水溶液,用氨水将溶液pH调节到7.5;将钙盐溶液逐滴滴加到连续搅拌的磷酸盐溶液中,维持反应体系的pH值为7.5,滴加完成后继续搅拌24 h,然后过滤,用去离子水和乙醇分别洗涤三次,80℃干燥,850℃煅烧2 h,得β-TCP粉体。
为了获得掺Sr硅灰石粉体,本文按Ca0.95Sr0.05SiO3的化学计量比分别配制相应成分的Ca(NO3)2、Sr(NO3)2混合水溶液和Na2SiO3水溶液;用稀氨水调节Ca(NO3)2、Sr(NO3)2溶液的pH值到10.0,并将其逐滴滴加到连续搅拌的Na2SiO3溶液中,滴加完成后继续搅拌24 h,用去离子水和乙醇分别洗涤三次,80℃干燥,850℃煅烧2h,得到掺锶硅灰石粉体[20]。
2.2 核-壳结构多孔生物活性陶瓷微球的制备
称取适量海藻酸钠溶解于去离子水中,形成海藻酸钠水溶胶;称取适量陶瓷粉体(β-CaSiO3或β-TCP),多孔壳层按照质量比β-TCP∶PS致孔剂=1∶1;边搅拌边将上述三份粉体缓慢加入海藻酸钠水溶胶中,经过充分搅拌(1h),制得粉体微粒均匀分散在海藻酸钠水溶胶中的浆料。
多层化核-壳结构多孔生物陶瓷微球的制备设备如图1(a)所示,主要包括多通道注射泵和同轴多层喷头。实验过程中,不同成分组成的海藻酸钠-陶瓷粉体浆料分装在各通道入口,经过导管与同轴多层喷头相连,并通过各自流道在末端汇集,形成具有核-壳结构的液滴。随着液滴增大并不能克服其重力,浆料液滴滴入到Ca(NO3)2接收液中,通过海藻酸根与钙离子的交联作用迅速交联、硬化。最终所制微球的各层浆料组成分别为Ca0.95Sr0.05Si@CaP@CaP-PS(外壳层造孔微球)、Ca0.95Sr0.05Si@CaP-PS@CaP(内壳层造孔微球)。收集到的陶瓷浆料微球经固化1~2 h后取出,用去离子水洗涤三次, 60℃干燥处理。

图1 (a)微球制备装置示意图,(b)多孔双壳结构的核-壳复相陶瓷微球内部微结构示意图Fig.1 (a) Schematic illustration of experimental device, (b) Schematic illustration of porous double-shell ceramic microspheres
为了探讨烧结温度制度对复相陶瓷微球的影响,本文采取了两种烧结方案:一步烧结法:将干燥后微球直接升温至1120℃,并保温3h,然后随炉冷却;两步烧结法:先将微球升至1120℃并保温30min,然后迅速降温(10min)至1060℃,并保温3h,然后随炉冷却。两步烧结法的原理是将试样首先加热到一个较高的温度,使体系获得一个足以发生晶界扩散的热力学驱动力,然后迅速降温至某一较低温度继续保温,抑制晶界迁移,从而达到细化晶粒的效果。
2.3 样品表征
利用数码相机和游标卡尺对微球样品进行外观和粒径分析,采用扫描电子显微镜(SEM)表征其表面、断面的形貌和微结构,采用X射线衍射(XRD)分析测试微球样品煅烧后的物相组成。
2.4 体外降解实验
称取0.45g陶瓷微球分别置于15mL Tris- HCl缓冲液(0.1mol/l,pH=5.2)中,放入37℃恒温箱。在预定时间间隔后取1.0mL上清液,再加入等体积新鲜缓冲液,偏酸性pH缓冲溶液是为了模拟活跃破骨细胞引起的局部酸化环境并促使骨吸收;采用电感耦合等离子体发射光谱仪(ICP-OMS)测试上清液中Ca、P、Si和Sr的浓度。
浸泡8周后取出微球,用去离子水和乙醇分别洗涤3次,再置于120℃条件下干燥24h,然后称量,根据浸泡前后的质量计算失重率(%),计算公式如下:失重率=(浸泡前质量-浸泡后质量)/浸泡前质量×100%。
3 实验结果
3.1 外观和粒径分析
图2是所制备复相陶瓷微球Ca0.95Sr0.05Si@CaP@CaP-PS、Ca0.95Sr0.05Si@CaP-PS@CaP在干燥前后和煅烧前后的光学照片。可以看出,本实验制备的微球尺寸均一、形态维持良好。结合图3所示粒径分析结果,可知所制备的微球Ca0.95Sr0.05Si@CaP@CaP-PS和Ca0.95Sr0.05Si@CaP-PS@CaP干燥前直径为3.5~4.0mm,且内壳层造孔的微球直径比外壳层造孔的微球直径略小。经60℃干燥处理后,颗粒直径发生显著收缩,但是仍旧维持良好的球形形态。经煅烧处理,颗粒的微球形态稳定,且一步烧结法煅烧的微球收缩率比两步烧结法收缩率略大,最终所得的复相陶瓷微球Ca0.95Sr0.05Si@CaP@ CaP-PS和Ca0.95Sr0.05Si@CaP-PS@CaP的直径在2.1~2.3mm之间。

图2 陶瓷浆料微球干燥与煅烧前、后的外观照片Fig.2 Outward appearance of the bioceramic microspheres before and after drying and sintering

图3 微球干燥与煅烧前、后的收缩率Fig.3 Shrinkage of the double-shell bioceramic microspheres before and after drying or sintering, respectively
3.2 多层化核-壳结构多孔生物活性陶瓷微球成分分析
图4为两种烧结制度所得产物的XRD图谱,可见两种烧结制度所获陶瓷微球Ca0.95Sr0.05Si@ CaP@CaP-PS和Ca0.95Sr0.05Si@ CaP-PS@CaP产物的物相成分相同,表明烧结温度制度对材料物相没有影响。同时,XRD图谱中不仅可以检测到β-TCP和β-CaSiO3相,还存在HA的衍射峰,说明β-TCP相在煅烧过程中发生相转化,形成HA-TCP双相陶瓷。分析其原因,可能是由于海藻酸根与接收液中钙离子螯合,在煅烧过程中钙离子与β-TCP发生反应,进而形成HA-TCP双相陶瓷,因而与常规的仅仅由HA高温煅烧发生相转化的情况不同。

图4 采用一步烧结法(a)和两步烧结法(b)制备的复相陶瓷微球X-射线衍射图谱Fig.4 XRD patterns of the double-shell bioceramic microspheres sintered by (a) one-step and (b) two-step methods, respectively
3.3 多层化核-壳结构多孔生物活性陶瓷微球形貌与微结构分析
图5是多孔生物陶瓷微球表面形貌SEM照片,比较可知,内外壳层具有孔道的两种微球表面形貌差异明显。外壳层被造孔的微球表面存在球形孔结构,孔径在10μm左右,这一尺度略小于PS致孔剂形状尺寸,说明烧结过程发生收缩;从图3(A2、C2)可知,孔隙内壁与外缘形貌类似,说明PS致孔剂无残留。内部造孔微球表面光滑,结构致密,晶粒相互融合,晶界清晰可见。

图5 外壳层造孔(A0~A2,C0~C2)和内壳层造孔(B0~B2,D0~D2)陶瓷微球烧结后的表面形貌Fig.5 SEM images of the surface microstructures of l bioceramic microspheres with external (A0~A2, C0~C2) or interior (B0~B2, D0~D2) porous shell
图6为多层化核-壳结构多孔生物陶瓷微球的断面形貌SEM照片,从低倍SEM图可以看出微球明显呈双壳结构,内壳层与外壳层之间因多孔结构的存在可看出明显分界,核层与内壳层之间因陶瓷相不同导致的收缩率不同而产生空隙。从高倍SEM图可看出双壳层复相陶瓷微球核层均由微米级颗粒烧结而成,结构较为致密,并在相应壳层出现球形孔结构,表明利用该同轴喷头制备的微球是双壳层化的核-壳结构,并且多孔层的部位可以调整和控制。比较两种烧结制度所得结果进一步可知,两步烧结法所得产物的晶粒细小,结构更致密,表明两步烧结法达到了细化晶粒的效果,这势必有利于改善多层化核-壳结构多孔生物陶瓷微球的力学性能。
3.4 多层化核-壳结构多孔生物活性陶瓷微球体外降解行为分析
为明确两种不同结构的多层化核-壳结构多孔生物陶瓷微球的降解行为和生物活性离子释放特征,图7(a)所示的是复相陶瓷微球在Tris-HCl溶液中降解28d后的失重率。结果显示,多孔性外壳层微球28 d内失重率在2%~3%之间,而多孔性内壳层微球失重率高于4%,表明多孔性结构特征能显著改变陶瓷微球的降解性。
进一步对两种复相陶瓷微球Ca0.95Sr0.05Si@ CaP@CaP-PS和Ca0.95Sr0.05Si@CaP-PS@CaP在Tris-HCl中浸泡28d的无机离子释放规律进行了表征。从图8(a)可见,来源于硅灰石核层Sr的浓度随着时间延长逐渐升高,且离子释放的水平与壳层孔道分布区域密切相关,多孔性外壳层的微球高于多孔性内壳层微球,表明多孔结构处于最外壳层比处于内壳层更有利于核心层的降解。Ca、Si的浓度变化规律在降解前期(24h)与Sr的浓度变化规律基本一致,后期则比较紊乱(图8b,c)。再看P浓度变化规律(图8d),可知最初4h,P浓度升高,在此之后P浓度不升反降,7d之后基本维持平衡,且整个过程中,多孔性外壳层的复相陶瓷微球中P离子释放水平均低于多孔性内壳层的复相陶瓷微球。
结合上述复相陶瓷微球的失重率和Ca、P的浓度水平和变化规律,在本实验的弱酸性条件下(模拟体内破骨细胞活跃区微环境条件),壳层的TCP会发生较快溶解并释放Ca、P离子,由此推测该类复相陶瓷降

图6 复相陶瓷微球烧结后的断面形貌。外壳层被造孔的微球(A0~A5,C0~C5);内壳层被造孔微球(B0~B5,D0~D5)Fig.6 SEM images of the fracture microstructures of double-shell bioceramic spheres with external (A0~A5,C0~C5) or interior (B0~B5,D0~D5) porous shell

图7 陶瓷微球在pH5.2的Tris-HCl溶液中浸泡28d后的失重率Fig.7 weight loss (%) of in the Tris-HCl buffer with initial pH 5.2 during soaking the bioceramic spheres
解过程中可能因出现有酸性钙磷酸盐析出或沉积,从而导致P离子浓度呈现明显下降的趋势,后期降解速率与沉积速率达到平衡,P离子浓度也达到平衡。
4 实验讨论
骨损伤修复材料的生物活性和降解性是影响骨再生修复效率的重要因素。HA和β-TCP等磷酸钙类陶瓷材料因具有与骨矿物质类似的钙-磷酸盐组成,而受到广泛关注。大量研究证实磷酸钙类陶瓷材料具有良好的生物相容性及骨传导性能。微球型骨缺损填充材料因其外形规则、易于塑型的优点而得到广泛应用。临床上,颗粒型骨修复材料主要用于非承重骨缺损填充,其堆砌形成的三维网络结构有利于细胞长入[21-22]。Lal和Sun借助计算机辅助模拟计算了等径微球紧密堆积体系的孔道结构参数,从而精确计算微球颗粒尺度从400到600μm增长带来的孔隙率和孔尺度变化[23]。理论上,等径球堆积的最大堆积密度为71.4%,并且孔分布呈周期性和均一性。很显然,本文制备的微球颗粒度达到2mm以上,四个微球形成最紧密堆积的三角锥结构内部孔道尺度超过500μm,满足原位骨再生对支架材料孔尺度的基本需求。众所周知,体内实验证实常规磷酸钙微球陶瓷材料经高温煅烧后,降解较为缓慢,生物活性较差。一些研究证实植入体内的磷酸钙微球仅仅传导骨组织在微球间隙内生长,难以与各种病理性骨损伤修复速率相匹配[24]。本文利用自制微球制备系统成功实现一步制备双壳层型核-壳结构复相陶瓷微球材料,该制备工艺极为简便,制备出的微球尺寸均一,经干燥、煅烧处理后微球发生一定收缩,最终尺寸在2.1~2.3mm之间,由此紧密堆积形成的多孔网络势必非常有利于成骨相关细胞迁移和血管化发生,以及新生骨长入。
作为骨缺损填充材料的生物活性陶瓷微球,内部结构诸如孔隙大小、孔隙内部连通性等都至关重要[25]。Gonda Y等[26]的研究证明,微观结构对于陶瓷材料的成骨性能有显著影响。理论上,具有多孔结构的微球材料相比致密微球材料,与体液接触面积大,离子溶出速度加快,同时微孔结构有利于吞噬细胞吸附,加速陶瓷材料降解。另一方面,植入体内的微球逐渐降解,微球尺度降低,微球之间的间隙越小,必然会限制成骨相关细胞向微球内部迁移、微球间隙内血管化和新骨再生。本研究制备的双壳层型核-壳结构复相陶瓷微球材料还利用添加致孔剂造孔方案,在不同的壳层浆料中添加PS微球致孔剂,经烧结后致孔剂挥发从而形成空腔,并最终形成10μm左右、分布较为均匀的球形孔,在多层化复相微球的不同壳层分别实现了多孔结构。近些年的研究表明,硅酸钙陶瓷具有良好的骨诱导性和降解性,在模拟体液中能够快速诱导沉积羟基磷灰石,而锶作为人体骨代谢必需的微量元素之一,具有促进成骨新骨生成、抑制骨再吸收的双重功效[27]。其次,锶还被证明具有调节骨质密度和强度,抑制骨质疏松等生物学效应,并且在介导骨髓间充质干细胞分化方面也显示其特异性生物学潜力[28-29]。因此,在该微球材料降解后期,微球之间间隙减小,但是硅酸钙材料优异的降解性和生物活性有利于微球材料的进一步降解吸收,实现与骨损伤速率相匹配。本研究的体外离子释放实验结果表明,两种壳层结构的复相陶瓷微球在降解过程中处于核层的Sr离子表现出明显差异,多孔性内壳层陶瓷微球内核层Sr离子释放水平低于多孔性外壳层微球。失重变化则与之相反,可能的原因是外壳层的多孔结构增大了表面积,而释放的Ca、P离子达到某酸性磷酸钙的过饱和水平,从而发生沉积效应。
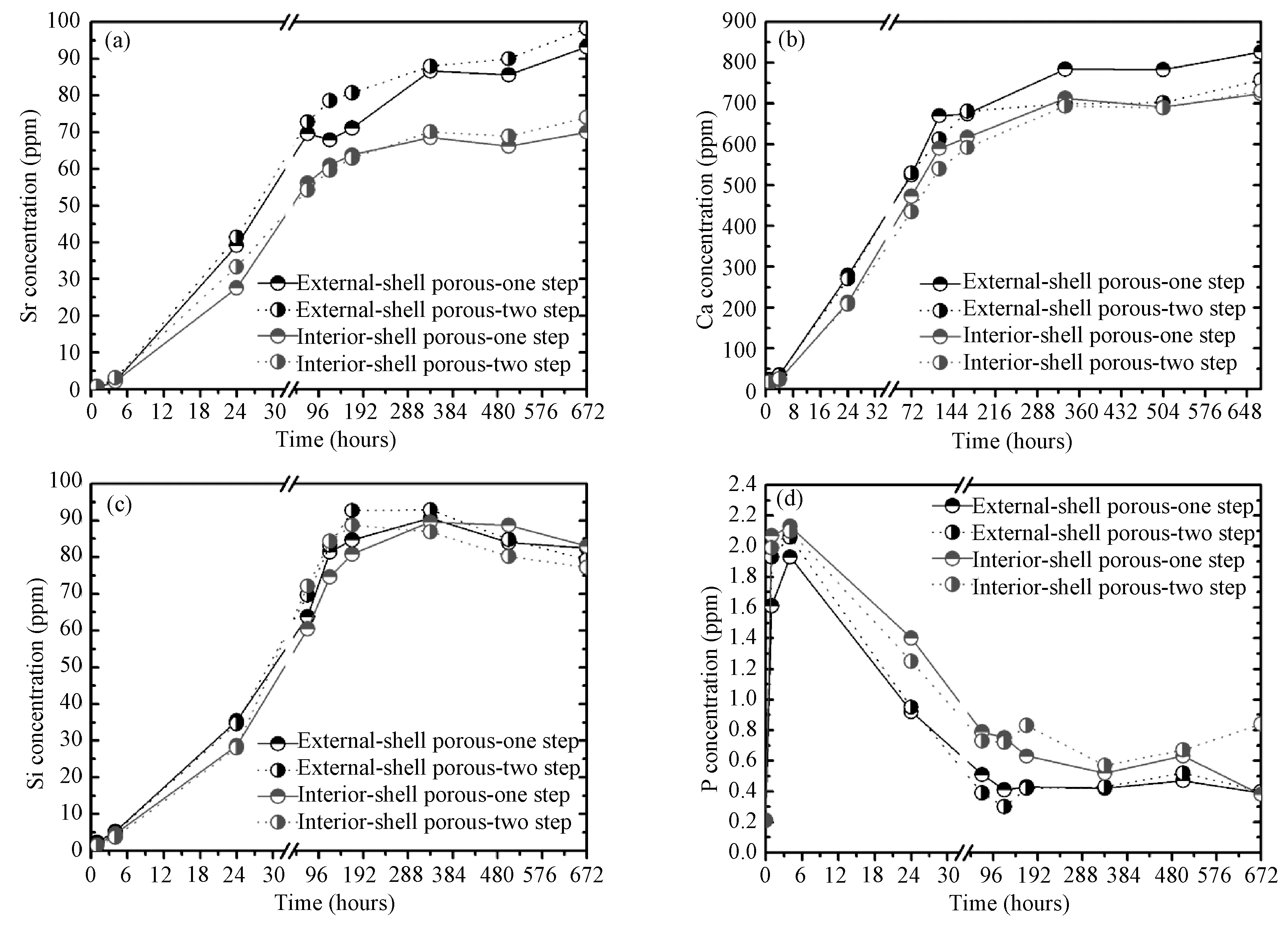
图8 陶瓷微球在pH 5.2的Tris-HCl溶液中的Sr(a)、Ca(b)、Si(c)、P(d)离子浓度变化Fig.8 Changes in Sr(a),Ca(b),Si(c) and P(d) concentrations in the Tris-HCl buffer with initial pH 5.2 during soaking the ceramic spheres
5 结 论
本文利用自制陶瓷微球制备系统实现了一步制备多层化复相陶瓷微球Ca0.95Sr0.05Si@CaP@CaP-PS和Ca0.95Sr0.05Si@CaP-PS@CaP,结合添加致孔剂造孔工艺,实现了不同壳层中微观结构的可调可控,该方法制备的微球尺度均一,球形度良好,壳、核层的结构完整,界面清晰;体外降解实验结果表明,多孔孔道所处位置不同对微球降解性有显著影响,核层的Sr离子释放水平与不同壳层的多孔性特征密切相关。该方法制备的多孔双壳结构的复相陶瓷微球的组分及微结构均可调可控,势必将在骨缺损修复研究和微球载药领域具有重要应用意义。
[1] Dorozhkin SV, Epple M. Biological and medical significance of calcium phosphates[J]. Angewandte Chemie International Edition, 2002, 41 (17):3130~3146.
[2] Salinas AJ, Esbrit P, Vallet-Regí M. A tissue engineering approach based on the use of bioceramics for bone repair[J]. Biomaterial Science, 2013, 1(1):40~51.
[3] Rodriguez JP, Garat S, Gajardo H, Pino AM, Seitz G. Abnormal osteogenesis in osteoporotic patients is reflected by altered mesenchymal stem cells dynamics[J]. Journal of Cellular Biochemistry, 1999, 75(3):414~423.
[4] Manjubala I, Sastry TP, Kumar RVS. Bone in-growth induced by biphasic calcium phosphate ceramic in femoral defect of dogs[J]. Journal of Biomaterials Applications, 2005, 19(4):341~360.
[5] Wu C, Jiang C. A review of bioactive silicate ceramics[J]. Biomedical Materials, 2013, 8(3):032001~0320013.
[6] Quarto R, Mastrogiacomo M, Cancedda R, et al. Repair of Large Bone Defects with the Use of Autologous Bone Marrow Stromal Cells[J]. New England Journal of Medicine, 2001, 344(5):385~386.
[7] Aza PND, Guitian F, Aza SD. Bioactivity of wollastonite ceramics: In vitro evaluation[J]. Scripta Metallurgica Et Materialia, 1994, 31(8):1001~1005.
[8] Siriphannon P, Hayashi S, et al. Preparation and sintering of CaSiO3from coprecipitated powder using NaOH as precipitant and its apatite formation in simulated body fluid solution[J]. Journal of Materials Research, 1999, 14(2):529~536.
[9] Xu S, Lin K, Wang Z, et al. Reconstruction of calvarial defect of rabbits using porous calcium silicate bioactive ceramics[J]. Biomaterials, 2008, 29(17): 2588~2596.
[10] Lin K, Liu Y, Huang H, et al. Degradation and silicon excretion of the calcium silicate bioactive ceramics during bone regeneration using rabbit femur defect model[J]. Journal of Materials Science Materials in Medicine, 2015, 26(6):1~8.
[11] 李至成, 陈晓怡, 杨贤燕, 苟中入. 采用两步pH调节仿生水溶胶介质法合成磷酸钙微球[J]. 材料科学与工程学报, 2013, 31(4):550~556.
[12] 王彦伟, 蔡舒, 彭珍珍, 姚康德. 微球堆积法制备多孔磷酸钙生物材料[J]. 材料科学与工程学报, 2005, 23(3), 235~238.
[13] 张立岩, 金掌, 甘维, 等. 锶锌共掺杂磷酸八钙微球制备及骨修复性能研究[J].材料科学与工程学报, 2016, 34(1):900~905.
[14] Zhu Y, Min Z, Xing H, Zhang J, Tao C. Substitutions of strontium in mesoporous calcium silicate and their physicochemical and biological properties[J]. Acta Biomaterialia, 2013, 9(5):6723~6731.
[15] Xu S, Lin K, Wang Z, et al. Reconstruction of calvarial defect of rabbits using porous calcium silicate bioactive ceramics[J]. Biomaterials, 2008, 29: 2588~2596.
[16] Jones AC, Arns CH, Hutmacher DW, et al. The correlation of pore morphology, interconnectivity and physical properties of 3D ceramic scaffolds with bone ingrowth[J]. Biomaterials, 2009, 30(7):1440~1451.
[17] Hossain KZ, Patel U, Ahmed I. Development of microspheres for biomedical applications: a review[J]. Progress in Biomaterials, 2015, 4(1):1~19.
[18] 李波, 徐文峰, 廖晓玲. 磷酸钙微球骨修复材料研究进展[J].无机材料学报, 2014, 29(10):1009~1017.
[19] Ribeiro CC, Barrias CC, Barbosa MA. Preparation and characterisation of calcium-phosphate porous microspheres with a uniform size for biomedical applications[J]. Journal of Materials Science Materials In Medicine, 2006, 17(5):455~463.
[20] Lin K, Xia L, Li H, et al. Enhanced osteoporotic bone regeneration by strontium-substituted calcium silicate bioactive ceramics[J]. Biomaterials, 2013, 34(46): 10028~10042.
[21] Silva GA, Coutinho OP, Ducheyne P, Reis RL. Materials in particulate form for tissue engineering. 2. Applications in bone[J]. Journal of Tissue Engineering and Regenerative Medicine, 2007, 1(2): 97~109.
[22] Silva GA, Ducheyne P, Reis RL. Materials in particulate form for tissue engineering. 1. Basic concepts[J]. Journal of Tissue Engineering & Regenerative Medicine, 2007, 1(1):4~24.
[23] Lal P, Sun W. Computer modeling approach for microsphere- packed bone scaffold[J]. Computer-Aided Design, 2004, 36(5):487~497.
[24] Tadic D, Epple M. A thorough physicochemical characterisation of 14 calcium phosphate-based bone substitution materials in comparison to natural bone[J]. Biomaterials, 2004, 25(6): 987~994.
[25] Jin QM, Takita H, Kohgo T, et al. Effects of geometry of hydroxyapatite as a cell substratum in BMP- induced ectopic bone formation[J]. Journal of Biomedical Materials Research, 2000, 52(4):841~851.
[26] Kawamura H, Ito A, Miyakawa S, et al. Stimulatory effect of zinc on bone formation around zinc-releasing calcium phosphate ceramics implanted rabbits femora[J]. Journal of Biomedical Material Research, 2000, 50(2):184~190.
[27] Gary AF, Will S, Susmita B. Effects of SiO2, SrO, MgO, and ZnO dopants in tricalcium phosphates on osteoblastic Runx2 expression[J]. Journal of Biomedical Materials Research Part A, 2013, 102(7): 2417~2426.
[28] Yang F, Yang D, Tu J, Zheng Q, Cai L, Wang L. Strontium enhances osteogenic differentiation of mesenchymal stem cells and in vivo bone formation by activating Wnt/Catenin signaling[J]. Stem Cells. 2011, 29(2): 981~988.
[29] Nielsen FH. Importance of making dietary recommendations for elements designated as nutritionally beneficial, pharma-cologically beneficial, or conditionally essential[J]. Journal of Trace Elements Expert Medicine, 2000, 13(6):113~122.
Preparation and Characterization of Core-shell-structured Wollastonite/Calcium Phosphate Porous Bioceramic Spheres
LIU Limin2, ZHANG Lei2, YANG Xianyan1, ZHUANG Chen1, KE Xiurong2, YANG Guojing2, GOU Zhongru1
(1.Zhejiang-California International NanoSystems Institute, Zhejiang University, Hangzhou 310058, China; 2.The 3rdaffiliated Hospital of Wenzhou Medical University, Rui’an 325200, China)
The regeneration and repair of pathological bone defect is still a great challenge in clinic. Here we demonstrated how a versatile andexible one-step process can generate multilayer bioceramic microspheres with tunable core or shell composition and shell microstructures. The sphere-forming equipment, as a laboratory scale apparatus, is composed of multi-channel injection pump, coaxially aligned multilayer capillaries, and collection container, to help with the formation of bioceramic microspheres beyond homogenous hybrid. We chose β-tricalcium phosphate (CaP) and β-phase wollastonite (CaSi) to demonstrate the effectiveness of this method in fabricating the bioceramic microspheres with the tunableness mentioned above. The choosing was based on that these materials exhibit excellent bioactivity, and show either slower or faster biodegradation rate than the new bone regeneration rate in vivo. When organic microbeads (~15μm) are pre-mixed into the shell bioceramic slurry, the tailorable porous structures can be introduced into different shell layers after sintering, and thus the permeability is potentially maximized for rapid exchange of guest molecules into and inorganic ions out of the microspheres. This new strategy can be used to fabricate a variety of multilayer porous bioceramic microspheres for applications in tissue engineering and drug delivery, ect..
β-tricalcium phosphate; β-phase wollastonite; double-shell microspheres; porous microstructure; bioceramic composites
1673-2812(2017)01-0019-07
2015-12-25;
2016-01-19
国家自然科学基金资助项目(51372218)和浙江省自然科学基金资助项目(LY15H180006)
柳丽敏(1990-),硕士研究生。研究方向:生物材料。
苟中入(1975-),副研究员,硕士生导师。研究方向:生物材料。E-mail: zhrgou@zju.edu.cn。
P578.92; TQ126.3
A
10.14136/j.cnki.issn 1673-2812.2017.01.005

