Nb基添加剂对AlH3放氢行为的影响
陈 田,刘海镇,,徐 丽,李寿权,葛红卫,王新华
(1.浙江大学材料科学与工程学院,浙江 杭州 310027; 2.全球能源互联网研究院,北京 102211)
Nb基添加剂对AlH3放氢行为的影响
陈 田1,刘海镇1,2,徐 丽2,李寿权1,葛红卫1,王新华1
(1.浙江大学材料科学与工程学院,浙江 杭州 310027; 2.全球能源互联网研究院,北京 102211)
氢化铝(AlH3)具有储氢量高(10.1wt%)等优点,是近年来受到广泛关注的储氢材料之一。本文采用有机合成法制备了AlH3,并添加了铌基添加剂(Nb、NbC、Nb2O5和NbF5)对其进行改性,系统研究了铌基添加剂对AlH3放氢性能的影响。研究结果表明,制备的AlH3纯度较高,不含其他杂质相,起始放氢温度约为130℃,终止放氢温度约为170℃,总放氢量达8.5wt%左右;添加剂Nb和NbC对AlH3放氢性能有明显的改善作用,起始放氢温度降低到90~95℃;Nb2O5和NbF5对AlH3的放氢行为影响显著,手工研磨的AlH3+Nb2O5样品后,AlH3的起始放氢温度从130℃下降到70℃,终止放氢温度随添加量的增加而降低,手工研磨的AlH3+1mol% NbF5样品的初始放氢温度降低到60℃,放氢终止温度为140℃。同时,本文分析讨论了铌基添加剂对AlH3的放氢性能的影响机理。
储氢材料; 放氢性能; 氢化铝; 添加剂
1 引 言
化石燃料的不断耗竭以及其对环境的污染迫使人们寻找新的替代能源。氢能是一种理想的二次能源,作为一种新型且能量密度高的绿色能源, 目前正受到世界各国的高度重视[1]。氢气的应用涉及氢气的制备、存储和利用三大技术,现阶段氢气储存是氢气利用的瓶颈技术,高性能储氢材料的研究开发是近年来氢能领域的研究热点之一。目前正在研究的储氢材料主要有金属(合金)、配位氢化物、碳基材料、有机液体氢化物和氨硼烷等。将氢气储存在固态材料中被认为是一种安全有效的方法[2-7]。LiBH4配位氢化物具有较高的质量储氢密度(18.4wt%),但是存在放氢温度高(300℃以上)、可逆吸氢条件苛刻等缺点[6],不能满足实际应用的要求。AlH3是一种二元共价氢化物,早期主要用于有机合成的还原剂、聚合催化的添加剂以及火箭燃料的高能组分等领域[8-10]。由于AlH3的理论质量储氢密度高达10.1wt%,近年来作为储氢材料受到了高度重视[11-25]。
据报道,大颗粒(约100μm)AlH3的放氢温度在175~200℃之间[9],这一温度范围与美国能源部(DOE)提出的车载储氢系统的工作温度[21]相比仍然偏高。Sandrock等人[11,22]报道了降低颗粒尺寸和添加LiH、KH和NaH可以使AlH3的放氢温度降低25~50℃。然而,其他添加剂(如过渡金属的化合物)对于AlH3放氢行为的影响鲜有报道。本文采用有机溶液合成法制备了新鲜的AlH3,并添加Nb基添加剂对AlH3进行了改性。
2 实验部分
2.1 试剂与仪器
LiAlH4(Alfa Aesar,Powder,97%),AlCl3(Alfa Aesar,Powder,99%),无水乙醚(国药集团,AR,99.5%),Nb、NbC、Nb2O5、NbF5均为分析纯。
球磨采用QM-1SP行星式球磨机(南京大学仪器厂),球磨罐和球磨球材质为1Cr18Ni9Ti不锈钢。XRD分析采用D/MAX-RA型X射线粉末衍射仪(XRD,日本理学公司)。
采用自制Sievert型吸放氢测试装置测定材料吸放氢性能。反应器的温度由厦门宇电自动化科技有限公司生产的Al-808PA2K1G型温控仪控制,压力传感器为江门利德信息技术有限公司(LEADER)生产的LDN500-A-11N-1MPa和LDN500-A-11N-16MPa型传感器。温度和压力数据通过厦门宇电自动化科技有限公司生产的Al-706MJ1J5J5S型多路巡检显示仪进行采集转化,并传输到计算机端进行记录储存。装置的阀门使用美国Swagelok公司生产的SS-41GS3MM型阀门,耐压可达17MPa以上。
2.2 实验方法
AlH3的制备是采用有机溶液合成法进行,合成工艺流程如图1所示。在AlH3的合成过程中,氢化铝的乙醚络合物(AlH3·nEt2O)的脱醚反应AlH3·nEt2O → AlH3+ Et2O(g)的反应条件(如脱醚气氛、脱醚温度、脱醚时间以及脱醚助剂等)对最后产生的AlH3的晶相有比较大的影响[25]。而本实验中采取的是如下条件,分别配制1mol/L LiAlH4乙醚溶液和1mol/L AlCl3乙醚溶液;将两溶液按溶质摩尔比4∶1混合后,立即过滤得滤液,将滤液静置2h,再经减压干燥得到白色AlH3乙醚络合物。然后,将AlH3乙醚络合物密封于样品罐中,于60℃下动态真空恒温4h,以使AlH3从乙醚络合物中解离出来。最后,用乙醚溶液将脱醚后的样品清洗三遍以除去多余的LiAlH4,即可得纯的AlH3样品。整个制备过程全部在充满惰性气体(氮气或者氩气)的手套箱中进行,样品的转移也均是在惰性气氛下进行的。
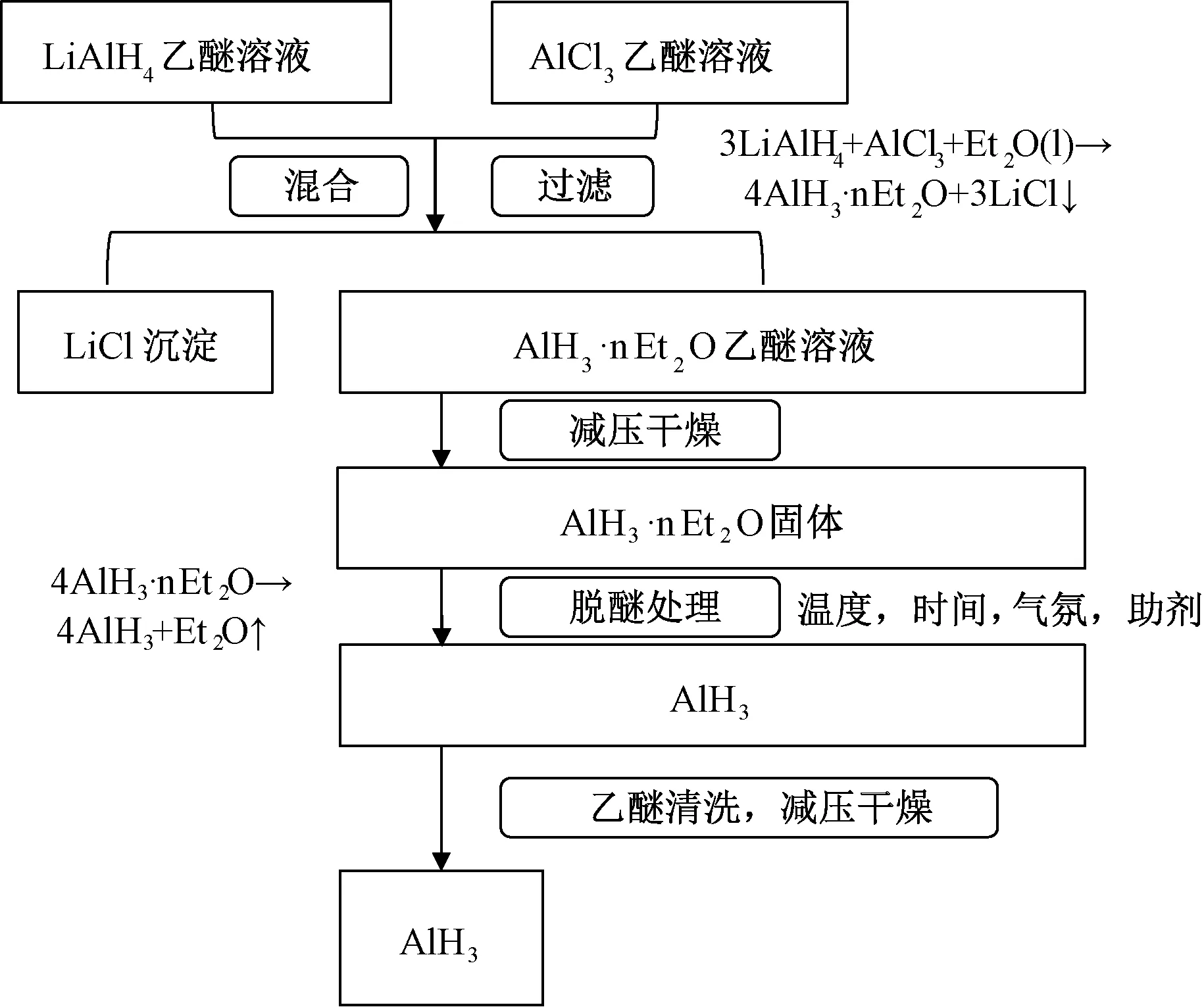
图1 AlH3的合成工艺流程图Fig.1 Preparation process of AlH3
按一定比例将单独的AlH3以及AlH3和Nb基添加剂密封于球磨罐中(球料比为50∶1)进行球磨,球磨转速为150rpm或者250rpm,球磨时间为2h,为减轻球磨过程温升对样品的影响,采用间歇球磨,即每球磨6min歇停6min。将球磨后的样品在手套箱中取出,并密封于反应器中进行程序控温放氢,放氢过程中,样品温度由室温以2℃/min的速率加热到200℃,并在200℃下保温30min。然后,对放氢后的样品进行X射线衍射分析,采用Cu Kα辐射,管电压为40kV,管电流为40mA,扫描步长为0.0167113,另外,为防止氧化,样品需要由专用样品罩进行保护。
3 结果与讨论
3.1 AlH3的制备与放氢性能
通过对AlH3的合成工艺的优化,以LiAlH4和AlCl3为原料利用有机溶液合成法成功制备了AlH3。当固定时间为4h,将温度升高到77℃进行脱醚,脱醚产物为AlH3。当固定温度为60℃,将时间延长至6.5h时,脱醚产物也基本为AlH3。值得一提的是,脱醚温度不宜太高,脱醚时间也不能太长,否则生成的AlH3会发生分解。最后,脱醚产物通过乙醚洗涤除去LiAlH4后可以得到纯的AlH3样品,制备得到的样品的XRD的图谱如图2所示,从图中可以看出,用有机溶液合成法制备得到的AlH3样品并没有其他杂质相,且没有其他AlH3晶相,说明AlH3产物纯度较高。
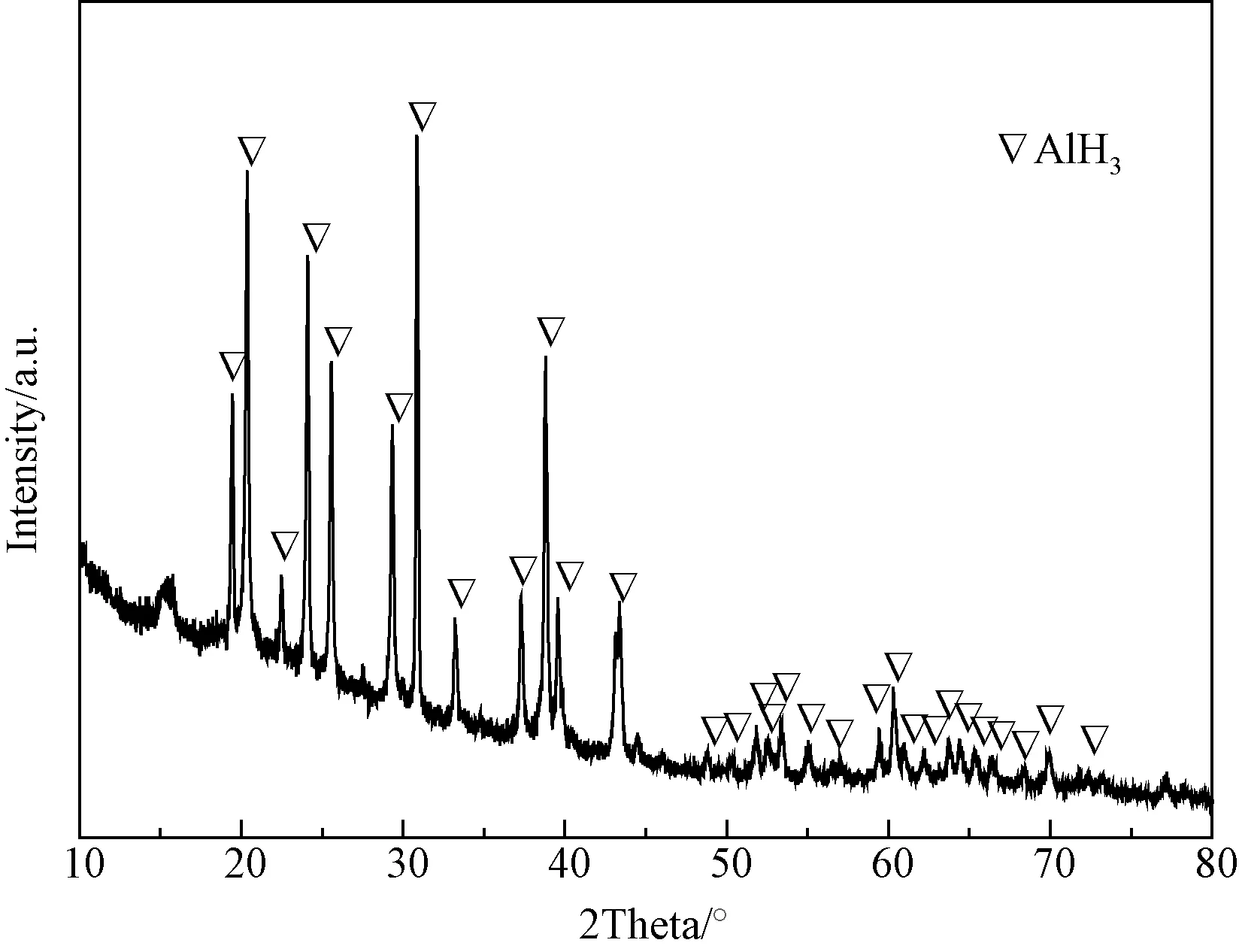
图2 制备的AlH3样品的XRD图谱Fig.2 XRD pattern of the as-prepared AlH3
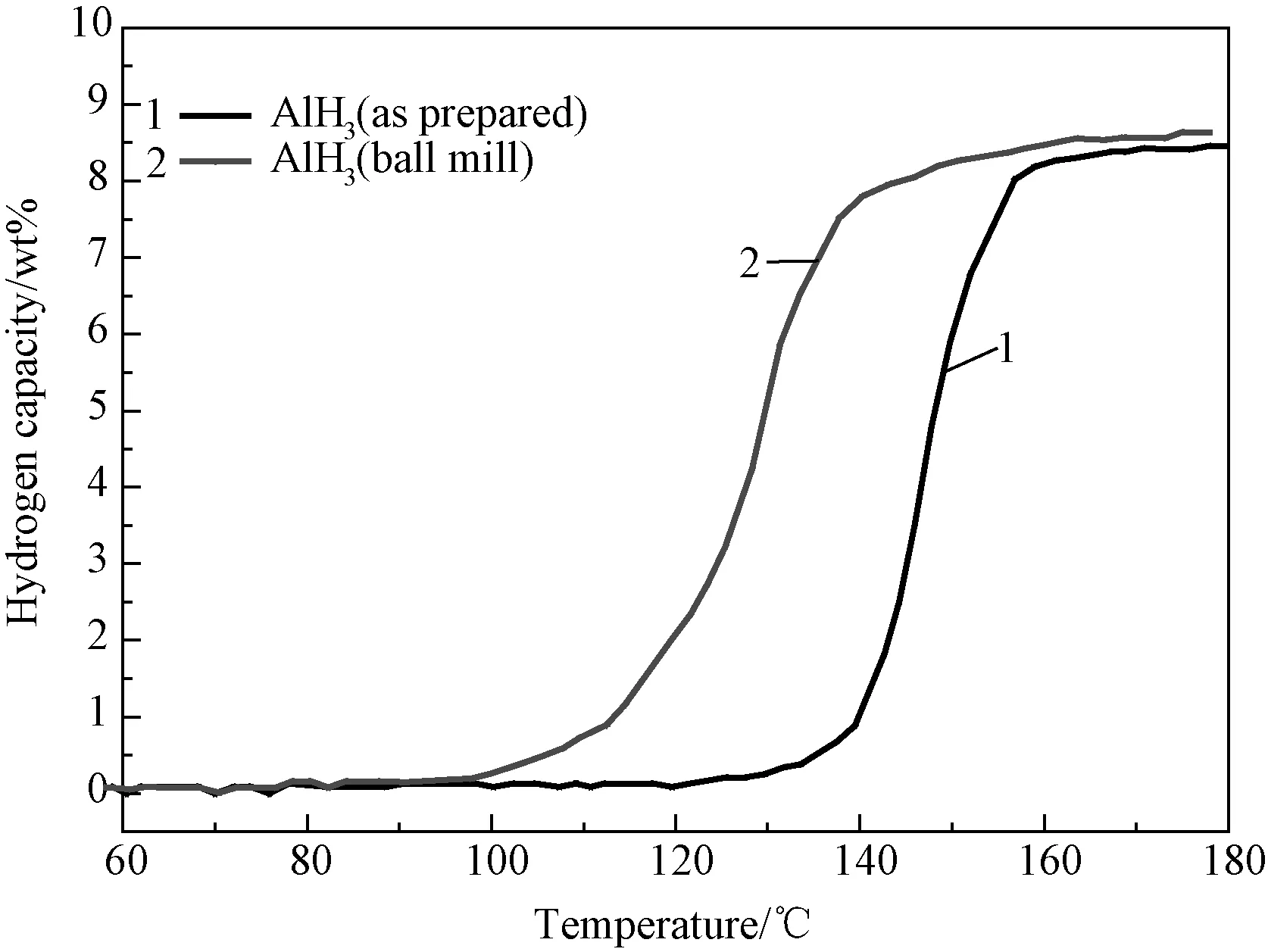
图3 AlH3球磨前后的程序控温放氢曲线Fig.3 TPD curves of AlH3 before and after milling
图3为未经任何处理和球磨后的AlH3的程序控温放氢曲线。从图3可以看出,未经任何处理的AlH3的起始放氢温度约为130℃,终止放氢温度约为170℃,总放氢量可达8.5wt%。为了改善AlH3的放氢性能,对制备得到的AlH3样品进行了球磨处理,球磨参数为在150rpm的转速下球磨2h。经球磨处理后的AlH3的放氢曲线如图3所示,从图中可以看出,AlH3经球磨处理后起始放氢温度由球磨前的130℃降低到了100℃左右,终止放氢温度由球磨前的170℃降低到了150℃,球磨后的AlH3样品的整体放氢温度比未球磨的AlH3样品降低了20℃以上。这是由于AlH3经球磨处理后颗粒尺寸减小,比表面积增大,同时使颗粒内部缺陷增多,即可以使样品中产生大量的缺陷和应力,从而有利于氢的扩散,降低了AlH3的放氢势垒,以上这些因素都可以在一定程度上促进样品的放氢。
3.2 Nb基添加剂对AlH3放氢行为的影响
为了进一步改善AlH3样品的放氢性能,分别在AlH3中添加了Nb、NbC、Nb2O5和NbF5后进行球磨处理,然后对样品进行程序控温放氢曲线的测试,研究Nb基添加剂对AlH3放氢性能的影响。
添加Nb前后的AlH3样品的程序控温放氢曲线如图4所示,实验参数为2℃/min的加热速率,加热到的最高温度为200℃,并在200℃下保温30min。由图可见,添加Nb后对AlH3的性能有所改善,改善的效果体现在起始放氢温度降低到了约95℃,终止放氢温度降低到了140℃以下,并且样品整体的脱氢量无明显降低。
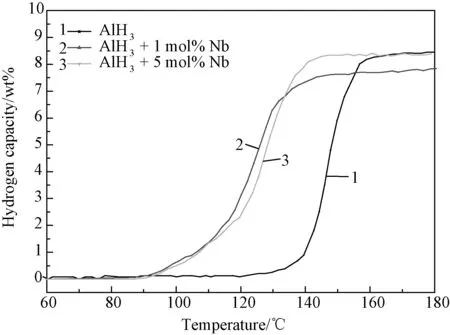
图4 AlH3添加Nb前后的TPD曲线Fig.4 TPD curves of AlH3 and AlH3 with addition of Nb
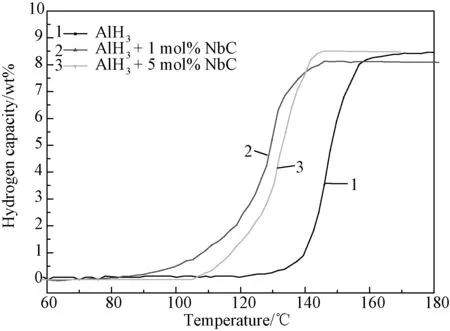
图5 AlH3添加NbC前后的程序控温放氢曲线Fig.5 TPD curves of AlH3 and AlH3 with addition of NbC
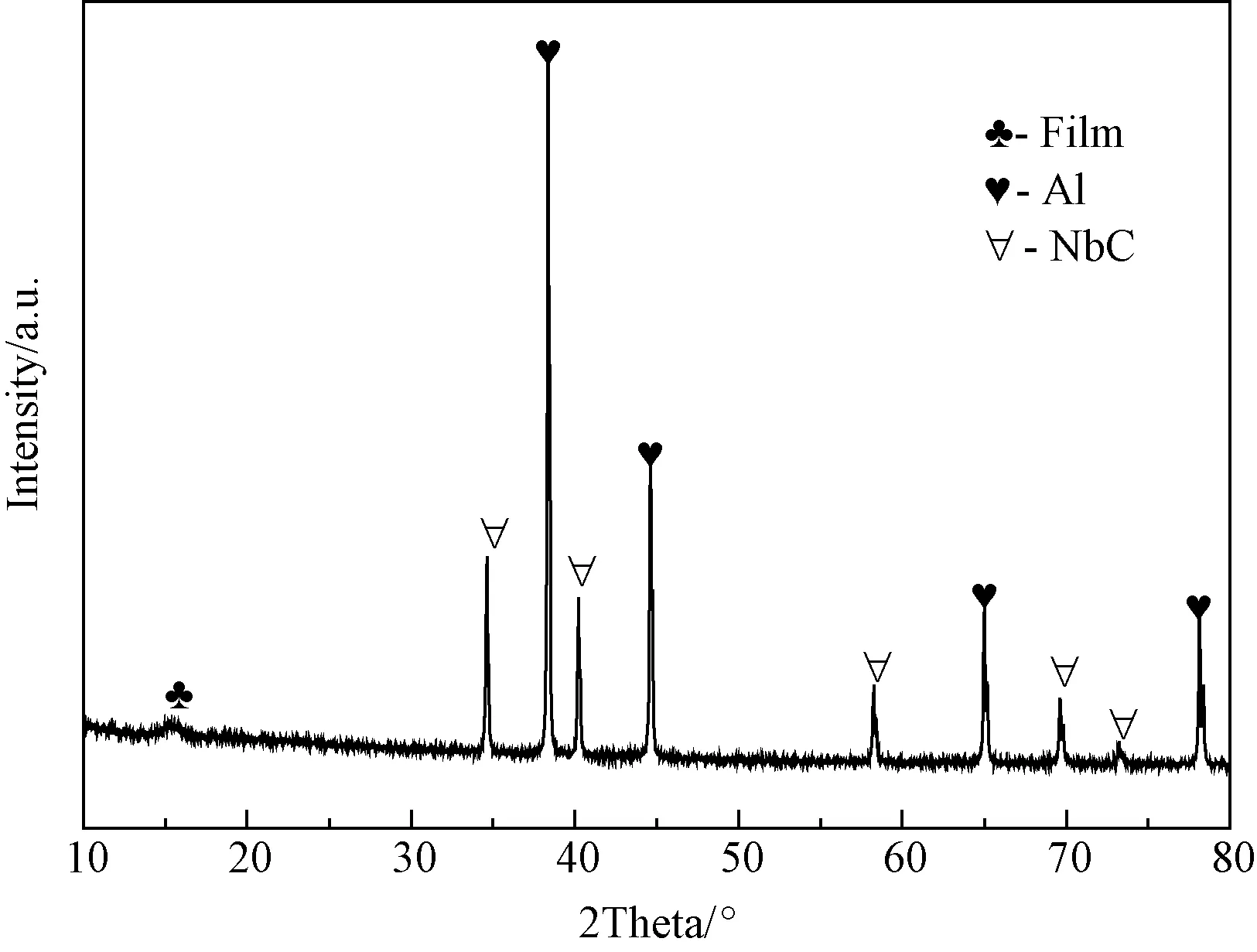
图6 AlH3 + 5 mol% NbC放氢产物的XRD图谱(图中的film是试验方法中提到的专用样品保护罩)Fig.6 XRD patterns of the AlH3+5mol% NbC composite after hydrogen desorption
图5为对添加NbC前后的AlH3样品进行程序控温放氢曲线的测试。在AlH3中添加NbC的效果跟添加Nb单质的效果是类似的,放氢温度下降,并且起始放氢温度降低得更加明显,起始放氢温度降低到了90℃左右,终止放氢温度降低到了140℃以下,并且样品整体的脱氢量并无明显变化。为了进一步研究NbC添加剂对AlH3样品性能改善的具体原因,对样品放氢后的产物进行了XRD分析,分析结果如图6所示。由图可见,AlH3添加NbC加热到300℃后的放氢产物为Al和NbC,说明NbC没有参与放氢反应。其作用主要是以下几方面:一方面是起催化作用;另一方面可在球磨过程中起分散作用,减小AlH3的颗粒尺寸,从而起到提高比表面积的作用;第三方面是NbC添加剂可以使样品中产生大量的缺陷和应力,从而有利于氢的扩散,降低了AlH3的放氢势垒,这些因素都可以在一定程度上促进AlH3样品的放氢。
图7为添加Nb2O5的AlH3样品的放氢曲线。实验结果发生了其他的变化。实验发现添加Nb2O5后,AlH3的起始放氢温度大幅降低,从未添加任何添加剂时的130℃左右下降到了70℃左右。不同Nb2O5添加量的AlH3样品的起始放氢温度大致相同,而终止放氢温度随添加量的增加而降低,这是因为添加量多的时候,大部分AlH3能够得到充分接触活化而在较低温度下放氢。虽然添加5mol% Nb2O5后样品的放氢温度大幅降低,但是由于5mol% Nb2O5的重量占到样品总质量的1/3,且球磨过程也导致部分AlH3的分解,这两个因素导致样品的放氢容量从8.5wt%降低到了3.5wt%。而添加1mol% Nb2O5时,AlH3的放氢温度虽不及添加5mol%的样品,但相比未添加的样品,其放氢温度也有一定程度的下降,且放氢容量并没有严重下降。因此,添加Nb2O5可以显著降低AlH3的放氢温度,如果综合考虑催化效果和放氢容量,最佳的添加量应为1mol%左右。
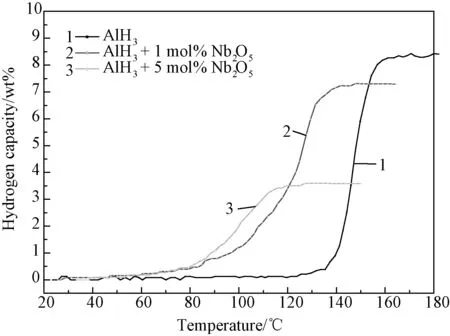
图7 AlH3添加Nb2O5前后的程序控温放氢曲线Fig.7 TPD curves of AlH3 and AlH3 with addition of Nb2O5
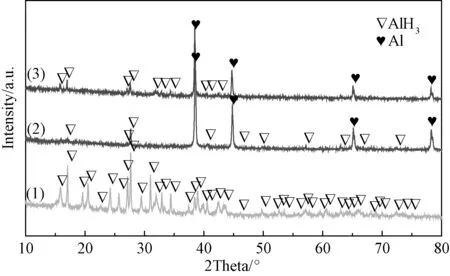
图8 AlH3+x mol% NbF5(x=0,1, 5)的XRD图谱(1)AlH3,(2)AlH3+1 mol% NbF5,(3)AlH3+5 mol% NbF5Fig.8 XRD patterns of AlH3+x mol% NbF5(x=0, 1, 5) composites:(1)AlH3,(2)AlH3+1mol% NbF5, (3)AlH3+5mol% NbF5
在AlH3中添加NbF5样品与添加Nb和NbC的样品完全不同,实验发现将AlH3与1mol% NbF5的混合物进行手工研磨时,混合物颜色由原来的白色渐渐变为褐色然后变为黑色。对纯的AlH3以及手工研磨后的AlH3+xmol% NbF5(x=1,5)样品进行X射线衍射分析,结果如图8所示。从图中可以看出,纯的AlH3中主要含有AlH3,不含其他杂质相,而手工研磨后的AlH3+xmol% NbF5(x=1, 5)样品主要含有Al和少量AlH3,说明AlH3没有与NbF5发生反应,NbF5对AlH3起到很好的放氢催化作用,使AlH3在手工研磨过程中已发生放氢分解生成Al。对于AlH3+1mol% NbF5体系手工研磨时间较长的样品进行程序控温放氢测试发现其放氢量极少,说明在研磨过程中AlH3已经基本分解完全。为了研究NbF5对AlH3程序控温放氢性能的影响,将AlH3与1mol% NbF5样品进行短时间手工研磨至样品颜色呈褐色后,立即对研磨后的样品进行程序控温放氢测试,结果如图9所示,可以看到手工研磨的AlH3+1mol% NbF5样品的初始放氢温度大幅降低,从120℃下降到60℃,当温度升到140℃时,放氢过程结束。单独的AlH3样品的整体的放氢量为8.5wt%左右,而手工研磨的AlH3+1mol% NbF5样品整体的放氢量只有5wt%,这一结果表明NbF5使AlH3在手工研磨过程中已发生放氢分解,对AlH3起到了很好的放氢催化作用。上述结果说明NbF5对AlH3的放氢行为具有显著作用。造成这些结果的具体原因是因为AlH3在常温下是亚稳的,这种亚稳性来源于其颗粒表面的氧化膜阻挡了氢气的逸出。AlH3只有在表面氧化膜破裂、新鲜表面与气相接触时才会开始分解放氢。因此,在本文中,NbF5之所以对AlH3样品的性能有改善作用,是因为NbF5可以很容易地破坏AlH3颗粒表面的氧化膜,从而促进AlH3的失稳放氢。
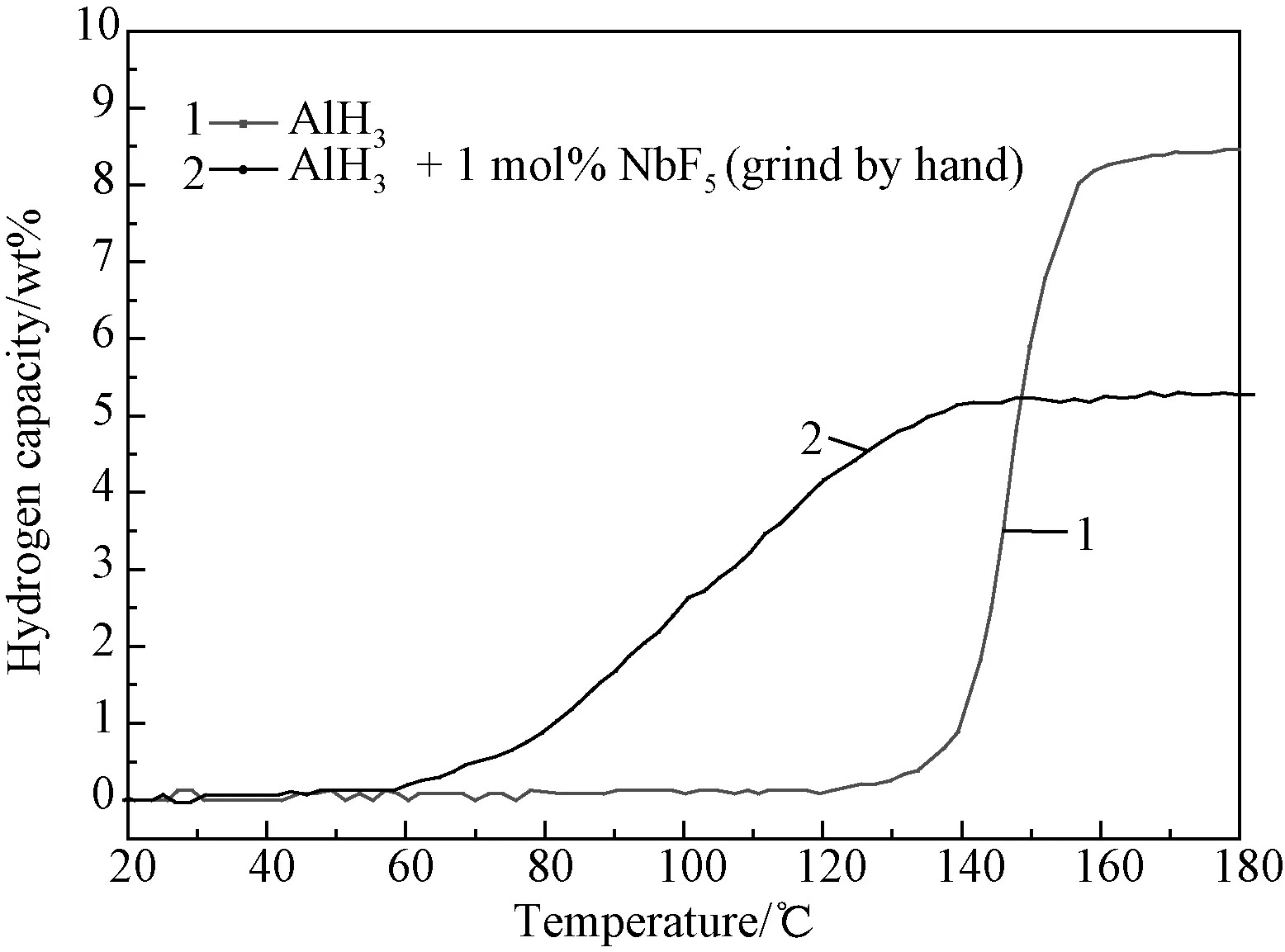
图9 AlH3以及AlH3+1mol% NbF5混合物手工研磨后的样品的程序控温放氢曲线Fig.9 TPD curves of AlH3 and AlH3+1mol% NbF5
4 总 结
本文采用有机溶液合成法制备了纯度较高的AlH3,其起始放氢温度约为130℃,终止放氢温度约为170℃,总放氢量可达8.5wt%左右。添加Nb、NbC后AlH3的起始放氢温度可降低到90~95℃左右,终止放氢温度降到了150℃。添加NbF5和Nb2O5对AlH3的放氢行为有显著的影响,将AlH3与1mol% NbF5进行简单手工研磨即可导致AlH3的部分分解,手工研磨的AlH3+1mol% NbF5样品的起始放氢温度可降低到60℃,在140℃可完全放氢。总之,Nb基添加剂对AlH3的放氢行为有显著影响。
[1] 周素芹,程晓春,居学海,朱小红.储氢材料研究进展[J].材料科学与工程学报, 2010,(05): 783~790.
[2] L. Schlapbach, A. Züttel. Hydrogen-storage materials for mobile applications[J].. Nature, 2001, 414(15):353~358.
[3] P. Chen, M. Zhu. Recent progress in hydrogen storage[J]. Materials Today, 2008, 11(12): 36~43.
[4] A. Züttel. Materials for hydrogen storage[J]. Materials Today, September, 2003.
[5] 顾颖杰,李超,莫方杰,等.MgNH改性Li-Mg-N-H体系的储氢性能及其机理[J].材料科学与工程学报, 2014, (02): 183~188.
[6] 陈君儿,熊智涛,吴国涛,等.配位氢化物储氢材料Mg(BH4)2的研究进展[J].材料科学与工程学报, 2011, (04): 639~646.
[7] 陈先华,耿玉晓,刘娟.镁及镁合金功能材料的研究进展[J]. 材料科学与工程学报, 2013, (1):148~152.
[8] A. E. Finholt, A. C. Bond, H. I. Schlesinger. lithium gallium hydride, and some of their applications in organic and inorganic chemistry[J]. J. Am. Chem. Soc., 1947, 69(5) ~1199:1203.
[9] F.M. Brower, N.E. Matzek, P.F. Reigler, et al. Preparation and properties of aluminum hydride[J]. J. Am. Chem. Soc., 1976, 98(9):2450~2453.
[10] D.D. Graham, J. Graetz, J.J. Reilly, et al. Location of Ti Catalyst in the ReversibleAlH3Adduct of Triethylenediamine[J]. J. Alloys Compd., 2010, 11:115.
[11] G. Sandrock, J. Reilly, J. Graetz, et al. Accelerated thermal decomposition of AlH3for hydrogen-fueled vehicles[J]. Appl. Phys. A, 2005, 80(4):687~690.
[12] J. Graetz, J. J. Reilly, J. G. Kulleck, R. C. Bowman. Kinetics and thermodynamics of the aluminum hydride polymorphs[J]. J. Alloys Compd., 2007, 446~447(Sp. Iss. SI):271~275.
[13] J. P. Maehlen, V. A. Yartys, R. V. Denys, et al. Thermal decomposition of AlH3studied by in situ synchrotron X-ray diffraction and thermal desorption spectroscopy[J]. J. Alloys Compd., 2007, 446~447(Sp. Iss. SI):280~289.
[14] S. Sartori, S.M. Opalka, O.M. Løvvik, et al. Hauback. Experimental studies of α-AlD3and α’-AlD3versus first-principles modeling of the alane isomorphs[J]. J. Mater. Chem., 2008, 18(20):2361~2370.
[15] S. Muto, K. Tatsumi, K. Ikeda, S. Orimo. Dehydriding process of α-AlH3observed by tansimission electron microscopy and electron energy-loss spectroscopy[J]. J. Appl. Phys., 2009, 105(12):123514.
[16] K. Ikeda, S. Muto, K. Tatsumi, M. Menjo, S. Kato, et al. Dehydriding reaction of AlH3: in situ microscopic obserbations combined with thermal and surface analysis[J]. Nanotechnology, 2009, 20(20):204004.
[17] S. Kato, M. Bielmann, K. Ikeda, S. Orimo. Surface changes on AlH3during the hydrogen desorption[J]. Appl. Phys. Lett., 2010, 96(5):051912.
[18] J. Graetz, S. Chaudhuri, J. Wegrzyn, et al. Direct and Reversible Synthesis of AlH3-Triethylenediamine from Al and H2[J]. J. Phys. Chem. C, 2007, 111(51):19148~19152.
[19] D.D. Graham, J. Graetz, J.J. Reilly, et al. Location of Ti catalyst in the reversible AlH3adduct of triethylenediamine[J]. J. Phys. Chem. C., 2009, 114(35):15207~15211.
[20] H. Saitoh, Y. Okajima, Y. Yoneda, et al. Formation and crystal growth process of AlH3in Al-H system[J]. J. Alloys Compd., 2010, 496(1~2):L25~L28.
[21] Fuel cells technologies program: Multi-year research, development and demonstration plan[A]. Planned program activities for 2005-2015. DOE U. S. 2009.
[22] G. Sandrock, J.J. Reilly, J. Graetz, et al. Alkali metal hydride doping of α-AlH3for enhanced H2desorption kinetics[J]. J. Alloys Compd., 2006, 421(1~2):185~189.
[23] J. Graetz, J.J. Reilly. Decomposition kinetics of the AlH3polymorphs[J]. J. Phys. Chem. B, 2005, 109(47):22181~22185.
[24] H.Z. Liu, X.H. Wang, Y.A. Liu, et al. Improved hydrogen storage properties of MgH2by ballmilling with AlH3: preparations, de/rehydridingproperties, and reaction mechanisms[J]. J. Mater. Chem. A, 2013, 1(40):12527~12535.
[25] H.Z. Liu, X.H. Wang, Y.A. Liu, et al. Microstructures and Hydrogen Desorption Properties of the MgH2-AlH3Composite with NbF5Addition[J]. The Journal of Physical Chemistry C, 2014, 118(33): 18908~18916.
Effects of Nb-based Additives on Hydrogen Desorption Properties of AlH3
CHEN Tian1, LIU Haizhen1,2, XU Li2, LI Shouquan1, GE Hongwei1, WANG Xinhua1
(1.School of Materials Science and Engineering, Zhejiang University, Hangzhou 31007, China; 2.Global Energy Interconnection Research Institute, Beijing 102211, China)
Aluminum hydride (AlH3) with the hydrogen storage capacity of 10.1wt% is regarded as one of the most promising materials for hydrogen storage. In this work, AlH3was prepared by organic synthesis method, then the prepared AlH3was milled with Nb-based additives (Nb, NbC, Nb2O5and NbF5) to further improve its hydrogen storage properties. The effects of the Nb-based additives on the hydrogen desorption properties of AlH3were systematically studied. The experimental results showed that organic synthesis method can prepare high-purity AlH3with hydrogen desortion capacity of 8.5wt% and initial hydrogen desorption temperature of around 130℃. Nb and NbC additives effectively improve the hydrogen desorption properties of AlH3, the initial hydrogen desorption temperature decreases from 130℃ to 90-95℃. Nb2O5and NbF5have remarkable effects on the hydrogen desorption properties of AlH3. When AlH3is grinded by hand with 1mol% NbF5, the initial hydrogen desorption temperature decreases to as low as 60℃, and hydrogen desorption end at 140℃. The mechanism of the effects of Nb-based additives was discussed.
hydrogen storage material; hydrogen desorption properties; aluminum hydride; additives
1673-2812(2017)01-0009-06
2015-12-04;
2016-01-18
国家自然科学基金资助项目(51471149)、浙江省公益技术资助项目(2015C31029)及国家电网公司科技资助项目(SGRI-WD-71-15-001)
陈 田(1989-),硕士研究生,主要从事储氢材料方面的研究。E-mail:21326056@zju.edu.cn。
王新华,教授/博导,E-mail:xinhwang@zju.edu.cn。
TG 139.7
A
10.14136/j.cnki.issn 1673-2812.2017.01.003

