半胱氨酸链蛋白β在内耳中的表达及其与听功能的相关性研究
张世丽 祖勉 冀飞 蒋晴晴 邱士伟 李雅兰 郭维维 杨仕明 乔月华,3
1徐州医科大学听力中心(徐州221004)2中国人民解放军总医院耳鼻咽喉头颈外科;聋病教育部重点实验室(北京100853)3徐州医科大学附属医院临床听力中心(徐州221004)
哺乳动物的耳蜗能够编码不同频率、不同强度的声音信号,这一过程是由两种不同类型的机械感觉细胞:内毛细胞(Inner Hair Cell,IHC)和外毛细胞(Outer Hair Cell,OHC)参与实现的[1]。外毛细胞具有电能动性,对声音信号有放大作用,使耳蜗对不同频率的声音具有高度的敏感性和选择性[2]。而内毛细胞是真正的感觉细胞,与I型传入神经的树突形成突触;传入到内耳的声音信号是通过对内毛细胞产生机械刺激,引起其释放神经递质,从而造成传入神经元兴奋而引发动作电位,而将兴奋传入中枢系统[3]。
CSP是DnaJ/Hsp40分子伴侣家族的一员,位于神经元突触囊泡中,对维持神经递质释放和防止神经退行性病变具有非常重要的作用[4,5]。CSP有α,β,γ三个亚型,已有研究报道敲除CSPα亚型对小鼠的听力没有影响,但是小鼠的视力却出现进行性神经性病变,这很可能是因为小鼠的视网膜细胞中只有CSPα这一个亚型的表达,而小鼠耳蜗内同时有CSPα和CSPβ两个亚型的表达,而且这两个亚型发挥的功能在一定程度上存在重合,从而导致CSPα敲除小鼠的听力未受到影响[6]。本实验通过对CSPβ在耳蜗毛细胞中的分布定位,初步分析其在生长发育过程中的表达变化,探讨CSPβ与听力之间的可能关系。
1 材料与方法
1.1 材料
1.1.1 实验动物
1、10、12、14、16、28和60日龄SPF级C57小鼠(军科动物中心提供)各10只;出生1天的巴马小香猪3只(中科院北方大动物研究基地提供),雌雄不限。
1.1.2 实验试剂
4%PFA,10%EDTA,兔源性抗 CSPβ抗体(1:100,proteintech,17364-1-AP);鼠源性抗Ctbp2 抗体(1:100,美 国 BD 公 司,612044);Alexa Flu⁃orence647羊抗兔(1:400,invitrigen,1834794);phal⁃loidin(1:400,sigma,P-1951);免洗 DAPI液(4',6-Di⁃amidino-2-phenylindole,4',6-二脒基-2-苯基吲哚;中杉金桥)
1.2 方法
1.2.1 冰冻切片制备
耳蜗取材C57小鼠引颈脱臼处死,快速断头取出耳蜗,打通圆窗和卵圆窗,用游丝镊在蜗尖打孔,4%PFA灌流,并4℃固定过夜8-12小时,将固定后的耳蜗放入10%EDTA常温脱钙,直至前庭部分的骨质可用细针扎透,将脱钙后的耳蜗依次放入15%和30%蔗糖溶液梯度脱水各3小时,将耳蜗移入装有Tissue-Tek OCT的EP管中,浸胶2小时,然后在立体解剖显微镜下将耳蜗蜗轴与包埋盒底部水平位的平行线平行包埋,-20℃冷冻30分钟后进行切片,切片厚度为10μm。
1.2.2 耳蜗基底膜制备
耳蜗组织取材、灌流固定、脱钙同以上冰冻切片制备方法,7天日龄以前的小鼠耳蜗组织无需脱钙。脱钙后的耳蜗组织置于0.1M的PBS缓冲液中,于立体解剖显微镜下用游丝镊从顶回向底回剥除蜗壳,去除蜗轴,切除螺旋韧带,撕掉前庭膜和盖膜。
1.2.3 免疫荧光染色
将制备好的冰冻切片和基底膜用0.25%的Tri⁃tonX-100室温孵育30min,PBS漂洗3次,每次10min;然后用10%山羊血清室温封闭30min;加一抗 ,兔 源 性 抗 CSPβ抗 体(1:100,proteintech,17364-1-AP),鼠源性抗 Ctbp2抗体(1:100,BD,612044)4℃孵育过夜;PBS漂洗4次,每次15min;加二抗,冰冻切片加Alexa Fluorence647羊抗兔(1:400,invitrigen,1834794)和 phalloidin(1:400,sigma,P-1951);基底膜加Alexa Fluorence647羊抗兔(1:400,invitrigen,1834794);37℃孵育 1h;PBS漂洗 4次,每次15min;DAPI标记,在冰冻切片和铺了基底膜的载玻片上滴加一滴免洗DAPI液,盖玻片封片。
1.2.4 激光共聚焦显微镜成像
应用正置共聚焦显微镜(Zeiss780,德国)对免疫荧光染色标本进行观察,选择647nm、568nm以及358nm波长的激发光,对标本进行从上到下的扫描后进行叠加形成最终的结果图片,并对各标本进行荧光强度(荧光灰度值)的测定。
1.2.5 ABR检测
本实验室采用美国TDT(型号MCO-18A20)测听设备,Biosig32软件系统对小鼠进行ABR阈值检测。测听在隔声屏蔽室内进行,测听前使用1%戊巴比妥钠(0.1ml/10g,腹腔注射)对小鼠进行麻醉,麻醉满意后插入电极,直到检测不出波形,再增加5dB⁃SPL,测出可重复的波形,标记为听阈值(dBSPL)。
1.3 统计学处理
2 结果
2.1 CSPβ在成年C57小鼠内耳中的表达分布
CSPβ在Corti’s器的内毛细胞胞质中表达,围绕细胞核充满整个胞质(图1A和B白色箭头所示),在Corti’s器的基膜以及内毛细胞基底部内侧的内螺旋束神经纤维(图1B实线框内所示)和外毛细胞基底部下方的传入神经纤维中表达。另外,CSPβ在螺旋神经节细胞的胞质中也有表达(如图1C),而外毛细胞、螺旋韧带、血管纹以及其他耳蜗结构上未见有CSPβ的表达。
2.2 CSPβ在不同日龄的C57小鼠毛细胞中的表达
出生后1至10d,内外毛细胞上均未见CSPβ的表达信号(如图2所示)。直到出生后第12d,内毛细胞胞质内才出现较弱的CSPβ表达信号,外毛细胞中未见CSPβ信号出现。出生后14至28d,CSPβ仍旧只在内毛细胞中表达,表达信号随着日龄的增加逐渐增强,外毛细胞上始终未见CSPβ信号表达。本实验测得的内毛细胞中CSPβ的荧光值(Gray)分别是:14d组小鼠为42.76±12.22,16d组小鼠为90.37±8.57,21d组小鼠为126.75±31.6,28d组小鼠为143.31±37.65。组间差异分析显示,各组之间存在显著性差异(P<0.05)。说明在C57小鼠的发育过程中,随着日龄的增加,内毛细胞中CSPβ的表达量增加(如图4所示)。
2.3.1 CSPβ和Ctbp2共定位表达于基底膜内毛细胞胞质中如图3A所示,CSPβ在内毛细胞胞质中表达,内毛细胞中的Ctbp2分布表达于CSPβ的表达区域。
2.3.2 CSPβ在新生巴马小香猪内耳中的表达
与C57小鼠不同,刚出生的小型猪(P1)耳蜗内毛细胞和螺旋神经节中即都有CSPβ的表达(如图中白色箭头所示),同时内毛细胞下方的内螺旋束神经纤维也有CSPβ的表达(如图中黄色箭头所示);外毛细胞及外毛细胞下传入神经纤维中未见CSPβ的表达。
2.4 C57小鼠发育过程中的听力变化
在本研究的Click阈值(dBSPL)检测中,14d组小鼠为73.5±8.84,16d组小鼠为53.50±4.74,21d组小鼠为41.00±9.06,28d组小鼠为32.00±4.83。组间差异分析显示,各组之间存在显著性差异(P<0.05)。说明在C57小鼠的发育过程中,随着日龄的增加,C57小鼠的ABR(Click)阈值不断降低(如图4所示)。
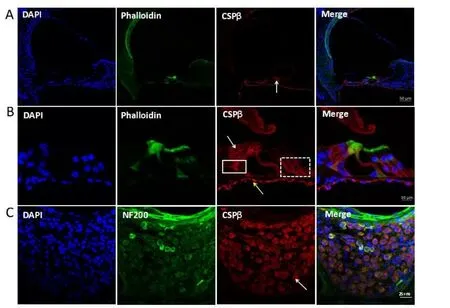
图1 CSPβ在60天C57小鼠内耳中的表达。CSPβ被标记显示为红色荧光信号,用DAPI标记细胞核,染成蓝色(A,B,C),phalloidin标记毛细胞的纤毛,显示为绿色(A,B),NF200标记螺旋神经节细胞,显示为绿色(C).CSPβ主要在C57小鼠的内毛细胞胞质和螺旋神经节细胞胞质中表达(白色箭头所示),另外,在基膜上也可见CSPβ荧光信号(黄色箭头所示);在内毛细胞底部的内螺旋束神经纤维中(实线框内所示)以及外毛细胞下的传入神经纤维中也有CSPβ表达(虚线框内所示)。在外毛细胞、螺旋韧带和血管纹以及前庭膜中未见CSPβ表达。Fig.1 The expression of CSPβin the inner ear of 60-day-old C57 mice.Expression of CSPβchannels(A,B,C)can be seen in red.The nuclei are stained with DAPI in blue(A,B,C).The cilia of hair cells are labeled with phalloidin in green(A,B)and the SGCs are marked with NF200 in green(C).Note CSPβare mainly expressed in cytoplasm of IHCs and SGCs of C57 adult mice(white arrow in A,B),and partly in the basement membrane(yellow arrow in A,B),the inner helix bundle of nerve fibers at the bottom of IHCs(shown within solid line box)and the afferent nerve fibers at the bottom of OHCs(shown within dotted line box).No CSPβ was expressed in the OHCs,spiral ligament and vascular lines and vestibular membrane.
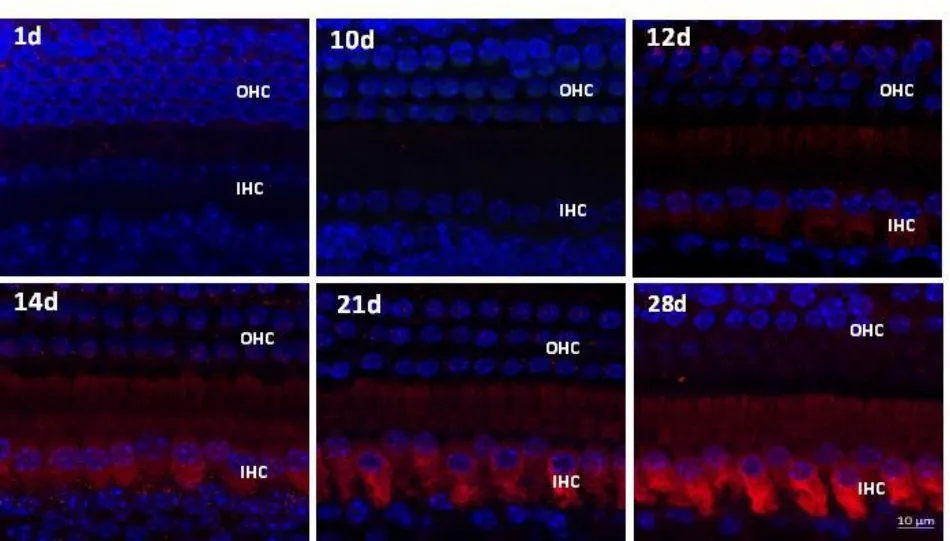
图2 不同时间点CSPβ在内耳毛细胞中的表达出生后1至10d,内外毛细胞上均未见CSPβ表达,直到出生后第12天才在内毛细胞中出现CSPβ表达,但表达信号较弱,外毛细胞中未见CSPβ的表达;出生后14至28d,CSPβ仍旧只在内毛细胞中表达,表达信号随着日龄的增加逐渐增强,外毛细胞上始终未见CSPβ信号表达。Fig.2 The expression of CSPβduring different period in C57mice cochlear hair cells.There was no visible expression of CSPβ in hair cells between postnatal day 1 and 10.The weak expression level of CSPβwas found in the IHCs at the 12th day after birth,with no CSPβ expression in the OHCs.From 14 to 28 day after birth,CSPβ was still expressed only in IHCs,with the gradually increased signal during development.The expression of CSPβwas never seen in the OHCs.
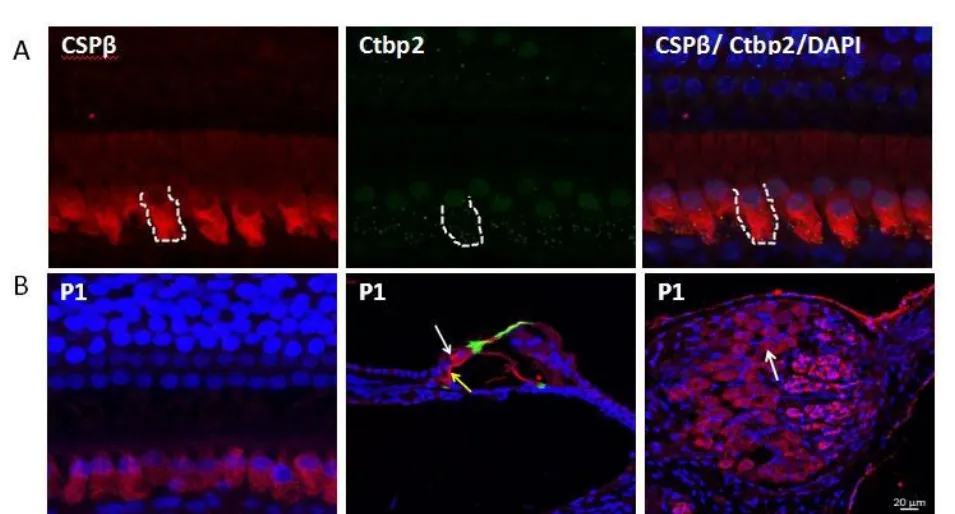
图3 A:CSPβ和Ctbp2共定位表达于基底膜内毛细胞胞质中如图所示,CSPβ在内毛细胞胞质中表达,内毛细胞中的Ct⁃bp2分布表达于CSPβ的表达区域。Fig.3A:CSPβ and Ctbp2 co-localized in cytoplasm of the IHCs.As shown in the figure3A,CSPβwas expressed in the cytoplasm of the IHCs,while the Ctbp2 distributed in the region of CSPβexpressed.图3 B:CSPβ在新生猪耳蜗内的表达新出生的小型猪耳蜗内毛细胞和螺旋神经节中都有CSPβ的表达(如图中白色箭头所示),同时内毛细胞下方的耳蜗神经纤维也有CSPβ的表达(如图中黄色箭头所示);外毛细胞及外毛细胞下传入神经纤维中未见CSPβ的表达。Fig.3B:The expression of CSPβ in the cochlea of new born miniature pigs.Both IHCs and SGCs of the new born miniature pigs expressed CSPβ(as shown in figure in white arrows);meanwhile the cochlear nerve fibers at the bottom of in hair cells also expressed CSPβ(as shown in figure in theyellow arrow);The expression of CSP beta was not seen in the fibers at the bottom of OHCs and the OHCs.
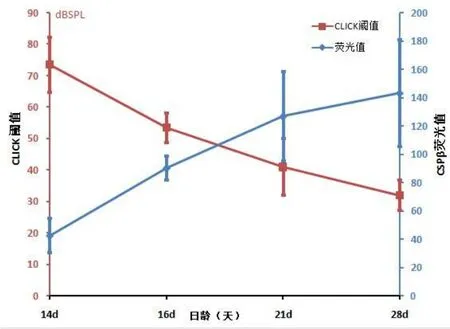
图4 CSPβ在不同发育期小鼠耳蜗内毛细胞中的表达以及相应CLICK诱发ABR阈值测定。随着小鼠日龄的增长,C57小鼠内毛细胞中CSPβ的荧光灰度值逐渐增加,ABR(CLICK)阈值逐渐降低。Fig.4 The fluorescence value of CSPβ and the CLICK threshold of C57 mice by postnatal day 14,16,21 and 28 respectively.As the continuous development of mouse cochlea,the fluorescence intensity of CSPβ in the IHCs gradually increased,corresponding to the gradually reduced threshold of the CLICKABR.
3 讨论
已有研究表明,CSP是重要的突触囊泡蛋白和分泌颗粒蛋白,是器官组织生长发育的必须蛋白质,而且在神经递质释放的过程中发挥至关重要的作用[4,7]。哺乳动物有三个CSP编码基因,分别编码CSPα,β,γ三个亚型,比较CSPα和CSPβ的氨基酸序列,发现两者具有高度的同源性,然而CSPγ与其他两个亚型差异较大[8],虽然CSPβ的生物学功能尚不清楚,但它与CSPα具有高度的相似性(65%相同的氨基酸),因此猜测两者具有相似的生物学功能[9]。之前就有研究者发现,在小鼠耳蜗的内毛细胞中有大量CSPα的表达,但对CSPα敲除小鼠进行听力学的研究,发现这些小鼠没有表现出任何听力和内耳形态学的改变,推测可能是CSPβ弥补了CSPα缺失带来的功能缺陷[6]。然而,该研究的报道者并没有对CSPβ进行更详细的进一步研究,关于CSPβ在内耳的表达情况以及功能也没有提出具体的研究论据。另有更早的研究发现,CSP在出生12天的大鼠耳蜗内毛细胞靠近蜗轴的质膜侧出现,而在出生12天之前的大鼠耳蜗内毛细胞内没有CSP的表达[10]。但此研究的研究者并未具体说明该CSP是哪一个亚型。
本研究使用CSPβ特异性抗体,利用免疫荧光染色定位的方法,揭示了CSPβ在小鼠耳蜗内的表达情况,探索其与听力之间的可能关系。本研究结果显示CSPβ在耳蜗螺旋神经节和基底膜内毛细胞的胞质中大量表达,而在外毛细胞中没有表达(图1、图2所示),这或许能够说明内毛细胞与外毛细胞进行信息传递的机制有所不同。内毛细胞主要受I型螺旋神经节细胞发出的传入神经纤维支配,将声信号转化为神经冲动,最后传递给大脑,外毛细胞主要受II型螺旋神经节细胞发出的传入神经纤维支配,它的主要功能是增加基底膜的振动幅度,增大内毛细胞的兴奋性,达到增加听神经兴奋性的作用[11]。内毛细胞的基底端与传入神经元的树突形成独特的带状突触(Ribbon Synapse,RS),该结构围绕以致密神经递质囊泡,是内毛细胞特有的与神经递质紧张性释放有关的结构[12,13]。本研究中,我们通过免疫荧光双标染色的方法,将突触带的特异结构蛋白(C-terminal bind protein,Ctbp2)和CSPβ在基底膜上进行共染色定位。结果显示Ct⁃bp2与CSPβ共定位于内毛细胞胞质和基底侧膜。CSPβ作为突触囊泡蛋白CSP的一个亚型[14],在内毛细胞中高表达预示其可能与内毛细胞的神经递质释放和信息传递有关。
本研究结果显示,C57小鼠在出生后12天之前无论是内毛细胞还是外毛细胞均未见CSPβ表达,但有研究报道,C57小鼠在出生时内、外毛细胞上即可观察到标记的带状突触,且刚出生时GluR2/R3 AMPA受体即已存在[15],但此时的小鼠并没有听力,表明出生时突触连接结构即已成功建立,然而该连接在功能上尚不成熟,不具信息传递功能。随着小鼠的生长发育,在出生后12天,小鼠耳蜗内毛细胞中出现CSPβ表达信号,与此同时(出生后第11至12天),可首次记录到耳蜗CAP[16]。有研究报道小鼠在P14耳蜗各回发育成熟,血管纹发育成熟,也有研究报道称C57小鼠听觉发生的平均时间是13.2天[17,18],这些都与CSPβ在内毛细胞中首次出现的时间基本一致。随后对出生后14天,21天,28天的C57小鼠进行基底膜免疫荧光染色发现,内毛细胞中CSPβ表达信号逐渐增强(图2和4所示),同时ABR结果显示小鼠听力也渐趋成熟稳定(图4所示),这表明CSPβ的表达可能与内毛细胞的发育成熟、带状突触的功能成熟以及听力的形成具有一定的关系。为了进一步验证这一假设,本研究还对出生后1天的新生巴马小香猪耳蜗基底膜进行免疫荧光染色,发现与C57BL/6小鼠不同的是,刚出生的小型猪耳蜗内毛细胞就有CSPβ的表达(图3所示),有研究者对小型猪进行内耳形态学发现猪出生时耳蜗就已发育成熟,而啮齿类动物在出生后耳蜗进一步分化成熟[19];而已有听力学研究显示猪出生后即有听力[20],CSPβ在小鼠与猪耳蜗内毛细胞首次出现的时间差异进一步证明了猪与小鼠耳蜗发育的不同,同时CSPβ出现时间与听力形成时间之间的平行关系,进一步表明CSPβ的表达与听力的早期形成具有密切的关系。
研究认为,CSPα与syntaxin-1,VAMP2,,SNAP25以及电压依赖性Ca2+通道之间存在相互作用,CSPα作为分子伴侣协调连接蛋白之间的相互作用,最终达到调节神经递质释放的目的[7,21]。内毛细胞突触结合蛋白复合体中主要包含的蛋白质有syntaxin-1,VAMP1,,SNAP25和 L 型 Ca2+通道[22],CSPα在内毛细胞突触中与这些蛋白之间的相互作用以及对递质释放活动的影响尚待进一步研究,而与CSPα具有高度同源性的CSPβ与这些蛋白之间是否存在相互作用也还需要进行详细研究。综上所述,虽然目前我们的研究尚不能详细阐明CSPβ在内耳中的具体功能和作用机制,但根据前人的研究[6,14]和本研究中发现的CSPβ主要在螺旋神经节细胞和内毛细胞中表达而不在外毛细胞中表达而且CSPβ的表达与听力平行出现的规律,推测该蛋白与内毛细胞释放神经递质和听力的发育成熟之间可能存在密切联系,可能是神经递质释放,信息传递以及听觉发生的前提条件之一。
1 陈丽平,商秀丽,内毛细胞带状突触结构及功能的研究进展[J].医学综述.2011,17(19):2899-2902 Chen LP,Shang XL.Progress of Research on the Structure and Function of Inner Hair Cell Ribbon Synapse[J].Medical Recapitu⁃late,2011,17(19):2899-2902.
2 Dallos P,Corey ME.The role of outer hair cell motility in cochlear tuning[J].CurrOpin Neurobiol,1991,1(2):215-220.
3 Issa NP,Hudspeth AJ.The entry and clearance of Ca2+at individ⁃ual presynaptic active zones of hair cells from the bullfrog's saccu⁃lus[J].Proc Natl Acad Sci USA,1996;93:9527-9532
4 Burgoyne RD,Morgan A.Cysteine string protein(CSP)and its role in preventing neurodegeneration[J].Seminars in Cell&Develop⁃mental Biology,2015,40:153–159.
5 Zinsmaier KE.Cysteine-String Protein’s Neuroprotective Role[J].J Neurogenetics,2010,24:120–132.
6 Schmitz F,Tabares L,Khimich D,et al.CSPalpha-deficiency causes massive and rapid photoreceptor degeneration[J].Proc Natl AcadSci USA,2006,10(3):2926–2931.
7 Chamberlain LH,Burgoyne RD.Cysteine-String Protein:The Chaperone at the Synapse[J].J Neurochem,2000,74:1781–1789.
8 Evans GJ,Morgan A,Burgoyne RD.Tying everything together:the multiple roles of cysteine string protein(CSP)in regulated exo⁃cytosis[J].Traffic,2003,4(10):653-659.
9 Gundersen CB,Kohan SA,Souda P,et al.Cysteine string protein β is prominently associated with nerve terminals and secretory or⁃ganelles in mouse brain[J].Brain Reseacch,2010,1332:1-11.
10 Eybalin M,Renard N,Aure F,et al.Cysteine-string protein in in⁃ner hair cells of the organ of Corti:synaptic expression and upreg⁃ulation at the onset of hearing[J].Eur J Neurosci,2002,15(9):1409-1420.
11 Robertson D.Horseradish peroxidase injection of physiologically characterized afferent and efferent neurones in the guinea pig spi⁃ral ganglion[J].Hear Research,1984,15:113–121.
12 Delacroix L,Malgrange B.Cochlear afferent innervation develop⁃ment[J].Hearing Research,2015,330:157-169.
13 Stamataki S,Francis HW,Lehar M,et al.Synaptic alterations at inner hair cells precede spiral ganglion cell loss in aging C57BL/6J mice[J].Hearing Research,2006,221(1-2):104-118.
14 Fernandez-Chacon R,Wolfel M,Nishimune H,et al.The synap⁃tic vesicle protein CSP alpha prevents presynaptic degeneration[J].Neuron,2004,42(2):237-251.
15 Huang LC,Barclay M,Lee K,et al.Synaptic profiles during neu⁃rite extension,refinement and retraction in the developing cochlea[J].Neural development,2012,7(1):38-55.
16 Puel JL,Uziel A.Correlative development of cochlear actionpoten⁃tial sensitivity,latency,and frequency selectivity[J].Dev Brain Res,1987,37:179–188.
17 赵玉林,董明敏,董民声等.小鼠胚胎及出生后耳蜗发育的组织学研究[J].中华耳鼻咽喉科杂志.1999,34(1):57-58.Zhao YL,Dong MM,Dong MS,et al.Histological study of develop⁃mental changes of cochlear in mice embryo and after birth[J].Chi⁃nese Journal of Otorhinolaryngology,1999,34(1):57-58.
18 杨乐,柳柯,杨仕明等.C57小鼠毛细胞突触带的发育观察[J].中华耳科学杂志.2017,1.15(2):234-239.Yang L,Liu K,Yang SM,et al.Observation of developmental changes of hair cell synaptic ribbons in C57 mice[J].Chinese Jour⁃nal of Otology,2017,1.15(2):234-239.
19 侯赟,郭维维,杨仕明等.小型猪内耳发育形态学观察[J].中华耳科学杂志.2012,10(4):485-488.Hou Y,Guo WW,Yang SM,et al.Developmental of Inner Ear in Miniature pigs[J].Chinese JournalofOtology,2012,10(4):485-488.
20 Guo W,Yi H,Ren LL,Chen L,Zhao L,Sun W,Yang SM.The Morphology and Electrophysiology of the Cochlea of the Miniature Pig.[J].The Anatomicai Record,2015,298:494–500.
21 Gorleku OA,Chamberlain LH.Palmitoylation and testis-enriched expressionof the cysteine-string protein beta isoform.[J].Biochem⁃istry,2010,49(25):5308-5313.
22 Ramakrishnan NA,Drescher MJ,Drescher DG.Direct interaction otoferlin with syntaxin1A,SNAP25,and the L-type voltage-gated calcium channel Cavl1.3[J].JBiol Chem,2009,284(1):1364–1372.

