两种茄科植物基因组提取方法的比较
刘秀丽,吕 红,范小峰
(1.陇东学院生命科学与技术学院,甘肃庆阳745000;2.甘肃省高校陇东生物资源保护与利用省级重点实验室,甘肃庆阳745000;3.庆阳市疾病预防控制中心,甘肃庆阳745000)
两种茄科植物基因组提取方法的比较
刘秀丽1,2,吕 红3,范小峰1,2
(1.陇东学院生命科学与技术学院,甘肃庆阳745000;2.甘肃省高校陇东生物资源保护与利用省级重点实验室,甘肃庆阳745000;3.庆阳市疾病预防控制中心,甘肃庆阳745000)
以番茄和马铃薯的幼叶、嫩茎组织作为实验材料,使用CTAB提取DNA法、SDS法和尿素提取法提取基因组DNA,利用琼脂糖凝胶电泳法检测基因组提取效果,筛选出适合不同组织的最优基因组提取方法。结果表明,采用不同的方法提取植物基因组DNA的质量不同而差异很大,CTAB法提取植物叶片基因组效果较好,SDS法提取植物嫩茎基因组效果较好,而尿素法提取效果均不佳。基因组提取方法的筛选与改良为这两种茄科作物的分子研究奠定了基础。
植物基因组;CTAB法;SDS法;尿素法;琼脂糖凝胶电泳
在茄科作物中,番茄(SolanumlycopersicumL.)和马铃薯(SolanumtuberosumL.)是人们经常食用的蔬菜,也是全球人类主要的粮食作物,无论是其具有的营养价值还是美味的口感都深受人们喜爱。番茄和马铃薯均含有大量的维生素和很多种人体必需的微量元素,番茄有清热消暑、生津止渴、健胃消食等功效[1-2],马铃薯是世界第四大作物,它营养丰富,具有益气调中、健脾和胃、减肥瘦身及消除疲劳等功效[2-3]。目前针对这两种农作物的研究非常多,随着分子生物学的发展,植物的研究也在向微观方向转移,而基因组DNA的提取就成为了对作物进行分子研究的基础问题及必经环节。因此,针对这两种茄科作物,寻找一种有效的、快速的DNA提取方法非常必要。
目前,对植物基因组总DNA的提取方法有很多种,如碱裂解法、CTAB法、SDS法、低pH值法、试剂盒法、尿素法等,SDS法和CTAB法是这些方法中最为常用、相比较也最为经济的方法[4]。其中SDS法根据的是SDS与蛋白质结合成为R-O-SO3-…R-复合物,从而使蛋白质变性而沉淀的原理,因此可通过SDS的作用,使膜蛋白溶解而破坏细胞膜。CTAB法是利用阳离子表面活性剂CTAB,在低离子强度溶液中可沉淀核酸和酸性多聚物,高离子强度溶液中又可与蛋白质等多聚物形成复合物。三种DNA提取方法在技术手段上类似,其中SDS法和CTAB法是通过表面活性剂的作用裂解细胞,尿素提取法是利用尿素(carbamide)的水解作用裂解细胞,待细胞裂解后,释放内容物,均用苯酚、氯仿—异戊醇等有机溶剂多次反复抽提,使蛋白质多糖等变性后沉淀于有机相中[5]68,把亲水性强的核酸分子留在水相,从而达到分离核酸的目的。其中尿素法作用比较温和,不需要剧烈震荡和高温处理且简单易行,在细菌、真菌的基因组提取中均有相关报道。另外,对于含有次生代谢产物如多酚、多糖、脂质、单宁等较高的植物,在DNA提取过程中通常需要添加一些能保护DNA免受多酚氧化酶、醌类等物质损害的还原性较强的抗氧化剂,相对而言,能在一定程度下使DNA的质量得以提高;如果所选的材料中含有蛋白质较高,为了降低蛋白质的污染,通常多次使用氯仿—异戊醇进行抽提[5]68。
本研究以番茄和马铃薯的不同组织作为材料,用CTAB法、SDS法、尿素提取法分别提取基因组DNA,比较并筛选针对某一组织的最优方法,从而为以后能更高效地提取植物基因组DNA提供理论实践依据。
1 材料和方法
1.1 材料
本研究使用番茄和马铃薯的嫩茎和嫩叶作为材料,均取自陇东学院生农科技园。
SDS、CTAB、尿素、氯仿、异戊醇、苯酚、异丙醇、乙醇、琼脂糖、EDTA、Tris均为分析纯。
1.2 方法
1.2.1 CTAB法[6]
①称取预处理的新鲜植物叶片或嫩茎约0.2g于研钵中低温研磨至粉末状后,快速转入2ml离心管中,立刻加入0.7ml65℃预热的含2%CTAB的提取缓冲液(2%CTAB,100mmol/lTris-HCl,20mmol/l EDTA,1.4mol/l NaCl,2%β-巯基乙醇,pH值8.0),反复颠倒摇匀,于65℃水浴加热40min,期间每隔10min左右摇动1次,充分混合样品与提取液。
②等待样品冷却至室温后在通风厨中加入0.9ml的酚/氯仿/异戊醇(V/V/V=25/24/1),反复颠倒呈乳状液为止,室温下12000rpm,离心10min。
③吸上清液于新的离心管中,加入0.7ml氯仿/异戊醇(V/V=24/1)轻摇混匀,室温下12000rpm,离心10min。此步骤根据情况可重复1~2次。
④加入50μl 3M NaAc(pH值5.2)溶液,轻摇混匀后,加入1ml预冷(-20℃)的异丙醇混匀,置-20℃冰箱1h。4℃下12000rpm,离心15min,弃上清液。
⑤用75%乙醇洗沉淀2次,自然风干DNA。
⑥DNA干燥后,加入50μl TE缓冲液(10mmol/l Tris-HCl,1mmol/l EDTA,pH8.0)和0.5μl RNase A(10mg/ml)并于37℃恒温消化RNA 2h,置4℃冰箱1d,然后保存于-20℃冰箱备用。
1.2.2 SDS法[7]
①称取预处理的新鲜植物叶片或嫩茎约0.2g于研钵中低温研磨至粉末状后,快速转入2ml离心管中,加入0.8ml 65℃预热的含1.5% SDS的提取缓冲液(500mmol/l NaCl,100mmol/l Tris-HCl,50mmol/l EDTA,1.5%SDS,2%β-巯基乙醇,pH8.0),于65℃水浴中加热40min,中间每隔约10min摇动一次,使提取液与样品充分混合。
②加入200μl 5M KAc溶液后,剧烈震荡,冰浴20min。
③4℃下12000rpm离心10min,吸取上清液并加入0.8ml酚/氯仿/异戊醇(V/V/V=25/24/1),反复颠倒呈乳状液为止,4℃下12000rpm,离心10min,根据情况重复此步骤1~2次。
④移取上清液,加入1ml预冷(-20℃)无水乙醇,沉淀1h。12000rpm,离心10min,丢弃上清液。
⑤用75%乙醇洗DNA沉淀2次,自然风干。
⑥待DNA干燥后,加入50μl TE缓冲液和0.5μl RNase A于37℃恒温放置2h后,然后保存于冰箱-20℃备用。
1.2.3 尿素法[8]
①称取预处理的新鲜植物叶片或嫩茎约0.2g于研钵中低温研磨至粉末状后,快速转入2ml离心管中,加入约20μl β-巯基乙醇和0.8ml含7mol/l尿素的裂解缓冲液(7mol/l尿素、500mmol/l NaCl、50mmol/l Tris-HCl,pH值8.0),并混合均匀。
②于通风橱中加入0.9ml的酚/氯仿/异戊醇(V/V/V=25/24/1,反复颠倒至乳状液为止,室温下12000rpm,离心10min。
③吸取上清,加入0.3ml 10mol/l NH4AC混合均匀。
④加入1ml预冷的无水乙醇,轻柔转动离心管,直到形成絮状核酸沉淀,室温下12000rpm,离心10min。
⑤用75%乙醇洗DNA沉淀2次,自然风干,加入0.5mlTE缓冲液(pH值8.0)溶解。
⑥待核酸完全溶解后,加入约0.5μl RNA酶(10mg/ml),于37℃恒温保持约1h,最后于-20℃贮存备用。
1.2.4 琼脂糖凝胶电泳检测法[9]
①制胶(1%琼脂糖凝胶):清洗好胶模并架好梳子,称取0.2g琼脂糖,加入20ml1倍的TAE缓冲液,在微波炉上加热熔化至无颗粒澄清透明状,取出待其冷却至50~60℃后,加入1μl核酸染料,摇匀后立即倒入准备好的胶模中,待20分钟左右胶完全凝固后放入已倒入适量1×TAE缓冲液的电泳槽,拔去梳子备用。
②加样:取5μl提取的DNA样品,与1μl 6×电泳加样缓冲液混匀,用微量移液枪小心加入样品槽中。
③电泳:一组样加完后,盖上槽盖,接通电源,使电压调制80V,恒压电泳。当溴酚蓝条带移动到距加样孔到整块凝胶的三分之二处时,停止电泳。
④观察和拍照:取出胶块放置于紫外灯下观察,DNA可显示出肉眼可辨的橘黄色荧光带,再用凝胶成像仪拍照,以便分析保存。
2 结果与分析
2.1 植物叶片基因组的提取结果
采用CTAB法、SDS法、尿素法分别对番茄和马铃薯幼嫩叶片的基因组进行提取,最后通过琼脂糖凝胶电泳检测(图1~图4),并用紫外分光光度计检测DNA浓度。结果表明,CTAB法提取的两种植物叶片的基因组,平均浓度达1.9mg/ml,SDS法提取的叶片基因组,平均浓度约0.8mg/ml,尿素法对个别样品没有明显条带,DNA浓度均在0.2mg/ml以下。因此,针对马铃薯、番茄叶片组织,CTAB法效果最佳,尿素法提取效果最差。
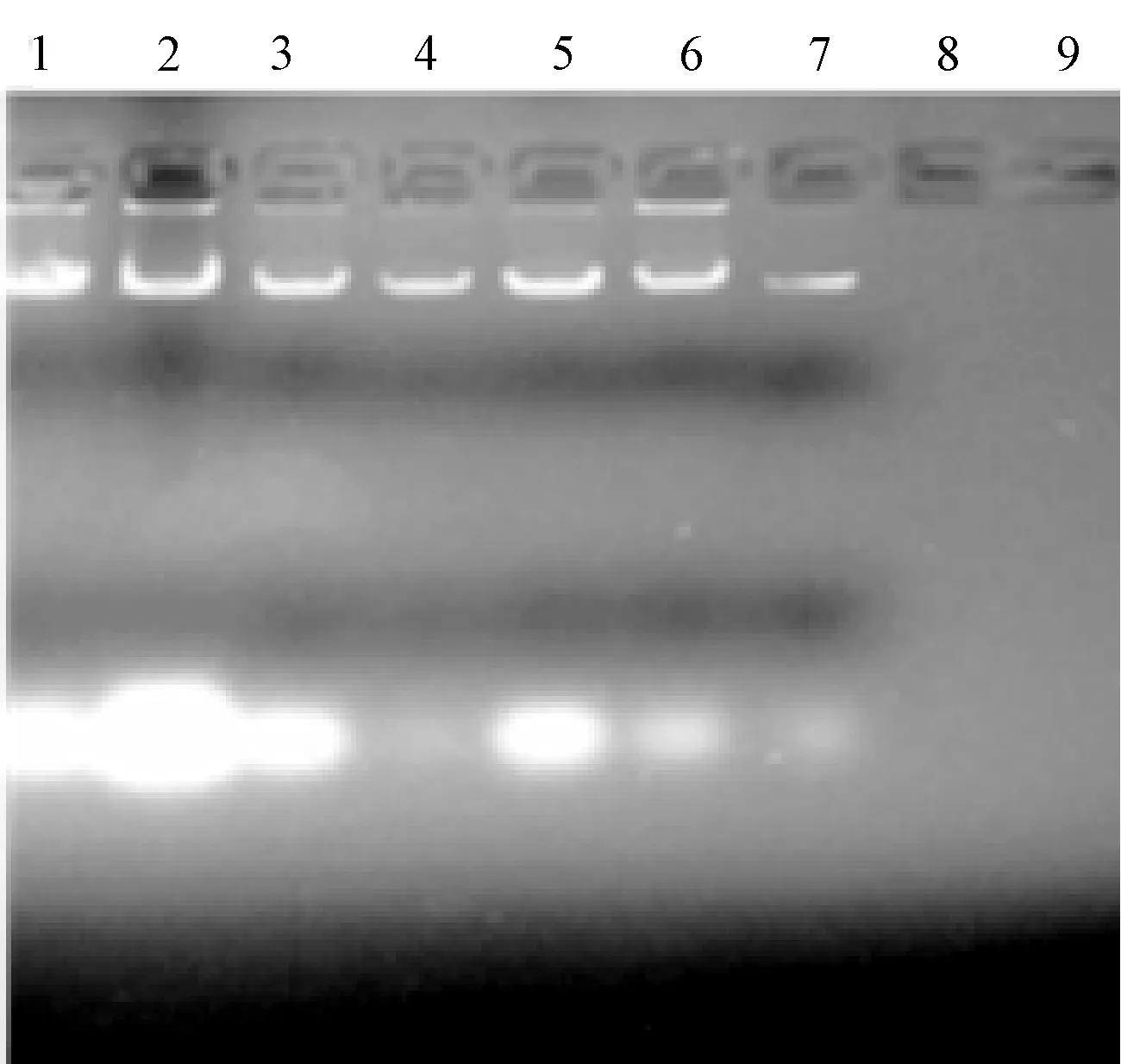
图1 番茄叶片基因组提取的结果注:1~3:CTAB法;4~6:SDS法;7~9:尿素法
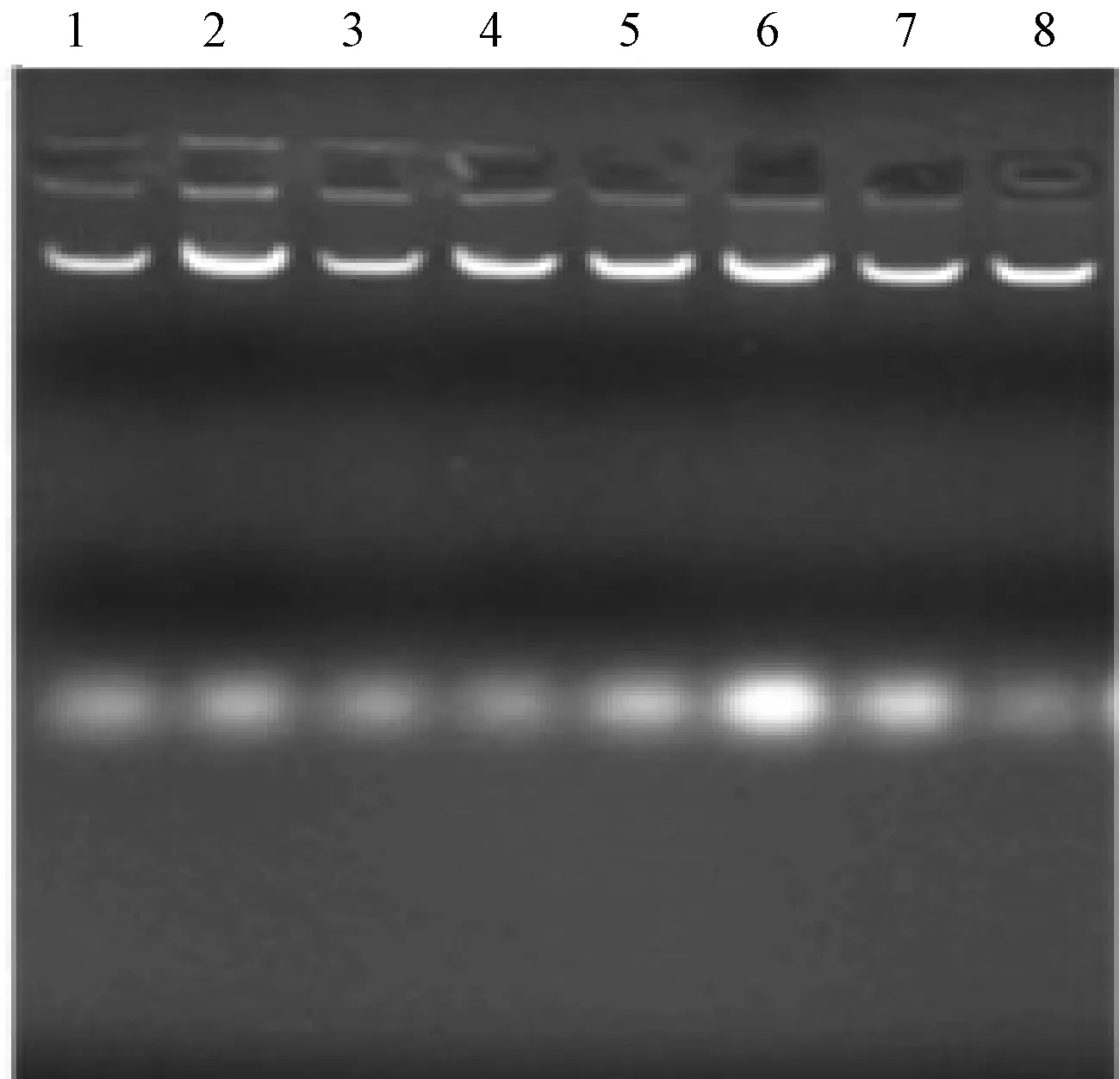
图2 CTAB法提取番茄叶片基因组的结果注:1~8:CTAB法提取番茄叶片DNA
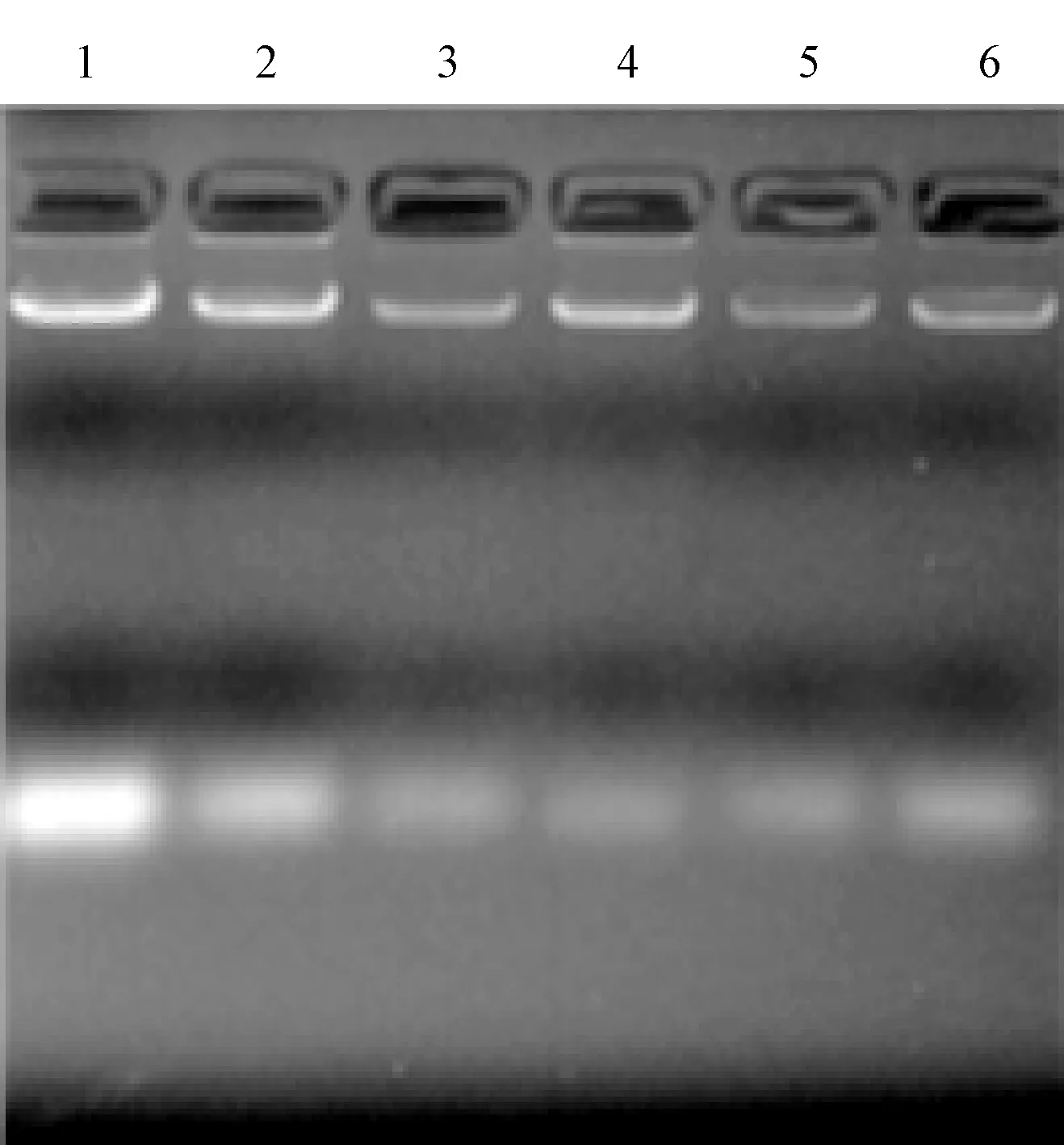
图3 马铃薯叶片基因组的提取结果注:1~2:CTAB法;3~4:SDS法;5~6:尿素法
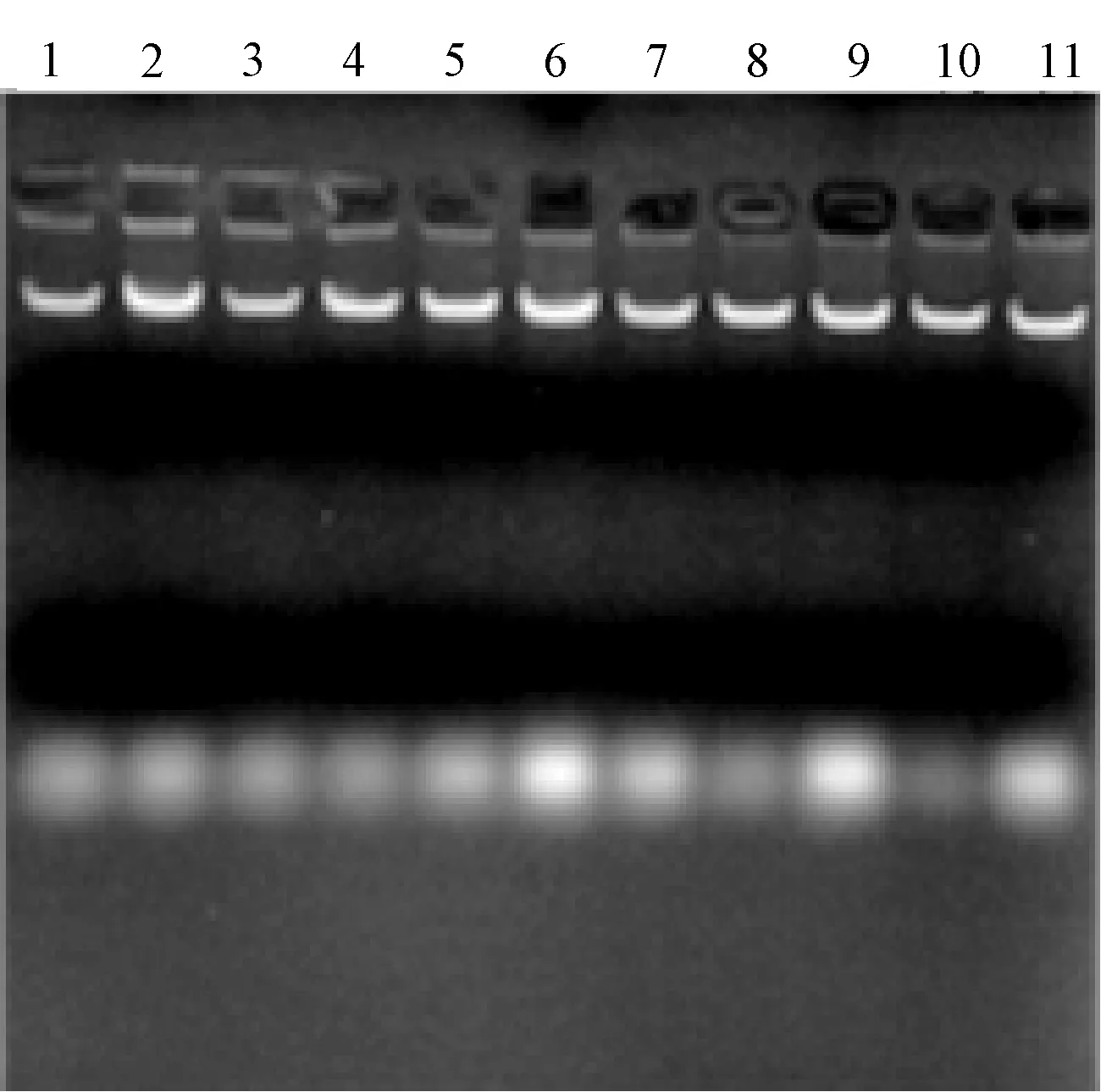
图4 CTAB法提取马铃薯叶片基因组的结果注:1~11:CTAB法提取马铃薯叶片DNA
2.2 植物嫩茎基因组的提取结果
采用CTAB法、SDS法、尿素法分别对番茄和马铃薯嫩茎进行基因组提取,最后通过琼脂糖凝胶电泳检测(图5~图8),并用紫外分光光度计检测DNA浓度。结果表明,CTAB法提取的两种植物嫩茎的基因组,平均浓度达0.4mg/ml最后通过琼脂糖凝胶电泳检测,SDS法提取的嫩茎基因组,平均浓度约0.8mg/ml,尿素法对嫩茎提取的基因组,DNA浓度均在0.3mg/ml左右,但电泳条带弥散,有杂带,并且测得OD260/OD280比值均小于1.023,说明有较多的蛋白质污染。因此,在植物嫩茎基因组的提取中SDS法效果最佳,而尿素法效果最差。
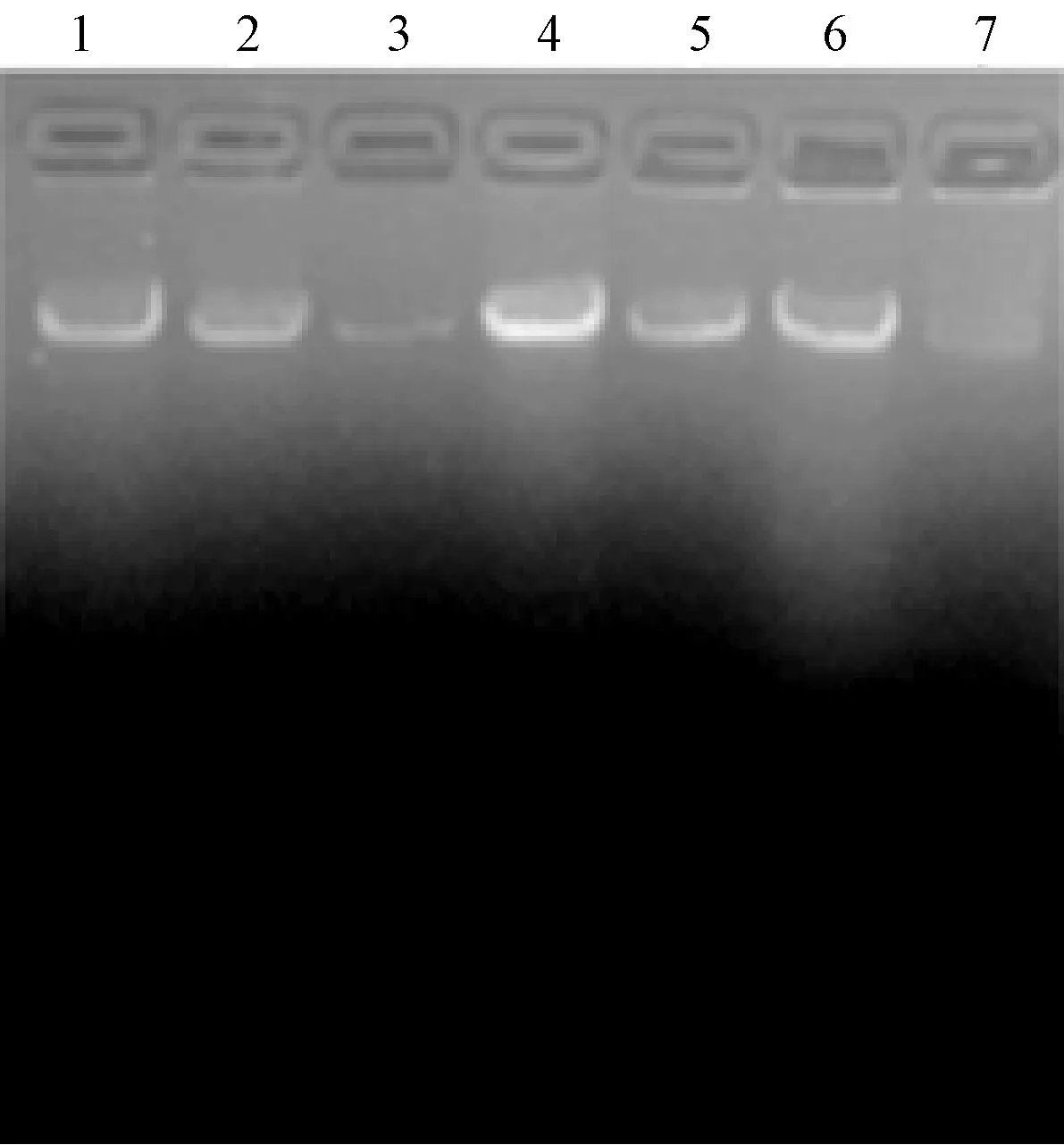
图5 番茄嫩茎基因组的提取结果注:1~2:CTAB法;3~5:SDS法;6~7:尿素法
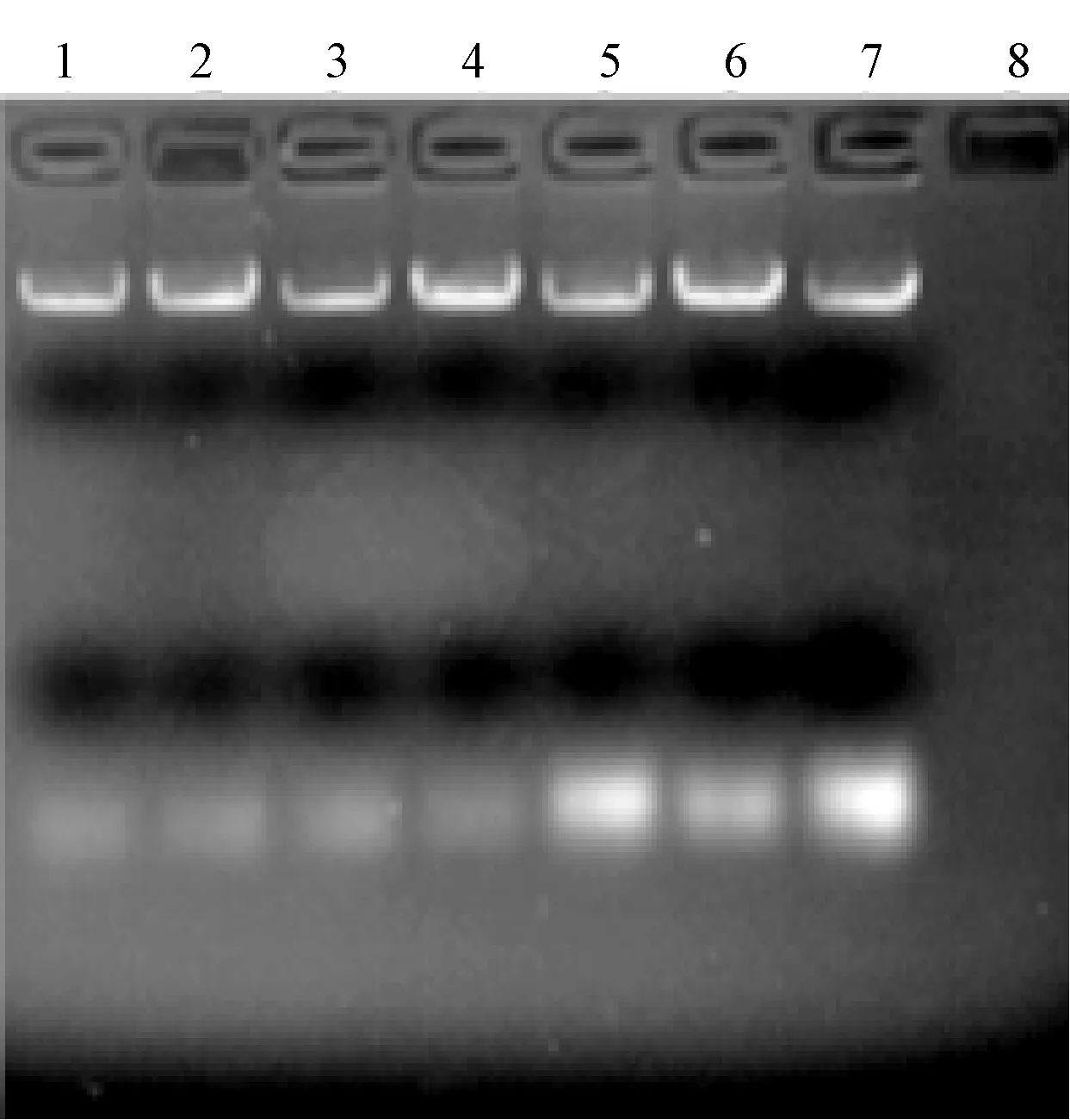
图6 SDS法对番茄嫩茎基因组的提取结果注:1~7:SDS法提取番茄嫩茎基因组DNA

图7 马铃薯嫩茎基因组的提取结果注:1~2:CTAB法;3~5:SDS法;6~8:尿素法
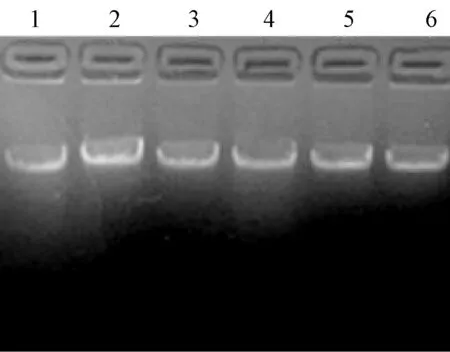
图8 SDS法对马铃薯嫩茎基因组的提取结果注:1~6:SDS法提取马铃薯嫩茎基因组DNA
3 讨论
对于在植物分子生物学领域的研究来说,基因组总DNA的提取是分子生物学研究开展的基础。只有获得高质量的基因组DNA,才能更好地进行后续的分子操作,包括分子杂交、基因克隆、酶切、PCR扩增以及遗传多态性分析等很多相关实验[10-11]。随着在农作物中对番茄和马铃薯的研究越来越多,并且逐渐向微观发展,对这两种植物组织的基因组DNA提取方法的改良也尤为重要。本研究采用CTAB法、SDS法、尿素法对两种茄科植物不同组织进行基因组DNA提取,三种方法的区别在于裂解液不同,即分别在裂解液中加入CTAB、SDS和尿素,但其它后续试剂差别不大,都是利用EDTA鳌和金属离子镁离子防止脱氧核糖核酸酶降解DNA、Tris-HCl作为缓冲剂为DNA提供稳定的pH值体系,NaCl增加体系中的盐强度,破坏细胞以后在苯酚、氯仿、异戊醇的作用下抽提DNA,沉淀细胞碎片、蛋白质及多糖,再于预冷乙醇中使核酸沉淀。研究过程中为了获得更好的提取方法,反复试验试剂的添加量、有机溶剂的萃取次数以及萃取时间,从而使提取的DNA的杂质更少。最后通过琼脂糖凝胶电泳检测技术获得针对特定组织的最优方法;针对茄科植物叶片的基因组提取,CTAB法更优;针对茄科植物嫩茎基因组的提取,SDS法更优。
[1]文升.西红柿的营养和药用[J].现代农业,1985(9):38.
[2]张继红,陶能国,张小云,等.三种豆科植物总DNA提取方法的比较[J].湖南农业学,2007(2):31-33.
[3]文菊华,颜亨梅.一种蜘蛛基因组DNA的简易提取方法[J].蛛形学报,2005,14(2):126-128.
[4]李妮亚,王芳,沈文涛,等.椰子植物叶基因组DNA提取[J].海南师范大学学报(自然科学版),2008,21(1):71-74.
[5]刘哲,刘庆平,孙霞,等.几种基因组DNA提取方法的比较研究[J].中国高新技术企业,2008(10).
[6]徐伟丽,杜明,马莺,等.生豆浆基因组DNA不同提取方法的比较研究[J].安徽农业科学,2011,39(20):805-808.
[7]陆丹,牛楠,李玥莹.高粱基因组DNA提取方法的比较与优化[J].生物技术,2010,20(3):49-52.
[8]赵成萍,雷万钧,刘亚令,等.两种膜荚黄芪DNA提取方法的优化与比较[J].天津农业科学,2012,18(3):5-8.
[9]刘敏,严萍,詹若挺,等.黄芪干燥根DNA提取方法的研究[J].药物生物技术,2010(5):393-396.
[10]于得水,刘金荣,周玉雷,等.翦股颖属植物基因组DNA提取方法的比较[J].广东农业科学,2009(12):164-167.
[11]张慧,张小平,李晓红,等.青檀基因组DNA提取方法的优化[J].安徽师范大学学报(自然科学版),2011,34(3):256-259.
【责任编辑 赵建萍】
A Comparison on the Methods for Genome Extraction on Two Plant Species of Solanaceae
LIU Xiu-li1, 2, LV Hong3, FAN Xiao-feng1, 2
(1.CollegeofLifeScienceandTechnology,LongdongUniversity,Qingyang745000,Gansu; 2.UniversityProvincialKeyLaboratoryforProtectionandUtilizationofLongdongBio-resourcesinGansuProvince,Qingyang745000,Gansu; 3.QingYangCenterforDiseasesPreventionandControl,GansuProvince,Qingyang745000,Gansu)
Using CTAB method, SDS and urea method ion, plant leaves, roots and other organizations were taken as materials to extract genomic DNA. A method which is the best genome extraction for given organization was picked out by agarose gel electrophoresis. The results show that the quality of extracted genomic DNA by different methods was very different. Compared with the three methods, CTAB method to extract genome is better for plant leaves, SDS method is better for plant spears, and relatively urea method is not good for the plant tissues. It lays foundation for molecular research of two plant species of Solanaceae to improve extraction method of genome.
plant genome; CTAB method; SDS method; Urea method; Agarose gel electrophoresis
1674-1730(2017)01-0053-04
2016-09-26
甘肃省庆阳市科技支撑计划项目《几种球根花卉的引种繁殖及栽培示范》(KZ2015-12);甘肃省庆阳市科技支撑计划项目《石油残留物中重金属对动植物生长发育的影响》(KZ2012-78)
刘秀丽(1979—),女,满族,河北承德人,讲师,硕士,主要从事植物分子及生理研究。
Q781
A

