磁性微球的制备及其在分离纯化生物大分子中的应用
王 妍,王亚涛
(陇东学院化学化工学院,甘肃庆阳745000)
磁性微球的制备及其在分离纯化生物大分子中的应用
王 妍,王亚涛
(陇东学院化学化工学院,甘肃庆阳745000)
磁性微球是一种新型的功能化材料,因其独特的优点被广泛地应用在环境工程、生物医学工程、生化分离和细胞生物学等诸多领域。而磁性微球的研究现状以及未来的发展趋势表明,如何开发出粒度比较均匀、悬浮稳定性好、磁响应性强和表面富含多种活性功能基团的磁性微球将是今后该领域的一个研究重点。
磁性微球;分离;纯化;生物大分子
磁性微球是由磁性纳米粒子与含有各种活性功能基团的高分子材料复合而形成的具有特殊表面结构和功能团的微球。对于磁性微球的研究最早开始于20世纪70年代,而我国对它的研究从20世纪80年代开始才日渐活跃。这种磁性微球本身具有很多优点,其最显著的两个特点是:(1)磁性微球具备良好的顺磁性,在外加磁场下能被其吸引,但在撤消掉外加磁场后又能够很好地分散;(2)磁性微球具有高分子粒子的特性,通过化学聚合和表面改性,可以使其表面含有多种具有生物活性的官能团(如-OH、-NH2、-COO等)和生物活性物质(如:抗体、酶、蛋白质等)。作为新型的功能化材料,磁性微球在生物医学、生物工程和环境工程等领域有着广阔的应用前景和潜力,已引起了各国研究者的高度重视,成为日前生物医学材料领域中研究最热门的课题。本文主要从磁性微球的结构、特点、制备方法以及在生化分离中的应用等几个方面论述了近年来国内外对磁性微球的研究现状。
1 磁性微球的结构及特点
1.1 磁性微球的结构
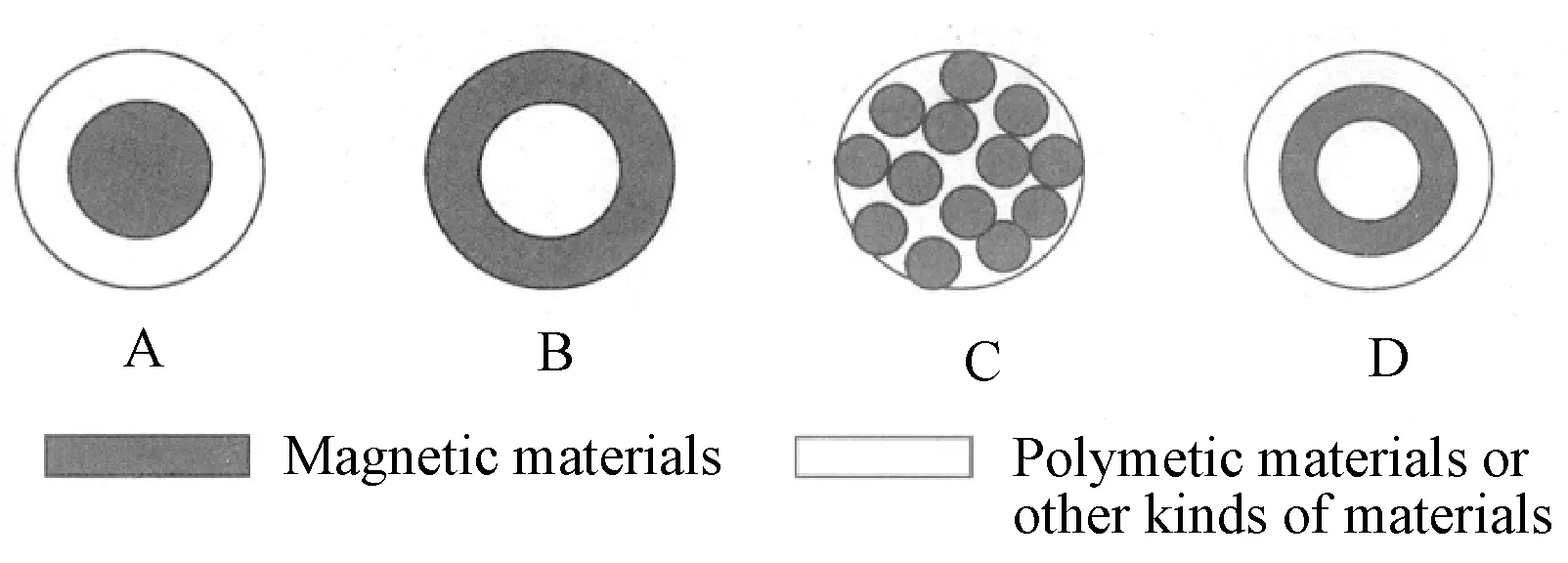
A,B. Core-shell C. mix-up D. multiple laye图1 磁性微球的分类
根据磁性纳米粒子与含有各种活性功能基团的高分子材料形成时的方式不同,磁性微球通常可分为三类:核壳型,包括磁性核型(图1A)、磁性壳型(图1B),混合型(图1C)和多层型(图1D)。
1.2 磁性微球的特点
磁性微球作为一种分离材料载体具有以下特点:(1)粒径小,比表面积大,易在溶液中分散,且对被分离物质的吸附量大;(2)具有良好的顺磁性和磁响应性,在外加磁场的作用下易实现固-液分离;(3)易于进行表面改性,可在其表面键合多种活性基团,如-OH、-COOH、-NH2、-CONH2等,这些基团容易与生物活性物质(酶、抗体、核酸等)连接,具有良好的生物相容性[1]。
1.3 磁性微球的生物相容性
生物相容性是指将一些非活性材料植入生命体组织后,它与生命体的相容程度,也就是说植入的这些非活性材料是否会对生命体组织产生毒害作用。而磁性微球作为输送药物的载体,它在临床研究中其自身的生物相容性和安全性已成为医药领域的研究热点。何秋星[2]等采用乳化交联法制备了5-氟尿嘧啶磁性壳聚糖微球,并通过四噻唑蓝法、溶血实验、血常规实验以及植埋实验评价了该磁性微球的细胞毒性和组织相容性,结果显示该磁性微球具有很好的生物相容性。Shouhu Xuan[3]等制备了具有核壳结构的单分散的磁性微球,实验结果显示该微球既可以用于药物的输送又可作为一种磁共振成像的造影剂。Jing Sun[4]等分别制备了油酸钠包覆的磁性微球和聚乙二醇包覆的磁性微球,并对这两种磁性微球进行了比较,结果显示油酸钠包覆的磁性微球具有较好的磁性和生物相容性。
2 磁性微球的制备
磁性微球是由磁性粒子与含有各种活性功能基团的高分子材料复合而形成的,目前常用的磁性粒子主要有铁的氧化物(Fe3O4、γ-Fe2O3)[5,6]、金属合金(FePt、CoPt3)[7,8]、尖晶石型的磁铁物质(MgFe2O4、MnFe2O4、CoFe2O4)[9]等。其中Fe3O4是应用最广泛的磁性粒子,因为它很容易在水溶液中通过化学共沉淀的方法制备,其粒子形状、粒度大小以及组成也可以通过调节反应条件而得到控制。目前文献报道的磁性微球的制备方法主要有包埋法、聚合法、浸渍法和生物合成法等。
2.1 包埋法
此方法是以Fe3O4纳米粒子为核心,将其分散在高分子溶液中,通过氢键、配位键、共价键、范德华力等作用而形成高分子溶液包被Fe3O4纳米粒子的磁性微球。安小宁等[10]用壳聚糖直接包埋磁粉的方法,制备出了具有高磁性的壳聚糖磁性微球,研究了磁粉与壳聚糖用量的比例对壳聚糖磁性微球的磁性的影响,结果显示壳聚糖磁性微球的磁性与壳聚糖的用量成反比。利用包埋法制备磁性微球的优点在于其操作方法简单,其缺点在于制备出的磁性微球形状不规则、大小难控制且粒径分布范围较宽,因此在实际应用中具有一定的局限性。
2.2 聚合法
此方法应用比较广泛,主要包括悬浮聚合法、乳液聚合法、分散聚合法以及活性/可控自由基聚合法等。它是在乳化剂、引发剂以及稳定剂存在的情况下,单体直接在磁性粒子的表面发生聚合反应而形成磁性微球。
2.2.1 悬浮聚合法
悬浮聚合法是一种比较常用的制备磁性微球的方法。王胜林等[11]将表面经过改性处理后的Fe3O4磁性纳米粒子分散到苯乙烯中,形成苯乙烯磁流体,在苯乙烯磁流体中加入引发剂和交联剂,经乳化后进行微悬浮聚合,成功制备了粒径为0.7~2.0μm的磁性微球。薛屏等[12]以甲酰胺为分散剂,通过反相悬浮聚合的方法,制备出了粒度分布较窄,且表面带环氧基的亲水性磁性复合微球。金凤等[13]也采用悬浮聚合的方法,成功制备了平均孔径为40nm,且表面带环氧功能基团的多孔性磁性复合微球。但是利用悬浮聚合法制备磁性微球时,最主要的缺点就是所制得的微球往往具有较宽的粒径分布。
2.2.2 分散聚合法
使用分散聚合法可制备粒径比较大的磁性微球,此种微球在被用于细胞分离、固定化酶等领域时,具有在外加磁场的作用下快速得到分离的优点。王凯等[14]将聚乙二醇(PEG)和十二烷基磺酸钠(SDS)包裹的Fe3O4磁流体加入到以乙醇/水为分散介质,聚乙二醇为稳定剂,过氧化苯甲酰为引发剂,苯乙烯为单体,二乙烯苯为交联剂的分散聚合体系中,成功制备出了粒径为300~500μm的大粒径磁性复合微球。Ma[15]等采用分散聚合法以油酸改性的Fe3O4磁性纳米粒子为基体,制得了平均粒径约为1μm,具有超顺磁性的无孔磁性复合微球。袁定重等[16]在乙醇/水分散介质中,以聚乙烯吡咯烷酮为稳定剂,偶氮二异丁腈为引发剂,苯乙烯和甲基丙烯酸为共聚单体,将纳米级的Fe3O4粒子制成了单分散性较好、且呈微米级的P(St/MAA)磁性复合微球。
2.2.3 乳液聚合法
乳液聚合法可细分为种子乳液聚合法、无皂乳液聚合法和细乳液聚合法等,是目前研究的最多、应用最广泛的一种方法。龚涛[17]等采用两步乳液聚合的方法成功制备了具有核壳结构的Fe3O4/P(MMA/DVB)(core)-P(St/GMA/DVB)(shell)磁性复合微球。首先他采用细乳液聚合法制备了Fe3O4/P(MMA/DVB)核,然后在通过种子乳液聚合法制备具有核-壳结构的复合微球,即以第一步制备的Fe3O4/P(MMA/DVB)核为种子,以苯乙烯为单体,二乙烯苯(DVB)为交联剂,甲基丙烯酸缩水甘油酯(GMA)为引发剂,使种子再次进行聚合反应而制得。实验结果表明,该核壳结构的磁性复合微球的磁含量可控制在20wt%~76wt%之间。独俊红等[18]采用无皂乳液聚合法在Fe3O4磁流体的存在下,成功制备出了苯乙烯-甲基丙烯酸缩水甘油酯(GMA)-甲基丙烯酸-β羟乙酯/Fe3O4三元共聚物磁性复合微球。该磁性复合微球Fe3O4含量可达19.80%,具有良好的超顺磁性。
2.2.4 活性/可控自由基聚合法
活性/可控自由基聚合法主要包括原子转移自由基聚合法(ATRP)和1,1-二苯基乙烯法(DPE)。与其他聚合方法相比,原子转移自由基聚合法(ATRP)有两个显著特点:(1)在合成过程中可以控制聚合物分子的分子量和分子量分布情况;(2)其合成方式不仅仅局限于本体溶液中,在悬浮液、乳液、超临界流体中均可以进行聚合反应,并能实施端基的功能化。Vestal等[19]利用ATRP技术成功制备出了平均粒径小于15nm、表面洁净并具有超顺磁性的核壳式MnFe2O4/PS复合微球。在2001年BASF公司首次提出了1,1-二苯基乙烯(DPE)。1,1-二苯基乙烯分子中含有两个苯环,能形成共轭体系,这使得所生成的自由基非常稳定。此外,在DPE自由基聚合过程中,1,1-二苯基乙烯还起到了调节分子量的作用。张和鹏等[20]以Fe3O4磁性纳米粒子为基体,成功地利用DPE法制备出了磁含量较高、微球大小均匀,平均粒径为265nm且不含其它杂质的磁性复合微球。
2.3 浸渍法
浸渍法也称原位法。它是将已经合成好的高分子多孔复合微球浸渍在含有Fe2+和Fe3+离子(或其他金属离子)的混合液中,然后加入强碱,使在高分子多孔复合微球中形成磁性金属氧化物纳米粒。早在1988年Ugelstad等[21]就把原位法应用到磁性高分子多孔复合微球的制备中,并相继开发了一系列商品化磁性微球,该微球已广泛地应用到很多领域。利用浸渍法制备的磁性复合微球表面常有一些裸露的金属离子,使得磁性微球在某些特定的应用中受到限制,这是该方法主要的缺点。
2.4 生物合成法
一些生物体如磁性细菌(水生螺菌、嗜胆球菌等),它在沿着地球磁力线迁移时,能够在自身体内合成出生物膜包被的磁性微球[22]。通过对这些磁性细菌进行培养和修饰,就可得到大量的粒径均匀的细菌磁性微球,这是利用生物合成法制备磁性微球的一种方法。另一种方法是利用仿生学的方式,以具有笼状结构的蛋白质为反应介质,加入亚铁盐水溶液进行氧化,就可得到具有磁性的纳米微球。马脾铁蛋白是一种具有笼状结构的蛋白,其内部有一个8nm可容纳铁的空腔,通过在该蛋白溶液中滴加含Fe2+的水溶液,进行部分氧化后就可得到红棕色的磁性纳米微球[23]。利用生物合成法制备的磁性微球粒径分布均匀,微球间不相互聚集且无细胞毒性,在医学界有着很大的应用价值。但磁性细菌的培养条件和生物合成反应所需要的条件均比较高,难以掌控且产量低,这是该方法最大的局限性。
3 磁性微球的应用
磁性微球因其具有良好的超顺磁性,在外加磁场下很容易实现液—固分离,其操作简单,可省去过滤、离心等繁杂的操作,因此在生物大分子的分离纯化中具有广阔的应用前景。
3.1 蛋白质的分离纯化
磁性微球经过表面改性后可键合能被目标蛋白识别且特异性结合的配基,当在分离含有目标蛋白的提取液时,目标蛋白与含该配基的磁性微球紧密结合而从提取液中分离出来,然后在外加磁场的作用下,释放出目标蛋白从而达到分离纯化蛋白的目的。与传统的蛋白分离纯化方法相比,该方法避免了在分离纯化过程中目标蛋白的损失,具有操作简单、便捷快速、回收率高等优点。Zhang等[24]成功制备了具有核壳结构的三(羟甲基)氨基甲烷磁性微球,该磁性微球具有很高的磁响应性,对溶菌酶的吸附可达到108.6mg/g,利用此磁性微球可从鸡蛋清中提取出纯度高、活性达8140U/mg的溶菌酶。Hu等[25]将蛋白质G键合到Fe3O4@SiO2磁性微球表面,然后用此复合微球对免疫球蛋白进行了富集分离,实验结果表明该复合微球对免疫球蛋白的吸附量可达41mg/g。
3.2 固定化酶
酶是一类具有生物催化作用的蛋白质,在生物体内的新陈代谢方面起着至关重要的作用。在常规的提取分离中,酶的活性和稳定性容易遭到破坏,而导致酶失活,使其丧失生物催化作用。因此,为了防止在分离纯化过程中酶的失活,固定化酶技术应运而生。而磁性微球因其具有良好的生物相容性,在被作为酶固定的新型载体。Tiantian Tang[26]等在经氨基化修饰的磁性复合微球上固定了血红蛋白,然后利用该微球成功地从溶液中分离提取出了双酚A。Marsza[27]等将人血清白蛋白(HSA)固定在磁性微球上,成功制备了人血清白蛋白固定化磁性微球,研究小分子药物与人血清白蛋白(HSA)的亲和能力。
3.3 核酸的分离
传统的核酸分离技术要经过沉淀、离心等步骤,其步骤繁杂、耗时长、含有有毒试剂,且收率低。而采用磁分离技术就可以有效地克服这些缺点,其分离原理基于碱基配对原则,通过在磁性微球上键和与目标核酸碱基互补的核酸链而使目标核酸达到分离。Oster[28]等利用聚乙烯醇磁性复合微球从不同血样中成功提取出了基因组DNA,突显出了该方法简单、快速、选择性高等优点。
3.4 细胞分离
磁性微球作为一种不溶性的功能化载体,可在其表面修饰一些具有生物活性功能的吸附剂或其它配基(如抗体,外源凝集素等)。在特定条件下,被修饰的磁性微球能被目标细胞识别并发生特异性结合,而在外加磁场的作用下,又能释放出目标细胞,从而达到分离细胞的目的。Josephson[29]制备出了戊二醛活化硅烷包覆的磁性微球,然后利用此微球成功地从人血清中分离出了淋巴细胞;刘天孚等[30]用羧基修饰的磁性复合微球分离出了细胞纯度高达94%的CD4细胞。

图2 用磁性微球分离细胞
3.5 靶向给药
靶向给药又称定位释放药物,即把药物直接定向释放在靶区,使靶区的药物浓度比正常机体组织的浓度高,从而减少药物的用量,增强药物对靶组织的特异性,提高治疗效果。磁性微球在通过表面改性后可载送药物,在外加磁场作用下将药物载送至靶区,实现靶向给药的功能。李瑞歌[31]等制备了β-环糊精/丁二酸酐共聚磁性复合微球,以水杨酸作为模型药物,对微球载药的体外释药性能进行了研究,结果表明该微球可以用作药物缓控释系统的良好载体。王文[32]等人制备了磁性万古霉素复合微球,当把该复合微球静脉注射在大鼠体内后,在外加磁场的作用下这些微球聚集在病灶区,能有效地抑制大鼠的急性骨感染。
3.6 免疫分析
磁性微球在免疫分析中的应用,就是对磁性微球的表面进行修饰,使其表面偶联上抗体(抗原),然后从生物样品中分离纯化出目标抗原(抗体),该方法简便、快速,适用于大批量物质的分析检测。Yu Cao[33]等在磁性纤维素基质的复合微球表面偶联抗-干扰素α-2b单克隆抗体,用来从粗的细胞裂解液中分离纯化干扰素α-2b,结果表明可分离纯化出纯度为92.9%,活性回收率为88.5%,特定抗病毒活力为2.7×108IU/mg的干扰素α-2b。
4 展望
磁性微球因其独特的优势(磁响应性高、生物相容性好、可循环再利用等),而在生物大分子的分离纯化中有着广阔的应用前景。目前,市场上已经有商品化的磁性微球,但价格昂贵。因此,如何开发出粒度比较均匀、悬浮稳定性好、磁响应性强和表面富含多种活性功能基团的磁性微球是今后该领域的一个研究重点,而如何提高磁性微球对生物大分子的亲和能力和专一性也是致力于生化分离技术研究工作者的努力方向。作为一种新型的功能化材料,相信不久的将来,生物磁性微球分离技术必将得到进一步更深入的发展,从而促进整个生化分离技术得到进步。
[1]Lin-sen Qing, Ying xue, Yi Zheng, Jing Xiong. Ligand fishing from Dioscorea nipponica extract using human serum albumin functionalized magnetic nanoparticles[J].Journal of Chromatography A,2010,1217:4663-4668.
[2]何秋星,王学文.磁性壳聚糖微球制备及生物相容性的研究[J].中国新药杂志,2013(2):221-225.
[3]Shou-hu Xuan, Feng wang, Josie M Y Lai.Synthesis of Biocompatible, Mesoporous Fe3O4Nano/Microspheres with Large Surface Area for Magnetic Resonance Imaging and Therapeutic Applications[J].ACS Applied Materials & Interfaces,2011,3:237-244.
[4]Jing Sun, Shaobing Zhou, Peng Hou. Synthesis and characterization of biocompatible Fe3O4nanoparticles[J].Journal of Biomedical Materials Research Part A,2006,25:333-341.
[5]Neveu S, Bee A, Robineau M. Size-selective chemical synthesis of tartrate stabilized cobalt ferrite ionic magnetic fluid[J].Journal of Colloid and Interface Science,2002,255:293-298.
[6]Mornet S, Grasset F, Duguet E. Magnetic nanoparticle design for medical diagnosis and therapy[J].Journal of Materials Chemistry,2004,14:2161-2175.
[7]Sun S, Murray C B, Weller D. Monodisperse FePt nanoparticles and ferromagnetic FePt nanocrystal superlattices[J].Science,2000,287:1989.
[8]Shevchenko E V, Talapin D V, Rogach A L. Charge Carrier Dynamics in Colloidal Semiconductors[J].Journal of the American Chemical Society,2002,124:11480-11485.
[9]Chen Q, Rondinone A J, Chakoumakos B C. Synthesis of nanoparticles by coprecipitation[J].Journal of Magnetism and Magnetic Materials,1999,194:1-7.
[10]安小宁,苏致兴.高磁性壳聚糖微粒的制备与应用[J].兰州大学学报,2001,37(2):100-103.
[11]王胜林,朱以华,吴秋芳.微悬浮聚合法合成聚苯乙烯磁性微球[J].华东理工大学学报,2001,27(4):364-367.
[12]薛屏,刘海峰.亲水性含环氧基磁性聚合物微球的制备与性能表征[J].高分子学报,2007(1):64-69.
[13]金凤,张秋禹,周桓,等.环氧基多孔磁性复合微球的制备及性质[J].精细化工,2009,26(5):434-437.
[14]王凯,邱广明,邱广亮,等.单分散性大粒径磁性复合微球的制备和表征[J].功能材料,2010,41(S2):218-220.
[15]Ma Z, Guan Y, Liu X. Preparation and Characterization of Non-porous Superparamagnetic Microspheres with Epoxy Groups by Dispersion Polymerization[J].中国化学工程学报,2005,13(2):239-243.
[16]袁定重,张秋禹.分散聚合法制备功能高分子磁性微球P(St/MAA)/Fe3O4[J].材料科学与工程学报,2008,26(3):342-346.
[17]龚涛,汪长春.具有核壳结构磁性复合微球的制备和表征[J].高分子学报,2008,1(11):1037-1041.
[18]独俊红,白耀文,刘莲英,等.含环氧基团的磁性高分子复合微球[J].北京化工大学学报,2008,35(1):45-49.
[19]Vestal C R, Zhang Z J. Atom Transfer Radical Polymerization Synthesis and Magnetic Characterization of MnFe2O4/Polystyrene Core/Shell Nanoparticles[J].Journal of American Chemical Society,2002,124:14312-14313.
[20]张和鹏,张秋禹,张宝亮,等.1,1-二苯基乙烯存在下无皂乳液聚合制备磁性复合微球[J].高分子学报,2010(5):508-514.
[21]Ugelstad J, Ellingsen T, Berge R, et al. Process for preparing magnetic polymer particles[P].US Patent:4774265,1988.
[22]景晓燕,李茹民,王鹏,等.磁微球及其在生化分离分析中的应用[J].分析化学,1999,27(12):1462-1467.
[23]Lang C, Schuler D, Faivre D. Synthesis of magnetite nanoparticles for bio- and nanotechnology:Genetic engineering and biomimetics of bacterial magnetosomes[J].Macromolecular Bioscience,2007,7:144-151.
[24]Guoqing Zhang, Qing Cao, Na Li, Kean Li, Feng Liu. Tris(hydroxymethyl)aminomethane-modified magnetic microspheres for rapidaffinity purification of lysozyme[J].Talanta,2011,83:1515-1520.
[25]Juan Hu, Shao-jie Huang , Xiao Huang , Zhuang Kang, Ning Gan. Superficially mesoporous Fe3O4@SiO2core shell microspheres:Controlled syntheses and attempts in protein separations[J].Microporous and Mesoporous Materials,2014,197:180-184.
[26]Tang T, Fan H, Ai S. Hemoglobin (Hb) immobilized on amino-modied magnetic nanoparticles for the catalytic removal of bisphenol A[J].Chemosphere,2011,83:255-264.
[27]Marszall M P, Bucinski A. A protein-coated magnetic beads as a tool for the rapid drug-protein binding study[J].Journal of Pharmaceutical and Biomedical Analysis,2010,52:420-424.
[28]Oster J, Parker J, Brassard L. Polyvinyl- alcohol- based magnetic beads for rapid and efficient separation of specific or unspecific nucleic acid sequences[J].Journal of magnetism and Magnetic Materials,2001,225:145-150.
[29]Josephson. Magnetic particles for use in separations[P].US Patent:4672040,1987.
[30]刘天孚,刘琦,王君.羧基磁性微球的制备及其用于CD4细胞分离应用[J].化学工程师,2011,195(12):06-07.
[31]李瑞歌,李鼎,朱春山.β-环糊精/丁二酸酐共聚高分子磁性微球的制备及其体外释药性能研究[J].辽宁化工,2011,40(6):543-546.
[32]王文,蔡锦方,曹学成,等.外部磁场介导下万古霉素磁性微球靶向治疗大鼠骨感染[J].中国组织工程研究与临床康复,2010,14(38):7108-7111.
[33]Cao Y, Bai G, Chen J. Preparation and characterization of magnetic microspheres for the purication of interferon α-2b[J].Journal of Chromatography B,2006,833:236-244.
【责任编辑 赵建萍】
Preparation of Magnetic Microspheres and the Review of Their Application in Separation and Purification of Biological Macromolecules
WANG Yan, WANG Ya-tao
(CollegeofChemistryandChemicalEngineering,LongdongUniversity,Qingyang745000,Gansu)
Magnetic microspheres are a new functional material because its unique advantages are widely used in the field of environmental engineering, biomedical engineering, biochemical isolation and cell biology. However, the present research status and the development trend of magnetic microspheres indicate that how to develop magnetic microspheres with uniform particle size, good suspension stability, and strong magnetic response and variety active functional groups is one of the future research focuses.
magnetic microspheres; separation; purification; biomacromolecule
1674-1730(2017)01-0038-05
2016-03-24
王 妍(1988—),女,甘肃正宁人,助教,硕士,主要从事液相色谱填料的合成及其应用研究
TB383
A

