抑制Sema 4D表达介导的成骨前体细胞AKT磷酸化水平上调在乳腺癌骨转移中的作用*
王 振,赵永强,刘继军,金 毅,陈 骁,郑 稼
河南省人民医院骨科,郑州 450003
抑制Sema 4D表达介导的成骨前体细胞AKT磷酸化水平上调在乳腺癌骨转移中的作用*
王 振,赵永强,刘继军,金 毅,陈 骁,郑 稼△
河南省人民医院骨科,郑州 450003
目的 探讨抑制Sema 4D介导的成骨前体细胞AKT磷酸化水平上调在乳腺癌骨转移中的作用。方法 通过siRNA技术构建稳定的Sema 4D低表达人乳腺癌MCF-7细胞株,采用实时荧光定量PCR检测细胞Sema 4D mRNA表达,MTT法检测各组细胞增殖能力,Transwell法检测各组细胞侵袭能力;采用Transwell小室建立成骨细胞和乳腺癌细胞的共培养体系,茜素红染色实验检测骨矿化能力,Western blot检测AKT、p-AKT蛋白表达。结果 MCF-7细胞Sema 4D mRNA相对表达量显著高于Hs578Bst细胞(P<0.05)。Sema 4D siRNA转染后,Sema 4D siRNA组Sema 4D mRNA相对表达量显著低于Control组和NC组(均P<0.05),Control组和NC组Sema 4D mRNA相对表达量比较,差异无统计学意义(P>0.05)。Sema 4D siRNA组细胞增殖率显著低于NC组和Control组(均P<0.05),Sema 4D siRNA组细胞侵袭率亦显著低于NC组和Control组(均P<0.05)。MCF-7+OM组和Sema 4D siRNA+OM组骨结节面积显著低于Control+OM组(均P<0.05),Sema 4D siRNA+OM组骨结节面积显著高于MCF-7+OM组(均P<0.05)。Control+OM组、MCF-7+OM组、Sema 4D siRNA+OM组AKT蛋白表达水平比较差异无统计学意义(P>0.05);MCF-7+OM组和Sema 4D siRNA+OM组p-AKT蛋白表达水平显著低于Control+OM组(均P<0.05),Sema 4D siRNA+OM组p-AKT蛋白表达水平显著高于MCF-7+OM组(P<0.05)。结论 人乳腺癌细胞系MCF-7 Sema 4D表达显著上调,并与细胞增殖、侵袭等生物学行为有关;下调Sema 4D表达,能够提高AKT磷酸化水平,减弱对成骨细胞分化的抑制作用。
乳腺癌; 骨转移; 信号素4D; 成骨分化; AKT磷酸化
乳腺癌是女性发病率最高的恶性肿瘤之一,其发病率约占所有女性肿瘤的30%[1]。中早期乳腺癌诊疗效果较为满意,一旦发生转移则严重影响患者预后。骨骼是乳腺癌首要转移部位[2],发生骨转移后会引起骨痛、病理性骨折、神经压迫等症状,导致患者生活质量显著降低,生存时间明显缩短。研究证实[3],乳腺癌骨转移发病机制与骨重塑平衡破坏、成骨作用和溶骨作用失调有关。信号素4D[4](Semaphorin 4D,Sema 4D)是神经轴突生长导向因子,在多种恶性肿瘤中呈高表达,并与肿瘤的发生和进展密切相关。近年来有研究发现[5]破骨细胞能够分泌Sema 4D,并参与调节成骨细胞的分化和转移。Zhang等[6]将小鼠成骨细胞Sema 4D基因敲除,结果发现小鼠成骨细胞分化能力增强,提示Sema 4D可能在调控骨代谢平衡中发挥重要作用。然而乳腺癌来源的Sema 4D是否在乳腺癌骨转移中发挥作用尚不清楚。鉴于此,本研究通过抑制乳腺癌Sema 4D表达,探讨其介导的成骨前体细胞AKT磷酸化在乳腺癌骨转移发病中的作用,旨在为乳腺癌骨转移防治提供新的思路。
1 材料与方法
1.1 细胞来源
人乳腺癌细胞株MCF-7购自中国科学院细胞资源中心,人正常乳腺细胞Hs578Bst购自上海拜力生物科技有限公司,小鼠胚胎成骨细胞前体细胞MC3T3-E1购自上海研域生物科技有限公司。
1.2 主要试剂
MTT染料、结晶紫染料、溴化乙啶、胎牛血清、DMEM培养液购自美国Gibco公司,二甲基亚砜(DMSO)、焦碳酸二乙酯(DEPC)、茜素红粉末购自美国Sigma公司,RPMI-1640培养液、成骨诱导培养液(osteogenic medium,OM)、α-MEM完全培养液、胰蛋白酶购自HyClone公司,RIPA裂解液、BCA蛋白定量检测试剂盒、SDS-PAGE凝胶配制试剂盒、SDS-PAGE转膜液、电泳液购自苏州碧云天公司,Sema 4D siRNA、慢病毒载体购自上海吉凯基因化学技术有限公司,小鼠来源Sema 4D多克隆抗体、小鼠来源GAPDH多克隆抗体、辣根过氧化物酶标记的山羊抗小鼠二抗均购自北京天根生化科技有限公司,RNAiso裂解液、PrimeScript®反转录试剂盒、PrimeScript®RT Enzyme MixⅠ、RT Primer Mix、SYBR®Premix EX Taq TMⅡ购自宝生物工程(大连)有限公司,LipofectamineTM2000转染试剂、小鼠来源AKT多克隆抗体、p-AKT多克隆抗体购自美国Invitrogen公司,Transwell小室购自美国Costar公司。
1.3 方法
1.3.1 细胞培养 MCF-7和Hs578Bst细胞系均接种于DMEM培养液,以37℃、5%CO2培养箱中培养;待细胞融合≥90%时,加入胰蛋白酶消化,不含血清的培养液重悬,按照1∶3传代。
1.3.2 实时荧光定量PCR检测细胞Sema 4D mRNA表达 取对数生长期细胞,PBS冲洗3次,加入1 mL胰蛋白酶消化,1 500 r/min离心5 min,弃去上清液。向沉淀中加入1 mL细胞裂解液,冰浴上静置10 min,将细胞转移至EP管中,加入0.2 mL氯仿,充分振荡,冰浴上静置5 min,12 000 r/min离心10 min,取上清液,加入等体积的异丙醇,振荡10 s,12 000 r/min离心10 min,上清液弃去,75%乙醇洗涤沉淀。采用核酸检测仪对RNA浓度及纯度进行检测。取5 μg总RNA,按照PrimeScript®反转录试剂盒说明书进行逆转录,逆转录体系:Prime Script®反转录试剂4 μL,PrimeScript®RT Enzyme MixⅠ 1 μL,RT Primer Mix 1 μL,双蒸水补充至总反应体系20 μL;反应条件:37℃ 15 min,85℃ 10 s,逆转录产物置于4℃冰箱保存。采用实时荧光定量PCR检测细胞Sema 4D mRNA表达,操作参考SYBR®Premix EX Taq TMⅡ试剂盒说明书,引物委托上海生工生物工程有限公司合成,Sema 4D上游:5′-GAGAAGCAGCATGAGGTGTATTGGA-3′,下游:5′-GGATGTAGTTGAGGCACTCTG-TCTG-3′;GAPDH上游:5′-CCAGCAAGAGCACAAGAGGAAGAG-3′,下游:5′-GGTCTACATGGCAACTGTGAGGAG-3′。PCR体系:SYBR®Premix EX Taq TMⅡ 10 μL,上下游引物各1 μL,DNA模板2 μL,蒸馏水补充至总反应体系20 μL;反应条件:95℃预变性30 s,95℃变性10 s,60℃延伸40 s,35个循环后74℃延伸5 min。以GAPDH作为内参照,检测细胞Sema 4D mRNA相对表达量。
1.3.3 siRNA构建Sema 4D低表达乳腺癌MCF-7细胞系 按照转染的类型将细胞分为3组:空白对照组(Control),阴性对照组(negative control,NC)和Sema 4D siRNA组,其中NC组siRNA正义链:5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACAGCUUCGGAGAATT-3′;Sema 4D siRNA正义链:5′-UUCUCCGAACGU-GUCACGUTT-3′,反义链:5′-ACGUGACACGU-UCGGAGAATT-3′。取对数生长期细胞,按照1×105个/孔接种于24孔板,待细胞生长≥50%融合时,重新更换培养液,Control组不做任何处理,继续培养;NC组加入LipofectamineTM2000转染试剂和siRNA-NC(si-RNA negative control),Sema 4D siRNA组加入LipofectamineTM2000转染试剂和siRNA-Sema 4D,病毒转染根据预实验确定的MOI值;转染48 h后提取总RNA,采用实时荧光定量PCR检测转染后Sema 4D mRNA表达水平,实验操作同1.3.2项。
1.3.4 MTT法检测各组细胞增殖能力 取对数生长期的各组细胞,以1.0×107个/孔接种于96孔板中,分别于12、24、36、48、60、72 h向每孔加入10 μL的5 g/L MTT溶液,培养4 h后将培养液弃去,再向每孔中加入150 μL DMSO,充分振荡,置于酶标仪上,测量450 nm波长处吸光度值。
1.3.5 Transwell法检测各组细胞侵袭能力 取对数生长期的各组细胞,用不含血清的培养液调整浓度为1.0×109个/孔,Transwell上室每孔植入150 μL细胞,下室加入600 μL含有20%胎牛血清的RPMI-1640培养液,每组分别设置6个复孔,细胞培养48 h,待培养结束后将Transwell小室滤膜用4%多聚甲醛固定,轻轻拭去表面细胞;结晶紫染色10 min,PBS冲洗3次,显微镜下观察穿透滤膜的细胞数。
1.3.6 共培养实验及成骨诱导分化 根据马敏等[7]报道,采用Transwell小室建立成骨细胞和乳腺癌细胞的共培养体系,模拟乳腺癌骨转移环境;将细胞分为3组,①对照组(Control+OM):Transwell上室仅加入OM培养液,下室加入MC3T3-E1细胞;②乳腺癌细胞组(MCF-7+OM):Transwell上室加入人乳腺癌细胞系MCF-7,下室加入MC3T3-E1细胞;③Sema 4D低表达乳腺癌细胞组(Sema 4D siRNA+OM):Transwell上室加入Sema 4D低表达乳腺癌MCF-7细胞系,下室加入MC3T3-E1细胞。具体实验方法取对数生长期的MC3T3-E1细胞、正常MCF-7细胞和Sema 4D低表达MCF-7细胞,MC3T3-E1细胞用不含血清的培养液调整浓度为1×105个/孔,MCF-7细胞、Sema 4D低表达MCF-7细胞调整浓度为3×104个/孔,接种于12孔板上,加入0.5 mL α-MEM完全培养液,以37℃、5%CO2条件培养,待细胞完全融合,再将培养液吸除,更换为0.5 mL OM培养液继续以37℃、5%CO2条件培养,以更换培养液时记为0 h,此后每隔12 h更换1次培养液。
1.3.7 茜素红染色实验检测骨矿化能力 细胞共培养2周后,将Transwell小室内培养液吸除,PBS冲洗3次,加入4%的多聚甲醛固定10 min,再将甲醛吸除,PBS冲洗3次。取出预先配置好的茜素红染液,按照200 μL/孔分别加入细胞培养板中,以茜素红染液刚好覆盖至细胞表面为宜;室温下孵育5~10 min,待细胞表面出现红色颗粒,且各组细胞染色反应趋势大体一致时,终止染色反应。吸除染色液,纯化水洗涤3次,室温下晾干。将染色细胞置于倒置显微镜下观察,记录各组细胞的染色情况,并用Quantity One软件分析各组细胞骨结节数量与面积,以反映成骨矿化能力。
1.3.8 Western blot检测AKT、p-AKT蛋白表达细胞共培养24 h后,取对数生长期细胞,加入100 μL含1%PMSF的细胞裂解液充分裂解,4℃离心20 min(15 000 r/min),吸取上清液,将上清液移至EP管中,加入等量上样液,100℃煮沸5 min,使蛋白完全变性。SDS-PAGE电泳分离蛋白,并转移至PVDF膜上,100 mA、40 min电转后将PVDF膜取出。5%脱脂牛奶封闭2 h,加入1∶1 000稀释的AKT多克隆抗体、p-AKT多克隆抗体和1∶5 000稀释的GAPDH多克隆抗体,4℃孵育过夜。PBS冲洗3次,再按照1∶1 000加入二抗,室温下振荡孵育2 h,PBS冲洗3次。ECL显色,凝胶成像分析仪采集图像,测定目的基因灰度,目的蛋白相对表达量为样本条带与GAPDH条带灰度值比值。
1.4 统计学方法
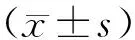
2 结果
2.1 MCF-7和Hs578Bst细胞系Sema 4D mRNA表达
实时荧光定量PCR检测结果显示,MCF-7细胞Sema 4D mRNA相对表达量为(7.331±0.974),Hs578Bst细胞为(1.483±0.341),MCF-7细胞Sema 4D mRNA相对表达量显著高于Hs578Bst细胞(P<0.05)。
2.2 siRNA干扰人乳腺癌细胞株MCF-7 Sema 4D mRNA表达
Sema 4D siRNA稳定转染后,Sema 4D siRNA组Sema 4D mRNA相对表达量(0.492±0.061)显著低于Control组(1.483±0.341)和NC组(1.398±0.283)(均P<0.05),Control组和NC组Sema 4D mRNA相对表达量比较差异无统计学意义(P>0.05)。
2.3 siRNA干扰Sema 4D表达对MCF-7细胞增殖能力的影响
36~72 h内,Sema 4D siRNA组细胞增殖率显著低于NC组和Control组(均P<0.05),Control组和NC组Sema 4D mRNA细胞增殖率比较差异无统计学意义(P>0.05),见图1。
2.4 siRNA干扰Sema 4D表达对MCF-7细胞侵袭能力的影响
Sema 4D siRNA组细胞侵袭数(267±19)显著低于NC组(421±33)和Control组(452±37)(均P<0.05),Control组和NC组Sema 4D mRNA细胞侵袭数比较差异无统计学意义(P>0.05)。
2.5 siRNA干扰Sema 4D表达对骨矿化能力的影响
茜素红染色的原理就是茜素红和钙发生显色反应,茜素红染色结果显示,MCF-7+OM组和Sema 4D siRNA+OM组骨结节面积分别为(1.26±0.21)μm2、(4.22±0.23)μm2,显著低于Control+OM组(9.63±0.71)μm2(均P<0.05),Sema 4D siRNA+OM组骨结节面积显著高于MCF-7+OM组(P<0.05),见图2。

与Control组比较,#P<0.05;与NC组比较,*P<0.05图1 各组细胞增殖能力的变化Fig.1 Cell proliferation changes of different groups

A:Control+OM组;B:MCF-7+OM组;C:Sema 4D siRNA+OM组图2 各组细胞茜素红染色结果(×100)Fig.2 Alizarin red staining results(×100)
2.6 siRNA干扰Sema 4D表达对AKT、p-AKT蛋白表达水平的影响
Western blot检测结果显示,Control+OM组、MCF-7+OM组、Sema 4D siRNA+OM组AKT蛋白表达水平比较差异无统计学意义(P>0.05),MCF-7+OM组和Sema 4D siRNA+OM组p-AKT蛋白表达水平显著低于Control+OM组(均P<0.05),Sema 4D siRNA+OM组p-AKT蛋白表达水平显著高于MCF-7+OM组(P<0.05),见图3。

与Control+OM组比较,#P<0.05;与MCF-7+OM组比较,*P<0.05图3 各组细胞AKT、p-AKT蛋白表达Fig.3 AKT and p-AKT protein expression in each cell group
3 讨论
Sema 4D是Ⅳ型Semaphorins蛋白家族成员之一,目前已知Semaphorins具有轴突导向作用,在维持正常神经生理功能方面发挥着重要作用。近年来研究发现[8-10]乳腺癌、前列腺癌、肺癌等多种恶性肿瘤组织中Sema 4D呈高表达,并介导肿瘤新生血管生成、肿瘤进展和细胞免疫等。陈武桂等[11]报道称Sema 4D在乳腺癌内高表达,并且表达水平越高,患者预后越差。Shanks等[12]认为Sema 4D主要来源于肿瘤相关巨噬细胞,并参与肿瘤血管的形成。本研究显示MCF-7细胞Sema 4D mRNA相对表达量显著高于Hs578Bst细胞,与Binmadi等[13]报道一致,提示Sema 4D可能与乳腺癌的一些生物学行为有关。
Tasaka等[14]发现,低氧诱导因子能够促进乳腺癌Sema 4D表达,并诱导内皮细胞发生迁移,导致肿瘤增殖、侵袭和新生血管形成。本研究采用siRNA技术干扰乳腺癌MCF-7细胞Sema 4D表达,结果显示Sema 4D siRNA稳定转染后,Sema 4D siRNA组Sema 4D mRNA相对表达量显著低于Control组和NC组,证实Sema 4D低表达MCF-7细胞系构建成功。进一步分析显示Sema 4D siRNA组细胞增殖率和细胞侵袭率均显著低于NC组和Control组,提示干扰Sema 4D表达能够抑制MCF-7细胞的增殖与侵袭。Binmadi等[15]在研究中发现,Sema 4D特异性与丝状蛋白B1和酪氨酸激酶受体结合后,能够激活RhoA通路,而RhoA通路是肿瘤细胞侵袭转移的关键信号通路。Giordano等[16]也证实下调Sema 4D表达能够抑制乳腺癌细胞的增殖,阻滞细胞周期在G1期,并明显抑制细胞的迁移能力,说明Sema 4D可能作为癌因子参与乳腺癌增殖、侵袭、转移等生物学过程。
骨转移是多种恶性肿瘤严重并发症之一,发生骨转移会导致骨重塑失衡,进一步引起多种骨相关事件[17-18]。Piccardo等[19]报道称乳腺癌发生骨转移后并非直接破坏骨质,其主要通过一系列调控机制抑制成骨前体细胞分化、成熟。最近研究显示[20],破骨细胞在分化时能够分泌Sema 4D,且Sema 4D越高,成骨细胞分化程度越低,提示Sema 4D可能参与了溶骨性破坏和抑制成骨分化。Wannemacher等[21]将小鼠Sema 4D基因敲除,结果显示小鼠表现出明显骨硬化特征,提示Sema 4D在成骨和破骨平衡中起到重要作用。本研究利用Transwell小室建立乳腺癌骨转移微环境,采用茜素红染色观察成骨分化情况,结果显示MCF-7+OM组和Sema 4D siRNA+OM组骨结节染色面积显著低于Control+OM组,Sema 4D siRNA+OM组骨结节染色面积显著高于MCF-7+OM组,说明乳腺癌细胞能够明显抑制成骨前体细胞的矿化程度,而干扰乳腺癌Sema 4D表达后,乳腺癌对成骨前体细胞的矿化抑制作用也明显减弱。
AKT是介导成骨细胞分化的关键蛋白,其通过激活Wnt/β-catenin通路诱导成骨分化[22]。既往研究证实[23],成骨诱导剂能够促进成骨前体细胞分化,且细胞中AKT磷酸化程度显著增加。本研究显示Control+OM组、MCF-7+OM组、Sema 4D siRNA+OM组AKT蛋白表达水平的差异无统计学意义,Sema 4D siRNA+OM组p-AKT蛋白表达水平显著高于MCF-7+OM组,说明乳腺癌细胞可能通过下调AKT磷酸化水平抑制成骨分化,干扰Sema 4D表达能够提高AKT磷酸化水平,从而减弱对成骨分化的抑制作用。虽然本研究证明了Sema 4D对乳腺癌骨转移的可能机制,但是Sema 4D如何调节AKT磷酸化以及是否对破骨细胞分化有促进作用,依然需要深入研究。
综上所述,人乳腺癌细胞系MCF-7 Sema 4D表达显著上调,并与细胞增殖、侵袭等生物学行为有关;下调MCF-7细胞Sema 4D表达,能够减弱对成骨细胞分化的抑制作用,其机制可能与提高AKT磷酸化水平有关。
[1] 郑莹,吴春晓,张敏璐,等.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013,23(8):561-569.
[2] Bersini S,Jeon J S,Dubini G,et al.A microfluidic 3Dinvitromodel for specificity of breast cancer metastasis to bone[J].Biomaterials,2014,35(8):2454-2461.
[3] Urakawa H,Nishida Y,Knudson W,et al.Therapeutic potential of hyaluronan oligosaccharides for bone metastasis of breast cancer[J].J Orthop Res,2012,30(4):662-672.
[4] Sekimoto T,Ishii M,Emi M,et al.Segmental copy number loss in the region of Semaphorin 4D gene in patients with acetabular dysplasia[J].J Orthop Res,2013,31(6):957-961.
[5] Negishi-Koga T,Shinohara M,Komatsu N,et al.Suppression of bone formation by osteoclastic expression of semaphorin 4D[J].Nat Med,2011,17(11):1473-1480.
[6] Zhang Y,Wei L,Miron R J,et al.Anabolic bone frmation via a site-specific bone-targeting delivery system by interfering with semaphorin 4D dxpression[J].J Bone Miner Res,2015,30(2):286-296.
[7] 马敏,胡旭,陈武桂,等.成骨前体细胞对乳腺癌细胞表达骨拟态特性及增殖的影响[J].第三军医大学学报,2016,38(9):954-958.
[8] Kato S,Kubota K,Shimamura T,et al.Semaphorin 4D,a lymphocyte semaphorin,enhances tumor cell motility through binding its receptor,plexin B1,in pancreatic cancer[J].Cancer Sci,2011,102(11):2029-2037.
[9] Malik M F,Ye L,Jiang W G.Reduced expression of semaphorin 4D and plexin-B in breast cancer is associated with poorer prognosis and the potential linkage with oestrogen receptor[J].Oncol Rep,2015,34(2):1049-1057.
[10] Deguchi K,Miyazaki K,Tian F,et al.Modifying neurorepair and neuroregenerative factors with tPA and edaravone after transient middle cerebral artery occlusion in rat brain[J].Brain Res,2012,1436:168-177.
[11] 陈武桂,沈伟伟,胡旭,等.siRNA沉默Sema 4D对乳腺癌MDA-MB-231细胞增殖及迁移的影响[J].中国肿瘤生物治疗杂志,2015,22(4):454-458.
[12] Shanks K,Nkyimbeng-Takwi E H,Smith E,et al.Neuroimmune semaphorin 4D is necessary for optimal lung allergic inflammation[J].Mol Immunol,2013,56(4):480-487.
[13] Binmadi N O,Yang Y H,Zhou H,et al.Plexin-B1 and semaphorin 4D cooperate to promote perineural invasion in a RhoA/ROK-dependent manner[J].J Pathol,2012,180(3):1232-1242.
[14] Tasaka G,Negishi M,Oinuma I.Semaphorin 4D/Plexin-B1-Mediated M-Ras GAP activity regulates actin-based dendrite remodeling through lamellipodin[J].J Neurosci,2012,32(24):8293-8305.
[15] Binmadi N O,Proia P,Zhou H,et al.Rho-mediated activation of PI(4)P5K and lipid second messengers is necessary for promotion of angiogenesis by Semaphorin 4D.[J].Angiogenesis,2011,14(3):309-319.
[16] Giordano S,Corso S,Conrotto P,et al.The Semaphorin 4D receptor controls invasive growth by coupling with Met[J].Nat Cell Biol,2002,4(9):720-724.
[17] Beriwal S,Rajagopalan M S,Flickinger J C,et al.How effective are clinical pathways with and without online peer-review? An analysis of bone metastases pathway in a large,integrated National Cancer Institute-designated Comprehensive Cancer Center Network[J].Int J Radiat Oncol Biol Phys,2012,83(4):1246-1251.
[18] Hahn S,Heusner T,Kümmel S,et al.Comparison of FDG-PET/CT and bone scintigraphy for detection of bone metastases in breast cancer[J].Acta Radiol,2011,52(9):1009-1014.
[19] Piccardo A,Altrinetti V,Bacigalupo L,et al.Detection of metastatic bone lesions in breast cancer patients:Fused 18F-Fluoride-PET/MDCT has higher accuracy than MDCT.Preliminary experience[J].Eur J Radiol,2012,81(10):2632-2638.
[20] Anastasilakis A D,Polyzos S A,Makras P,et al.Circulating semaphorin-4D and plexin-B1 levels in postmenopausal women with low bone mass:the 3-month effect of zoledronic acid,denosumab or teriparatide treatment[J].Expert Opin Ther Targets,2015,19(3):299-306.
[21] Wannemacher K M,Jiang H,Hess P R,et al.An expanded role for semaphorin 4D in platelets includes contact-dependent amplification of Clec-2 signaling[J].J Thromb Haemost,2013,11(12):2190-2193.
[22] Bhukhai K,Suksen K,Bhummaphan N,et al.A phytoestrogen diarylheptanoid mediates estrogen receptor/akt/glycogen synthase kinase 3β protein-dependent activation of the Wnt/β-catenin signaling pathway[J].J Biol Chem,2012,287(43):36168-36178.
[23] Serafino A,Moroni N,Psaila R,et al.Anti-proliferative effect of atrial natriuretic peptide on colorectal cancer cells:Evidence for an Akt-mediated cross-talk between NHE-1 activity and Wnt/β-catenin signaling[J].Biochim Biophys Acta,2012,1822(6):1004-1018.
(2016-09-14 收稿)
Role of Inhibition of Sema 4D-mediated AKT Phosphorylation of Osteogenic Precursor Cells in Breast Cancer Bone Metastasis
Wang Zhen,Zhao Yongqiang,Liu Jijunetal
DepartmentofOrthopedics,HenanProvincialPeople’sHospital,Zhenzhou450003,China
Objective To explore the role of inhibition of Sema 4D-mediated AKT phosphorylation of osteogenic precursor cells in breast cancer bone metastasis.Methods The stable low expression of Sema 4D in human breast cancer cell line MCF-7 was constructed by siRNA technique.Sema 4D mRNA expression was detected by real-time fluorescence quantitative PCR;cell proliferation activity was detected by MTT assay;cell invasion ability was detected by Transwell method.The co-culture system of osteoblasts and breast cancer cells was established by Transwell coculture system.Bone mineralization ability was detected by alizarin red staining.AKT and p-AKT protein expression were determined by Western blotting.Results The relative expression of Sema 4D mRNA was significantly higher in MCF-7 cells than in Hs578Bst cells(P<0.05).After Sema 4D siRNA transfection,Sema 4D mRNA was significantly lower in Sema 4D siRNA group than in control group and NC group(P<0.05),and there was no significant difference in Sema 4D mRNA expression between control group and NC group(P>0.05).The cell proliferation rate was significantly lower in Sema 4D siRNA group than in control group and NC group(P<0.05),and invasion rate in Sema 4D siRNA group was also significantly lower than that in control group and NC group(P<0.05).The bone nodule area in MCF-7+OM group and Sema 4D siRNA+OM group was significantly lower than that of the control+OM group(P<0.05),and bone nodule area of Sema 4D siRNA+OM group was significantly higher than that of the MCF-7+OM group(P<0.05).There was no significant difference in AKT protein expression between control+OM group,MCF-7+OM group and Sema 4D siRNA+OM group(P>0.05).The p-AKT protein expression in MCF-7+OM group and Sema 4D siRNA+OM group was significantly lower than that in control+OM group,and p-AKT protein expression in Sema 4D siRNA+OM group was significantly higher than that in MCF-7+OM group(P<0.05).Conclusion Sema 4D MCF-7 expression is significantly up-regulated in human breast cancer cell line MCF-7,and it is related to proliferation and invasion biological behavior.Down-regulation of the expression of Sema 4D in MCF-7 cells can improve the AKT phosphorylation levels,and weaken the inhibitory effect on osteoblast differentiation.
breast cancer; bone metastasis; semaphorin 4D; osteogenic differentiation; AKT phosphorylation
*河南省重大科技攻关项目(No.142102310081)
王 振,男,1979年生,主治医师,E-mail:wangzhen2837@sina.com
△通讯作者,Corresponding author,E-mail:zhengjia90180@sina.com
R737.9
10.3870/j.issn.1672-0741.2017.01.006

