ADAM8基因在胃癌组织中的表达及与临床病理特征的关系*
何 楠,金倩娜,黄永明,石 亮,吴 柯,王国斌△,陶凯雄
华中科技大学同济医学院附属协和医院 1胃肠外科 2放射科,武汉 430022
论 著
ADAM8基因在胃癌组织中的表达及与临床病理特征的关系*
何 楠1,金倩娜2,黄永明1,石 亮1,吴 柯1,王国斌1△,陶凯雄1
华中科技大学同济医学院附属协和医院1胃肠外科2放射科,武汉 430022
目的 检测ADAM8基因在胃癌组织中的表达水平,探讨胃癌的生物学特征与其表达之间的关系。方法 应用免疫组织化学、实时定量PCR及Western blot技术检测100例胃癌组织、20例正常胃黏膜组织中ADAM8基因的表达,并分析其与临床病理特征的相关性。结果 免疫组织化学分析显示ADAM8在正常胃黏膜组织中表达率为30%(6/20),而胃癌组织中ADAM8的表达率为86%(86/100),提示ADAM8基因表达在胃癌组织中显著上调(P<0.05);实时定量PCR检测显示在胃癌标本中ADAM8 mRNA的表达水平为(0.767±0.129),在正常胃组织中表达水平为(0.192±0.127),两者差异有统计学意义(P<0.01)。Western blot检测结果显示在胃癌组织中ADAM8蛋白表达水平为(0.659±0.027),而正常胃黏膜标本中其表达水平为(0.236±0.074),差异有统计学意义(P<0.01)。且伴淋巴结转移胃癌组织、无淋巴结转移胃癌组织与正常胃黏膜组织相比,ADAM8蛋白表达水平明显增高,差异均具有统计学意义(均P<0.05)。进一步分析ADAM8蛋白表达与临床病理特征之间的关系,结果显示其表达与肿瘤的直径、临床分期、肿瘤的浸润深度、有无转移等显著相关(均P<0.05);与性别、年龄等因素无明显相关(均P>0.05)。结论 ADAM8在胃癌组织中的高表达与胃癌侵袭转移有关,提示ADAM8可能参与胃癌的发生、发展过程,可能成为胃癌预后判断的参考指标。
胃癌; ADAM8; 侵袭; 转移; 临床病理特征
胃癌是全球最常见的恶性肿瘤之一,在全世界范围内,胃癌在恶性肿瘤导致的死亡中位居第2位[1]。我国每年约有40万例新发病例,同时每年有17万人死于胃癌,几乎接近全部恶性肿瘤死亡人数的1/4[2]。ADAM8基因是解聚素和金属蛋白酶(a disintegrin and metalloproteinase,ADAMs)家族的成员。其编码的蛋白ADAM8,又名CD156、MS2,是具有824个氨基酸的膜蛋白。ADAM8具有金属内切酶活性,参与一系列膜结合受体、细胞因子等蛋白的水解过程[3-4]。近年的研究显示ADAM8蛋白在多种肿瘤中异常表达,如肝细胞癌、乳腺癌、肺癌、脑胶质瘤、胰腺癌和结肠癌等[5-10],但是ADAM8基因与胃癌的关系目前报道尚少。我们在正常胃组织和胃癌组织中检测ADAM8基因的表达,探讨其表达与胃癌临床病理特征之间的关系。
1 材料与方法
1.1 一般资料
选取华中科技大学同济医学院附属协和医院2013年1月至2014年12月手术切除的胃癌标本100例,所有标本均经组织病理学检查确诊为胃癌,其中低分化腺癌30例,中分化腺癌48例,高分化腺癌22例;男60例、女40例;平均年龄(57.2±8.8)岁。临床分期依据2010年美国肿瘤联合委员会(AJCC)发布的胃癌TNM标准:Ⅰ(含A/B)期胃癌8例,Ⅱ(含A/B)期胃癌30例,Ⅲ(含A/B/C)期胃癌44例,Ⅳ期胃癌18例;无淋巴结转移者29例、有淋巴结转移者71例。正常对照为20例胃镜病理活检正常胃黏膜组织。所有标本留取2份,液氮中速冻10 min后置于-70℃保存备用。本研究得到协和医院伦理委员会批准,入选的所有患者均无既往胃癌手术史,未接受任何胃癌相关放化疗、介入及免疫治疗,入选该研究患者均签署知情同意书。所用试剂如下:免疫组织化学试剂盒(武汉博士德公司)、兔抗人ADAM8单克隆抗体(美国,Abcam公司),反转录试剂盒(大连Takara公司)、提取总RNA所用的Trizol、TaqDNA聚合酶、引物设计合成(美国,Invitrogen公司)。ADAM8引物序列为:上游引物5′-GAGCAGTATGAGGTCGTGTT-3′,下游引物5′-GTGGAGGGTGAAGTTGTG-3′;内参GAPDH的引物序列为:上游引物5′-AGGTCGGAGTCAACGGATTTG-3′,下游引物5′-GTGATGGCATGGACTGTGGT-3′。
1.2 实验方法
1.2.1 免疫组织化学法检测 标本均经10%中性甲醛溶液固定,常规脱水后石蜡包埋,厚4 μm连续切片,按照免疫组织化学链霉菌抗生物素蛋白-过氧化物酶(SP)法进行检测。根据染色细胞百分比和染色强度进行评定:着色细胞占计数细胞百分比<5%为0分,5%~为1分,25%~为2分,≥50%为3分;不着色计0分,着色较淡计1分,着色较深计2分;以每张切片染色细胞百分比得分乘以染色程度的积为最后得分;0分为阴性,l~4分为弱阳性,>4分为阳性。
1.2.2 RT-PCR检测 用Trizol试剂一步法将组织中的总mRNA提取出来,按反转录试剂盒说明书进行RNA反转录。然后将所得的反转录产物行PCR扩增。PCR的反应条件:预变性95℃ 4 min,变性95℃ 30 s,退火59℃ 45 s,延伸72℃ 30 s,共循环35次,最后72℃延伸5 min。以阈值循环(threshold cycle,Ct)值反映基因含量,通过2-ΔΔCt方法计算胃癌组织、正常胃黏膜组织目的基因的相对表达量。
1.2.3 Western blot检测 取标本100~200 mg,加入液氮研磨均匀,再加入RIPA裂解液+PMSF(100∶1)150 μL,冰上振荡裂解30 min后,12 000 r/min 4℃离心15 min,吸取上清,BCA法测定蛋白质浓度。按4∶1比例加入5倍蛋白上样缓冲液后,100℃煮沸5 min,SDS聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭1 h,加入稀释的一抗ADAM8(1∶1 000)、GAPDH(1∶3 000)4℃摇床过夜。第2天,TBST洗膜后加入二抗,室温孵育1 h,再经TBST洗膜后加入ECL发光液,应用化学发光凝胶成像系统分析目的蛋白的表达。所有检测重复3次。测量条带灰度值并计算目的条带和内参照条带灰度值比值。
1.3 统计学方法
2 结果
2.1 免疫组织化学法检测胃癌组织及正常胃黏膜组织ADAM8表达
免疫组织化学分析显示ADAM8在正常胃组织中表达率为30%(6/20)(多为弱阳性),而胃癌组织中ADAM8的表达率为86%(86/100)(多为强阳性),两者差异有统计学意义,提示ADAM8基因表达在胃癌组织中显著上调(P<0.01),见图1。有淋巴结转移和无淋巴结转移的胃癌组织表达率分别为93.5%、73.6%,两组比较,差异有统计学意义(P=0.023),提示淋巴结转移患者的胃癌组织中ADAM8表达率更高,进一步分析,患者肿瘤分期越晚胃癌组织中ADAM8的表达率越高,差异有统计学意义(P=0.001)。
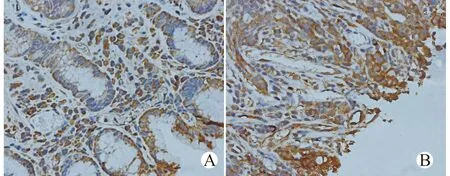
A:正常胃黏膜组织;B:胃癌组织图1 免疫组织化学方法检测胃正常黏膜组织与胃癌组织ADAM8蛋白表达(SP染色,×100)Fig.1 Detection of expression of ADAM8 in gastric cancer samples and normal mucosal tissues by immunohistochemistry(SP staining,×100)
2.2 RT-PCR及Western blot检测胃癌组织及正常胃黏膜组织中ADAM8的表达
使用实时定量PCR分别检测胃癌组织标本及正常胃黏膜中ADAM8 mRNA的表达,结果显示在胃癌标本中ADAM8 mRNA表达水平为(0.767±0.129),在正常胃组织中表达水平为(0.192±0.127),两者差异有统计学意义(P<0.01)。进一步Western blot检测,结果显示在胃癌组织中ADAM8蛋白表达水平为(0.659±0.027),而正常胃黏膜组织中其表达水平为(0.236±0.074),差异有统计学意义(P<0.01)。且伴淋巴结转移胃癌组织、无淋巴结转移胃癌组织与正常胃黏膜组织相比ADAM8蛋白表达水平明显增高,差异具有统计学意义(均P<0.05),见图2。
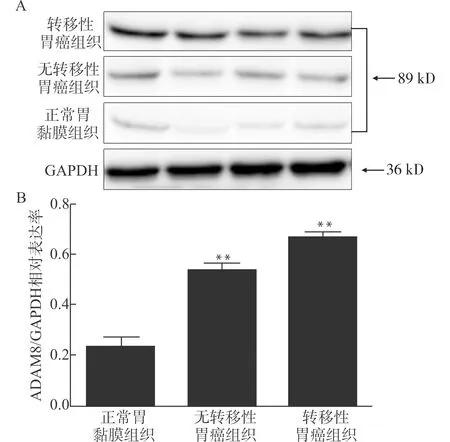
A:ADAM8蛋白表达情况;B:ADAM8/GAPDH相对表达率;与正常胃黏膜组织比较, **P<0.01图2 Western blot检测不同组织中ADAM8蛋白表达Fig.2 Detection of expression of ADAM8 in gastric cancer samples and normal mucosal tissues by Western blotting
2.3 ADAM8表达与胃癌患者临床病理特征的关系
胃癌患者临床病理特征与免疫组织化学检测ADAM8蛋白表达水平之间的关系见表1。胃癌组织中ADAM8蛋白表达水平与患者性别、年龄、肿瘤的部位及肿瘤的分化程度无关(均P>0.05);直径≥5 cm、临床肿瘤分期晚、肿瘤浸润深、淋巴结转移及远处转移的患者ADAM8蛋白表达阳性率明显增高,且差异有统计学意义(均P<0.05)。
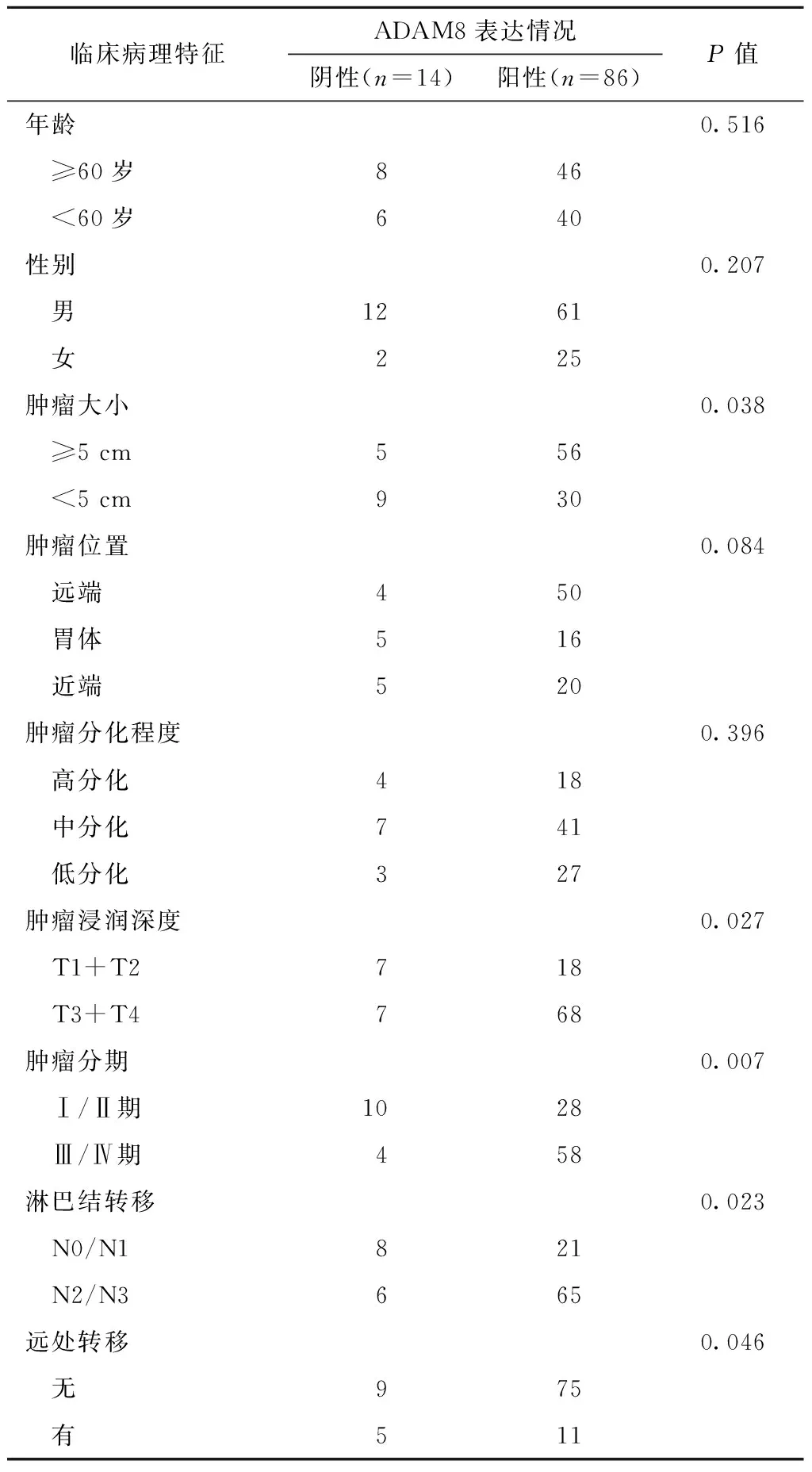
表1 ADAM8表达与患者临床病理特征之间的关系Table 1 Relationship between ADAM8 expression and clinicopathologic characteristics in gastric cancer
3 讨论
ADAM8是ADAM家族的成员之一,具有去整合素及金属蛋白酶两个功能结构域,具有细胞粘附及蛋白水解酶活性,在乳腺癌、结肠癌、胰腺癌等多种肿瘤组织中都有表达,其在细胞中的生理功能涉及到促进细胞增殖、侵袭和肿瘤血管的生成等,并且与肿瘤的发生、发展及预后密切相关[7-10]。本研究采用免疫组织化学方法检测胃癌组织和胃正常黏膜组织中ADAM8的表达,显示胃癌组织的表达阳性率明显高于胃正常黏膜组织。通过实时定量PCR和Western blot方法分别从基因和蛋白水平定量分析进一步验证了免疫组化检测的结果,提示ADAM8基因表达增高与胃癌的发生发展有关。通过将临床病理资料与ADAM8表达情况进行单因素分析,结果显示胃癌组织中ADAM8蛋白表达与患者性别、年龄、肿瘤的部位及肿瘤的分化程度无关;但是直径≥5 cm、肿瘤的临床分期晚、肿瘤浸润深、淋巴结转移及远处转移与患者ADAM8蛋白表达增高有关(均P<0.05)。提示ADAM8蛋白表达、肿瘤大小、病理类型和肿瘤分期是影响患者预后的危险因素。Yang等[6]的研究也显示ADAM8的表达促进结肠癌的侵袭和转移,并影响肿瘤的预后。另一项研究也显示ADAM8的高表达与肿瘤的大小、病理类型、甲胎蛋白(AFP)水平、临床分期和预后密切相关[11]。
由于肿瘤侵袭转移是复杂的多基因、多步骤相互作用的结果,包括癌细胞从原发灶脱离、穿过细胞外基质(ECM)和基膜、穿过血管壁进入宿主微环境等关键步骤。ADAM8蛋白能通过结合细胞表面结合素使细胞相互粘附及结合ECM,从而提高了细胞的侵袭能力[12-13]。另外ADAM8能够使ECM和基底膜降解,从而破坏ECM屏障促进癌细胞转移[14]。Schlomann等[15]研究发现胰腺癌组织中ADAM8表达与表皮生长因子受体(EGFR)表达相关,直接或间接激活EGFR相关通道,进而参与肿瘤的发生、发展。并且ADAM8可以剪切脱落双调蛋白、转化生长因子TGF-α等多种EGFR的配体并活化EGFR,从而提高肿瘤细胞的增殖和细胞运动能力[16]。我们研究团队的另一项研究也显示ADAM8通过激活EGFR/ERK通道上调MMP-2、MMP-9的表达而促进胃癌细胞的侵袭和转移[17]。Hernández等[18]的研究也证实,ADAM8通过剪切细胞因子并使其脱落的机制参与了转移性鳞癌的生成,说明ADAM8蛋白表达上调可能导致肿瘤进展速度加快、复发或促进侵袭转移。
综上所述,ADAM8在胃癌组织中的高表达与胃癌侵袭转移有关,提示ADAM8可能参与胃癌的发生、发展过程,其可能成为判断胃癌预后的参考指标。然而,由于ADAM蛋白家族结构复杂、功能多样,关于ADAM8在肿瘤中的作用机制研究仍存在争议,有待深入研究。
[1] Siege R,Ma J,Zou Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[2] Yang L.Incidence and mortality of gastric cancer in China[J].World J Gastroenterol,2006,12(1):17-20.
[3] Srinivasan S,Romagnoli M,Bohm A,et al.N-glycosylation regulates ADAM8 processing and activation[J].J Biol Chem,2014,289(48):33676-33688.
[4] Schlomann U,Wildeboer D,Webster A,et al.The metalloprotease disintegrin ADAM8.Processing by autocatalysis is required for proteolytic activity and cell adhesion[J].J Biol Chem,2002,277(50):48210-48219.
[5] Valkovskaya N,Kayed H,Felix K,et al.ADAM8 expression is associated with increased invasiveness and reduced patient survival in pancreatic cancer[J].J Cell Mol Med,2007,11(5):1162-1174.
[6] Yang Z,Bai Y,Huo L,et al.Expression of A disintegrin and metalloprotease 8 is associated with cell growth and poor survival in colorectal cancer[J].BMC Cancer,2014,14:568.
[7] Romagnoli M,Mineva N D,Polmear M,et al.ADAM8 expression in invasive breast cancer promotes tumor dissemination and metastasis[J].EMBO Mol Med,2014,6(2):278-294.
[8] Ishikawa N,Daigo Y,Yasui W,et al.ADAM8 as a novel serological and histochemical marker for lung cancer[J].Clin Cancer Res,2004,10(24):8363-8370.
[9] Zhang Y,Tan Y F,Jiang C,et al.High ADAM8 expression is associated with poor prognosis in patients with hepatocellular carcinoma[J].Pathol Oncol Res,2013,19(1):79-88.
[10] Dong F,Eibach M,Bartsch J W,et al.The metalloprotease-disintegrin ADAM8 contributes to temozolomide chemoresistance and enhanced invasiveness of human glioblastoma cells[J].Neuro Oncol,2015,17(11):1474-1485.
[11] 张云,胡本顺,谈永飞,等.ADAM8蛋白在肝细胞癌的表达及其临床意义[J].中华肝胆外科杂志,2013,19(2):116-119.
[12] Zhang W,Wan M,Ma L,et al.Protective effects of ADAM8 against cisplatin-mediated apoptosis in non-small-cell lung cancer[J].Cell Biol Int,2013,37(1):47-53.
[13] Roemer A,Schwettmann L,Jung M,et al.The membrane proteases adams and hepsin are differentially expressed in renal cell carcinoma.Are they potential tumor markers? [J].J Urol,2004,172(6 Pt 1):2162-2166.
[14] Dehmel T,Janke A,Hartung H P,et al.The cell-specific expression of metalloproteinase disintegrins(ADAMs)in inflammatory myopathies[J].Neurobiol Dis,2007,25(3):665-674.
[15] Schlomann U,Koller G,Conrad C,et al.ADAM8 as a drug target in pancreatic cancer[J].Nat Commun,2015,6:6175.
[16] Schlomann U,Rathke-Hartlieb S,Yamamoto S,et al.Tumor necrosis factor alpha induces a metalloprotease-disintegrin,ADAM8(CD156):implications for neuronglia interactions during neurodegeneration[J].J Neurosci,2000,20(21):7964-7971.
[17] He N,Jin Q N,Shi L,et al.ADAM8 promotes gastric cancer cell invasiveness via EGFR/ERK signaling pathway to upregulate matrix metalloproteinases 2 and 9 expression[J].Int J Clin Exp Pathol,2016,9(10):9963-9973.
[18] Hernández I,Moreno J L,Zandueta C,et al.Novel alternatively spliced ADAM8 isoforms contribute to the aggressive bone metastatic phenotype of lung cancer[J].Oncogene,2010,29(26):3758-3769.
(2016-05-02 收稿)
Expression of ADAM8 in Gastric Carcinoma and Its Association with Clinicopathologic Features
He Nan1,Jin Qianna2,Huang Yongming1etal
1DepartmentofGastrointestinalSurgery,2DepartmentofRadiology,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
Objective To detect the expression of ADAM8 mRNA and protein in gastric carcinoma and to investigate the correlation between ADAM8 gene expression and clinicopathological features.Methods ADAM8 was detected in 100 cases of gastric carcinoma and 20 cases of normal gastric tissues by reverse transcriptase-polymerase chain reaction(RT-PCR)and Western blotting.The correlation between the ADAM8 expression and clinicopathological features was analyzed.Results Immunohistochemical analysis showed that the expression rate of ADAM8 in gastric carcinoma was increased significantly[86%(86/100),P<0.05] as compared with that in normal gastric tissues[30%(6/20)].ADAM8 mRNA expression level was (0.767±0.129) in gastric carcinoma and (0.192±0.127) in normal gastric tissue,with a significant difference(P<0.05).Western blotting showed that the ADAM8 protein expression level was (0.659±0.027) in gastric carcinoma and (0.236±0.074) in normal gastric specimens,with a significant difference(P<0.01).ADAM8 mRNA and protein expression levels in gastric carcinoma tissues were significantly higher than those in normal gastric tissues(P<0.05).There were significant correlations between the expression level and diameter of the tumor,clinical stage,differentiation,biological behaviors,and lymphatic metastasis(allP<0.05),but no significant correlations were found between the expression level and gender,age(bothP>0.05).Conclusion Overexpression of ADAM8 in gastric carcinoma may be associated with tumor progression.
gastric carcinoma; ADAM8; invasiveness; metastasis; clinicopathologic features
*国家自然科学基金资助项目(No.81272424);湖北省分子影像重点实验室开放基金资助项目(No.000003200);国家卫生和计划生育委员会公益性行业科研专项基金资助项目(No.201402015)
何 楠,男,1981年生,博士研究生,主治医师,E-mail:hero_nan@163.com
△通讯作者,Corresponding author,E-mail:wangguobin_union@163.com
R735.2
10.3870/j.issn.1672-0741.2017.01.001

