基于催化剂、有机氧化反应概念建构的乙醇氧化实验改进
伏劲松+黄红梅+彭蜀晋+张艳华
摘要:为了给催化剂、有机氧化反应概念的建构提供实验支持,对乙醇氧化制乙醛实验进行改进。将氧气和乙醇蒸气交替通过催化剂,使催化剂(铜)变黑、变亮的实验现象交替出现,便于学生观察,为催化剂参与化学反应的观念建构提供实证支撑;将乙醇蒸气通过催化剂,为建构有机氧化反应概念——得氧失氢的核心理念提供实验支持;将乙醛制备和检验同时进行,节省了实验时间,有利于课堂演示和分组实验。
关键词:乙醇氧化;催化剂;有机氧化反应;实验改进;概念建构
文章编号:1005–6629(2017)1–0065–03 中图分类号:G633.8 文献标识码:B
乙醇氧化制乙醛是中学化学教材必做的实验,教材中利用该实验讲解乙醇的化学性质[1]。对于该实验中学一线教师以及一些专家进行了改进,主要有(1)用CuO代替空气中的氧气做氧化剂[2~5];(2)铜直接加热后反应[6~9];(3)铜与乙醇混合加热反应[10~13];(4)改进检验乙醛方法[14~17];(5)系统改进[18]。用氧气代替空气,并将氧气通入加热的乙醇中,混合气体通入加热的铜丝,用新制Cu(OH)2溶液代替银氨溶液进行乙醛的收集,制备完成后再加热新制的Cu(OH)2溶液,用于检验生成的产物是乙醛。以上改进对教师讲解乙醇的化学性质起到很好的支持作用,有利于学生掌握乙醇氧化生成乙醛的化学知识。我们还发现若把该实验进行必要的改进,能为催化剂、有机氧化反应概念的建构提供实证支持,进一步扩大了实验的教学功能。
催化剂是中学化学教学中的一个重要概念,也是学生后续化学学习的核心知識,在中学化学教材中多次出现,其主要观点有:(1)催化剂改变化学反应的速率,但反应前后质量和化学性质不变;(2)催化剂改变化学平衡所需要的时间,但不改变平衡状态。对于这些观点教材中仅凭H2O2在MnO2的催化作用下生成O2的实验来进行概念建构,有一定的困难。教材中对于催化剂概念、催化剂参与化学反应改变反应路径从而改变化学反应的活化能进而改变化学反应速率的基本观念没有相应的实验事实做支持,仅仅在过渡态理论中有一个简单的模型阐述,不利于学生理解和概念的建立,因此直接导致学生对催化剂不改变化学平衡状态的错误理解,特别对于最新研究的生物催化剂“酶”可以改变化学平衡的观念更是缺乏了解[19]。
氧化反应是中学化学中的另一个重要概念,在初中化学教材中定义为物质与“氧”发生的反应;在高中无机化学相关内容的教学中定义为失去电子的反应或者化合价升高的反应;在有机化学中氧化反应的概念定义为物质得氧失氢的反应。在前两个定义中有相关的化学实验做支撑,学生能很好地建构氧化反应的概念,但对于有机化学中物质得氧失氢的定义没有相关的实验模型,造成学生对这一概念理解的偏差。
不少参考文献中对该实验的改进方法主要关注乙醇可以被氧化生成乙醛的事实,从各个方面对实验进行了改进和优化,但对于催化剂参与化学反应的观念以及物质失氢的反应也是氧化反应观念建构的实验改进并没有涉及。
基于以上分析我们对乙醇氧化成乙醛的实验进行改进,将氧气和乙醇蒸气交替地通过催化剂,使催化剂(铜)变黑、变亮的实验现象交替出现,为催化剂参与化学反应观念的建构提供实验支持;随后向催化剂(铜)通入乙醇蒸气,为有机氧化反应概念的建构提供实证支持;此外将制备和检验同时进行,节省了实验时间,有利于一线教师的课堂演示和学生分组实验。
1 实验改进方法
1.1 实验装置图
乙醇氧化生成乙醛实验改进后的装置图,见图1。
1.2 实验仪器和药品
无水乙醇、铜丝、AgNO3、氨水、无水CuSO4、MnO2、碱石灰、干燥管、试管、烧杯、铁架台、硬质玻璃管、软胶管、酒精灯、秒表
1.3 实验方法
1.3.1 基于催化剂概念建构的实验改进
1.3.1.1 实验装置及其实验步骤
(1)实验装置见图1。
(2)在A的试管中加入5mL无水乙醇,并置于60℃的热水浴中;B的小试管中加入0.5g MnO2,并在分液漏斗中加入5mL 10%的H2O2溶液,B的干燥管中装满碱石灰;C的试管中加入绕成螺旋状的铜丝5g,C的干燥管中装满无水CuSO4粉末;在D的试管中加入新配制的银氨溶液5mL,置于水浴中并酒精灯加热。
(3)打开B处的分液漏斗活塞,控制H2O2的滴速让其逐滴滴入试管中,产生连续不断的气泡。打开B的开关,关闭A的左侧开关并点燃C处的酒精灯加热,直到铜丝完全变黑;然后关闭B的开关、打开A右侧开关、关闭A上部的开关,继续加热到铜丝变亮。继续重复前两次的步骤反应3min。
1.3.1.2 实验现象
当O2通过铜丝时,铜丝变黑,停止通O2,改通乙醇蒸气时,铜丝变亮;此现象反复进行至 3min时,D处试管的中上部有光亮的银镜出现。C处的干燥管内的无水CuSO4变蓝。
1.3.2 基于氧化反应概念建构的实验改进
1.3.2.1 实验装置及其实验步骤
(1)将图1装置中的D部分换成如下的装置(见图2),前面装置不变。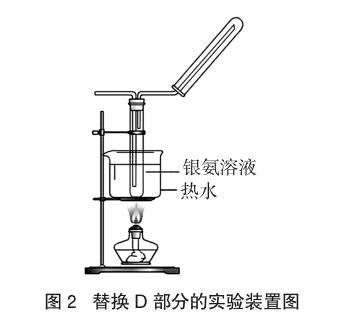
(2)重复1.3.1.1(2)的方法。
(3)将A产生的乙醇蒸气直接通入C,点燃C处的酒精灯加热,并用小试管在D装置的出口处收集排出的气体,检验。
1.3.2.2 实验现象
将乙醇的蒸气通入铜丝时,能观察到铜丝持续保持亮红色,具支试管的中上部出现银镜,同时用小试管收集气体,待冷却后移近火焰能听到爆鸣声,表明有氢气生成。C中的无水CuSO4粉末的颜色未发生改变。
2 实验及教学运用探讨
(1)本实验装置简单易于搭建,同时将制备和物质检验实验合二为一,节省了实验时间,有利于教师的课堂教学演示以及学生的分组实验。
(4)该改进实验中乙醛通过银镜反应来进行检验,如果溶液扰动过大生成的银不利于在试管壁上聚集,因此在通气的时候不宜过快,以致银镜在试管的底部难以形成。在酒精灯加热时C处的催化剂温度需保持在300℃左右。
参考文献:
[1]宋心琦主编.普通高中课程标准实验教科书·化学2[M].北京:人民教育出版社,2004:68.
[2]何家忠.乙醇氧化制乙醛的实验改进[J].安庆师范学院学报(自然科学版),1998,4(3):113~114.
[3]肖锡均.乙醇氧化制乙醛的探讨[J].江苏教育,1987,(3):45.
[4]秦自云.乙醇氧化制乙醛实验的改进[J].化学教学,1988,(1):22.
[5][14]韦艳月.乙醛的制备及性质实验的改进[J].化学教学,2011,(4):44~45.
[6][15]左宏柱.乙醇催化氧化制乙醛的实验[J].化学教学,1985,(1):22~23.
[7]李周平,张乐伟.乙醇的催化氧化实验改进[J].化学教育,2009,(11):71.
[8]凌云清.乙醇氧化制乙醛实验的改进[J].教学仪器与实验,1990,(1):27.
[9]朱国英.乙醇氧化制乙醛实验的改进[J].教学仪器与实验,1986,2(4):40.
[10]李玉萍.乙醇催化氧化制乙醛的设计[J].实验教学与仪器,1996,(2):34.
[11]孙克福.乙醇氧化制乙醛的方法之一[J].化学教育,1985,(1):34~35.
[12]李鐘寿.乙醇氧化制乙醛实验的改进[J].化学教学,1992,(2):21~22.
[13]詹晓渊.乙醇氧化制乙醛实验装置的改进[J].化学教育,1996,(9):34.
[16]赵立国,齐俊林.乙醇催化氧化生成乙醛实验的改进[J].中国教育技术装备,2011,2(6):111.
[17]胡崇安,丁伟.乙醇催化氧化实验的改进[J].化学教育,2011,(12):71~79.
[18]邢瑞斌,刘贞花. 乙醇氧化生成乙醛实验的改进[J]. 实验教学与仪器,2005,(7~8):33.
[19][20] Burbaum JJ,Knowles J R.Internal Thermodynamics of Enzymes Determined by Equilibrium Quench:Values of Kint for Enolase and Creatine Kinase [J]. Biochemistry,1989,(28):9306~9317.

