铜锌原电池作为原电池基本模型的局限及其突破
吴晗清+张娟+赵冬青
摘要:铜锌原电池作为学生学习原电池的基本模型,不具备原电池工作原理的普适性,从而导致师生对原电池的理解存在诸多困境。对北京市某示范高中的158名高一学生进行测试发现:绝大部分学生认为“电极材料必然活泼性不同”,“电极材料的不同是产生电势差的本质原因”,学生对原电池工作原理的理解局限于铜锌原电池模型。基于此,构建了原电池认知的通用模型,并提出相应的教学建议。
关键词:铜锌原电池;原电池模型;局限性;教学建议;化学教学
文章编号:1005–6629(2017)1–0016–05 中图分类号:G633.8 文献标识码:B
“原电池”是高中化学的核心概念,也是电化学的基础,与生产、生活有着密切联系。对于这部分学习,不仅要基于相关物质的性质、氧化还原反应、电解质、离子反应、能量变化等知识的综合理解和运用[1],还涉及物理学中电流产生的原因,电势差等知识。初学阶段,就要求学生能够对原电池的宏观现象进行微观、抽象的解释;随着学习的深入,原电池的种类越来越多,涉及的理论也更加抽象。在实际教学中,铜锌原电池常作为学生对原电池的第一认知模型,认为“原电池由活泼性不同的电极材料、电解质溶液、导线构成”(负极反应为Zn-2e-=Zn2+;正極反应H++2e-=H2),这极易引发学生对于原电池模型及其工作原理的错误理解。例如,学生通常认为两极一定为活泼性不同的材料,而较活泼的材料必为负极。甚至有学生认为电极材料的差异是原电池产生电势差的本质原因。由此可见,学生对于原电池模型及其工作原理的理解存在大量的迷思概念。笔者通过实证研究的方式调查学生对于电极材料、电流产生原因、工作原理等内容的理解,分析学生对于原电池模型及工作原理理解的症结所在。笔者尝试建构有助于学生对于原电池工作原理深入理解的通用模型,并提出相应的教学建议,以期为完善原电池内容的教学现状带来教益。
1 铜锌原电池作为原电池基本模型的局限性
1.1 不具备原电池工作原理的普适性
铜锌原电池相对简单,新旧教材和大部分的教学也都将其作为学生对原电池的第一认识模型,这种由浅入深的教学方式不可否认存在一定的优点,但同时也对于学生错误概念的产生埋下了隐患。
首先,铜锌原电池的两个电极材料不同,但并非所有的原电池都要求两个不同的电极材料,比如燃料电池。其次,大都认为电势差是由两个不同的电极材料产生。由于锌的失电子能力比铜的强,导致锌的周围电子相对富集。金属的性质越活泼其电极电势就越低,当连接两个电极时,电子就从电势低的锌这一极向电势高的铜这一极移动[2]。但电势差的产生绝非仅来自两个不同的电极材料,还可以由氧化还原反应的两个半反应电对以及溶液中电荷的不均匀分布产生。比如氢氧燃料电池的两个电极材料相同,其液接电势一样,此时提供电势差的是氢气和氧气发生氧化还原反应的两个半反应电对[3]。溶液中电荷的不均匀分布引起阴、阳离子的定向移动。
再者,较活泼的锌做负极,较不活泼的铜做正极。学生在大量题海训练时,如果学生没有掌握原电池的本质,往往会认为较活泼的一极必是负极,而忽略离子导体的影响。比如铁铜做电极材料,电解质溶液分别为稀硫酸和浓硫酸的两个原电池,总的氧化还原反应不同,正负极也恰好相反。因为,前者是铁和稀硫酸的反应,铁是负极;后者是铜和浓硫酸的反应,铁则成了正极。
此外,锌这一极既做载体又参与电极反应,而铜这一极仅充当载体。因此学生往往认为负极的电极材料就一定参加电极反应,而正极材料就一定不能参加。事实上,对于原电池来说,如果氧化剂和还原剂可以充当电极材料则优先考虑;若不能,再考虑其他的材料,但选择的电极材料不能影响总反应。
1.2 导致师生对原电池工作原理的认知困境
近年来原电池相关的考题越来越灵活,原电池也更加的抽象。在此情境下,如何让学生对原电池的原理有更深层次的认识,能够促进学生思维的多元发展,自主建构原电池的通用模型,就显得尤为重要。
首先,教材以铜锌原电池引入,导致各种参考用书及教辅资料大都在铜锌原电池的基础上总结原电池的构成条件:即两个活泼性不同的金属或者金属与可导电的其他物质;电解质溶液;闭合回路;自发进行的氧化还原反应。但当学生学习氢氧燃料电池时就会产生困惑,它为何是两个相同的电极材料,一些师生错误地将其当作原电池中的特例。
其次,学生学习铜锌原电池的一大障碍是难以理解电子为何从锌流向铜,使得氧化反应和还原反应分别在两极上发生。多数教师归因于锌的活泼性强于铜,从而导致学生认为电子的移动需要有两个活性不同的电极。事实上,这里涉及电势差产生的最根本的原因,即氧化还原反应的两个半反应电对之间的电势不同。
此外,铜锌原电池仅是众多原电池中的一种,师生易将其作为原电池的“标本”,从而产生错误的认知。比如电极材料是否发生反应,并非都像铜锌原电池一样,要求一极参加反应而一极不反应,还可以两个电极材料均参与反应,也可以均不参与反应。
2 学生对原电池理解的实证研究
为了进一步了解课堂观察与访谈得到的原电池教学困境,笔者针对北京市某示范高中高一实验班的158名学生进行纸笔测试,收回有效测试卷156份,有效率为98.7%。问题主要涉及三个方面:学生对电极材料的理解、对原电池反应的理解、对原电池工作原理的理解。为了保证研究的有效性,该测试在集中的时间段内进行。
2.1 学生对电极材料的理解:大部分学生错误地认为“电极材料必然活泼性不同”
为了考察学生对电极材料的理解,笔者设计了“原电池中一定是较活泼的电极做负极”、“原电池中两个电极材料一定是活泼性不同的”两道题,让学生进行判断并解释说明。具体结果如表1所示。
从表1可以看出,有75.6%的学生能正确判断“在原电池中不一定是较活泼的电极做负极”,通过原因分析发现,学生的解释可以分为三个层面。其一,凭感觉作判断,没有提供任何合理的解释,这类学生较少。其二,多数学生以举反例的方式做判断。有55%的学生将燃料电池作为反例,认为“两个电极可以是一样的,如碳棒”;另有15%的学生认为较不活泼金属也可以作负极,比如Zn-Al-浓HNO3构成的原电池。其三,通过分析原电池的本质得出正确结论,仅占3.1%。这部分学生明确地指出“只要看氧化还原反应中哪一极发生氧化反应,其就做负极”。
由于绝大部分学生并未从本质的角度来理解,有71.8%的学生坚定地认为“原电池的两个电极材料一定是活泼性不同的”,其理由是“要想发生电子的转移,电极必须不同”。
2.2 学生对电流产生原因的理解:大部分学生不能认识原电池中电势差产生的本质原因
为了考察学生对原电池反应的理解,笔者设计了以下问题:从电子移动的角度分析“原电池中的氧化还原反应为何在两极发生”,从离子在离子导体中移动的角度分析“原电池中阴、阳离子分别向哪一极移动”,并解释说明。
学生大都能准确地说出:电子是由负极出发经过导线流向正极,阴离子往负极移动,阳离子往正极移动。但对于电子为何这样移动,少数学生能从电势差的角度分析,但对于电势差的理解局限于不同的电极材料产生的电极电势不同;仅有极个别学生认为“电极材料既可做电极反应物,又可做反应的载体,比如氢氧燃料电池”,能认识到电势差产生的最根本原因即氧化还原反应的两个半反应电对之间的电势不同。
2.3 学生对原电池工作原理的理解:局限于铜锌原电池模型
通过测试发现,很少有学生能分清楚电极材料、电极反应、电解质溶液三者之间的关系。多数学生依据铜锌原电池去分析它们之间的关系,局限地认为:负极电极材料一定和电解质溶液发生氧化反应,变成阳离子进入溶液,正极则是溶液中的离子得电子发生还原反应,而且必须用导线连接形成闭合回路。具体分析见表2。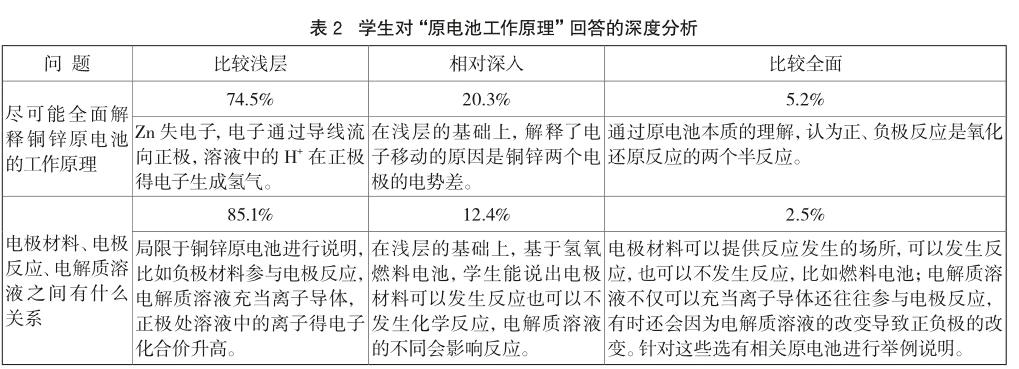
原电池的内容相对抽象,理论性和综合性又强,学生只能通过逻辑推理和想象,无法通过直观的实验现象来理解原电池的工作原理,学生从微观上理解微粒的移动和所发生的反应。
3 促进学生有效认知原电池的教学建议
课程标准对原电池的教学提出了以下的要求[4]:能够举例说明化学能与电能的关系;经历化学能转化为电能的探究过程,了解原电池的工作原理,能写出电极反应和电池反应方程式。然而通过理论分析及实证研究发现学生对原电池的理解很大程度上受到铜锌原电池的干扰。教材中缺少对电极的说明,学生易将电极材料和电极反应物混为一谈,如果把铜锌原电池作为第一认知模型,并由此总结原电池的构成条件,容易导致学生产生一些错误的认知。
因此教师如何帮助学生建构原电池通用模型就显得非常重要,只用铜锌原电池去建构学生对原电池的认知模型显然是不够的,甚至是有害的。笔者基于对原电池系统的整体分析,设计了“两个电极材料均不参与反应”、“一个电极材料参与反应”、“两个电极均参与反应”的原电池认知教学方案。具体的典型案例见表3。
在教學中首先通过火力发电效率低,引入火力发电的实质是想通过化石燃料燃烧最终实现向电能的转化,由此引发学生思考:化学能通过什么途径释放出来?又如何能将化学能转化为电能?通过问题线索引发学生思考,引导学生逐步认识氧化还原反应与电荷移动的关系。在深入分析的基础上得出,化学能向电能的转化需要有电子的定向移动,需要提供电子的装置和接受电子的装置。如何实现氧化还原反应中电子的定向移动,引出还原剂提供电子,氧化剂接收电子,两极之间连接电子导体(如导线或者直接接触)以及离子导体(电解质溶液或熔融电解质等)从而形成闭合的回路。学生在思考中逐步构建基本模型:两极的反应物、两极的电极材料、电子导体、离子导体。基于此,在依次分析“两个电极材料均不参与反应”的氢氧燃料电池、“一个电极材料参与反应”的铜锌原电池、“两个电极均参与反应”的铅蓄电池后,接下来从电极材料、电极反应、原电池工作原理三个方面分别阐释。
3.1 对电极材料和电极反应物的探讨
如上所述,根据电极材料是否参加反应,可分为三类。首先讨论氢氧燃料电池,引导学生分析其中的总反应,确定还原剂和氧化剂。装置的作用使得反应不再需要点燃引发就可以直接进行,其中电极反应物分别是通入的H2和O2,电极材料是两个相同的石墨。氢气做还原剂发生氧化反应,氧气做氧化剂发生还原反应。两个相同的电极材料提供反应发生的场所,但均不参加反应。其次,对铜锌原电池进行分析,在思考总反应的基础上分析电极材料,锌既做电极反应物,又提供反应场所;铜与稀硫酸不反应,仅充当载体。最后,分析“两个电极均参与反应”的铅蓄电池,在给出其装置和总反应方程式的基础上,探讨两个电极材料均参与反应,铅在负极被氧化,既做电极材料,又参与反应;同样氧化铅在正极被还原,既做电极材料,又参与反应。
3.2 对电流产生原因的探究
在教师提供电势差资料的基础上,学生分析三种类型原电池的电势差产生的来源,引导学生分析电子导体中的电子移动及离子导体中离子的运动。首先对氢氧燃料电池进一步分析,两个电极材料相同,它们之间不存在电势差。但是通入的氢气在界面上有发生氧化反应的趋势、电子相对富集;通过氧气的这一极有得电子的趋势,使得电子从电势低的负极通过导线向正极移动。电子在输送的过程中,氢气不断地失电子,不断有氢离子进入溶液,氧气这一极则源源不断地得到电子发生氧化反应。


3.3 对原电池工作原理的整体把握
整个设计是基于电极材料是否参与电极反应,原电池是自发的氧化还原反应提供电势差,使得电流得以产生而展开。在对三类原电池案例分析的基础上,开展学生活动,以粘贴纸的形式更换电极材料、电极反应物,以及电子导体、离子导体的方式,让学生明白无论什么类型的原电池,其构成的基本要素必须有:两个电极材料、两个电极反应物、离子导体和电子导体[6],只不过同一极的电极材料和电极反应物可以相同也可以不同,从而建立原电池认知的通用模型,以期消除以铜锌原电池作为第一认知模型带来的教学困境,具体如图1所示。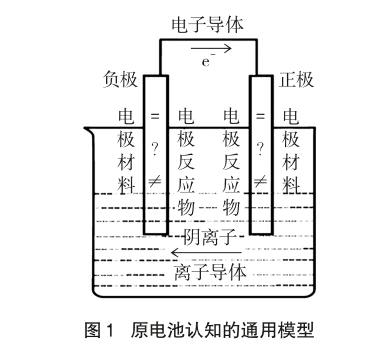
在上述通用模型中,一方面以“问号”引发学生对原电池的电极材料与电极反应物之间的关系进行思考。对于铅蓄电池,电极反应物即电极材料本身,此时电极材料Pb和PbO2均“=”电极反应物。有些则不然,如氢氧燃料电池的两个铂电极均“≠”电极反应物H2和O2。因此,通用模型以“电极材料”、“等号”、“不等号”等内容替换铜锌原电池中的“铜”和“锌”,在一定程度上增强了原电池模型的普适性。另一方面,电子和离子在电势差的作用下,定向移动至原电池的两极。图中“箭头”表示电子导体中电子由负极移到正极,离子导体中陰离子向负极移动,阳离子向正极移动。自发进行的氧化还原反应是产生电势差推动电子或离子定向移动的本质原因。在铜锌原电池模型中,学生无法对电势差究竟产生于电极材料还是电极反应做出有效判断。而在通用模型中,“问号”、“电极材料”、“等号”、“不等号”、“箭头”等符号将抽象的概念原理进行形象化,让学生有效地建构了对“原电池”的深度认知。
参考文献:
[1]姜丽莉.高中生原电池错误概念的诊断及教学对策[J].教学仪器与实验,2015,(31):3~6.
[2]周庆华.对原电池工作原理的探讨[J].化学教学,2016,(1):23~25.
[3]张玲,陈磊磊.有关原电池的概念及原理[J].化学教学,2010,(4):1~4.
[4]中华人民共和国教育部制定.普通高中化学课程标准(实验)[S]北京:人民教育出版社,2003:9~20.
[5]吴晗清.高中生科学素养模型的建构及其实证研究[J].上海教育科研,2016,(5):33.
[6]徐敏.深入原电池原理本质,促进学生观念和能力的发展[J].化学教育,2015,36(19):27~31.

