猪流行性腹泻病毒分离鉴定及其灭活疫苗免疫保护效果研究
代洪波,岳丰雄,徐宏军,魏胜男,高 鹏,胡来根
(成都天邦生物制品有限公司,四川成都 610100)
猪流行性腹泻病毒分离鉴定及其灭活疫苗免疫保护效果研究
代洪波,岳丰雄,徐宏军,魏胜男,高 鹏,胡来根
(成都天邦生物制品有限公司,四川成都 610100)
为筛选能用于猪流行性腹泻病毒(PEDV)疫苗研发的流行毒株,收集PEDV阳性病料,以Vero细胞进行病毒分离试验,并对分离毒株进行外源病毒检测、病毒培养特性研究、仔猪毒力试验及免疫效力试验等。9份PEDV阳性病料共分离到3株病毒,分别命名为PEDV-SC12、PEDV-JS12、PEDV-JX12。其中PEDV-SC12株存在支原体污染;PEDV-JS12株与PEDV-JX12株均能被PEDV特异性阳性血清中和;PEDV-JS12株能在Vero细胞上增殖并产生细胞病变,但适应细胞45代以后病毒培养效价仍然偏低;PEDV-JX12滴度能维持在106.0TCID50/mL以上。PEDV-JX12株毒力试验显示,该分离株能够通过人工感染复制出腹泻病例,并能从发病动物体内检测到感染的病毒。免疫攻毒保护试验显示,以PEDV-JX12株制备的灭活疫苗免疫母猪,对所产仔猪攻毒后免疫组6.25%(1/16)发病,对照组100%(8/8)发病。说明PEDV-JX12株能够适应细胞培养,免疫接种母猪能给仔猪提供有效保护,可以用于PEDV流行毒株的疫苗研发。
猪流行性腹泻病毒;分离鉴定;毒力试验;免疫效力试验
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的急性、高度传染性的肠道疾病,临床上主要以严重呕吐、水样腹泻及脱水为特征,感染仔猪病死率极高。1971年,猪病毒性腹泻病毒首先在英国被报道,主要引起架子猪和育肥猪急性腹泻,当时被称为“流行性病毒性腹泻”。1977年首次报道该病可侵害哺乳仔猪,症状与猪传染性胃肠炎相似,在排除了猪传染性胃肠炎病毒和其他病原以后,将其命名为2型腹泻,以与早期发现的1型腹泻区别,随后分离得到该病的病原,命名为CV777[1-2]。1982年统一命名为“猪流行性腹泻”。之后该病在欧洲、东亚、东南亚、北美洲等的许多国家均有报道[3-5]。
PEDV属冠状病毒,只有1个血清型,可以在Vero细胞上增殖,但小牛血清会抑制PEDV与细胞受体的结合。在培养液中添加一定量的胰酶,可以促进PEDV在Vero上产生明显的细胞病变[6]。2010年以来,中国暴发大规模猪腹泻疫情,证实主要病原为PEDV。近期流行的PEDV毒株与早期我国流行的PEDV相比产生了明显的变异[7],疫情之初通过提高CV777疫苗毒株的病毒含量制备灭活疫苗,可以给猪群提供一定的免疫保护。本试验利用全国收集的多份PEDV阳性病料进行病原分离鉴定,并开展毒力与保护效力研究,旨在筛选能够用于PEDV疫苗研发的流行毒株。
1 材料与方法
1.1 材料
1.1.1 主要试剂 PEDV胶体金检测试剂盒,安捷公司产品;病毒基因组RNA提取试剂盒、病毒基因组DNA提取试剂盒、2×TaqPCR Master Mix、DNA Marker DL 2 000等,天根生物公司产品;DMEM细胞培养液、新生牛血清等,Gibco公司产品;0.22 μm滤器,默克公司产品;Vero细胞、PEDV特异性阳性血清(中和效价大于1∶16)由成都天邦生物制品有限公司提供。
1.1.2 试验用动物 PEDV非免疫母猪所产3日龄仔猪12头,PEDV抗原抗体阴性妊娠母猪4头,筛选自成都周边养殖场。
1.2 方法
1.2.1 病毒分离 从四川、江西、湖北、江苏、广西等地共收集PEDV抗原阳性病料9份,将肠系膜淋巴结与小肠黏膜加液氮混合研磨,组织悬液冻融3次后8 000 r/min离心10 min,取上清加入双抗至终浓度1 000 IU/mL处理过夜;接种单层Vero细胞,加含胰酶(3 μg/mL)的无血清DMEM细胞培养液,置37℃二氧化碳培养箱培养2 d~3 d,观察细胞病变。冻融细胞收集细胞培养液即病毒液进行传代培养。1.2.2 病毒核酸检测 以病毒基因组RNA提取试剂盒提取病毒液RNA,以猪流行性腹泻病毒(PEDV)S基因RT-PCR检测方法进行PEDV核酸检测,目的片段大小为651 bp,引物序列如下:PEDV-S1:5′-TTCTGAGTCACGAACAGCCA-3′;PEDV-S2:5′-CATATGCAGCCTGCTCTGAA-3′。引物由宝生物工程(大连)有限公司合成。
分别以本实验室建立的猪瘟病毒、猪繁殖与呼吸综合征病毒、猪传染性胃肠炎病毒及猪轮状病毒的RT-PCR检测方法进行病原检测。以病毒基因组DNA提取试剂盒提取病毒液DNA,进行伪狂犬病毒、猪圆环病毒2型、猪细小病毒及支原体PCR检测。1.2.3 细胞适应性试验 病毒分离株在Vero细胞上传代至产生稳定细胞病变后,继续在Vero细胞上进行细胞传代适应,选取不同代次的病毒培养液,以96孔细胞培养板培养的Vero细胞进行病毒TCID50测定。
1.2.4 病毒中和试验 常规方法消化Vero细胞,制备2×105个/mL的细胞悬液接种24孔细胞培养板,待24孔板长成单层细胞后,以无血清DMEM培养液洗涤细胞1次~2次备用。将分离的病毒液稀释至103.0TCID50/mL,与等体积灭活后的PEDV特异性阳性血清混合,置37℃水浴中和1 h,同时设立病毒阳性对照与血清对照。中和完成后将样品接种到洗涤后的24孔细胞培养板中,每个样品接种4孔,每孔接种0.2 mL,设立正常细胞对照孔,加样完成后置37℃二氧化碳培养箱中吸附1 h。吸附完成后,以无血清DMEM培养液洗涤2次~3次,补加含胰酶无血清MEME培养液,置37℃二氧化碳培养箱中培养3 d~5 d,观察并记录细胞病变孔数。
1.2.5 仔猪毒力试验 选取PEDV非免疫母猪所产3日龄仔猪12头,随机分为3组,每组4头,在隔离器内离乳饲养。试验1组,每头口服接种分离株F8代病毒液1 mL;试验2组,每头口服接种分离株F10代病毒液1 mL;对照组口服接种含胰酶无血清DMEM培养液1 mL。接种完成后连续观察5 d,记录试验猪发病信息,试验分组信息见表1。
1.2.6 PEDV灭活疫苗制备 以Vero细胞繁殖分离的PEDV,制备病毒含量高于106.0TCID50/mL的PEDV半成品抗原,以5 mmol/L的BEI灭活24 h制备PEDV灭活抗原并进行灭活检验。灭活检验合格后,以铝胶佐剂制备PEDV灭活疫苗。
1.2.7 PEDV灭活疫苗免疫攻毒保护试验 筛选PEDV抗原抗体阴性妊娠母猪4头,随机分为2组,免疫组2头母猪分别在产前40 d与产前15 d,分别进行一次后海穴PEDV灭活疫苗接种,每头4 mL;对照组2头母猪后海穴接种DMEM培养液,每头4 mL。母猪产仔以后,将母猪与仔猪回购至成都天邦试验动物中心进行攻毒保护试验,免疫组2头母猪各选8头仔猪进行攻毒试验,对照组选用其中1头母猪及8头仔猪进行攻毒试验,3日龄口服接种105.0TCID50的PEDV F8代病毒液。攻毒完成后连续观察5 d,记录试验仔猪发病信息,试验分组与免疫攻毒信息见表2。

表1 仔猪毒力试验分组信息

表2 PEDV灭活疫苗免疫攻毒保护试验信息
1.2.8 试验猪腹泻发病要求 PEDV攻毒试验猪发病要求:所有试验猪攻毒后连续观察5 d,每隔6 h观察记录1次是否出现腹泻症状,出现腹泻后36 h剖解试验猪观察肠道病变;剖检攻毒期内死亡仔猪,观察期结束后剖解所有存活仔猪,观察肠道病变:①观察期内有3次及以上腹泻;②试验猪剖解观察,肠道充气,肠壁变薄;③腹泻试验猪肠内容物PEDV胶体金检测为阳性。同时符合以上3个条件时判定为腹泻发病。
2 结果
2.1 病毒分离结果
从9份PEDV阳性病料中共成功分离到3株病毒,分别命名为PEDV-SC12、PEDV-JS12、PEDV-JX12。PEDC-SC12株传至F7代以后可见细胞病变,PEDV-JS12株连续传至F10代以后可见稳定的细胞病变,PEDV-JX12株传至F8代以后可见典型细胞病变。病毒接种细胞后36 h左右,细胞开始出现原位死亡(图1);接毒后48 h左右,90%以上细胞产生细胞病变。
2.2 病毒核酸检测结果
分离株产生细胞病变前每隔2代进行一次PEDV核酸检测,结果显示9分样品中有4份样品在F4代时检测不到PEDV核酸,有2份样品在F6代时检测不到PEDV核酸。PEDV-SC12株在F7代可见细胞病变,但在PEDV-SC12病毒液中检测到支原体污染。PEDV-JS12株与PEDV-JX12株在出现细胞病变以后,选取连续两代的病毒液进行病毒核酸检测,仅PEDV核酸检测为阳性,无外源病毒与支原体污染。分离毒株病毒核酸检测结果见表3;PEDV核酸检测结果见图2。

A.Vero 细胞对照; B.Vero细胞病变

毒株Strains代次Generation检测项目TestitemPEDVCSFVPRRSVTGEVPRoVPRVPCV2PPVMycoplasmaPEDV⁃SC12F7+-------+F8+-------+PEDV⁃JS12F10+--------F11+--------PEDV⁃JX12F8+--------F9+--------
注:“+”表示阳性;“-”表示阴性。
Note:“+”means positive;“-”means negative.
2.3 病毒细胞适应性试验结果
PEDV-JS12株与PEDV-JX12株产生稳定细胞病变以后,连续传代至F45代,每隔5代进行1次病毒含量测定。结果显示,PEDV-JS12株连续传代至F45代,病毒含量维持在104.5~5.0TCID50/mL左右;PEDV-JX12株从F35代至F45代,病毒含量维持在106.0TCID50/mL以上。PEDV分离株不同代次病毒含量测定结果见图3。
2.4 病毒中和试验结果
选用PEDV-JS12株与PEDV-JX12株的F10代与F12代病毒液进行病毒微量中和试验,结果显示,2个分离株F10代病毒液与F12代病毒液接种所有细胞孔均产生细胞病变,血清对照与细胞对照孔未见细胞病变,F10代中和样品与F12代中和样品接种的细胞孔均未见细胞病变,说明分离毒株能够被PEDV特异性阳性血清完全中和。试验结果见表4。

M.DNA标准DL 2 000;N.阴性对照;P.阳性对照;SC7.PEDV-SC12 F7;SC8.PEDV-SC12 F8;JS10.PEDV-JS12 F10;JS11.PEDV-JS12 F11;JX8.PEDV-JX12 F8;JX9.PEDV-JX12 F9
M.DNA Marker DL 2 000; N.Ngetive control; P.Positive control; SC7.PEDV-SC12 F7; SC8.PEDV-SC12 F8; JS10.PEDV-JS12 F10; JS11.PEDV-JS12 F11; JX8.PEDV-JX12 F8; JX9.PEDV-JX12 F9
图2 PEDV核酸检测电泳图
Fig.2 PCR detection results of PEDV

图3 PEDV分离株不同代次病毒含量测定结果
2.5 仔猪毒力试验结果
以PEDV-JX12株F8代与F10代病毒液进行动物回归试验,结果显示,F8代与F10代病毒液分别接种4头试验仔猪,4头仔猪表现均符合腹泻发病要求;对照组4头仔猪口服DMEM培养液,均未发病。动物回归试验结果见表5;仔猪剖检图片见图4。
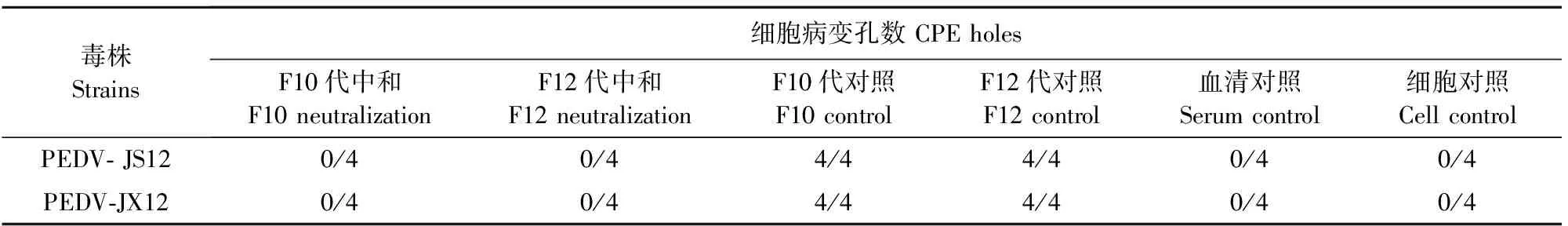
表4 病毒中和试验结果
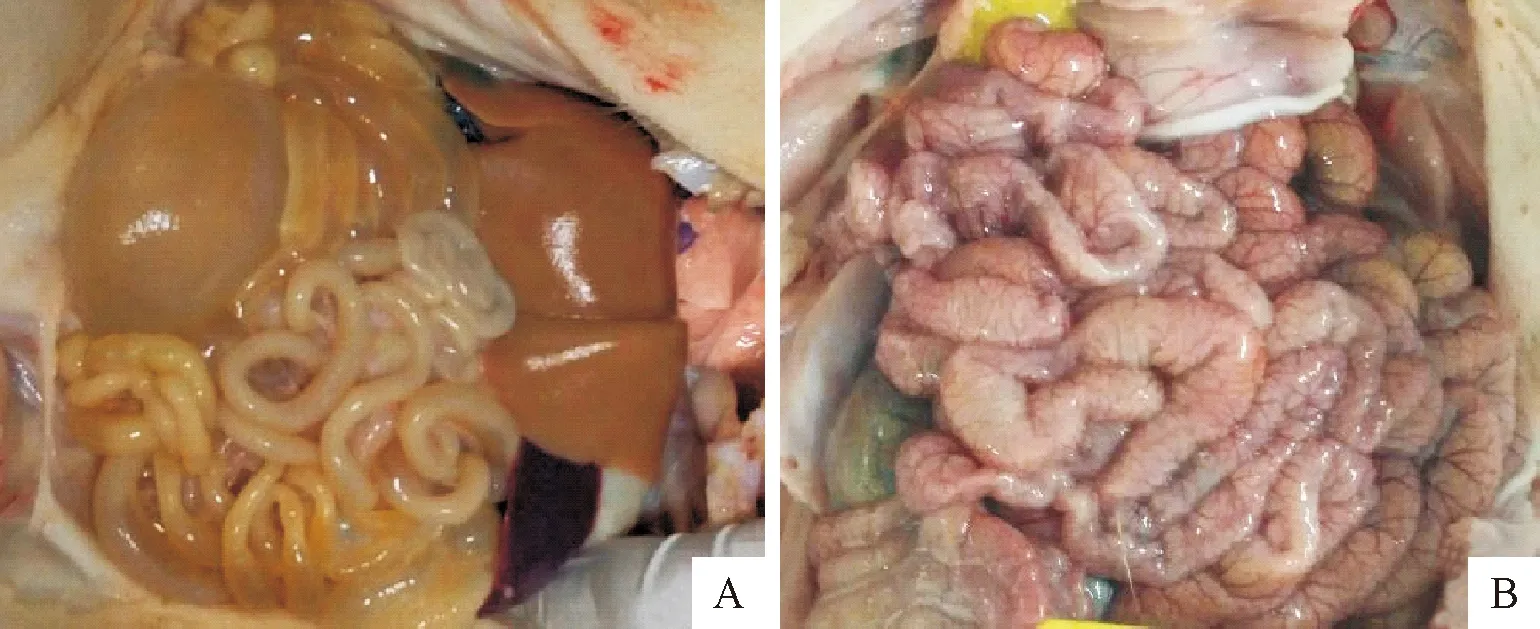
A.攻毒仔猪肠道病变;B.对照组仔猪肠道
2.6 PEDV灭活疫苗免疫攻毒保护试验结果
以PEDV-JX12株制备灭活疫苗免疫母猪,以免疫母猪生产仔猪进行攻毒保护试验。结果显示,免疫组M-1母猪所产仔猪攻毒后,有1头出现腹泻症状,12.5%(1/8)发病,87.5%(7/8)保护;免疫组M-2母猪所产仔猪攻毒后,无(0/8)发病,100%(8/8)保护;对照组全部(8/8)发病,37.5%(3/8)死亡。PEDV灭活疫苗免疫攻毒保护试验结果见表6。

表6 PEDV灭活疫苗免疫攻毒保护试验结果
3 讨论
2010年以来,中国暴发大范围的仔猪腹泻疫情,主要表现为产房仔猪高发病率、高病死率,给我国养猪业造成严重的经济损失。通过对全国范围内的几百个养殖场进行病原检测证实,引起本次疫情的主要病原为PEDV,并且病原产生了较大的变异,母猪免疫接种PEDV CV777灭活疫苗后,仔猪发病率和死亡率低于未免疫猪群,但不能提供完全保护。何启盖等分别对我国不同省份的数10个猪场进行PEDV病原监测发现,2010年以后,流行的PEDV毒株与我国早期分离病毒的S基因序列同源性为95%左右,与我国广泛使用的CV777疫苗毒同源性为93%左右[8-9]。近期流行毒株与我国早期流行毒株的S基因氨基酸序列比较发现,部分氨基酸位点发生突变,破坏了部分糖基化位点,并产生部分新的糖基化位点,同时部分中和表位关键性氨基酸位点也存在突变[10]。
本次试验从全国不同省份采集的9份PEDV阳性病料中分离到3株PEDV,然而PEDV-SC12株存在支原体污染,PEDV-JS12株与PEDV-JX12株无外源污染,并且能够在Vero细胞上产生稳定的细胞病变,可以用作疫苗研发的备选毒株。然而疫苗生产中需要考虑半成品的效价,PEDV-JS12株在Vero细胞连续传代至F45代,病毒含量维持在104.5~5.0TCID50/mL左右,而PEDV-JX12株传代至F35代以后,病毒含量维持在106.0TCID50/mL以上,两株病毒相比,PEDV-JX12株更适合疫苗生产。以PEDV-JX12株进行仔猪毒力试验,F8代与F10代接种3日龄仔猪全部发病,能够复制出典型的腹泻病例,可以作为疫苗免疫后检验用的强毒。
PEDV感染主要引起10日龄以内仔猪死亡,如何给仔猪提供有效保护是PEDV疫苗研发的关键。给仔猪接种疫苗进行主动免疫,难以在短时间内形成有效保护。因此,只能通过疫苗免疫母猪群,使仔猪获得被动保护。母猪通过乳汁将分泌性IgA(SIgA)与IgG抗体传递给仔猪,分泌性IgA具有分泌片结构,可以防止抗体在胃肠道内降解,而且PEDV在肠道内的免疫保护主要依靠黏膜,因此提高母猪乳汁中的SIgA水平,就能够提高对仔猪群的免疫保护。通过肌肉注射难以激活母猪的肠道黏膜免疫,我国主要通过后海穴注射进行PEDV的疫苗免疫,后海穴分为皮下区和直肠肛管外膜区,在直肠肛管外膜区分布有大量的肠相关淋巴组织(GALT),后海穴免疫可以直接将抗原注射到GALT,可以激活黏膜免疫,同时可以避免抗原进入血液循环,造成抗原稀释和抗原降解[11-12]。本试验以PEDV-JX12株制备的灭活疫苗,给PEDV阴性母猪产前免疫2次,对生产仔猪进行攻毒试验。结果显示免疫组6.25%(1/16)发病,对照组全部(8/8)发病,说明该灭活疫苗母猪产前后海穴免疫2次,能够给仔猪群提供较为理想的被动免疫保护。就我国目前的现状来说,发生过腹泻的猪场母猪肠道黏膜免疫已被激活,产生效应B细胞和记忆细胞,再次以PEDV灭活疫苗免疫,记忆细胞迅速被激活,产生高水平的IgA,可以给仔猪群提供更好的免疫保护。未感染过PEDV的猪场及后备猪群,需要通过后海穴免疫刺激黏膜免疫,再通过增加免疫次数的方式,提高母猪群的免疫水平,以便给仔猪提供更好的免疫保护。
[1] 毕 静.猪流行性腹泻病毒AJ1102株的分离、鉴定及其分子进化特征[D].湖北武汉:华中农业大学,2013.
[2] 刘艳成,芦 婷,刘丹丹,等.2010年-2014年猪流行性腹泻病毒S基因遗传进化分析[J].动物医学进展,2015,36(8):28-34.
[3] 张 志,李 炭,王赛赛,等.猪流行性腹泻新毒株的分离与鉴定[J].中国兽医学报,2012,32(10):1423-1428.
[4] Chae C,Kim O,Choi C,et al.Prevalence of porcine epidemic diarrhoea virus and transmissible gastroenteritis virus infection in Korean pigs[J].Vet Rec,2000,147(21):606-608.
[5] Chen J,Wang C,Shi H,et al.Molecular epidemiology of porcine epidemic diarrhea virus in China[J].Arch Virol,2010,155(9):1471-1476.
[6] 林庆燕,陈书琨,孙 洁,等.引起猪腹泻的病毒分离鉴定[J].动物医学进展,2014,35(10):75-79.
[7] Li Z L,Zhu L,Ma J Y,et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field strains in south China[J].Virus Genes,2012,45(1):181-185.
[8] 曹恭貌,张 斌,岳 华,等.四川部分猪场PEDV、TGEV、GARV和PKV感染状况调查[J].动物医学进展,2016,37(1):118-122.
[9] Li W T,Li H,Liu Y B,et al.New variants of porcine epidemic diarrhea virus China in 2011[J].Emerg Infect Dis,2012,8:1350-1353.
[10] Tian Y F,Yu Z J,Cheng K H,et al.Molecular characterization and phylogenetic analysis of new variants of the porcine epidemic diarrhea virus in Gansu,China in 2012 [J].Viruses,2013,5:1991-2004.
[11] 谭会兵.后海穴抗原免疫的免疫增强作用及其机制研究[D].北京:中国协和医科大学,1996.
[12] 卓秀萍,朱 玲,乔小改,等.人工感染猪流行性腹泻病毒的哺乳仔猪的病理学观察[J].中国兽医科学,2015,45(2):202-207.
Isolation and Identification of Porcine Epidemic Diarrhea Virus Epidemic Strain and Study on Its Immune Protection Efficacy of Inactivated Vaccine
DAI Hong-bo,YUE Feng-xiong,XU Hong-jun,WEI Sheng-nan,GAO Peng,HU Lai-gen
(ChengduTecbondBiologicalProductsCo.,Ltd,Chengdu,Sichuan,610100,China)
In order to isolate one porcine epidemic diarrhea virus (PEDV) epidemic strain for vaccine research,the samples infected with PEDV were collected from different provinces of China,viruses were isolated from Vero cells,and went through SN test,RT-PCR and the characteristics of virus culture.3 strains of virus were isolated from 9 PEDV positive samples,named as PEDV-SC12,PEDV-JS12,and PEDV-JX12.The PEDV-SC12 strain was contaminated with mycoplasma.Both PEDV-JS12 and PEDV-JX12 strains can be neutralized by PEDV positive serum,but after being cultured for 45 generations,PEDV-JS12’s titer is much lower than PEDV-JX12’s.The virulence of PEDV-JX12 was tested by challenging piglets,and diarrhea can be observed in the infected piglets.Sows immunized with PEDV-JX12 inactivated vaccine,1/16 can be observed with diarrhea in the immune group,while 8/8 in the control group.The isolated PEDV-JX12 strain can be used as epidemic strain for PEDV vaccine research.
Porcine epidemic diarrhea virus; isolation and identification; virulence test; immune efficacy test
2016-05-31
代洪波(1988-),男,四川德阳人,硕士,主要从事动物传染病病原分子生物学研究。
S852.659.6;S858.28
A
1007-5038(2017)01-0050-06