bta-miR-205和bta-miR-497调控牛病毒性腹泻病毒复制的研究
刘 升,孟露萍,张 辉,付 强,史慧君,陈创夫*
(1.石河子大学动物科技学院,新疆石河子 832000;2.新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
bta-miR-205和bta-miR-497调控牛病毒性腹泻病毒复制的研究
刘 升1,孟露萍1,张 辉1,付 强2,史慧君2,陈创夫1*
(1.石河子大学动物科技学院,新疆石河子 832000;2.新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
为探究bta-miR-205和bta-miR-497对牛病毒性腹泻病毒(BVDV)复制的调控作用,在前期建立BVDV感染MDBK细胞miRNAs差异表达谱的基础上,筛选出表达量显著差异的bta-miR-205和bta-miR-497,通过生物信息学软件预测、荧光素酶报告基因检测等方法鉴定bta-miR-205和bta-miR-497的靶基因。应用RT-qPCR和病毒滴度测定等方法验证bta-miR-205和bta-miR-497对BVDV复制的影响。结果发现,bta-miR-205能显著抑制BVDV的复制,而bta-miR-497显著促进BVDV的复制。研究结果为BVD防控提供了新的思路和依据。
牛病毒性腹泻病毒;复制;bta-miR-205;bta-miR-497
随着集约化养牛产业的发展,由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的以发热、腹泻、黏膜糜烂溃疡、怀孕母牛流产或产畸形胎儿为主要特征的牛病毒性腹泻-黏膜病(Bovine viral diarrhea-mucosal disease,BVD-MD)已成为严重影响养牛业健康发展、造成全球养牛业经济损失的主要病原[1-2]。BVDV还是牛源生物制品(如血清、冻精、胚胎、疫苗等)常在的污染源,严重影响畜牧业生产和科学研究工作[3]。但是由于BVDV与宿主细胞相互作用的分子机制、BVDV持续性感染和免疫抑制的分子机制尚未系统阐明,目前尚无有效的防控技术和手段。欧美等部分国家已开始实施以发现-扑杀为主的根除计划,但这种手段不适用于我国的国情,导致该病在我国广泛流行。
微小RNA(microRNA或miRNA)是一种广泛存在于动物、植物等基因组中的微小非编码RNA[4]。miRNAs调控人类近30%基因的表达,并且参与几乎所有真核生物的生理和病理过程[5]。同时,随着miRNA高通量测序平台日新月异的变化,许多疾病异常表达的miRNAs被陆续发现,靶基因的预测和鉴定成为miRNAs功能研究的一个新切入点。
本研究在基于二代高通量测序建立的BVDV感染MDBK细胞miRNAs差异表达谱(Gene Expression Omnibus数据库登录号GSE61251)的基础上,筛选出表达量显著差异的miRNAs,并应用RT-qPCR和病毒滴度测定等方法验证miRNAs对BVDV复制的影响,为利用miRNAs建立防控BVD的新技术提供理论依据,并为后续的抗病毒研究提供参考。
1 材料与方法
1.1 材料
1.1.1 质粒、细胞与病毒 含BVDV NADL全长cDNA的pACNR/NADL质粒,由美国洛克菲勒大学Charles M Rice友情惠赠;BVDV NADL毒株购自中国兽医药品监察所;HEK-293FT和MDBK细胞均购自中国科学院上海细胞库,并使用含100 mL/L胎牛血清的DMEM高糖培养基培养;大肠埃希菌DH5α,由石河子大学动物疫病防控兵团重点实验室保存;双荧光素酶报告基因分析系统载体pmirGLO,为Promega公司产品。
1.1.2 主要仪器 LightCycler 480型RT-qPCR仪,Roche公司产品;核酸定量仪Nanodrop 2000c、二氧化碳培养箱,Thermo公司产品;DYY-4C型高压双稳电泳仪电源、DYCZ-24A型双垂直电泳仪和DYCP-40C型半干式碳板转印仪,北京六一公司产品;TE2000型荧光倒置显微镜,Nikon公司产品;PowerWave HT型酶标仪,Biotek公司产品;TECAN SUNRISE型酶标仪,TECAN公司产品。
1.1.3 主要试剂 bta-miR-205-Antagomir(bta-miR-205的抑制剂片段)、bta-miR-205-agomir(bta-miR-205的成熟片段)、bta-miR-497-Antagomir(bta-miR-497的抑制剂片段)、bta-miR-497-agomir(bta-miR-497的成熟片段)、Stable negative control(阴性对照)均由上海吉玛制药公司合成;双荧光素酶报告基因检测试剂盒(E1910),Promega公司产品;Lipofectamine 2000,Invitrogen公司产品;DMEM(高糖)培养基、胎牛血清和DMSO,Gibco公司产品;SYBR Green Master Mix试剂盒,Roche公司产品;cDNA合成试剂盒,北京天根生物科技有限公司产品;TRIzol细胞裂解液、TryPLE和NEAA,Life Tec公司产品;General AllGen kit(通用型柱式基因组提取试剂盒)、无内毒素大提质粒试剂盒和琼脂糖凝胶回收试剂盒,康为世纪生物科技有限公司产品;其余分子生物学试剂,上海生工生物工程技术服务有限公司产品。
1.2 方法
1.2.1 靶向BVDV NADL全基因组的miRNA预测 BVDV与丙型肝炎病毒(Hepatitis c virus,HCV)在基因组结构上具有高度相似性,同时靶向于HCV基因组的miRNAs的种类和功能研究报道较为丰富。因此,首先使用Target Scan软件搜索HCV感染人后差异表达的miRNAs,并且在miRBase数据库中找到相应的miRNAs序列;将该miRNAs序列与前期建立的BVDV感染MDBK细胞miRNAs差异表达谱进行比对分析,寻找与牛同源的miRNAs序列;然后使用TargetScan、miRanda等生物信息学软件预测这些miRNAs在BVDV NADL基因组中的靶位点。
1.2.2 双荧光素酶报告基因载体的构建 根据GenBank数据库中BVDV NADL基因组序列(登录号NC-001461),用Primer premier 5.0软件设计扩增miRNAs靶向于NS5B的3′端序列及RT-qPCR检测E0基因的引物,扩增靶向于NS5B 3′端基因的引物序列见表1(划线部分为酶切位点)。
以pACNR/NADL质粒为模板,PCR扩增NS5B的3′端基因序列,PCR体系如表2所示。PCR条件为:95℃ 5 min;95℃ 40 s,64℃ 40 s,72℃ 30 s,35个循环;72℃ 10 min。
使用琼脂糖凝胶电泳检测PCR扩增结果并回收目的基因;将回收产物与pMD 19-T载体进行过夜连接反应;连接产物热激转化至大肠埃希菌DH5α感受态细胞中;涂布于含氨苄青霉素的固体LB上,倒置于37℃恒温箱中培养12 h~16 h;挑取单克隆菌落置于含氨苄青霉素的液体LB中扩大培养4 h后,采用PCR方法鉴定单克隆菌落;将阳性的单克隆菌液送至上海生工生物工程技术服务有限公司进行测序鉴定。

表1 扩增NS5B 3′端基因的引物

表2 PCR反应体系
将测序正确的菌液接种到20.0 mL含氨苄青霉素的液体LB中,摇菌培养12 h~16 h后,按照质粒小提试剂盒说明书提取重组质粒pMD19-T-NS5B-3′ end-1和pMD19-T-NS5B-3′ end-2;用核酸定量仪测定质粒浓度,用XhoⅠ和SalⅠ酶切重组质粒及双荧光素酶报告基因分析系统载体pmirGLO,酶切体系见表3,37℃水浴酶切4 h。

表3 双酶切反应体系
用琼脂糖凝胶电泳检测酶切产物并使用凝胶回收试剂盒回收酶切产物;按照表4反应体系进行酶切产物的连接;连接反应过夜后,将连接产物转化至大肠埃希菌DH5α感受态细胞中,并涂布到含氨苄青霉素的固体LB,静置培养后挑取单克隆菌落、PCR鉴定、测序鉴定等步骤同上。
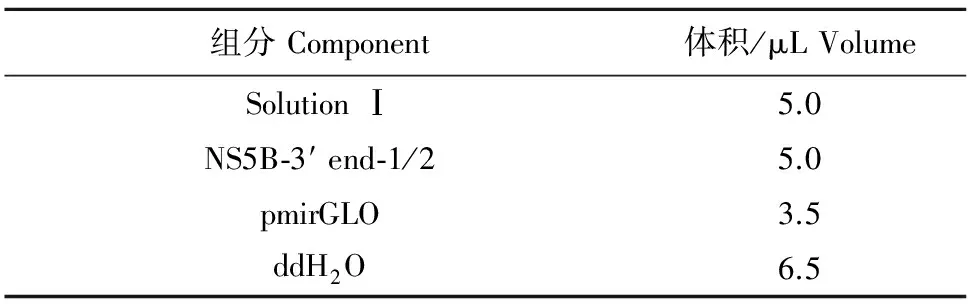
表4 连接体系
1.2.3 双荧光素酶报告基因分析鉴定bta-miR-205和bta-miR-497的靶基因 按照无毒素质粒大提试剂盒说明书提取重组质粒pmirGLO-NS5B-3′ end-1和pmirGLO-NS5B-3′ end-2;用核酸定量仪测量重组质粒的浓度和纯度;按照1×104个/孔的密度将HEK-293FT细胞接种于明胶包被(每孔加入100 μL 1 g/L明胶溶液,静置孵育过夜)的96孔细胞培养板中,置于细胞培养箱中继续培养;待细胞汇合度达到80%时,按照Lipofectamine 2000转染试剂盒说明书将构建好的双荧光素酶报告基因载体分别与bta-miR-205-Agomir/Antagomir、bta-miR-497-Agomir /Antagomir或negative control共转染至HEK-293FT细胞,6 h后将培养基更换成含100 mL/L FBS的细胞完全培养液,此时刻记为转染后0 h;转染后36 h时,按照双荧光素酶报告基因检测系统试剂盒说明书分别测量萤火虫荧光活性和海参荧光活性,并按照如下公式计算相对荧光活性:
相对荧光活性=(试验组萤火虫荧光活性/试验组海肾荧光活性)/(对照组萤火虫荧光活性/对照组海肾荧光活性)
1.2.4 RT-qPCR检测bta-miR-205和bta-miR-497对BVDV NADL转录水平的影响 按照1.8×105个/孔的密度将MDBK细胞接种至12孔细胞培养板中;待细胞汇合度达到80%时,使用Lipofectamine 2000分别转染bta-miR-205-Agomir/Antagomir、bta-miR-497-Agomir/Antagomir或negative control至MDBK细胞中,6 h后更换培养基为含100 mL/L FBS的细胞完全培养液,此时刻记为转染后0 h;转染后36 h时加入BVDV NADL分别感染4 h和8 h;加入TRIzol裂解液裂解细胞,提取细胞总RNA,将1 μg总RNA反转录成cDNA;使用RT-qPCR方法检测BVDV NADL E0基因的转录水平变化[5]。
1.2.5 BVDV NADL感染miRNAs处理的MDBK细胞早期病毒滴度的检测 按照如上方法接种MDBK细胞,并转染bta-miR-205-Agomir/ Antagomir、bta-miR-497-Agomir/Antagomir或negative control;转染后感染BVDV NADL;BVDV NADL感染后36 h时,反复冻融3次,收集病毒悬浮液,按Reed-Münch法测定病毒TCID50。
2 结果
2.1 bta-miR-205和bta-miR-497靶向BVDV NADL基因组的预测
用TargetScan、miRanda等生物信息学软件预测bta-miR-205和bta-miR-497靶向BVDV NADL基因组可能的结合位点,结果如图1所示。bta-miR-205和bta-miR-497能与BVDV NADL基因组中NS5B(RNA-dependent-RNA-polymerase,RdRp)序列以不完全互补的方式结合。
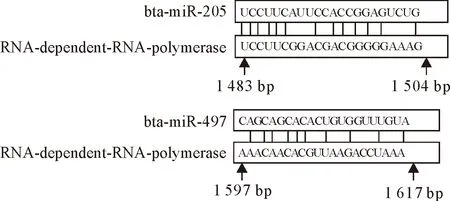
图1 bta-miR-205和bta-miR-497在BVDV NADL基因组中的识别位点预测
2.2 重组双荧光素酶报告基因载体的鉴定
双酶切pmirGLO-NS5B-3′ end-1和pmirGLO-NS5B-3′ end-2重组质粒,电泳结果出现3个条带,分别是pmirGLO载体、NS5B-3′ end-1和NS5B-3′ end-2,大小分别为7 350、234、153 bp,与预期结果相符(图2)。

1、6.PmirGLO-NS5B-3′ end-1和pmirGLO-NS5B-3′ end-2重组质粒;2、3.酶切鉴定重组质粒pmirGLO-NS5B-3′ end-1;4、5.酶切鉴定重组质粒pmirGLO-NS5B-3′ end-2;M.DNA标准DL 10 000
1,6.PmirGLO-NS5B-3′ end-1 and pmirGLO-NS5B-3’end-2 recombinant plasmids,respectively; 2,3.Results of double enzyme digestion for pmirGLO-NS5B-3′ end-1; 4,5. Results of double enzyme digestion for pmirGLO-NS5B-3′ end-2; M.DNA Marker DL 10 000
图2 重组双荧光素酶报告基因载体酶切鉴定
Fig.2 Identification of recombinant dual-luciferase reporter vector by double enzyme digestion
2.3 双荧光素酶报告基因分析鉴定bta-miR-205和bta-miR-497的靶基因
用双荧光素酶报告基因系统检测bta-miR-205和bta-miR-497是否靶向于BVDV NADL基因组的NS5B基因。结果如图3所示,bta-miR-205-Agomir/ Antagomir、bta-miR-497-Agomir /Antagomir和Stable阴性对照分别与重组双荧光素酶报告基因载体pmirGLO-NS5B-3′ end-1和pmirGLO-NS5B-3′ end-2共转染后,试验组与对照组相比,相对荧光素酶活性并没有显著性的变化。表明bta-miR-205和bta-miR-497并不直接靶向于BVDV NADL基因组中的NS5B基因(表5)。
2.4 RT-qPCR检测bta-miR-205和bta-miR-497对BVDV转录水平的影响
MDBK细胞分别转染bta-miR-205-Agomir/Antagomir、bta-miR-497-Agomir /Antagomir和Stable 阴性对照后感染BVDV NADL株,分别于感染后不同时间段,收集细胞提取总RNA,反转录成cDNA,用RT-qPCR检测bta-miR-205和bta-miR-497对BVDV转录水平的影响。结果如图4所示,与转染negative control相比,转染后4 h和8 h,转染bta-miR-205 agomir能显著降低BVDV NADL E0 基因mRNA水平(P<0.01),转染bta-miR-205-antagomir能显著升高BVDV NADL E0 基因mRNA水平(P<0.01),表明bta-miR-205 agomir可抑制BVDV的复制。转染bta-miR-497 agomir能显著升高BVDV NADL E0 基因mRNA水平(P<0.01),转染bta-miR-497-antagomir能显著降低BVDV NADL E0 基因mRNA水平(P<0.01),表明bta-miR-497 agomir促进BVDV的复制。

图3 双荧光素酶报告基因系统分析bta-miR-205和bta-miR-497的靶位点
2.5 BVDV NADL感染miRNAs处理后的MDBK细胞早期的病毒滴度的检测
MDBK细胞分别转染bta-miR-205-agomir、bta-miR-497-agomir 和 Stable阴性对照后感染BVDV NADL,感染36 h后收集病毒悬液,用Reed- Münch法计算病毒悬液的TCID50。结果如表6所示,与阴性对照转染的阴性对照组相比,转染bta-miR-205-agomir能抑制病毒的复制,而bta-miR-497-agomir转染后则促进病毒的复制。
3 讨论
miRNA是一类长度约为22 nt的内源性单链非编码小RNA,它可以通过诱导靶基因mRNA的降解或转录后基因沉默来负向调节基因的表达,所以miRNA在细胞增殖、分化和死亡等一系列生理病理过程中起关键的调控作用[5-6]。大量研究发现,miRNA与病毒感染、复制和包装等过程之间存在密切关系,影响着病毒的复制、免疫逃逸及宿主抗病毒等过程。通过对miRNA和病毒相互作用的研究,可以为病毒感染诊断及治疗提供新的策略[7]。
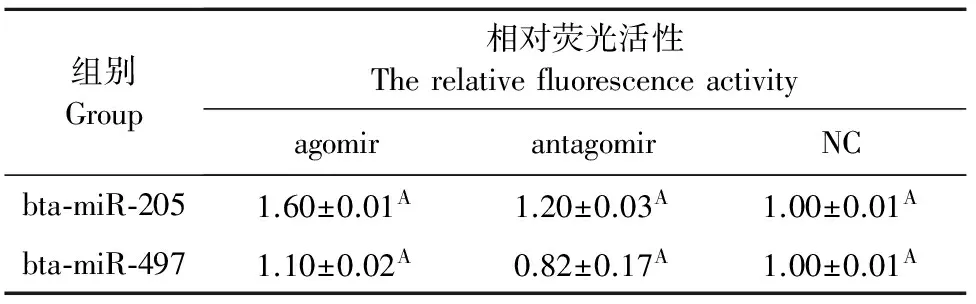
表5 相对荧光活性
注:同行数据后标相同字母者表示差异不显著(P>0.05)。
Note:Data with same letters indicate no significant difference (P>0.05).

表6 病毒悬液滴度测定
miRNA可以调节抗病毒免疫,有些可以抑制病毒的复制[8],有些可能被病毒利用,促进其复制。Zheng S Q等[9]发现单纯疱疹病毒感染宿主时,宿主细胞编码的miR-101的表达量增加,会抑制ATP 5B的活性,减少细胞内ATP的产生,从而影响病毒的复制。Wen B P等[10]发现宿主细胞编码的miR-23b可通过作用于肠道病毒71型的3′UTR保守序列从而抑制EV71的复制。Li S等[11]研究发现miR-130通过恢复宿主先天免疫反应或下调pro-HCV miR-122的表达来抑制丙型肝炎病毒复制。Fang J等[12]发现在流感病毒感染的A549细胞及流感患者外周血单核细胞(PBMC)中,miR-29的表达上调了近50倍,并且miR-29可以抑制DNA甲基转移酶(DNMT)的活性,从而诱导环氧化酶2(COX2)的表达,增强抗病毒的作用。然而,肝脏中特异性表达的miR-122有利于HCV的复制[13]。Jopling C L等[14]发现miR-4661可以直接靶向与IFN-α基因的mRNA的3′UTR,从而抑制疱疹性口炎病毒(VSV)和仙台病毒(SeV)感染所引起的巨噬细胞和树突状细胞抗病毒免疫反应,从而促进病毒的复制。
多项研究表明,宿主编码的miRNAs不仅可以通过间接作用调控病毒的复制,也可以直接靶向于病毒的某些结构蛋白基因或非结构蛋白基因,从而影响病毒的复制。本文预测到bta-miR-205和bta-miR-497这两个miRNAs可能直接靶向于BVDV NADL基因组中NS5B基因,通过双荧光素酶报告基因试验得出bta-miR-205和bta-miR-497并不靶向于NS5B。BVDV NADL株侵染转染bta-miR-205和bta-miR-497后的MDBK细胞,试验结果表明,bta-miR-205抑制病毒的复制,bta-miR-497促进病毒的复制。至于bta-miR-205和bta-miR-497如何影响病毒的复制,它们作用的部位和方式是什么?后续的工作中将会继续研究。
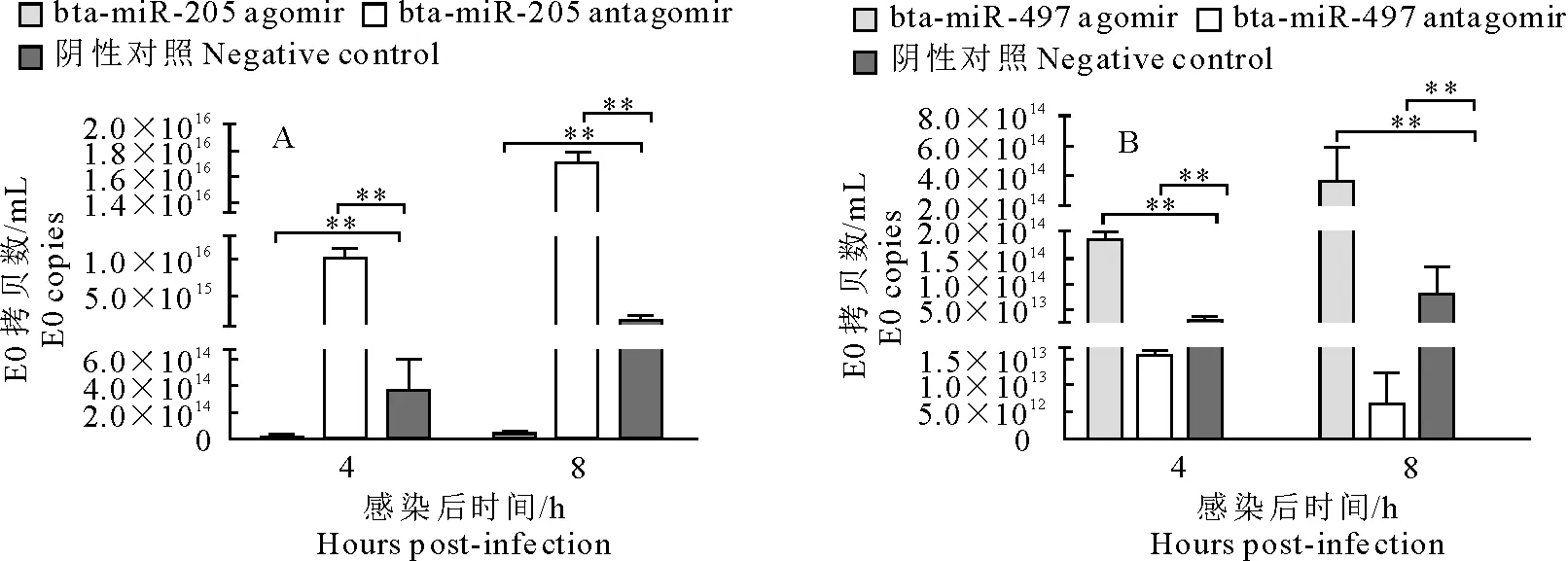
“**”表示差异显著,P<0.01。
“**”means significant difference,P<0.01.
图4 RT-qPCR检测BVDV NADL E0的转录水平
Fig.4 Detection of BVDV NADL E0 transcription levels by real-time quantitative PCR
BVDV感染及在细胞内的复制是病毒与宿主细胞之间相互作用、相互协调的结果,目前BVDV感染动物后,没有有效的治疗方法,也没有有效的疫苗可以用来免疫动物。因此,有必要寻求新的、安全有效的抗病毒治疗策略。研究表明,miRNA在调控病毒复制方面扮演着非常重要的角色,所以对有效miRNA的筛选和深入研究十分迫切。其研究结果将有助于阐明BVDV的致病机制,同时还可以为BVDV感染的治疗提供新的分子靶标。
[1] 韩玉霞,孟露萍,孙志华,等.不同生物型 BVDV 感染对 MDBK 细胞类泛素基因转录水平的影响[J].动物医学进展,2015,36(12):11-17.
[2] 范 晴,谢芝勋,谢志勤,等.牛病毒性腹泻病毒抗原捕获 ELISA 方法的建立[J].动物医学进展,2015,36(2):21-24.
[3] Fu Q,Shi H,Ni W,et al.Lentivirus-mediated bta-miR-29b overexpression interferes with bovine viral diarrhea virus replication and viral infection-related autophagy by directly targeting ATG14 and ATG9A in MDBK cells[J].J Gen Virol,2014,96(Pt1).
[4] Chang T C,Pertea M,Lee S,et al.Genome-wide annotation of micro RNA primary transcript structures reveals novel regulatory mechanisms[J].Genome Res,2015,25(9):1401-1409.
[5] 付 强.牛病毒性腹泻病毒持续性感染的分子机制研究及其定点突变株的构建[D].新疆石河子:石河子大学,2015.
[6] 孙佳增.F81细胞感染水貂肠炎病毒前后microRNA表达谱分析及相关功能鉴定[D].北京:中国农业大学,2014.
[7] 赵福林,李宇宁,段招军.MicroRNA与病毒感染[J].病毒学报,2015,31(2):187-191.
[8] Fu Q, Shi H, Shi M, et al. bta-miR-29b attenuates apoptosis by directly targeting caspase-7 and NAIF1 and suppresses bovine viral diarrhea virus replication in MDBK cells[J]. Can J Microbiol, 2014, 60(7):455-460.
[9] Zheng S Q,Li Y X,Zhang Y,et al.MiR-101 regulates HSV-1 replication by targeting ATP5B[J].Antiviral Res,2011,89(3):219-226.
[10] Wen B P, Dai H J, Yang Y H, et al. MicroRNA-23b inhibits enterovirus 71 replication through downregulation of EV71 VPl protein[J].Int Virol, 2013,56(3):195-200.
[11] Li S,Duan X,Li Y,et al.MicroRNA-130a inhibits HCV replication by restoring the innate immune response[J].J Viral Hepatitis,2013,21(2):121-128.
[12] Fang J,Hao Q,Liu L,et al.Epigenetic changes mediated by microRNA miR29 activate cyclooxygenase 2 and lambda-1 interferon production during viral infection[J].J Virol,2012,86(2):1010-1020.
[13] Kohno T,Tsuge M,Murakami E,et al.Human microRNA hsa-miR-1231 suppresses hepatitis B virus replication by targeting core mRNA[J].J Viral Hepatitis,2014,21(9):e89-e97.
[14] Jopling C L,Yi M,Lancaster A M,et al.Modulation of hepatitis C virus RNA abundance by a liver-specific microRNA[J].Science,2005,309(5740):1577-1581.
Study on Replication of Bovine Viral Diarrhea Virus Regulated by bta-miR-205 and bta-miR-497
LIU Sheng1,MENG Lu-ping1,ZHANG Hui1,FU Qiang2,SHI Hui-jun2,CHEN Chuang-fu1
(1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi,Xinjiang,832000,China; 2.CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi,Xinjiang,830052,China)
In order to explore the regulation effect of bta-miR-205 and bta-miR-497 on the bovine viral diarrhea virus(BVDV)' replication,based on the established miRNAs' differential expression profile of BVDV infected MDBK cells,the bta-miR-205 and bta-miR-497 with significantly different expressions were selected. The target genes of bta-miR-205 and bta-miR-497 were identified by the methods of bioinformatics software prediction and luciferase reporter gene verification. The effects of bta-miR-205 and bta-miR-497 on BVDV replication were verified by qRT-PCR and virus titer assay. The results showed that bta-miR-205 significantly inhibited the replication of BVDV, and bta-miR-497 significantly promoted the replication of BVDV. The study provided a new idea and basis for establishing a new technology to control BVDV.
Bovine viral diarrhea virus; bta-miR-205; bta-miR-497; replication
2016-06-20
国家自然科学基金项目(U1303283,31502095,31560328);国际科技合作项目(2013DFR30970)
刘 升(1992-),女,安徽萧县人,硕士研究生,主要从事分子病毒学研究。*通讯作者
S852.659.6
A
1007-5038(2017)01-0015-06