副鸡禽杆菌感染对鸡鼻区免疫相关因子的影响
徐玉智,李淑芳,张培君,龚玉梅,王宏俊*
(1.北京市农林科学院畜牧兽医研究所畜禽疫病防控技术北京市重点实验室,北京 100097;2.沈阳农业大学生物科学与技术学院,辽宁沈阳 110866)
副鸡禽杆菌感染对鸡鼻区免疫相关因子的影响
徐玉智1,2,李淑芳1,张培君1,龚玉梅1,王宏俊1*
(1.北京市农林科学院畜牧兽医研究所畜禽疫病防控技术北京市重点实验室,北京 100097;2.沈阳农业大学生物科学与技术学院,辽宁沈阳 110866)
副鸡禽杆菌是巴氏杆菌科的一种短小革兰阴性菌,也是鸡传染性鼻炎的致病菌。为探讨副鸡禽杆菌感染后靶器官免疫相关因子的变化情况,用副鸡禽杆菌进行人工感染SPF试验鸡,分别在第3天和第6天采集鼻区组织,应用RT-qPCR方法检测了IL-1β、IL-6、 IL-8、 IFN-γ、IL-4、IL-10、 TLR4、TLR5、TLR15、AvβDs 4和AvβDs 10的相对表达量;收集鼻黏膜洗液,检测sIgA水平。结果显示,感染组试验鸡IL-1β、IL-6、IL-8、IFN-γ、IL-4、IL-10、TLR4、TLR5、TLR15、β-防御素4、10相对表达量显著上升;鼻腔黏膜sIgA显著增高。提示前炎因子、趋化因子、Th1细胞因子、Th2细胞因子都参与了对副鸡禽杆菌感染的免疫调控,分泌的sIgA在抗副鸡禽杆菌感染过程中也起到重要作用。本研究探索了副鸡禽杆菌感染后细胞因子及抗体变化,对探寻新的免疫或治疗方法奠定了基础。
副鸡禽杆菌;细胞因子;sIgA;黏膜免疫
鸡传染性鼻炎(Infectious coryza,IC)是由副鸡禽杆菌(Avibacteriumparagallinarum,Apg)引起的一种上呼吸道传染病。病鸡主要表现为颜面水肿,鼻腔有浆液性或黏液分泌物,并伴有结膜炎和鼻炎[1]。本病一经发生即污染整个鸡场,使幼鸡生长停滞,母鸡产蛋量下降(10%~40%)[2],轻度消瘦和衰弱,肉鸡增重下降,因水肿而肉质变劣,给养鸡业带来较大的经济损失。2003年张培君等[3]在北京某鸡场分离出B型副鸡禽杆菌,龚玉梅等[4]证实B型分离株具有很强的致病力。该病在我国大中型养鸡场时有发生,目前主要采用全菌灭活苗配合抗生素治疗的综合防疫措施来防治[5]。
虽然灭活菌苗可以给鸡提供不同程度的保护,但存在抗原用量大、副反应较强、免疫持续期较短等不足之处。深入研究鸡体对抗副鸡禽杆菌的免疫反应,揭示相关细胞因子及抗体变化,对探寻新的免疫治疗方法具有一定参考意义。
1 材料与方法
1.1 材料
1.1.1 主要仪器 离心机5810R/5415D,Eppendorf公司产品;荧光定量PCR仪,Life(USA)公司产品反转录试剂、PCR试剂,Life(USA)公司产品;酶标仪,BIO-RAD公司产品。
1.1.2 主要试剂 PCR试剂,Life(USA)公司产品;RNA提取试剂TRlzol、TMB显色液,天根生化科技公司产品;辣根过氧化物酶标记的羊抗鸡IgA二抗,Sigma公司产品;RNA later,北京百灵克生物科技公司产品。
1.1.3 实验动物和菌株 6周龄SPF鸡购自北京梅里亚生物科技公司,在SPF隔离器中饲养至试验结束;副鸡禽杆菌由张培君研究员在北京鸡场分离的B型分离株,北京农林科学院畜牧兽医研究所卵黄冻干保存。
1.2 方法
1.2.1 动物试验 B型北京分离株接种到无菌TSA平皿中,37℃培养18 h。然后,37℃传代培养18 h,用无菌PBS洗下菌株。用梯度稀释法进行活菌计数,调至1×106CFU/mL,用于人工感染。
18只SPF鸡随机分为2组,每组9只,分别属于人工感染组和对照组。感染组全部眶下接种副鸡禽杆菌(1×106CFU/mL)活菌0.2 mL/只,放入隔离器饲养。对照组试验鸡则眶下注射PBS,0.2 mL/只,放在另一个隔离器饲养。试验过程中,每只鸡作为一个样本,进行3个生物学重复。在第3天和第6天,分别处死人工感染组和对照组3只鸡,采集鼻区组织,储存在RNAlater中备用。第6天,每组各处死3只鸡,用1 mL黏膜洗液冲洗鼻腔,收集洗脱液,用于sIgA检测。
1.2.2 RNA提取与反转录 鼻区组织材料从RNAlater中取出,用无菌PBS冲洗3遍,放入无菌研钵中,迅速加入液氮并快速研磨,组织研磨成粉末状,加入1 mL Trizol裂解液,混合组织与裂解液,转入1.5 mL无菌EP管中。参照Trizol使用说明书分别提取对照组、免疫组、攻毒组的组织样品RNA。取5 μL 总RNA,加入DEPC水5.0 μL、随机反转录引物1 μL、10 mmol/L dNTP Mix 1μL,在65℃ 5 min,冰浴1 min;加入反转录体系:5×First-strand buffer 4 μL、0.1 mmol/L dTT 2 μL、RNaseout(40 U/μL)1 μL、SuperScrip Ⅲ RT (200 U/μL) 1 μL,瞬时离心,25℃ 5 min,50℃ 60 min,70℃ 15 min,立即放置到冰上,制备的cDNA置-20℃保存备用。
1.2.3 实时荧光定量PCR检测 以反转录得到的cDNA为模板,内参基因act-b为对照,用相对定量的检测方法测定IL-1β、IL-6、IL-8、IFN-γ、IL-4、IL-10、TLR4、TLR5、TLR15、β防御素4,10和act-b的Ct值。各因子的特异性引物(表1)通过Primer5设计,由北京六合华大科技有限公司合成。人工感染组和空白对照组每个样品进行3次平行重复。
1.2.4 sIgA的ELISA检测 用B型副鸡禽杆菌超声裂解抗原(10 ng/孔)4℃包被过夜,PBST洗3次,用50 g/L脱脂奶37℃封闭2 h,PBST洗3次,用10 g/L脱脂奶1∶1稀释收集液(人工感染组和对照组鼻腔洗液),每孔加入100μL,置于37℃经1 h。PBST洗3次,每孔加入羊抗鸡IgA酶标二抗(1∶10 000)100 μL,37℃经1 h。PBST洗3次,TMB显色15 min,加入终止液50 μL,在450 nm处读OD值,重复3次。
1.2.5 数据处理和统计分析 经RT-qPCR反应后,获得目的基因和内参基因act-b的Ct值。以act-b为参照,采用2-△△Ct法计算各基因在不同时间和不同试验组的相对表达量。组织样品的相对表达量和ELISA读数用Spass制图和进行单因素方差分析,P<0.05为差异显著。
2 结果
2.1 人工感染组Toll-like 受体、β防御素4和10、细胞因子及趋化因子在鼻区的表达
根据多次研究发现,在实验室条件下,一个发病剂量的副鸡禽杆菌攻击后,大部分SPF鸡在24 h内即可出现明显的临床症状。在3 d后鸡群临床症状达到高峰,之后逐渐转归康复。6 d~7 d后绝大部分试验鸡的临床症状消失。本研究通过RT-qPCR的方法,以actb基因为内参,比较了2个时间点各因子相对表达量。结果显示,Toll-like受体(TLR4、5、15)在第3天和第6天,相比于对照组,表达量显著增加(P<0.05)。并且相对表达量在第3天高于第6天(图1)。TLR4是LPS主要受体,LPS是革兰阴性细菌外膜的主要成分,TLR5识别鞭毛蛋白,TLR15是禽类特有的模式识别系统[6-7]。结果可知,TLR4、TLR5、TLR15都参与了副鸡禽杆菌的识别。

表1 RT-PCR引物信息表
AvβBD4、AvβBD10在攻毒后第3天和第6天,相对表达量显著增加(P<0.05)(图2)。AvβDs是抗菌肽,在鸡天然免疫中起到重要作用[8]。结果说明,AvβBD4、AvβBD10参与了抗副鸡禽杆菌的感染过程,验证了天然免疫在抗副鸡禽杆菌感染中的作用。
Th2细胞因子(IL-4和IL-10)、前炎因子IL-6在第3天和第6天相对表达量显著增加(P<0.05)。Th1细胞因子IFN-γ、趋化因子IL-8、前炎因子IL-1β在第3天表达量显著增加(P<0.05)(图3)。在第6天,Th2细胞因子相对表达量仍然显著,然而,Th1细胞因子与对照组相比差异不显著。结果说明,副鸡禽杆菌感染主要引起Th2类型免疫反应,前炎因子和趋化因子参与抗副鸡禽杆菌的免疫调节。
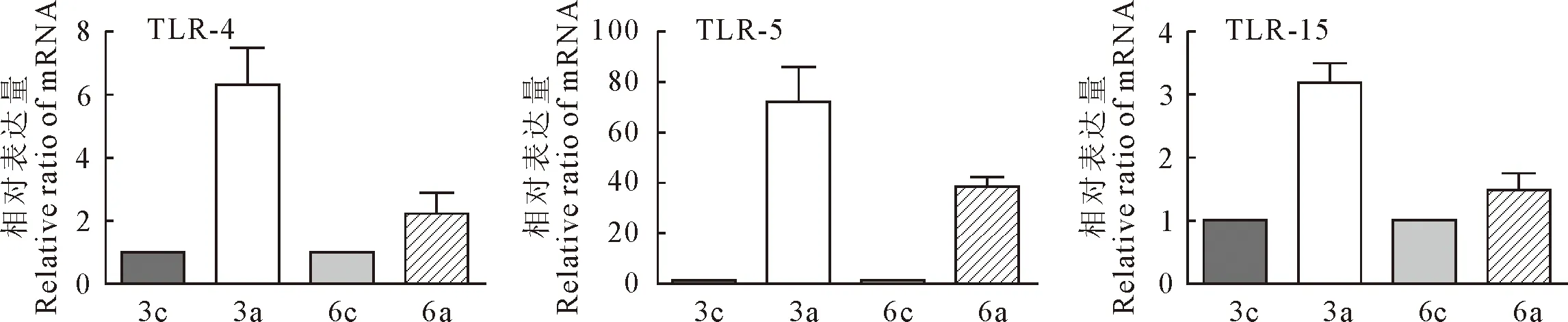
3c、6c是第3、6天的对照组;3a、6a是第3、6天的人工感染组
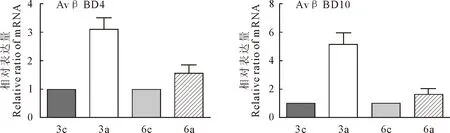
3c、6c是第3、6天的对照组;3a、6a是第3、6天的人工感染组
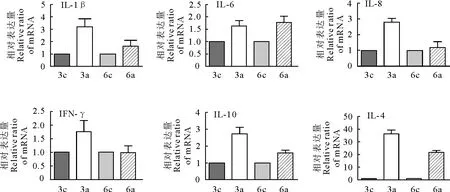
3c、6c是第3、6天的对照组;3a、6a是第3、6天的人工感染组
2.2 ELISA检测sIgA
鸡sIgA主要存在于呼吸道、肠道、胆汁、泌尿生殖道和眼睛中,在保护黏膜、发挥局部免疫方面起到重要作用。其不仅可以中和、排斥病原体,防止细菌、病毒与黏膜结合,还可以促进分泌液中天然抗菌因子的作用,并可调节黏膜免疫。在活菌接种后第6天,用ELISA检测鼻黏膜sIgA,结果在攻毒组sIgA水平相对于对照组显著增加(P<0.05)(图4)。结果说明,sIgA参与了清除副鸡禽杆菌感染的过程。

6a是第6天的人工感染组;6c是第6天的对照组
6a is the 6 days later of the infection group; 6c is the 6 days later of the control group
图4 感染组sIgA在第6天的相对值
Fig.4 The relative values of sIgA in the infection group in the sixth day
3 讨论
近年来,随着超强耐药菌株的不断出现,社会各界对抗生素禁用的呼声愈来愈高,这促使对天然免疫和新的免疫预防方法的深入研究。鼻黏膜是抵抗病原入侵的生理学和免疫学屏障。天然免疫系统被认为是清除系统,负责抵抗侵入的病原。激活的天然免疫系统的特征是产生炎性因子和抗菌肽。天然免疫细胞调控特殊的免疫反应,然后引起进一步获得性免疫反应。天然免疫和获得性免疫的复杂相互作用可能对于清除副鸡禽杆菌感染也十分重要。
Toll样受体(Toll-like receptors,TLRs)是模式识别系统主要成分。因为病原菌有一系列病原相关保守结构(病原相关分子模式,PAMPs),所以TLRs不论天然免疫过程中还是获得免疫过程中都可以检测病原入侵,TLRs识别PAMPs,然后引起快速的、特异的免疫反应[7]。在来亨鸡异嗜白细胞中有TLRs的广泛表达[8]。在本次试验发现鸡鼻区的TLR4、TLR5、TLR15也都参与了副鸡禽杆菌的识别。
在脊柱动物中,鉴定出大量抗菌肽类防御素作为天然免疫成分。鸡基因组比对发现其含有β防御素家族。禽β防御素(AvβDs)有广泛的抗微生物作用,可以抗革兰阴性菌、革兰阳性菌、真菌和酵母,目前发现的AvβDs一共有14种[9]。TLRs与相应配体结合,可以上调表达促炎因子和AvβDs表达,促炎因子可以进而促进炎症因子表达,也可以继续促进AvβDs表达[10-11]。本试验中,鸡感染副鸡禽杆菌过程中β防御素和促炎因子(IL-1β、IL-6)表达显著升高,说明天然免疫参与了鸡清除副鸡禽杆菌的过程。
细胞免疫和体液免疫分别被Th1/Th2平衡控制,Th1细胞因子主要调节细胞免疫对抗胞内细菌和病毒,Th2细胞因子抑制一些吞噬细胞功能,调控体液免疫,调控或抑制炎症,促进非吞噬细胞的炎症反应[12-13]。促炎因子和抗炎因子相互作用形成复杂的网络,其动态平衡决定了炎症的发展与结局[14]。sIgA是黏膜免疫的主要效应分子。有研究资料显示,细胞因子在抗沙门菌中起到重要的作用,IFN-γ、IL-12和IL-18表达与抗沙门菌感染有关,IL-4和IL-10起到的作用是下调细菌的炎症反应[15]。Th1细胞因子和Th2细胞因子都参与了鸡抗副鸡禽杆菌免疫反应。IFN-γ和IL-4分别是Th1和Th2类型免疫反应关键的细胞因子[15]。其中IFN-γ可以活化巨噬细胞,IL-4有拮抗IFN-γ的功能,其可以促进Th0细胞转化为Th2细胞,减少Th1细胞的形成,并可以下调单核巨噬细胞分泌IFN-γ,分别在细胞免疫和体液免疫水平抑制炎症反应,同时可以促进B细胞增殖及分泌IgA、IgE等抗体,促进机体在炎症消散后产生获得性免疫。本试验在第6天检测到鸡鼻黏膜抗副鸡禽杆菌sIgA明显增加。此外,IL-10抑制T细胞增殖并且可以抑制多种促炎因子的释放,如IL-1和IL-6[16]。本研究发现副鸡禽杆菌活菌接种有高水平的IL-4和IL-10表达,可以认为获得性免疫以Th2细胞反应为主。
通过检测副鸡禽杆菌感染过程中细胞因子的变化,本研究认为,天然免疫和获得性免疫共同参与了副鸡禽杆菌的清除,Th2类型获得性免疫起到重要作用,最终促进了特异性的sIgA分泌。在防治方法的研究过程中,有必要探索更为有效的佐剂或刺激剂,以便更好地激发产生Th2细胞因子。
[1] 路迎迎,路明华,陈小玲,等.B型副鸡禽杆菌安徽株的分离与鉴定[J].动物医学进展,2014,35(1):122-125.
[2] 李淑芳,龚玉梅,王宏俊,等.副鸡禽杆菌的分离鉴定[J].中国兽医杂志,2015,51(11):58-59.
[3] 张培君,苗得园,龚玉梅,等.B型副鸡嗜血杆菌的分离鉴定[J].中国预防兽医学报,2003,25(1):56-58.
[4] 龚玉梅,张培君,孙惠玲,等.三型副鸡禽杆菌对SPF鸡的致病力实验[J].动物医学进展,2011.32(2):33-36.
[5] 龚玉梅,张培军,朱文革,等.鸡传染性鼻炎(三价)和新城疫二联灭活苗的研究[J].动物医学进展,2015,36(1):40-44.
[6] Abdel Mageed A M,Isobe N,Yoshimura Y.Effects of different TLR ligands on the expression of proinflammatory cytokines and avian β-defensins in the uterine and vaginal tissues of laying hens [J].Vet Immunol Immunopathol,2014,162(3-4):132-141.
[7] Werling D,Jungi T W.Toll-like receptors linking innate and adaptive immune respone[J].Vet Immunol and Immunopathol,2003,91(1):1-12.
[8] Kogut M H,Iqbal M,He H,et al.Expression and function of Toll-like receptors in chicken heterophils[J].Dev Comp Immunol,2005,29(9):791-807.
[9] Xu Yang,Zhang Tingting,Xu Qianqian,et al.Differential modulation of avian β-defensin and Toll-like receptor expression in chickens infected with infectious bronchitis virus[J].Appl Microbiol Biotechnol,2015,99(21):9011-9024.
[10] Yoshimura Y.Avian β-defensins expression for the innate immune system in hen reproductive organs [J].Poult Sci,2015,94(4):804-809.
[11] Sonoda Y,Abdel Mageed A M,Isobe N,et al.Induction of avian β-defensins by CpG oligodeoxynucleotides and proinflammatory cytokines in hen vaginal cells in vitro [J].Reproduction,2013,145(6):621-631.
[12] 岳丽敏,秦峻岭,王春芳,等.Th1/Th2平衡在结核分支杆菌免疫中的研究进展[J].中国免疫学杂志,2015,31(10):1426-1429.
[13] Chaussé A M,Grépinet O,Bottreau E,et al.Expression of Toll-like receptor 4 and downstream effectors in selected cecal cell subpopulations of chicks resistant or susceptible toSalmonellacarrier state[J].Infect Immun,2011,79(8):3445-3454.
[14] Corthay A.A three-cell model for activation of naïve T helper cells [J].Scand J Immunol,2006,64(2):93-96.
[15] 刘 莹,李 磊,王 洋,等.鸡免疫器官中Th1和Th2星细胞因子mRNA转录水平的比较[J].中国兽医杂志,2015,51(7):17-21.
[16] Bai S P,Huang Y,Luo Y H,et al.Alteration in lymphocytes responses,cytokine and chemokine profiles in laying hens infected withSalmonellatyphimurium[J].Vet Immunol Immunopathol,2014,160(3-4):235-243.
Effect ofAvibacteriumparagallinarumInfection on Immune Related Factors in Nasal Region of Chickens
XU Yu-zhi1,2,LI Shu-fang1,ZHANG Pei-jun1,GONG Yu-mei1,WANG Hong-jun1
(1.BeijingInstitutionofAnimalHusbandryandVeterinaryMedicine,BAAFS,BeijingMunicipalKeyLaboratoryofAnimalDieasePreventionandControlTechnology,Beijing,100097,China;2.CollegeofBiologicalTechnology,ShenyangAgriculturalUniversity,Shenyang,Liaoning,110866,China)
Avibacteriumparagallinarum(Apg) is a Gram negative bacterium of Pasteurellaceae,which is the pathogen of chicken infectious coryza.In order to investigate the changes of immune related factors of the target organ after the infection of Apg,SPF chickens were challenged with Apg.The expressions of IL-1β,IL-6,IL-8,IFN-γ,IL-4,IL-10,TLR4,TLR5,TLR15,AvβDs 4 and 10 were detected by RT-qPCR at three and six days after infection.At the same time,sIgA in nasal region was detected too.The results showed that expressions of IL-1β,IL-6,IL-8,IFN-γ,IL-4,IL-10,TLR4,TLR5,TLR15,AvβDs 4 and AvβDs 10 in infected group increased compared with that in control group,sIgA also increased.It showed that all the proinflammatory factors,chemokines,Th1 cytokines,Th2 cytokines and sIgA were involved in the immune regulation of anti-Apg infection.The changes of cytokines and antibody levels is revealed in this study.It provided a theoretical basis for the development of new immune or treatment methods of Apg.
Avibacteriumparagallinarum; cytokine; sIgA; mucosal immunity
2016-06-02
国家自然科学基金项目(31272558);农业部公益性行业专项(201303044);北京市农林科学院创新能力建设项目(KJCX20140410)
徐玉智(1990-),男,河南新乡人,硕士研究生,主要从事动物分子生物学研究。*通讯作者
S852.612;S858.31
A
1007-5038(2017)01-0036-05