4,7,10-三(叔丁氧碳酰甲基)-1,4,7,10-四氮杂环十二烷-1-乙酰肼的微波合成
周 进, 杨海东, 孙宏顺, 李玉龙, 蒋 蕻
(南京科技职业学院 江苏省磁共振靶向显像剂工程实验室,江苏 南京 210048)
·研究简报·
4,7,10-三(叔丁氧碳酰甲基)-1,4,7,10-四氮杂环十二烷-1-乙酰肼的微波合成
周 进, 杨海东, 孙宏顺*, 李玉龙, 蒋 蕻
(南京科技职业学院 江苏省磁共振靶向显像剂工程实验室,江苏 南京 210048)
以轮环藤宁为起始原料,依次与溴乙酸叔丁酯,溴乙酸乙酯和水合肼反应合成了一种核磁共振对比剂螯合前体——4,7-10-三(叔丁氧碳酰甲基)-1,4,7,10-四氮杂环十二烷-1-乙酰肼(4),其结构经1H NMR,13C NMR, FT-IR和MS(ESI)表征。研究了溶剂、水合肼用量、微波功率和反应时间对4收率的影响。结果表明:乙醇为溶剂,水合肼10 eq.,于400 W微波反应10 min, 4(粉末固体)收率90%。
轮环藤宁; 核磁共振对比剂; 螯合前体; 微波合成
自Lauterbur[1]首次发现磁共振成像(MRI)以来,MRI技术因其无创、无痛苦、精确定位和较精确的图像显示等特点而倍受科研人员重视。MRI设备在医学领域迅速发展,已成为影像学检查中最重要的医学影像设备之一。但在某些情况下,MRI的分辨率不能满足临床要求。为增强成像效果,需要在检查之前使用磁共振对比剂(CA)。研究表明,临床使用MRI技术时,超过50%的检查案例需要使用CA[2]。其中,钆类CA是应用最广泛的一种CA。美国FDA已经批准的
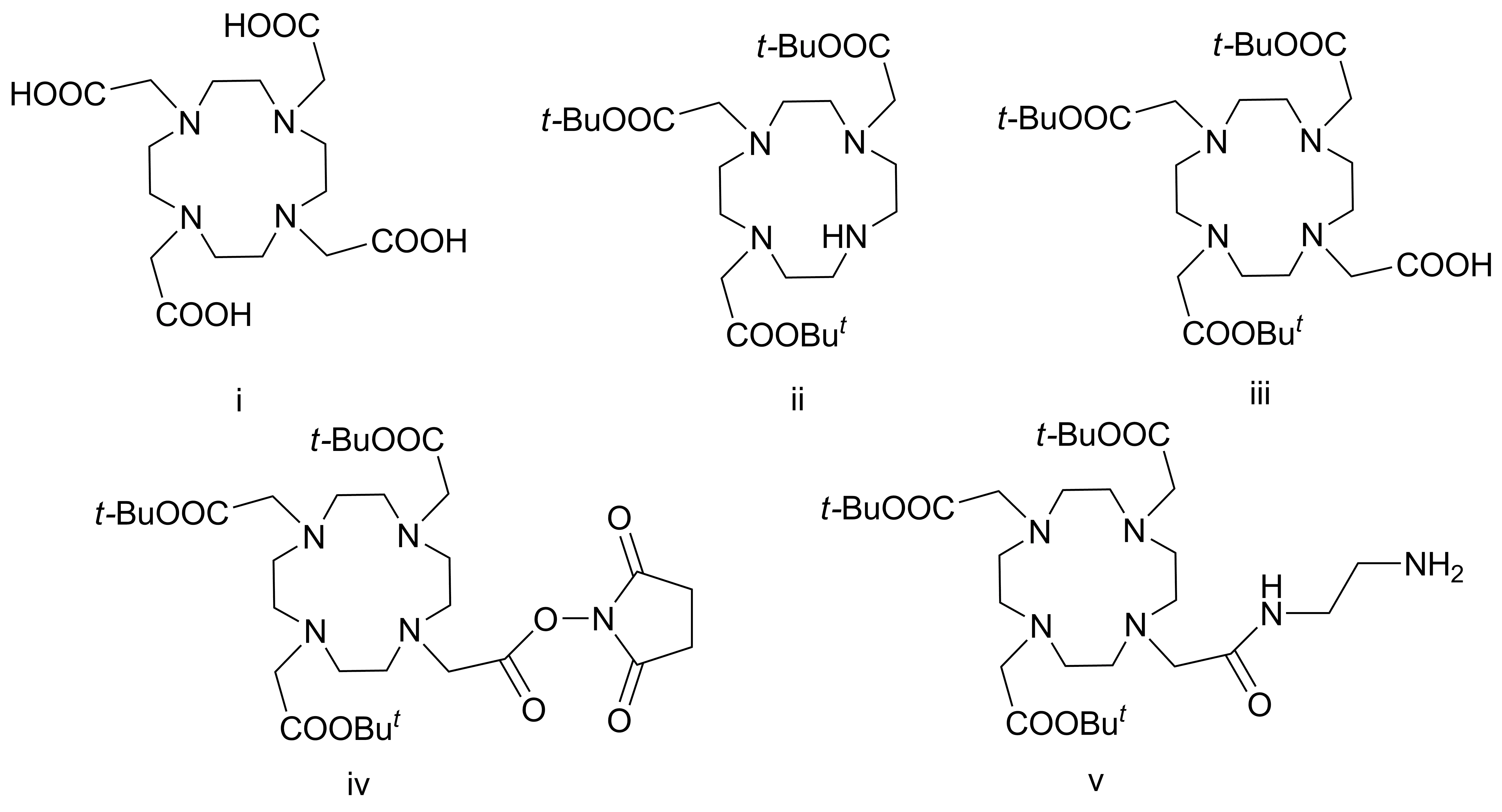
Chart 1
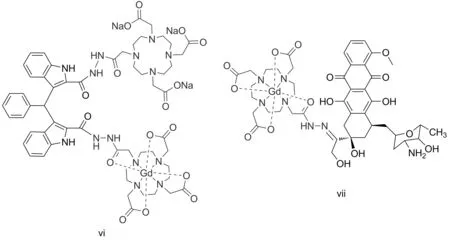
Chart 2
Scheme 1
钆类CA共9种,可分为两大类,分别以DTPA和DOTA为钆的螯合基团。由于DOTA与钆离子的结合能力更强,钆离子不容易游离,被认为安全性更高,其研究也更为深入。目前,化学工作者已合成了多种DOTA类螯合前体化合物,以便制得不同功能的靶向CA(Chart 1)[3-7]。
4,7-10-三(叔丁氧碳酰甲基)-1,4,7,10-四氮杂环十二烷-1-乙酰肼(4)是一种性能良好的CA螯合前体,在部分CA中已有应用(Chart 2)[8-10]。 4含有活性较高的胺基,可与醛、酮、羧酸等诸多基团发生反应,具有较好的应用前景。
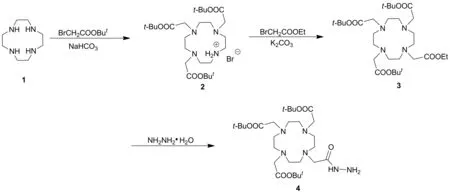
本文以轮环藤宁(1)为起始原料,依次与溴乙酸叔丁酯,溴乙酸乙酯和水合肼反应合成了4(Scheme 1),其结构经1H NMR,13C NMR, FT-IR和MS(ESI)表征。并研究了溶剂、水合肼用量、微波功率和反应时间对4收率的影响。
1 实验部分
1.1 仪器与试剂
XT-4A型显微熔点仪(温度未校正);ZF-7型三用紫外分析仪;BRUKER DRX300型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet FT-IR 360型红外光谱仪(KBr压片);Mircomass Q-TOF micro型质谱仪;WF-4000型常压微波合成系统。
所用试剂均为分析纯。
1.2 合成
(1) 2的合成
在圆底烧瓶中加入1 1.72 g(10.0 mmol),无水乙腈100 mL,加热至1完全溶解;加入无水乙腈30 mL,冷却至0 ℃,加入碳酸氢钠2.52 g(30 mmol),缓慢滴加溴乙酸叔丁酯5.85 g(30 mmol)的无水乙腈(100 mL)溶液,滴毕,于室温反应24 h,回流反应4 h(TLC监测)。过滤,滤液抽滤后用混合溶剂[V(甲醇) ∶V(二氯甲烷)=1 ∶9]重结晶得白色固体1,4,7,10-四氮杂环十二烷-1,4,7-三乙酸三叔丁酯氢溴酸盐(2)4.88 g,收率82%, m.p.189.7~191.6 ℃;1H NMRδ: 10.00(s, 2H), 3.36(s, 4H), 3.28(s, 2H), 3.09(s, 4H), 2.91(s, 7H), 2.87(s, 5H), 1.45(s, 27H);13C NMRδ: 170.4, 169.5, 81.7, 81.5, 58.1, 51.3, 49.2, 48.8, 47.4, 28.1; FT-IRν: 3 442, 2 976, 2 949, 2 853, 2 736, 1 729, 1 368, 1 255, 1 149 cm-1; HR-MS(ESI)m/z: Calcd for C26H50N4O6{[M+H]+}515.380 9, found 515.386 7。
(2) 3的合成
将2 2.93 g(5.0 mmol)溶于无水乙腈50 mL中,冷却至0 ℃,加入碳酸钾1.0 g(7.5 mmol),缓慢滴加溴乙酸乙酯1.25 g(7.5 mmol)的无水乙腈(20 mL)溶液,滴毕,回流反应12 h(TLC监测)。过滤除盐,滤液经硅胶柱层析[洗脱剂:A=V(甲醇) ∶V(-二氯甲烷)=5 ∶95]纯化得黄色油状液体1,4,7-三(叔丁氧碳酰甲基)-10-乙氧碳酰甲基-1,4,7,10-四氮杂环十二烷(3)2.7 g,收率90%;1H NMRδ: 4.14(dd,J=13.9 Hz, 6.9 Hz, 2H), 3.14(br s, 10H), 2.32(br s, 8H), 2.12(s, 6H), 1.43(s, 27H), 1.24(t,J=7.1 Hz, 3H);13C NMRδ: 172.1, 171.7, 170.6, 81.5, 55.4, 54.3, 49.8, 27.7, 27.6; FT-IRν: 3 422, 2 980, 2 935, 2 831, 1 728, 1 369, 1 226, 1 159 cm-1; MS(ESI)m/z: 601.4{[M+H]+}, 623.4{[M+Na]+}。
(3) 4的合成
在圆底烧瓶中加入3 1.20 g(2.0 mmol)和无水乙醇20 mL,加热使其溶解,加入80%水合肼溶液1.3 mL(20 mmol),于400 W微波反应10 min(TLC监测)。减压抽干溶剂,滤饼经硅胶柱层析(洗脱剂:A=5 ∶95)纯化后,用混合溶剂[V(乙酸乙酯) ∶V(乙醚)=3 ∶7]重结晶得白色固体4 1.0 g,收率90%, m.p.120.9~123.2 ℃;1H NMRδ: 9.53(s, 1H), 4.25(s, 2H), 3.34(s, 6H), 3.05(br s, 6H), 2.50(s, 6H), 2.26(br s, 6H), 1.43(s, 27H);13C NMRδ: 172.3, 171.9, 170.8, 81.8, 81.7, 55.7, 55.6, 54.6, 50.2, 27.9, 27.8; FI-IRν: 3 432, 3 234, 3 161, 2 973, 2 940, 2 832, 1 729, 1 683, 1 641, 1 533, 1 366, 1 310, 1 225, 1 163, 1 106 cm-1; MS(ESI)m/z: 587.5{[M+H]+}, 609.5{[M+Na]+}。
2 结果与讨论
2.1 4的合成
采用常规合成方法合成4时,第三步反应需要用到大量水合肼(100 eq.),后处理需要采用减压蒸干溶剂的方法,操作繁琐,收率较低(70%)。我们采用微波合成的方法,减少了水合肼的用量(10 eq.),后处理简便,反应时间缩短至10 min。通过重结晶,首次得到了粉末状固体的4。
表1为溶剂,水合肼用量,微波功率和反应时间对4收率的影响。由表1可见,No.1~No.5为溶剂对收率的影响,以EtOH为溶剂,收率最高(90%)。 No.1, No.6, No.7为微波功率对收率的影响,微波功率为400 W,收率最高(90%)。 No.1, No.8~No.10为水合肼用量对收率的影响,水合肼用量为10.0 eq.,收率最高(90%)。 No.1, No.11~No.13为反应时间对收率的影响,反应时间为10 min,收率最高(90%)。
综上所述,微波合成4的最佳条件为:乙醇为溶剂,水合肼10 eq.,于400 W微波反应10 min, 4(固体)收率90%,比常规合成方法提高20%,比文献值[10]提高5%。

表1 4的微波合成条件优化Table 1 Optimization of microwave reaction conditions for synthesizing 4
2.2 表征
2为胺基溴酸盐,2的1H NMR分析表明,δ10.00处为两个N—H吸收峰。2的熔点为189.7~191.6 ℃(190~191 ℃[11]),与文献值基本一致。
由4的1H NMR分析可知,伯胺的N—H吸收峰位于δ4.25处,酰胺的N—H吸收峰位于δ9.53处。24个—CH2—吸收峰位于δ2.26~3.34处,分别为两个单峰和两个宽峰。甲基吸收峰位于δ1.43处。由4的13C NMR分析可知,3个羰基碳的吸收峰分别位于δ172.3,δ171.9和δ170.8处,两类叔丁基碳的吸收峰分别位于δ81.8和δ81.7处。由4的FT-IR分析可知,3 432 cm-1处强吸收峰为N—H伸缩振动峰,2 973 cm-1处特征峰为甲基伸缩振动吸收峰,2 832 cm-1处特征峰为亚甲基伸缩振动吸收峰,1 729 cm-1处强吸收峰为C=O伸缩振动吸收峰。
以轮环藤宁(1)为原料,经3步反应合成了一种磁共振对比剂螯合前体——4,7-10-三(叔丁氧碳酰甲基)-1,4,7,10-四氮杂环十二烷-1-乙酰肼(4)。在最优合成条件(乙醇为溶剂,水合肼10 eq.,于400 W微波反应10 min)下, 4(粉末固体)收率90%。
[1] Lauterbur P C. Image formation by induced local interaction:Examples employing nuclear magnetic resonance[J].Nature,1973,242:190-191.
[2] Shiraishi K, Kawano K, Maitani Y,etal. Polyion complex micelle MRI contrast agents from poly(ethylene glycol)-b-poly(L-lysine) block copolymers having Gd-DOTA:Preparations and their control of T1-relaxivities and blood circulation characteristics[J].Journal of Controlled Release,2010,148:160-167.
[3] Desreux J F, Merciny E, Loncin M F. Nuclear magnetic resonance and potentiometric studies of the protonation scheme of two tetraaza tetraacetic macrocycles[J].Inorganic Chemistry,1981,20(4):987-991.
[4] Allen M J, Meade T J.Synthesis and visualization of a membrane-permeable MRI contrast agent[J].Journal of Biological Inorganic Chemistry,2003,8(7):746-750.
[5] Song Y, Kohlmeir E K, Meade T J. Synthesis of multimeric MR contrast agents for cellular imaging[J].Journal of the American Chemical Society,2008,130(21):6662-6663.
[6] Zhou Y, Kim Y S, Yan X,etal. 64Cu-Labeled lissamine rhodamine B:A promising PET radiotracer targeting tumor mitochondria[J].Molecular Pharmaceutics,2011,8(4):1198-1208.
[7] Barge A, Tei L, Upadhyaya D,etal. Bifunctional ligands based on the DOTA-monoamide cage[J].Organic & Biomolecular Chemistry,2008,6(7):1176-1184.
[8] Cresens E, Ni Y C, Adriaens P,etal. Substituted bis-indole derivatives useful as contrast agents,pharmaceutical compositions containing them and intermediates for producing them:WO 2002038546[P].2002.
[9] Zhang J D, Curry K. Targeted contrast agents comprising a hydrazide functional group:WO 2016090491[P].2016.
[10] Frullano L, Tejerina B, Meade T J. Synthesis and characterization of a doxorubicin-Gd(III) contrast agent conjugate:A new approach toward prodrug-procontrast complexes[J].Inorganic Chemistry,2006,45(21):8489-8491.
[11] Jagadish B, Brickert-Albrecht G L, Nichol G S,etal. On the synthesis of 1,4,7-tris(tert-butoxycarbonyl-methyl)-1,4,7,10-tetraazacyclododecane[J].Tetrahedron Letters,2011,52(17):2058-2061.
Microwave Synthesis of 4,7,10-Tris(tert-butoxycarbonylmethyl)-1,4,7,10-tetraazacyclodo-decane-1-acetohydrazide
ZHOU Jin, YANG Hai-dong, SUN Hong-shun*, LI Yu-long, JIANG Hong
(Targeted MRI Contrast Agents Laboratory of Jiangsu Province,Nanjing Polytechnic Institute, Nanjing 210048, China)
A chelator precursor for MRI contrast agent, 4,7,10-tris(tert-butoxycarbonylmethyl)-1,4,7,10-tetraazacyclodo-decane-1-acetohydrazide(4), was synthesized using cyclen as the starting material, then reaction withtert-butyl bromoacetate, ethyl bromoacetate and hydrazine hydrate, respectively. The structure was characterized by1H NMR,13C NMR, FT-IR and MS(ESI). The effects of solvents, molar ratio of hydrazine hydrate, microwave power and reaction time on the yield of 4 were investigated. The optimum conditions were as follows: ethanol as solvent, hydrazine hydrate 10 eq., microwave irradiation for 10 min under 400 W, the yield of 4(powder solid) was 90%.
cyclen; MRI contrast agent; chelator precursor; microwave synthesis
2016-09-14 ;
2017-01-04
江苏省高等学校大学生创新创业训练计划项目(201512920027H); 江苏高校品牌专业建设工程资助项目; 南京科技职业学院院级重点项目(NHKY-2015-1)
周进(1995-),男,汉族,江苏泰兴人,本科生,主要从事有机合成方法的研究。
孙宏顺,博士研究生,讲师, E-mail: njutshs@126.com
O623.7
A
10.15952/j.cnki.cjsc.1005-1511.2017.02.16234

