吖啶类衍生物的合成研究进展
魏 强, 耿新乐
(兰州交通大学 化学与生物工程学院,甘肃 兰州 730070)
·综合评述·
吖啶类衍生物的合成研究进展
魏 强, 耿新乐*
(兰州交通大学 化学与生物工程学院,甘肃 兰州 730070)
吖啶类衍生物具有良好的生物活性,在生物制药,功能材料和荧光标记物等领域有重要应用,但合成难度较大。综述了通过催化剂活化酰基的成环反应(分子内成环反应和分子间成环反应)合成吖啶衍生物的方法,并对其未来的发展进行了展望。参考文献19篇。
吖啶类衍生物; 分子内成环反应; 分子间成环反应; 合成; 研究进展; 综述
吖啶衍生物因其独特的物理、化学性质和生物活性而倍受研究者们的关注。吖啶衍生物在化学工业(如颜料和染料等[1]),医学(如抗菌,抗疟药,抗肿瘤,DNA和RNA嵌入等[2-6])等领域有广泛应用。此外,含有大共轭体系的吖啶衍生物因其具有特别的电子和光物理性质而有望作为新型有机半导体材料[7]。通过吖啶衍生物中齿状氮原子形成刚性结构,从而制备新型催化剂,也是催化工作者努力的方向[8-9]。
然而,吖啶类衍生物的高效合成是限制其深入研究的障碍。对吖啶类衍生物的合成方法进行系统研究显得尤为重要。通过催化剂活化酰基的成环反应是合成吖啶衍生物的重要途径之一,该方法的主要优点为原子利用率较高,副产物主要为水,对环境较为友好。成环反应合成吖啶类衍生物的方法主要有两种:分子内成环和分子间成环。本文对该类合成方法进行了概述,并对其未来的发展进行了简要展望。
1 分子内成环反应
分子内成环反应是成环反应合成吖啶衍生物的重要方法之一。研究人员通过考察多种合成路线,希望探索出普适性较好、反应条件温和的合成方法。
Scheme 1
Scheme 2
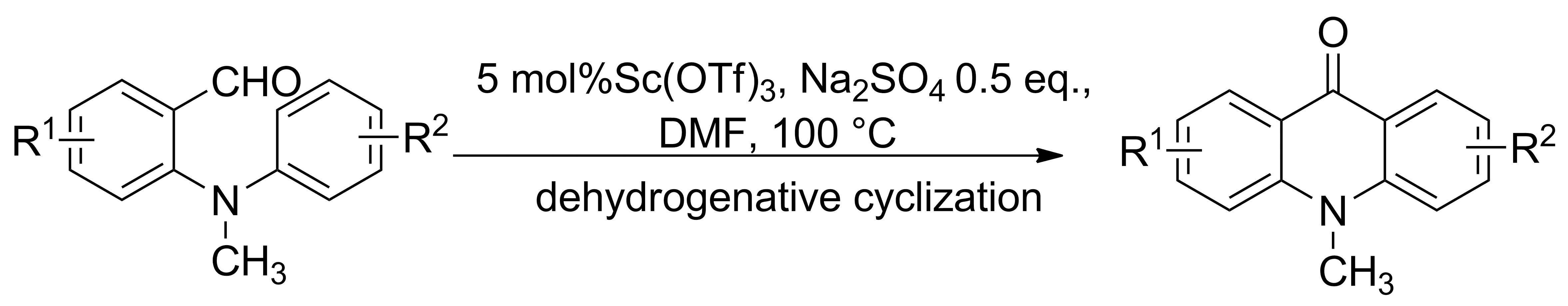
Scheme 3
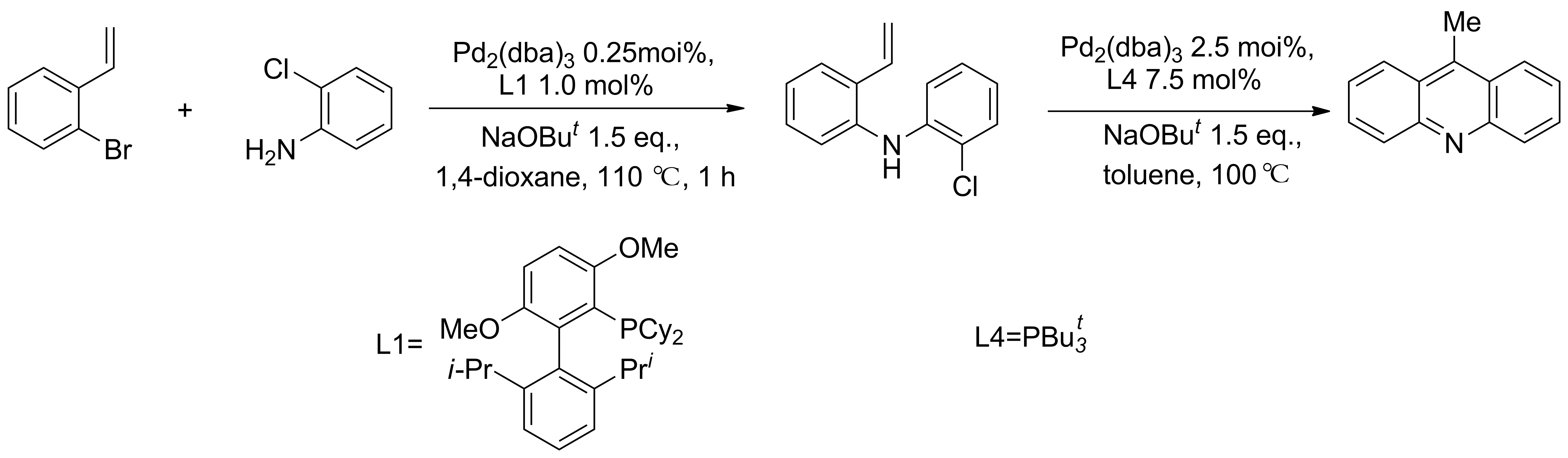
2010年,Tsvelikhovsky等[10]报道了一种合成吖啶类衍生物的新方法。2-溴苯乙烯和2-氯苯胺在钯催化下缩合制得二苯胺中间体,中间体在不同配体的钯的催化下经一步关环反应合成了吖啶类衍生物(Scheme 1)。该方法反应速率快,反应条件温和,产率较高,但对催化剂配体的要求比较苛刻,底物的普适性也较差。
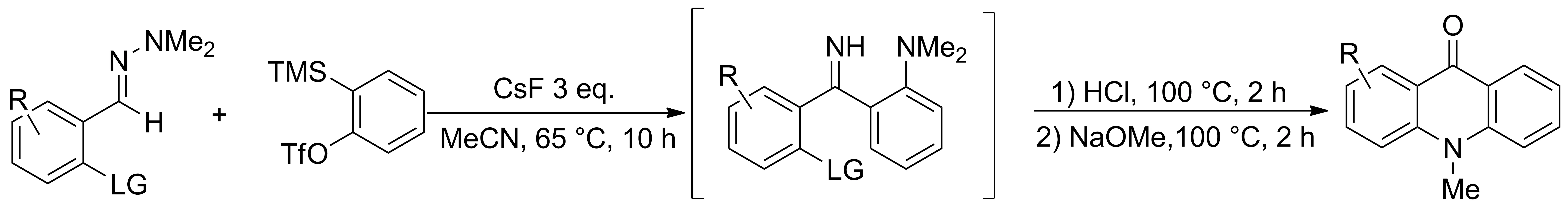
2012年,Dubrovskiy等[11]先通过CsF催化1,1-二甲基芳腙类化合物与芳炔反应制得亚胺中间体,再经盐酸和甲醇钠作用,合成了N-甲基吖啶酮类化合物(Scheme 2)。该方法底物普适性较好,底物不论含吸电子基团,还是供电子基团,均能反应,且产率较高,成本较低。用该方法已经成功合成了多种具有药物活性的天然产物(Chart 1)。
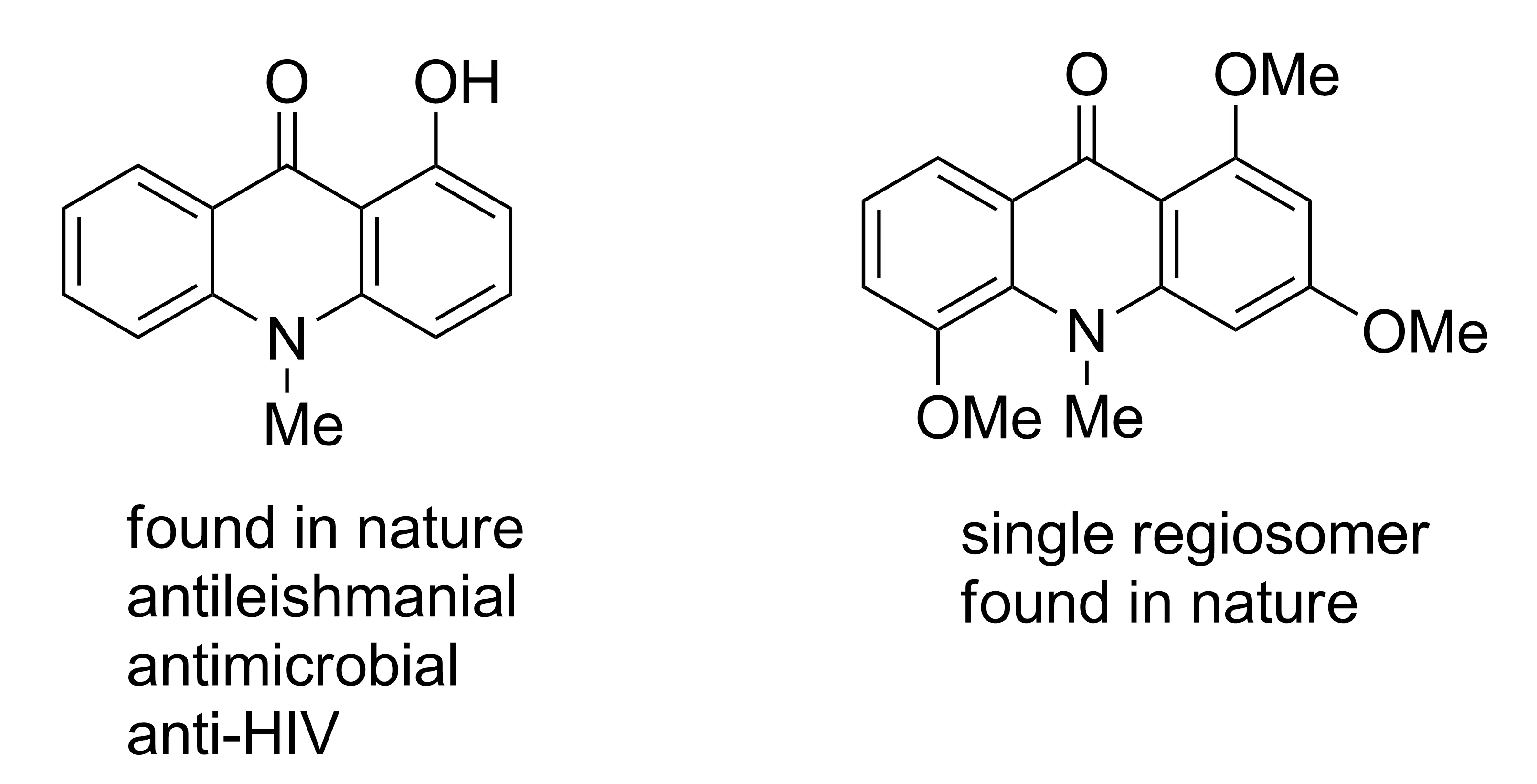
Chart 1
2014年,Zheng等[13]提出可通过分子内的芳基醛以Csp2—Csp2方式构筑吖啶酮衍生物。值得注意的是,该方法不使用金属催化,方法较新颖。以多种2-(N-芳基氨基)醛为原料,通过PhI(OAc)2和过氧化苯甲酰为媒介的分子内交叉脱氢偶联反应,直接与芳醛形成Csp2—Csp2键(Scheme 5)。该方法不需要醛基的预活化过程,适用范围较广,是一种构建含吖啶酮骨架的便利方法。
Scheme 4
Scheme 6
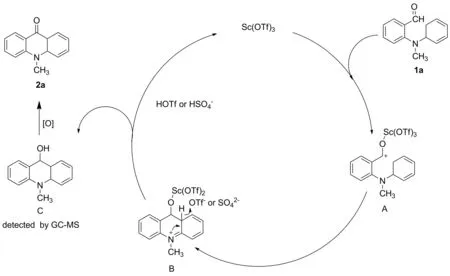
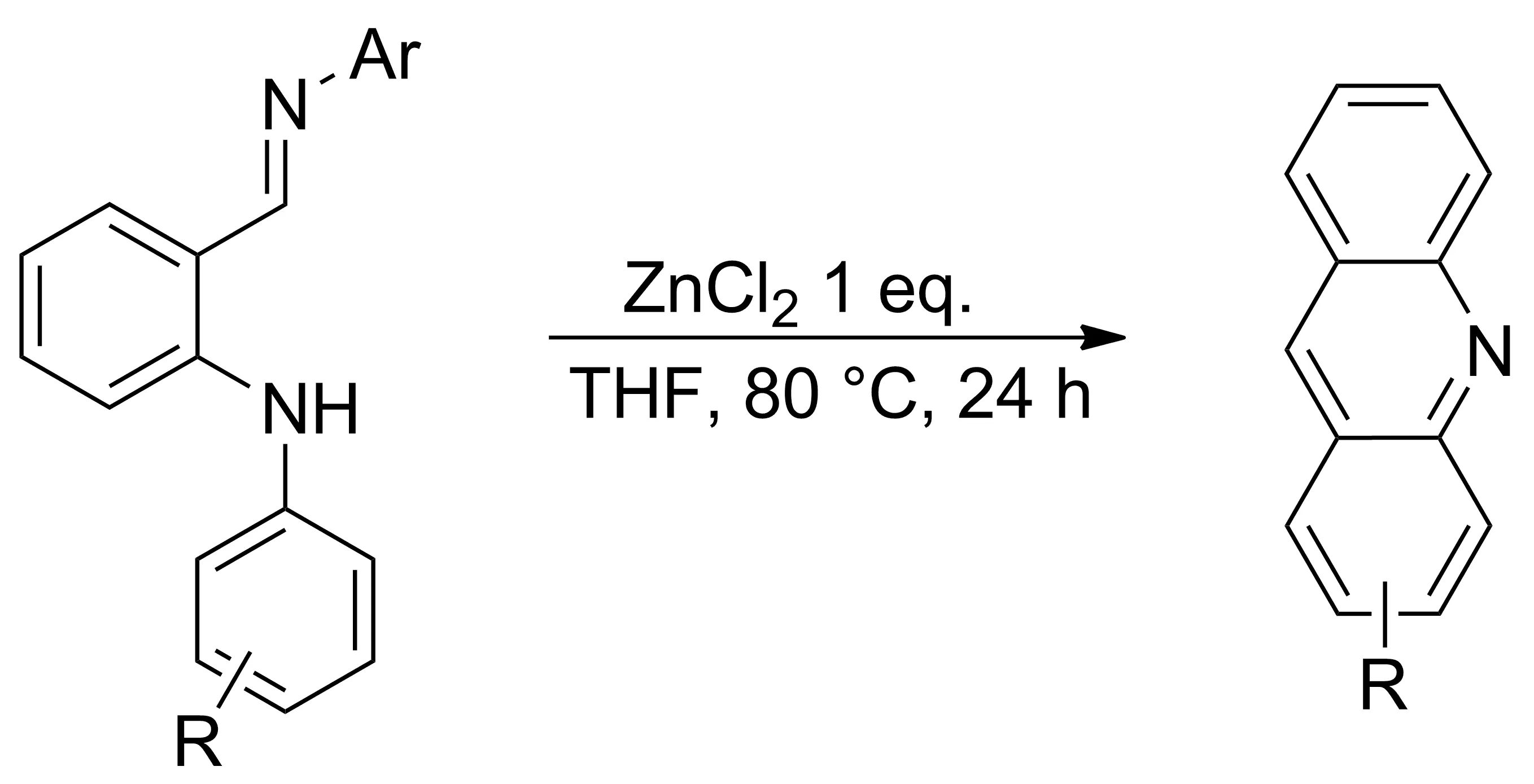
2014年,Su等[14]报道了一种简单高效合成吖啶类衍生物的方法。利用ZnCl2与邻芳基氨基苯席夫碱亚胺的氮原子形成ZnCl2络合物,锌原子诱导亚胺碳氮双键极化,使碳原子带正电荷,然后通过环化反应促使芳环上的分子内电子进攻胺基的邻位生成两性离子中间体,烯丙基碳正离子上的质子转移到氮负离子上形成取代9,10-二氢吖啶,最后在催化剂ZnCl2的作用下消去一分子芳胺并进一步芳构化形成稳定的吖啶类衍生物(Scheme 6)。通过氯化锌促进的邻苯基芳基胺类席夫碱化合物的环化反应合成吖啶衍生物,路线简洁,产率较高。该类环化反应也可通过双双环化反应应用到复杂多环氮杂芳族化合物的合成中。
综上可见,近年来分子内环化反应合成吖啶类衍生物的方法已经有了较大的发展与突破创新,但仍有一些无法克服的弊端和局限性,如催化剂成本较高,反应原料需有较高的活性等。
分子间环化反应合成吖啶类衍生物有多种方法,其中大多数化合物是通过[4+2]环加成反应和Lewis酸催化的Friedel-Crafts反应合成的。该方法具有反应条件温和,催化剂成本低廉,产率较高等优点,是今后的研究重点。
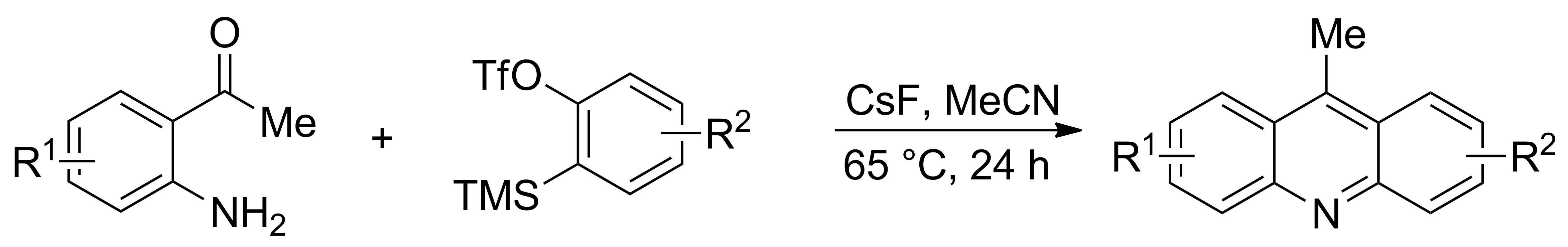
2010年,Rogness等[15]报道了通过分子间[4+2]环加成反应合成一系列吖啶酮类衍生物的方法。以芳炔和邻杂原子取代苯甲酮类化合物为原料,在氟化铯催化下合成吖啶酮类衍生物(Scheme 7)。该反应条件比较温和,催化剂价格低廉,且方法简单便捷,原料易得,唯一副产物为水,不足之处在于产率不高。
2012年,Huang等[16]从邻二卤代苯和N-甲基苯磺酰腙出发,经“一锅法”合成了含有多种官能团的吖啶类化合物(Scheme 8)。“一锅法”相对于已报道的两种耦合法,适用范围更广泛,反应步骤更简单,唯一不足之处在于催化剂较昂贵。
Scheme 7
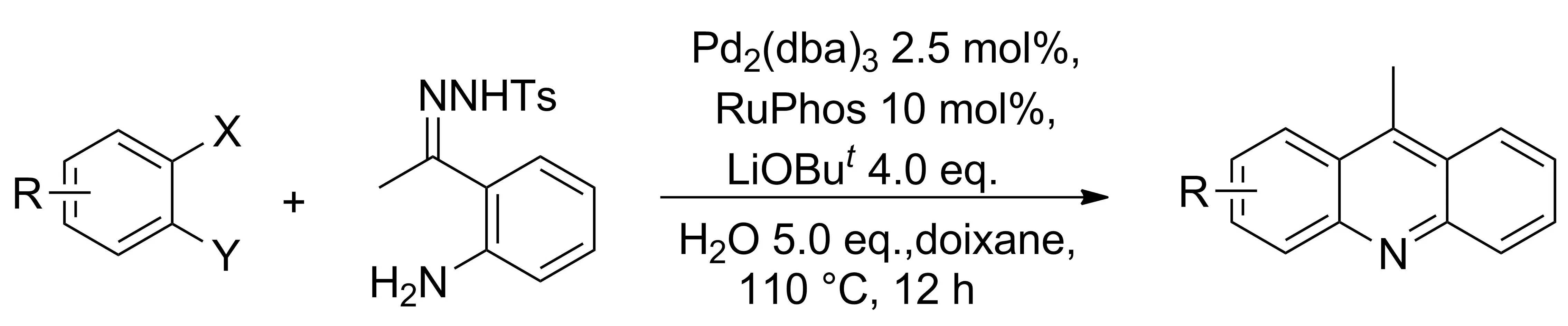
Scheme 8
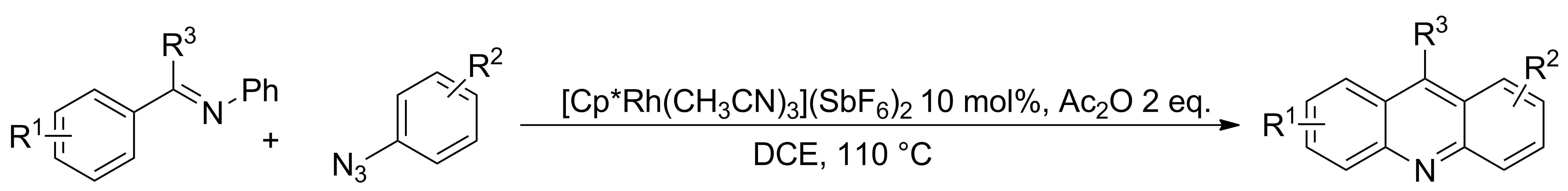
Scheme 9
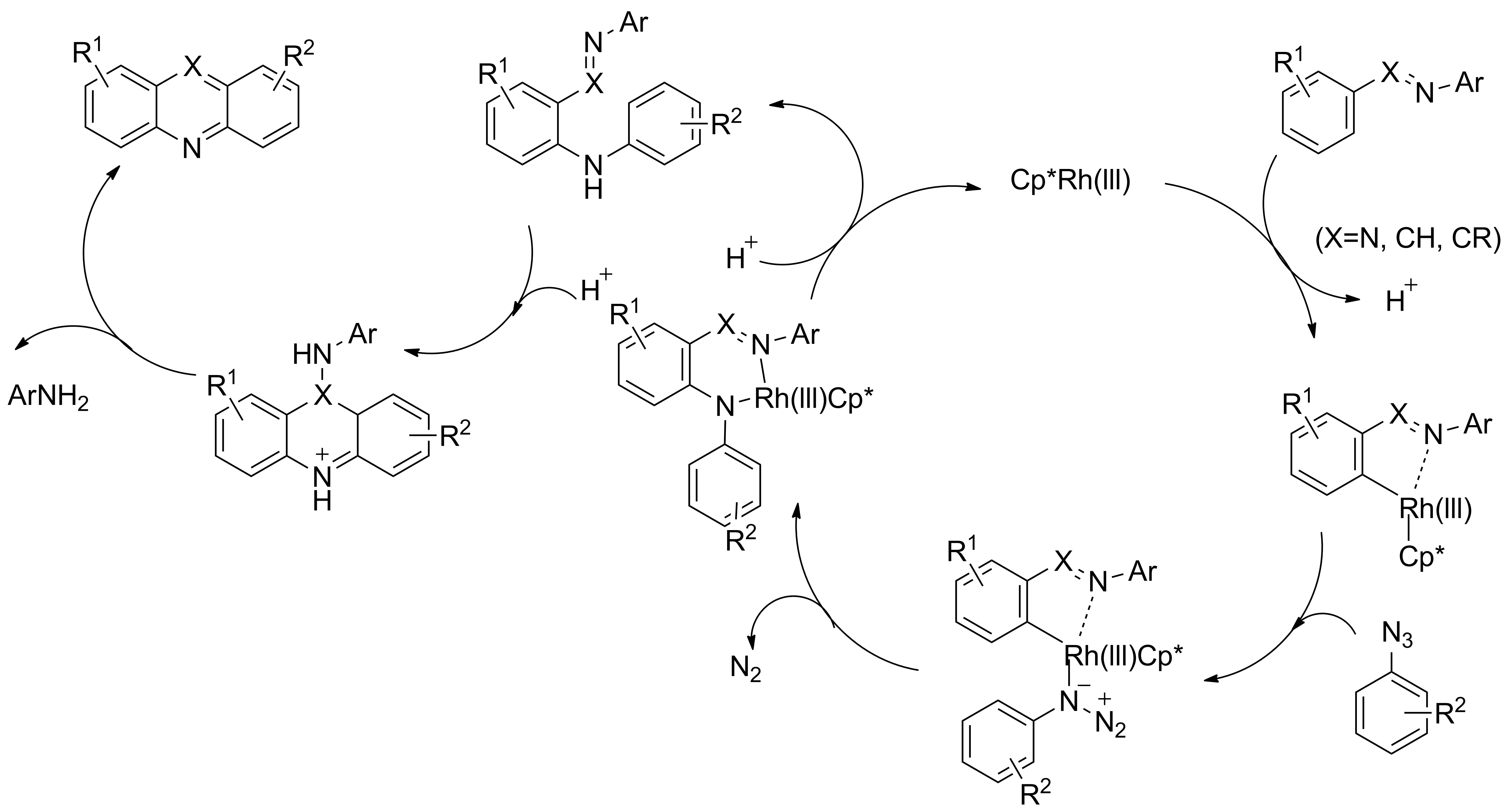
Scheme 10
2013年,Lian等[17]通过芳基亚胺与偶氮苯的芳香叠氮化物的[3+3]环化反应,合成了一系列吖啶类衍生物(Scheme 9)。在Rh(Ⅲ)催化下先进行胺化,随后通过分子内的芳族亲电取代和芳构化的级联过程合成吖啶类衍生物。
其反应机理为:亚胺或偶氮苯经过正交的C—H键活化,随后经配位和迁移插入叠氮化物提供金属环,金属环质子化释放二芳基胺和铑催化剂,最后进行分子内的芳香亲电取代和芳构化反应生成吖啶或吩嗪(Scheme 10)。反应一步完成,反应底物普适性好,产率较高,但对催化剂要求苛刻。
2015年,Pang等[18]报道了一种合成吖啶的全新方法。通过串联芳基化和Friedel-Crafts反应,由邻氰基苯胺和二芳基盐合成了9-氨基吖啶。在此基础上,他们又提出了更常用的方法,以邻酰基苯胺和二芳基盐为原料合成吖啶和吖啶酮。该反应在铜催化下或通过串联芳基化/Friedel-Crafts反应在高温下进行(Scheme 11)。该合成方法较为新颖,反应条件温和,催化剂廉价,无需贵金属催化也可以进行反应,产率较高。
同年,Wang等[19]以取代2-溴苯甲醛和苯胺为原料,经串联耦合和环化反应,成功合成吖啶类化合物(Scheme 12)。反应在三(二亚苄基丙酮)二钯和1,1′-双(二苯基膦)二茂铁催化下进行,产率较高。此外,抗白血病剂(DACA)也可以通过使用此方法制得。这一合成吖啶类衍生物的方法有良好的应用前景。

Scheme 11

Scheme 12
3 吖啶类化合物合成方法的展望
吖啶类衍生物的合成虽然已经取得了诸多成果,但报道的方法基本没有能够工业化。且大部分方法存在污染严重,催化剂昂贵,反应条件苛刻等缺点,高效绿色合成吖啶类衍生物仍然是一个难题。这就需要我们不断的探索研究,通过简单易得的原料,廉价、绿色的催化剂以及温和的反应条件,找到更环保的方法,使原子经济性更高,对环境更为友好,争取早日实现工业化生产。
[1] Geddes C D. Optical thin film polymeric sensors for the determination of aqueous chloride,bromide and iodide ions at high pH,based on the quenching of fluorescence of two acridinium dyes[J].Dyes Pigm,2000,45:243-251.
[2] Dollinger S, Lober S, Klingenstein R,etal. A chimeric ligand approach leading to potent antiprion active acridine derivatives:Design,synthesis,and biological investigations[J].J Med Chem,2006,49:659-6595.
[3] Ma Z, Choudhury J R, Saluta G,etal. A non-cross-linking platinum-acridine agent with potent activity in non-small-cell lung cancer [J].J Med Chem,2008,51:7574-7580.
[4] Denny W A. Acridine derivatives as chemotherapeutic agents[J].J Med Chem,2002,9:1655-1665.
[5] Goodell J R, Ougolkov A V, Hiasa H,etal. Acridine-based agents with topoisomerase II activity inhibit pancreatic cancer cell proliferation and induce apoptosis[J].J Med Chem,2008,51:179-182.
[6] Cheng M K, Modi C, Cookson J C,etal. Antitumor polycyclic acridines. Search for DNA quadruplex binding selectivity in a series of 8,13-dimethylquino[4,3,2-kl]acridinium salts:Telomere-targeted agents[J].J Med Chem,2008,51:963-975.
[7] Zhang D, Jiang X, Yang H,etal. Acridine-based macrocyclic fluorescent sensors:Self-assembly behavior characterized by crystal structures and a tunable bathochromic-shift in emission induced by H2PO4viaadjusting the ring size and rigidity[J].Org Biomol Chem,2013,11:3375-3381.
[8] Ye X, Plessow P, Brinks M K,etal. Alcohol amination with ammonia catalyzed by an acridine-based ruthenium pincer complex:A mechanistic study[J].J Am Chem Soc,2014,136:5923-5929.
[9] Graham L A, Suryadi J, West T K,etal. Synthesis,aqueous reactivity,and biological evaluation of carboxylic acid ester-functionalized platinum-acridine hybrid anticancer agents[J].J Med Chem,2012,55:7817-7827.
[10] Tsvelikhovsky D, Buchwald S. Synthesis of heterocyclesviaPd-ligand controlled cyclization of 2-chloro-N-(2-vinyl)aniline:Preparation of carbazoles,indoles,dibenzazepines,and acridines[J].J Am Chem Soc,2010,132:14048-14051.
[11] Dubrovskiy A, Larock R. Synthesis ofo-(dimethylamino)aryl ketones,acridones,acridinium salts,and 1H-indazoles by the reaction of hydrazones and arynes[J].J Org Chem,2012,77:11232-11256.
[12] Li X A, Wang H L, Yang S D. Sc(OTf)3-catalyzed dehydrogenative cyclization for synthesis ofN-methylacridones[J].Org Lett,2013,15(8):1794-1797.
[13] Zheng Z S, Dian L Y, Yuan Y C,etal. PhI(OAc)2-mediated intramolecular oxidative aryl-aldehyde Csp2—Csp2bond formation:Metal-free synthesis of acridone derivatives[J].J Org Chem,2014,79(16): 7451-7458.
[14] Su Q, Li P, He M N,etal. Facile synthesis of acridine derivatives by ZnCl2-promoted intramolecular cyclization ofo-arylaminophenyl Schiff bases[J].Org Lett,2014,16(1):18-21.
[15] Rogness D C, Larock R C. Synthesis of acridines by the [4+2]annulation of arynes and 2-aminoaryl ketones[J].J Org Chem,2010,75:2289-2295.
[16] Huang Z X, Yang Y, Xiao Q,etal. Auto-tandem catalysis:Synthesis of acridines by Pd-catalyzed C=C bond formation and C(sp2)-Ncross-coupling[J].Eur J Org Chem,2012,33:6586-6593.
[17] Lian Y J, Hummel J R, Bergman R G,etal. Facile synthesis of unsymmetrical acridines and phenazines by a Rh(III)-catalyzed amination/cyclization/aromatization cascade[J].J Am Chem Soc,2013,135(34):12548-12551.
[18] Pang X L, Lou Z B, Li M,etal. Tandem arylation/Friedel-Crafts reactions ofo-acylanilines with diaryliodonium salts:A modular synthesis of acridine derivatives[J].Eur J Org Chem,2015,15:3361-3369.
[19] Wang T J, Chen W W, Li Y,etal. Facile synthesis of acridinesviaPd(0)-diphosphine complex-catalyzed tandem coupling/cyclization protocol[J].Org Biomol Chem,2015,13:6580-6586.
Research Progress on Synthesis of Acridine Derivatives
WEI Qiang, GENG Xin-le*
(College of Chemical and Biological Engineering, Lanzhou Jiaotong University, Lanzhou 730070, China)
Acridine derivatives were widely used in biological pharmacy, function material, fluorescent mark, etc, due to its well bio-activities. However, the difficulties in synthesizing of acridine derivatives limited its application. The synthesis methods for acridine derivatives through catalyst-activited acyl cyclization, including intramolecular cyclization and intermolecular cyclization, were reviewed with nineteen references. The future development was prospected as well.
acridine derivative; intramolecular; intermolecular; synthesis; research advance; review
2016-11-06
国家自然科学基金资助项目(51402324)
魏强(1994-),男,汉族,山西太原人,硕士研究生,主要从事有机合成的研究。
耿新乐,硕士研究生, E-mail: gengxl007@163.com
O629.34
A
10.15952/j.cnki.cjsc.1005-1511.2017.02.16288

