新型吡啶类c-Met激酶抑制剂的设计、合成及抗肿瘤活性
宋 平, 李俊明, 秦婷婷, 常先磊,杨 洋, 梁 欢, 祝 宇, 赵砚瑾, 李庶心,*
(1. 江西中医药大学 研究生部,江西 南昌 330006; 2. 军事医学科学院 放射与辐射医学研究所,北京 100850;3. 广西医科大学 研究生院,广西 南宁 530021; 4. 广东药科大学 药科学院,广东 广州 510006)
·研究论文·
新型吡啶类c-Met激酶抑制剂的设计、合成及抗肿瘤活性
宋 平1, 李俊明1, 秦婷婷3, 常先磊2,杨 洋4, 梁 欢1, 祝 宇1, 赵砚瑾2, 李庶心1,4*
(1. 江西中医药大学 研究生部,江西 南昌 330006; 2. 军事医学科学院 放射与辐射医学研究所,北京 100850;3. 广西医科大学 研究生院,广西 南宁 530021; 4. 广东药科大学 药科学院,广东 广州 510006)
以BMS-777607和E7050为先导化合物,设计并合成了11个新型的吡啶类c-Met激酶抑制剂(9a~9f和10a~10e),其结构经1H NMR和MS(ESI)表征。采用MTT法测定了9a~9f和10a~10e对人胃癌细胞株(NCI-N87和GTL-16)的体外抗肿瘤细胞增殖活性。结果表明:9a, 9d和10a对GTL-16的抑制活性较好,其IC50分别为0.60 μmol·L-1, 1.36 μmol·L-1和0.93 μmol·L-1,优于BMS-777607(2.50 μmol·L-1)。
c-Met激酶抑制剂; 吡啶衍生物; 合成; 抗肿瘤活性
c-Met是一种重要的酪氨酸激酶[1],它和配体HGF已经成为一个很有潜力的癌症治疗靶点[2]。c-Met信号通路通过自分泌、旁分泌、扩增、突变激活等方式作用在所有的肿瘤实体中,是导致肿瘤形成和转移的重要交叉点[3]。以c-Met为靶标可以相对容易地实现对多通路的同时干扰,针对c-Met受体的抗肿瘤药物为恶性肿瘤的治疗提拱了新的机遇[4]。由于现有c-Met激酶抑制剂存在品种较少、抗肿瘤活性较低、毒副作用较大等缺点,寻找活性更高、副作用更小的新型c-Met激酶抑制剂[5]对肿瘤患者具有积极意义。

Chart 1
本文在课题组前期研究的基础上,根据吡啶类c-Met激酶抑制剂的结构特点,以BMS-777607和E7050为先导化合物,通过借鉴双方的优势基团,提高了化合物的酶活性和细胞活性。此外,还通过修饰酶抑制区的结合基团,以期提高抗肿瘤活性(Chart 1)。根据以上设计思路,以4-氯吡啶甲酸为原料,合成了11个新型的吡啶类c-Met激酶抑制剂(9a~9f和10a~10e, Scheme 1),其结构经1H NMR和ESI-MS表征。并以BMS-777607为阳性对照物,采用MTT法研究了9和10对人胃癌细胞(GTL-16和NCI-N87)的体外抗肿瘤细胞增殖活性。
1 实验部分
1.1 仪器与试剂
RY-1型熔点仪(温度未校正);JNM-ECA-400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Q-TOF型质谱仪。
所用试剂均为分析纯。
1.2 合成
(1) 4-氯吡啶甲酰氯盐酸盐(1)的合成
在三颈瓶中加入4-氯吡啶甲酸120 g和氯化亚砜200 mL,搅拌使其溶解;回流(75 ℃)反应4 h。旋蒸除去大部分氯化亚砜,加入甲苯,除去剩余氯化亚砜,旋干得金黄色固体1,加入重蒸的二氯甲烷溶解,直接投入下一步反应。
(2) 4-氯吡啶酰胺(2)的合成
在烧杯中加入浓氨水2 L,搅拌下于-4 ℃缓慢加入1,生成大量固体。抽滤,滤饼依次用饱和碳酸钾溶液和水洗涤至中性,抽干,残余物自然干燥后用混合溶剂[V(石油醚) ∶V(乙酸乙酯)=1 ∶10]重结晶得白色固体2 99.4 g,收率83.4%, m.p.167~169 ℃。
(3) 叔丁基{4-[(2-氨基甲酰基吡啶-4-基)氧基]苯基}氨基甲酸叔丁酯(3)的合成
在三颈瓶中加入叔丁醇钾57.5 g和重蒸DMF 500 mL,搅拌下于0 ℃加入叔丁基(4-羟基苯基)氨基甲酸107.2 g,加毕,搅拌30 min,加入2 80.0 g和重蒸THF 50 mL,于75 ℃反应8 h。依次加入饱和食盐水(150 mL)和乙酸乙酯(200 mL),分液,合并有机层,用无水硫酸钠干燥,抽滤,滤饼旋蒸,残余物用异丙醇重结晶得棕黄色固体3 72.2 g,收率42.8%, m.p.178~180 ℃;1H NMRδ: 1.45(s, 9H), 7.13~7.16(m, 3H), 7.35~7.36(d,J=2.6 Hz, 1H), 7.57~7.59(d,J=8.8 Hz, 2H), 7.72(s, 1H), 8.13(s, 1H), 8.49~8.51(d,J=5.6 Hz, 1H), 9.49(s, 1H)。

Scheme 1
(4) 叔丁基{4-[(2-氨基吡啶-4-基)氧基]苯基}氨基甲酸叔丁酯(4)的合成
将3 60.0 g溶解于混和溶剂[V(1,4-二氧六环) ∶V(甲醇)=1 ∶1]150 mL中,冰盐浴冷却至-4 ℃,滴加1.6 mol·L-1次氯酸钠溶液和3.6 mol·L-1氢氧化钠溶液的混和溶液(V∶V=1 ∶1)150 mL,滴毕,于5 ℃反应约3.5 h。快速升温至80 ℃,反应约2 h。冷却至室温,析出大量固体,抽滤,滤饼用水洗涤至中性,抽干得棕红色固体4 20.2 g,收率37.3%, m.p.135~138 ℃。
(5) 叔丁基【4-{[2-(苯氧基甲酰氨基)吡啶-4-基]氧基}苯基】氨基甲酸叔丁酯(5)的合成
将4 18.0 g和三乙胺12.1 g溶解于重蒸二氯甲烷80 mL中,于-4 ℃滴加氯甲酸苯酯12.52 g,滴毕,于5 ℃反应约2 h。搅拌析出固体,抽滤,滤饼用石油醚洗至白色,抽干得白色固体5 19.3 g,收率76.2%, m.p.153~156 ℃;1H NMRδ: 1.47~1.48(d,J=5.1 Hz, 9H), 6.66~6.68(dd,J=5.7 Hz, 2.3 Hz, 1H), 6.74~6.76(m, 1H), 7.02~7.08(m, 2H), 7.14~7.18(m, 2H), 7.24~7.27(t,J=7.4 Hz, 1H), 7.30~7.31(d,J=2.3 Hz, 1H), 7.39~7.43(m, 1H), 7.49~7.53(m, 2H), 8.17~8.19(d,J=5.8 Hz, 1H), 9.44~9.46(d,J=7.9 Hz, 1H), 10.79(s, 1H)。
(6) 7a~7f的合成(以7a为例)
将5 3.0 g, 1-甲基-4-(4-哌啶基)哌嗪盐酸盐1.72 g和N,N-二异丙基乙基胺1.84 g溶解于DMF 60 mL中,于50 ℃反应约2.5 h。冷却至室温,依次加入乙酸乙酯和饱和食盐水,分液,合并有机层,用无水硫酸钠干燥,抽滤,滤液减压蒸馏,残余物用适量乙酸乙酯溶解,加入大量石油醚,析出白色固体,抽滤,滤饼自然干燥得白色固体叔丁基【4-【{2-[4-(4-甲基哌嗪-1-基)哌啶-1-甲酰氨基]吡啶-4-基}氧基】苯基】氨基甲酸叔丁酯(7a)2.2 g,收率60.5%, m.p.165~168 ℃。
用类似的方法合成7b~7f。
(7) 8a~8f的合成(以8a为例)
将7a 2.0 g溶解于重蒸二氯甲烷40 mL中,加入三氟乙酸45 mL,反应0.5 h。减压蒸除二氯甲烷和大部分三氟乙酸,用饱和碳酸钾溶液调至pH 7,用二氯甲烷萃取,有机相用无水硫酸钠干燥,抽滤,滤液减压蒸馏,残余物加入混合溶剂[V(乙酸乙酯) ∶V(石油醚)=1 ∶10],抽滤,滤饼自然干燥得白色固体N-[4-(4-氨基苯氧基)吡啶-2-基]-4-(4-甲基哌嗪-1-基)哌啶-1-甲酰胺(8a)0.82 g,收率51.4%, m.p.163~169 ℃。
用类似的方法合成8b~8f。
(8) 9a~9f和10a~10e的合成(以9a为例)
在三颈瓶中加入8a 0.30 g和重蒸THF 20 mL,搅拌使其溶解;搅拌下加入碳酸钾0.21 g和2-(4-氟苯基)-3-氧代-2,3-二氢哒嗪-4-甲酰氯0.28 g,氮气保护下反应4 h。旋蒸除去THF,残余物用二氯甲烷50 mL溶解,用饱和碳酸钾溶液萃取,有机层用饱和食盐水洗涤,无水硫酸钠干燥,抽滤,滤饼经硅胶柱层析[V(二氯甲烷) ∶V(甲醇)=35 ∶1]纯化得黄绿色固体2-(4-氟苯基)-N-【4-【{2-[4-(4-甲基哌嗪-1-基)哌啶-1-甲酰胺]吡啶-4-基}氧基】苯基】-3-氧代-2,3-二氢哒嗪-4-甲酰胺(9a)0.29 g,收率62.6%, m.p.204~206 ℃。
用类似的方法合成黄绿色固体9b~9f,收率和熔点分别为:65.1%, m.p.122~124 ℃; 50.9%, m.p.244~248 ℃; 62.7%, m.p.225~228 ℃; 62.3%, m.p.203~206 ℃; 61.8%, m.p.209~212 ℃。
用类似的方法合成白色固体10a~10e,收率和熔点分别为:63.2%, m.p.196~199 ℃; 64.7%, m.p.184~185 ℃; 53.3%, m.p.181~183 ℃; 63.5%, m.p.190~192 ℃; 60.7%, m.p.167~170 ℃。
9a:1H NMRδ: 1.23~1.28(m, 2H), 1.70~1.72(d,J=11.0 Hz, 2H), 1.97~1.99(d,J=6.9 Hz, 1H), 2.17(s, 3H), 2.35(s, 4H), 2.49~2.50(m, 4H), 2.70~2.76(t,J=6.1 Hz, 2H), 3.49~3.52(m, 1H), 4.08~4.11(d,J=12.8 Hz, 2H), 6.57~6.59(dd,J=5.7 Hz, 2.3 Hz, 1H), 7.18~7.20(d,J=8.8 Hz, 2H), 7.37~7.43(m, 2H), 7.67~7.70(dd,J=8.8 Hz, 5.0 Hz, 2H), 7.81~7.83(d,J=8.9 Hz, 2H), 8.10~8.11(d,J=5.7 Hz, 1H), 8.25~8.26(d,J=4.1 Hz, 1H), 8.36~8.37(d,J=4.2 Hz, 1H), 9.19(s, 1H), 11.59(s, 1H); MS(ESI)m/z: 626.2{[M+H]+}。
9b:1H NMRδ: 2.44(s, 3H), 2.61(s, 4H), 3.67(s, 4H), 6.55~6.57(dd,J=6.0 Hz, 2.3 Hz, 1H), 7.09~7.12(m, 2H), 7.23~7.26(m, 4H), 7.58~7.62(m, 2H), 7.77~7.80(m, 1H), 7.99~8.01(d,J=5.9 Hz, 1H), 8.21~8.22(d,J=4.2 Hz, 1H), 8.40~8.41(d,J=4.2 Hz, 1H), 11.70(s, 1H); MS(ESI)m/z: 543.2{[M+H]+}。
9c:1H NMRδ: 2.27(s, 3H), 2.55(s, 4H), 3.07(s, 4H), 6.60~6.62(dd,J=5.8 Hz, 2.3 Hz, 1H), 6.87~6.90(d,J=9.0 Hz, 2H), 7.01~7.02(d,J=4.0 Hz, 1H), 7.21~7.23(d,J=9.0 Hz, 2H), 7.30~7.32(d,J=9.0 Hz, 2H), 7.39~7.44(t,J=7.1 Hz, 2H), 7.67~7.71(dd,J=9.0 Hz, 5.0 Hz, 2H), 7.83~7.86(d,J=9.0 Hz, 2H), 8.15~8.17(d,J=5.9 Hz, 1H), 8.26~8.27(d,J=4.2 Hz, 1H), 8.37~8.38(d,J=4.2 Hz, 1H), 9.29(s, 1H), 10.20(s, 1H), 11.60(s, 1H); MS(ESI)m/z: 634.3{[M+H]+}。
9d:1H NMRδ: 2.73~2.75(d,J=5.1 Hz, 2H), 2.91(m, 4H), 3.18(s, 4H), 3.85~3.95(dt,J=19.2 Hz, 9.0 Hz, 1H), 4.19~4.21(m, 1H), 6.32(s, 1H), 6.52~6.54(d,J=6.1 Hz, 1H), 6.88~6.90 (d,J=8.8 Hz, 2H), 7.09~7.11(d,J=8.8 Hz, 2H), 7.23~7.26(m, 5H), 7.43~7.45(d,J=8.7 Hz, 2H), 7.58~7.62(m, 3H), 7.79~7.81(d,J=8.8 Hz, 2H), 8.05~8.06(d,J=6.0 Hz, 1H), 8.22~8.23(d,J=4.1 Hz, 1H), 8.41~8.42(d,J=4.1 Hz, 1H), 11.34(s, 1H), 11.73(s, 1H); MS(ESI)m/z: 670.3{[M+H]+}。
9e:1H NMRδ: 3.09~3.12(m, 4H), 3.84~3.87(m, 4H), 6.57(s, 1H), 6.87~6.90(d,J=8.4 Hz, 2H), 7.08~7.09(d,J=8.7 Hz, 2H), 7.22~7.25(m, 3H), 7.43~7.45(d,J=8.6 Hz, 2H), 7.58~7.61(m, 2H), 7.80~7.82(d,J=8.4 Hz, 2H), 8.03(s, 1H), 8.22~8.23(d,J=4.1 Hz, 1H), 8.40~8.41(d,J=4.2 Hz, 1H), 11.74(s, 1H); MS(ESI)m/z: 621.2{[M+H]+}。
9f:1H NMRδ: 1.51~1.72(m, 6H), 1.94~2.00(m, 1H), 4.13~4.18(dd,J=13.0 Hz, 6.4 Hz, 1H), 6.27(s, 1H), 6.48~6.49(d,J=5.4 Hz, 1H), 7.07~7.09(d,J=8.9 Hz, 2H), 7.23~7.25(m, 3H), 7.58~7.62(m, 2H), 7.78~7.80(d,J=8.9 Hz, 2H), 7.95~7.97(d,J=6.0 Hz, 1H), 8.22~8.23(d,J=4.1 Hz, 1H), 8.40~8.41(d,J=4.1 Hz, 1H), 9.13(s, 1H), 11.73(s, 1H); MS(ESI)m/z: 528.2{[M+H]+}。
10a:1H NMRδ: 1.46~1.51(m, 2H), 1.88~1.51(d,J=11.9 Hz, 2H), 2.39(s, 1H), 2.48~2.69(m, 8H), 2.85~2.91(t,J=11.8 Hz, 2H), 3.61~3.62(m, 1H), 4.10~4.14(d,J=13.1 Hz, 2H), 6.48~6.50(dd,J=5.8 Hz, 2.3 Hz, 1H), 6.59~6.63(m, 1H), 7.05~7.08(m, 2H), 7.25~7.30(m, 3H), 7.40~7.43(m, 2H), 7.60~7.63(m, 2H), 7.75~7.77(m, 2H), 8.00~8.01(d,J=5.7 Hz, 1H), 8.73~8.76(dd,J=7.3 Hz, 2.2 Hz, 1H), 11.84(s, 1H); MS(ESI)m/z: 625.3{[M+H]+}。
10b:1H NMRδ: 2.40(s, 3H), 2.54(s, 4H), 3.61(s, 4H), 6.51~6.53(dd,J=5.9 Hz, 2.2 Hz, 1H), 6.60~6.63(t,J=6.9 Hz, 1H), 7.06~7.08(d,J=8.9 Hz, 2H), 7.25~7.30(m, 2H), 7.40~7.43(m, 2H), 7.61~7.63(dd,J=6.6 Hz, 2.2 Hz, 2H), 7.76~7.79(d,J=8.9 Hz, 2H), 7.98~8.00(d,J=5.6 Hz, 1H), 8.74~8.77(dd,J=7.3 Hz, 2.2 Hz, 1H), 11.88(s, 1H); MS(ESI)m/z: 542.2{[M+H]+}。
10c:1H NMRδ: 2.36(s, 3H), 2.58~2.61(m, 4H), 3.15~3.18(m, 4H), 6.26(s, 1H), 6.49~6.51(dd,J=5.9 Hz, 2.1 Hz, 1H), 6.59~6.63(t,J=6.7 Hz, 1H), 6.88~6.91(d,J=9.0 Hz, 2H), 7.04~7.06(d,J=9.0 Hz, 2H), 7.24~7.28(m, 3H), 7.37~7.47(m, 5H), 7.60~7.62(dd,J=6.6 Hz, 2.2 Hz, 1H), 7.76~7.78(d,J=8.9 Hz, 2H), 8.03~8.04(d,J=5.9 Hz, 1H), 8.73~8.76(dd,J=7.3 Hz, 2.2 Hz, 1H), 11.90(s, 1H); MS(ESI)m/z: 633.3{[M+H]+}。
10d:1H NMRδ: 2.36(s, 3H), 2.58~2.61(m, 4H), 3.15~3.18(m, 4H), 6.26(s, 1H), 6.49~6.51(dd,J=5.9 Hz, 2.1 Hz, 1H), 6.59~6.63(t,J=6.7 Hz, 1H), 6.88~6.91(d,J=9.0 Hz, 2H), 7.04~7.06(d,J=9.0 Hz, 2H), 7.24~7.28(m, 3H), 7.37~7.47(m, 5H), 7.60~7.62(dd,J=6.6 Hz, 2.2 Hz, 1H), 7.76~7.78(d,J=8.9 Hz, 2H), 8.03~8.04(d,J=5.9 Hz, 1H), 8.73~8.76(dd,J=7.3 Hz, 2.2 Hz, 1H), 11.90(s, 1H); MS(ESI)m/z: 669.3{[M+H]+}。
10e:1H NMRδ: 3.10~3.12(m, 4H), 3.85~3.87(m, 4H), 6.35(s, 1H), 6.53~6.55(d,J=6.0 Hz, 2H), 6.88~6.90(d,J=9.0 Hz, 2H), 7.06~7.08(d,J=8.9 Hz, 2H), 7.28~7.30(m, 2H), 7.40~7.46(m, 4H), 7.66~7.67(d,J=3.0 Hz, 1H), 7.77~7.79(d,J=8.9 Hz, 2H), 8.03~8.04(d,J=6.0 Hz, 1H), 8.70~8.71(d,J=3.0 Hz, 1H), 11.79(s, 1H); MS(ESI)m/z: 620.2{[M+H]+}。
1.3 体外抗肿瘤增殖活性测试
以BMS-777607为阳性对照物,采用MTT法[6-7]测试了9a~9f和10a~10e对人胃癌细胞株(NCI-N87TL-16[8])的体外抗肿瘤活性。
从液氮中取出细胞冻存管,于39 ℃快速融化,转移至15 mL离心管中,加入含10%FBS培养液10 mL,于1 000 rpm离心5 min,去除培养基,重新加入含10%FBS和双抗的培养液,转移至培养瓶中培养。取对数生长期细胞,去除培养瓶中的培养液,用PBS润洗细胞一次,胰酶消化离心收集,用含10%胎牛血清的培养基重悬,计数并调整到合适浓度(细胞密度5×104个/mL,细胞活力>90%),将细胞悬液加入96孔板,每孔100 μL。目标化合物均用DMSO配制成20 μL溶液,将待测目标化合物用DMSO 3倍梯度稀释。分别取5 μL稀释好的化合物溶液加入到495 μL含10%FBS的培养基中,配制成待测化合物。取100 μL含待测化合物的溶液加到96孔板相应孔中,在二氧化碳细胞培养箱中培养72 h。去除培养基,每孔加入0.3 mg·mL-1XTT工作液(0.002 65 mg·mL-1PMS)150 μL,在二氧化碳培养箱中放置2 h。微孔板振荡器震荡5 min,用酶标仪读取450 nm处吸光值A450,计算待测化合物的半数增殖抑制浓度(IC50)[9]。
2 结果与讨论
2.1 体外抗肿瘤增殖活性
表1为9a~9f和10a~10e对人胃癌细胞株NCI-N87和GTL-16的体外抗肿瘤细胞增殖活性。由表1可以看出,9a, 9d和10a对GLT-16抑制活性较好,拟作为候选药作进一步研究。根据先导化合物与c-Met激酶结合的特点以及所合成的化合物的初步活性数据,推测该类化合物的构效关系如下:(1)结构B中,用3-哒嗪酮取代2-吡啶酮可明显增强化合物的活性,即该结构上用体积较大的杂环取代对增强化合物的活性有利;(2)在D环上引入不同氨基取代基均能增强化合物的活性;(3)氨基取代基中含氮原子越多,化合物与c-Met的亲和力越强,抑酶活性越强。
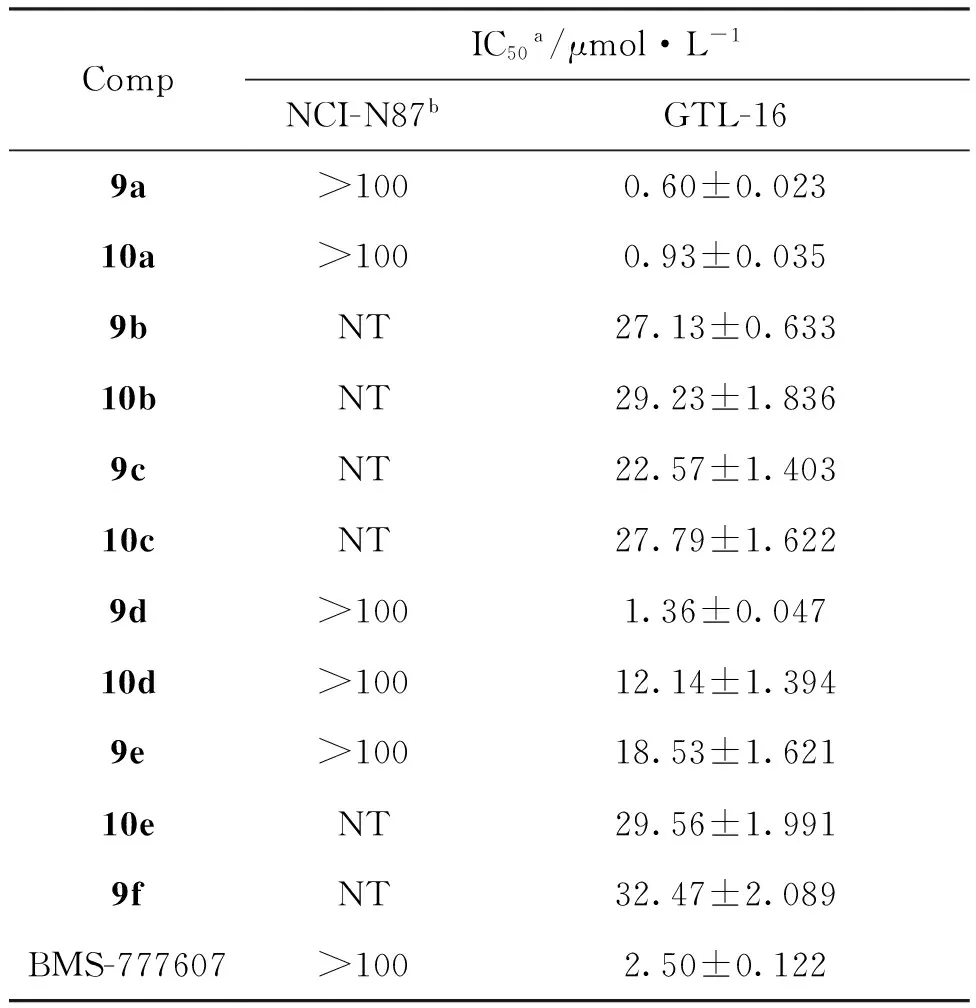
表1 9和10的抑制活性Table 1 The inhibition activities of 9 and 10
a所测得的活性数据来源于三组平行独立实验的均值±标准差;b目标化合物的IC50>100,被认为无抗肿瘤活性。
根据生物电子等排原理和拼接原理和c-Met抑制剂与生物大分子的互补性原则,设计并合成了11个新化合物(9a~9f和10a~10e)。采用MTT法研究了9a~9f和10a~10e对人胃癌细胞(GTL-16和NCI-N87)的体外抗肿瘤细胞增殖活性。结果表明: 9a(IC50=0.60 μmol·L-1), 10a(IC50=0.93 μmol·L-1)和9d(IC50=1.36 μmol·L-1)对GTL-16的抑制活性明显优于阳性药BMS-777607(IC50=2.5 μmol·L-1)。本研究对优化吡啶类抗肿瘤药物结构有一定借鉴意义。
[1] Blume J P, Hunter T. Oncogenic kinase signaling[J].Nature,2001,411(6835):355-365.
[2] 郑红,周有骏,王小燕. 抗肿瘤药物研究进展[J].中国新药与临床杂志,2005,24(2):139-143.[3] Liu X D, Robert C, Newton P A S. Developing c-Met pathway inhibitors for cancer therapy:Progress and challenges[J].Cell,2009,22(16):37-45.
[4] Tsatas D, Kanagasundaram V, Kaye A,etal. EGF receptor modifies cellular responses to hyaluronan in glioblastoma cell lines[J].J Clin Neurosci,2002,13(9):282-288.
[5] 王海勇,王林,杨晓明,等. 基于c-Met 信号通路的抗癌药物研究进展[J].国际药学研究杂志,2007,34(6):401-418.
[6] Carmichael J, DeGraff W C, Gazdar A F,etal. Evaluation of a tetrazolium-based semiautomated colorimetric assay:Assessment of chemosensitivity[J].Cancer Res,1987,47(4):943-946.
[7] 韩锐. 抗肿瘤筛选方法及毒理试验[M].北京:北京医科大学&中国协和医科大学联合出版,1991.
[8] Rege C G, Scaravaglio P, Carozzi F,etal. Karyotypic analysis of gastric carcinoma cell lines carrying an amplified c-Met oncogene[J].Cancer Genet Cytogenet,1992,64(2):170-173.
[9] Kyoung S K, Zhang L P, Robert S,etal. Discovery of pyrrolopyridine-pyridone based inhibitors of Met kinase:Synthesis,X-ray crystal,ographic analysis,and biological activities[J].JMed Chem,2008,51(17):5330-5341.
Design, Synthesis and Antitumor Activities of Novel Pyridine c-Met Kinase Inhibitors
SONG Ping1, LI Jun-ming1, QIN Ting-ting3, CHANG Xian-lei2,YANG Yang4, LIANG Huan1, ZHU Yu1, ZHAO Yan-Jin2, LI Shu-xin1,4*
(1. Department of Postgraduate, Jiangxi University of Traditional Chinese Medicine, Nanchang 330006, China;2. Institute of Radiation and Irradiation Medicine, Academy of Military Medical Science, Beijing 100850, China;3. Institute of Postgraduate, Guangxi Medical University, Nanning 530021, China;4. College of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China)
Eleven novel pyridine c-Met kinase inhibitors(9a~9f and 10a~10e) were designed and synthesized by using BMS-777607 and E7050 as the leading compounds. The structures were characterized by1H NMR and MS(ESI). Theinvitroantitumor activities of 10a~10e and 9a~9f against human gastric cancer cell lines(NCI-N87 and GTL-16) were determined by MTT method. The results showed that 9a, 9d and 10a exhibited best activities against GTL-16, with IC50of 0.60 μmol·L-1, 1.36 μmol·L-1and 0.93 μmol·L-1, which were better than BMS-777607(2.50 μmol·L-1).
c-Met kinase inhibitor; pyridine derivative; synthesis; antitumor activity
2016-11-09
国家自然科学基金资助项目(30973616)
宋平(1991-),汉族,江西新余人,硕士研究生,主要从事新药设计与合成的研究。 E-mail: 434470997@qq.com
李庶心,研究员, E-mail: lisx28@163.com
O625.6; O626.3
A
10.15952/j.cnki.cjsc.1005-1511.2017.02.16285
——非均布滤饼的局部比阻与平均比阻的测定与计算方法

