吲哚-3-乙醛酰胺类化合物的合成及生物活性研究进展
胡鸿雨, 王 飞, 赵胜贤, 方美娟*
(1. 浙江师范大学 行知学院,浙江 金华 321004; 2. 厦门大学 药学院,福建 厦门 361102;3. 浙江普洛得邦制药有限公司,浙江 东阳 322118)
·综合评述·
吲哚-3-乙醛酰胺类化合物的合成及生物活性研究进展
胡鸿雨1, 王 飞2, 赵胜贤3, 方美娟2*
(1. 浙江师范大学 行知学院,浙江 金华 321004; 2. 厦门大学 药学院,福建 厦门 361102;3. 浙江普洛得邦制药有限公司,浙江 东阳 322118)
综述了吲哚-3-乙醛酰胺类化合物(ID)的合成及生物活性的研究进展。ID具有抗肿瘤、抗病毒、抗菌、抗炎、腺苷受体功能调节、缓解疼痛和抗类风湿关节炎等多种生物活性,在药物化学领域有广泛应用。ID的合成方法主要为:吲哚母核与乙酰氯在乙醚(或THF)中于室温反应1 h制得含草酰氯结构的中间体;中间体与取代胺基化合物和二异丙基胺乙基胺反应合成ID。并对ID未来的应用作了简要展望。参考文献32篇
吲哚-3-乙醛酰胺; 生物活性; 合成; 研究进展; 综述
吲哚类化合物是一类重要的天然杂环化合物,具有良好的生物活性。吲哚类次生代谢产物广泛存在于十字花科蔬菜和海洋生物中,大多具有生物活性,在农药、医药、染料、饲料、食品及添加剂中有较多应用[1]。吲哚因其特有的化学结构,在医药和农药等领域表现出独特的生理活性[2-4],如2-甲基吲哚、3-甲基吲哚等均为重要的医药和农药中间体。5-羟基吲哚衍生物是中成药六神丸中蟾酥的重要成分。诸多生物碱中也含有吲哚环系,如常用降压药物利血平。此外,吲哚类化合物还具有较好的抗肿瘤活性。舒尼替尼、长春碱、长春新碱、长春地辛、长春瑞滨、靛玉红等含吲哚结构的新药已上市投入使用。这些药物具有毒副作用小和选择性强等特点[5]。
随着对吲哚研究的深入,吲哚-3-乙醛酰胺类化合物(ID)也逐渐引起了研究人员的关注。ID具有抗肿瘤、抗病毒、抗菌、抗炎、腺苷受体功能调节、缓解疼痛和抗类风湿关节炎等多种生物活性,在药物化学领域有广泛应用。本文对ID的合成方法和生物活性进行了综述。并对ID未来的应用作了简要展望。
1 生物活性
1.1 抗肿瘤活性
高效低毒的抗癌药物是近年来新药研发的热点。微管微丝抑制剂通过干扰微管微丝的形成和解聚使肿瘤细胞的增殖受到抑制,影响与凋亡有关的信号通路,最终导致肿瘤细胞凋亡[6]。自20世纪90年代末紫杉醇、长春碱类微管微丝抑制剂抗癌药上市后,此类药物引起了研究者的兴趣。Knaack等[7-9]报道了一类新型的小分子微管蛋白抑制剂——吲哚-3-草酰胺类化合物的合成与应用。此类微管蛋白抑制剂中最具代表性的化合物为吲地布林[D-24851(1), Chart 1]。 1在体内和体外抗肿瘤实验中均显示出很强的抗肿瘤活性[10]。如对Hela, A549等细胞的IC50均为μmol·L-1级,与阳性药紫杉醇和长春新碱的活性相近,现已作为抗肿瘤候选药物进入临床研究阶段。
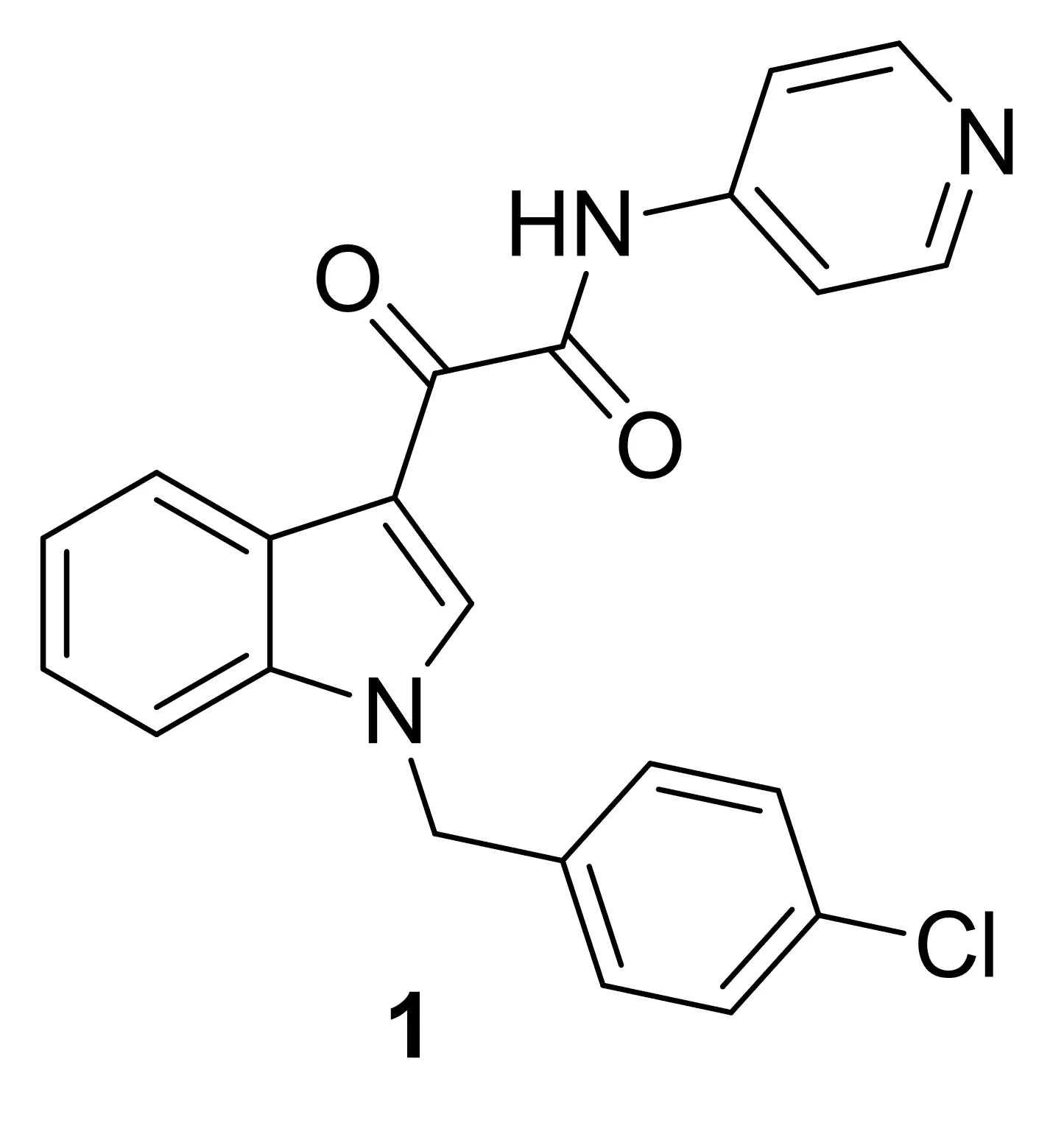
Chart 1
Oostendorp等[11]通过一期临床研究确定了治疗晚期实体瘤的1的最大耐受量,剂量限制毒性(DLT),药代动力学,安全性和耐受性。共有28例患者参加研究,患者服用1后,一般耐受性良好,剂量超过1 200 mg·d-1也未达到最大耐受量。药物给药剂量超过250 mg·d-1,观察到血浆浓度时间曲线不随剂量增加成比例增加,在达到DLT之前,血药浓度已达高峰平台,持续增加1剂量,血药浓度不再提高。
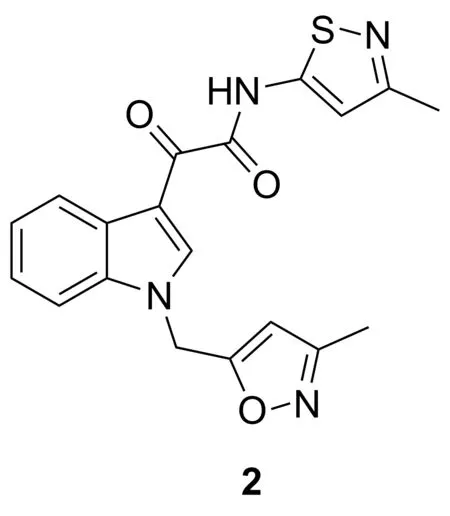
Chart 2
Hu[12]等发现1的类似物BPR0C261(2, Chart 2)也具有良好的抗肿瘤活性。2阻断细胞周期转化在G2/M阶段,并具有诱导凋亡作用。秋水仙碱结合实验表明,5 μmol·L-1和20 μmol·L-1的2都会竞争性地结合到微管蛋白,强烈影响秋水仙碱与微管蛋白结合。对于人脐静脉内皮细胞,其IC50为1.6 nmol·L-1。 2在小鼠模型中显示出抑制血管生成的作用。小鼠可口服吸收,对于狗也有较好的口服生物利用度(43%)。此外,2可与顺铂产生协同作用,延长患白血病小鼠的寿命。
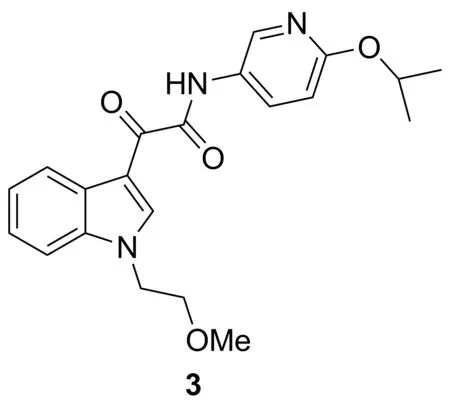
Chart 3
2015年,Oostendorp等[13]发现吲哚-3-乙醛酰胺(3, Chart 3)作为微管蛋白抑制剂在小鼠模型中显示出对头颈部肿瘤的生长具有抑制作用。对于3,他们通过减少芳环数量和增大饱和度的策略,保留了有效的微管蛋白聚合活性。3对于人咽鳞癌细胞的LC50为55 nmol·L-1,微管聚合蛋白的IC50为6.6 μmol·L-1。在小鼠头颈瘤的动物实验中,3表现出显著的抗肿瘤活性。
1.2 抗病毒活性
(1) 抗脘病毒
传染性海绵状脑病是由脘病毒引起的一种亚急性、渐进性、致死性中枢神经系统变性疾病,又称脘病毒病,目前尚无有效治疗方法。Tompson等[14]报道了ID具有抗脘病毒活性,化合物4~6(Chart 4)的EC50分别为0.009 μmol·L-1, 0.006 μmol·L-1和0.001 μmol·L-1,在朊病毒疾病的细胞模型中显示出亚微摩尔级活性。
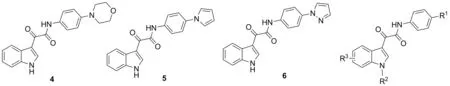
Chart 4
Thompson等[15]通过结构-活性关系研究发现,R1为五元杂环是最佳取代基,杂环部分含有两个以上杂原子,活性更强。进一步研究6的构效关系发现,6的辛醇缓冲分配系数较低,对微粒体代谢有较强的阻碍作用,EC50较低。6单独用药还可治愈经过多次传代后朊病毒感染的细胞。Thompson[16]通过分析吲哚环取代的构效关系还发现,6-位取代的ID(R3=6-Me, 6-CN或6-NO2)作抗脘病毒剂,具有增强细胞活性,提高微粒稳定性和低毒等优点。
(2) 抗HIV活性
高活性抗逆转录病毒疗法可将HIV感染个体转换为一种慢性病[17]。但长期的鸡尾酒疗法会导致的耐药性成为该疗法的主要问题。Tao等[18]发现,在实验菌株的HIV-1筛选中,6-氮杂吲哚-3-乙醛酰胺化合物(7, Chart 5)的EC50为36.5 nmol·L-1,活性较好。BMS-488043(5)是一种新型口服抗HIV附着抑制剂,可与gp120选择性和可逆性结合,防止gp120结合到CD4受体上。初步临床表明,使用5单一治疗8 d,每日服用剂量800 mg的患者中,58%的患者病毒量下降大于1.0 log10,说明5可显著减少感染者病毒血症。
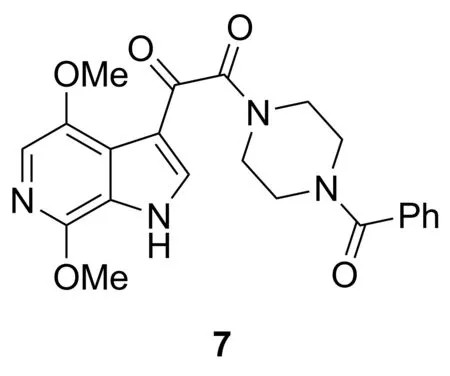
Chart 5
1.3 抗菌活性
细菌和真菌耐药性的增强导致许多抗生素和化疗药物效果减弱。开发新型抗菌药物有助于克服耐药性,改善抗微生物效力。Takhi等[19]报道了一系列含有吲哚-3-乙醛酰胺结构的新型噁唑烷酮衍生物(8a~8f, Chart 6)的合成和生物活性。该类化合物中C5-位为乙酰氨基,与利奈唑胺相比,有效性提高了1~2倍。C5侧链引入卤代酰胺、硫代酰胺和1,2,3-三唑化合物,对提高生物活性作用明显。8a, 8c, 8e和8f具有良好的抗革兰氏阳性菌活性,并对耐利奈唑胺的金黄色葡萄球菌和肠球菌也有抗菌活性(MIC=2~4 g·mL-1)。
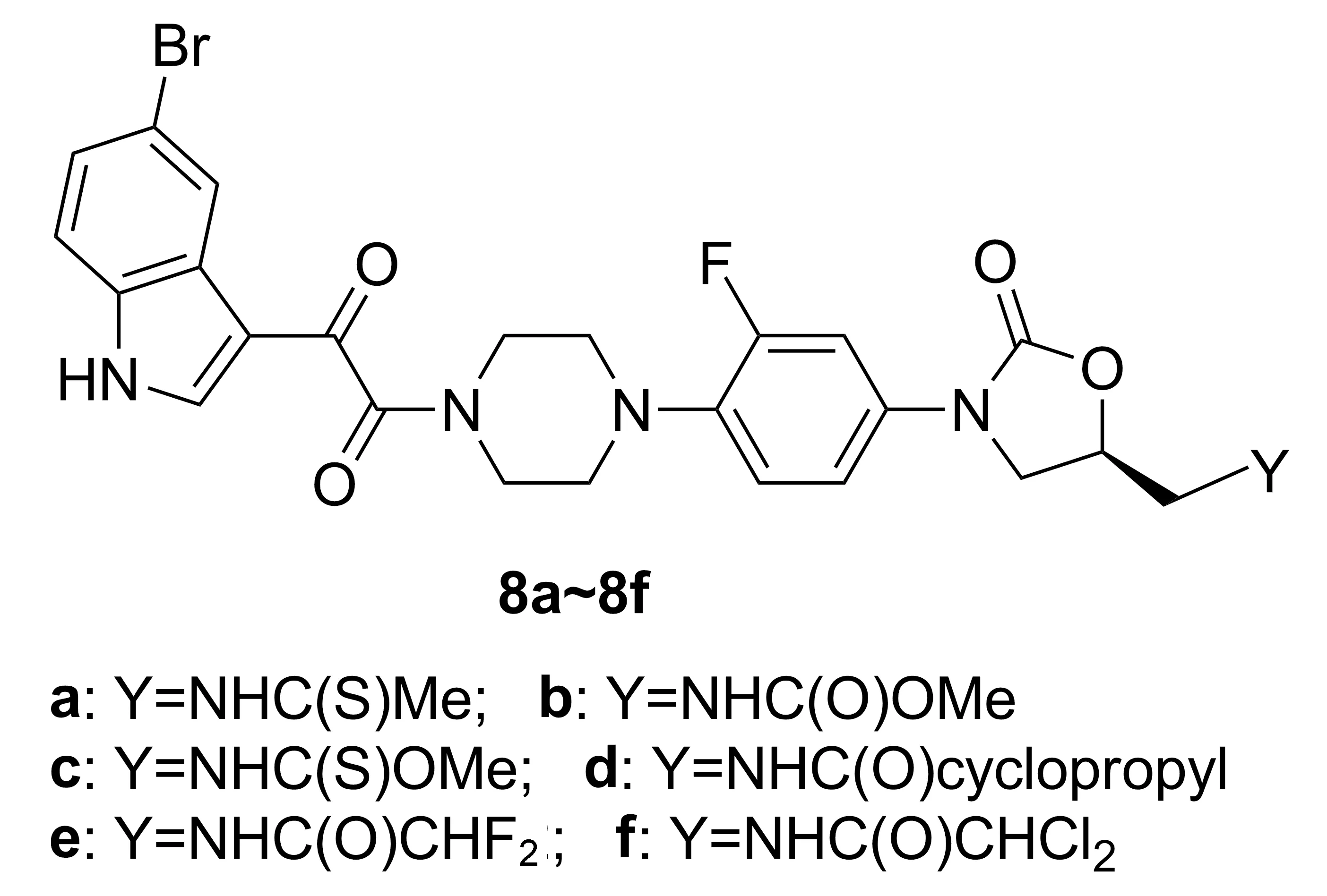
Chart 6
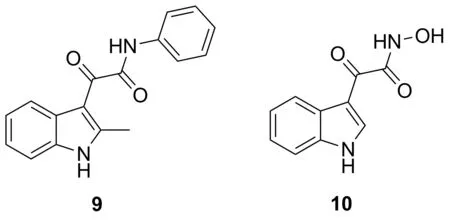
Chart 7
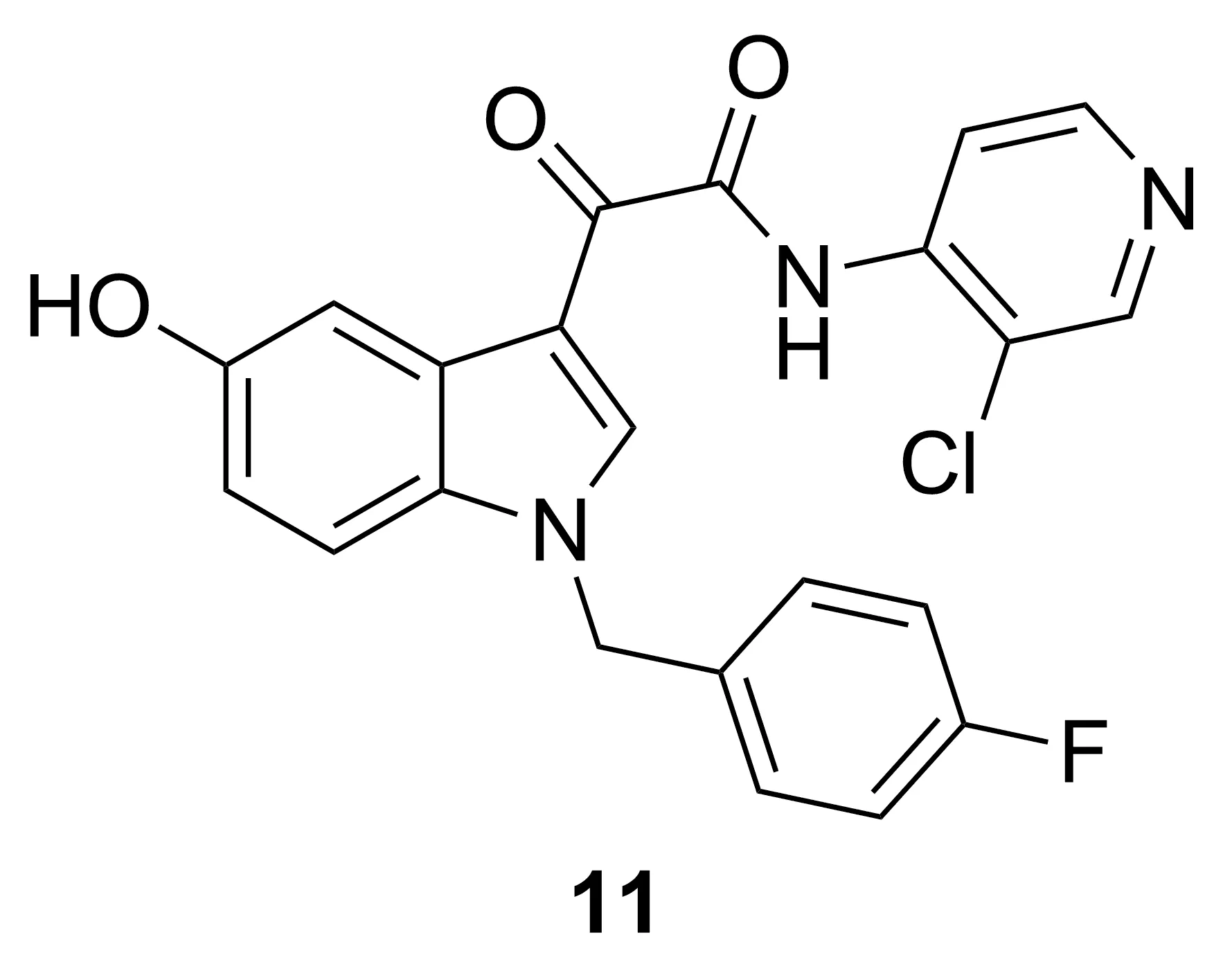
Chart 8
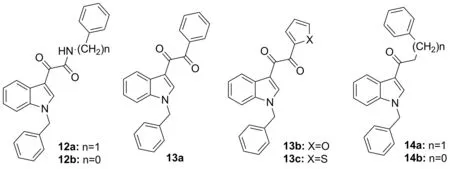
Chart 9
分选酶A(SrtA)普遍存在于革兰氏阳性细菌(如金黄色葡萄球菌)中,是一类膜结合的转肽酶,负责将表面蛋白共价结合到细胞壁的肽聚糖上。SrtA一直被认为是一个潜在的高效抗菌剂靶点。Lee等[20]发现化合物9(IC50=17 mg·mL-1, 61 μmol·L-1)和10(IC50=13 mg·mL-1, 60 μmol·L-1)(Chart 7)对SrtA酶具有抑制活性,其抑制能力是阳性对照药物p-HMB(IC50=42 mg·mL-1, 124 μmol·L-1)的两倍。
1.4 抗炎活性
磷酸二酯酶(PDE)是负责水解环磷酸腺苷(cAMP)的主要蛋白质,细胞内cAMP水平升高可以激活 cAMP依赖的蛋白激酶,从而减轻炎症反应和免疫效应。PDE4主要存在于炎症细胞中,动物模型研究表明PDE4选择性抑制剂能产生强抗炎作用,临床可用于治疗慢性阻塞性肺病和哮喘。
AWD12-281(11, Chart 8)为吸入型给药的PDE-4抑制剂,用于治疗慢性阻塞性肺炎、哮喘和过敏性鼻炎,现已经进入Ⅱ期临床试验。Draheim等[21]发现,11对PDE4的IC50为9.7 nmol·L-1,对TNF-α的EC50为110 nmol·L-1。此外,11与HPDE-4(PDE4存在两种同工酶,即HPDE-4与LPDE-4,抑制HPDE-4会导致胃肠道不良反应,抑制LPDE-4才是所需的抗炎作用)的作用低于阳性对照组咯利普兰,不良反应较小。
1.5 腺苷受体功能调节
腺苷是一种内源性嘌呤核苷,通过触发腺苷受体(ARS)的特定细胞膜G蛋白偶联受体(GPCR)来调节一系列生理过程。腺苷受体广泛分布于哺乳动物组织,被分为四个亚类:A1, A2A, AA2B和A3。
2013年,Taliani等[22]发现了一系列对人体A2B腺苷受体有调节作用的1-苄基-3-酮基吲哚衍生物(12a, 12b, 13a~13c和14a, 14b)。该类化合物对A2A和A3的腺苷受体无活性,对A1腺苷受体亲和力较弱(13a, 13b)或无亲和力(12a, 12b, 13c, 14a, 14b, Chart 9)。在A2B腺苷受体转染的中国仓鼠卵巢细胞模型实验中,12a, 12b和13a表现正向调节,13b, 13c, 14a和14b表现出负向调节,分别对应强化或者减弱腺苷受体激动剂(NECA)诱导的cAMP的增长水平。因此,12~14可以作为生物或药理学工具来探索A2B腺苷受体的潜在调节,其3-酮基吲哚结构可作为设计新类似物的参考。
1.6 缓解疼痛和抗类风湿关节炎
(1) P38激酶抑制剂
MAP激酶的P38亚家族包括四个亚型(p38α, p38β, p38γ和p38δ), P38α作为有丝分裂原激活蛋白家族丝氨酸/苏氨酸激酶中的一员,广泛表达于内皮,免疫和炎症细胞,在促炎细胞因子产生,TNF-R, IL-1β和IL-6调节中发挥较重要作用。这些细胞因子与生物制剂的选择性阻断作用,已被证明对炎性疾病[类风湿关节炎(RA),牛皮癣和肠炎等]有效。
Cottrell等[23]报道了一种高效的ID型镇痛剂SCIO-469(15, Chart 10)。骨折愈合实验中,经15处理的大鼠没有出现不良反应;免疫测试结果显示,P38α激酶在骨折首天就被大量激活。因此,15作为P38α激酶抑制剂,可有效治疗骨折导致的疼痛。
近年来,通过引入TNFa, IL-1和 IL-6细胞因子抑制剂,RA的治疗效果已经显著提高。以蛋白激酶抑制剂作潜在靶点对。Cohen等[24]发现,p38α丝裂原活化蛋白激酶被认为是有效抑制细胞因子产生的靶点。15, Pamapimod和VX-702以P38α同种型为靶点,具有抗类风湿关节炎的活性。但遗憾的是,上述化合物虽然在动物模型中作为p38激酶抑制剂用于RA治疗有一定疗效,但在人体二期临床实验中几乎没有效果,且发现了剂量相关毒性。
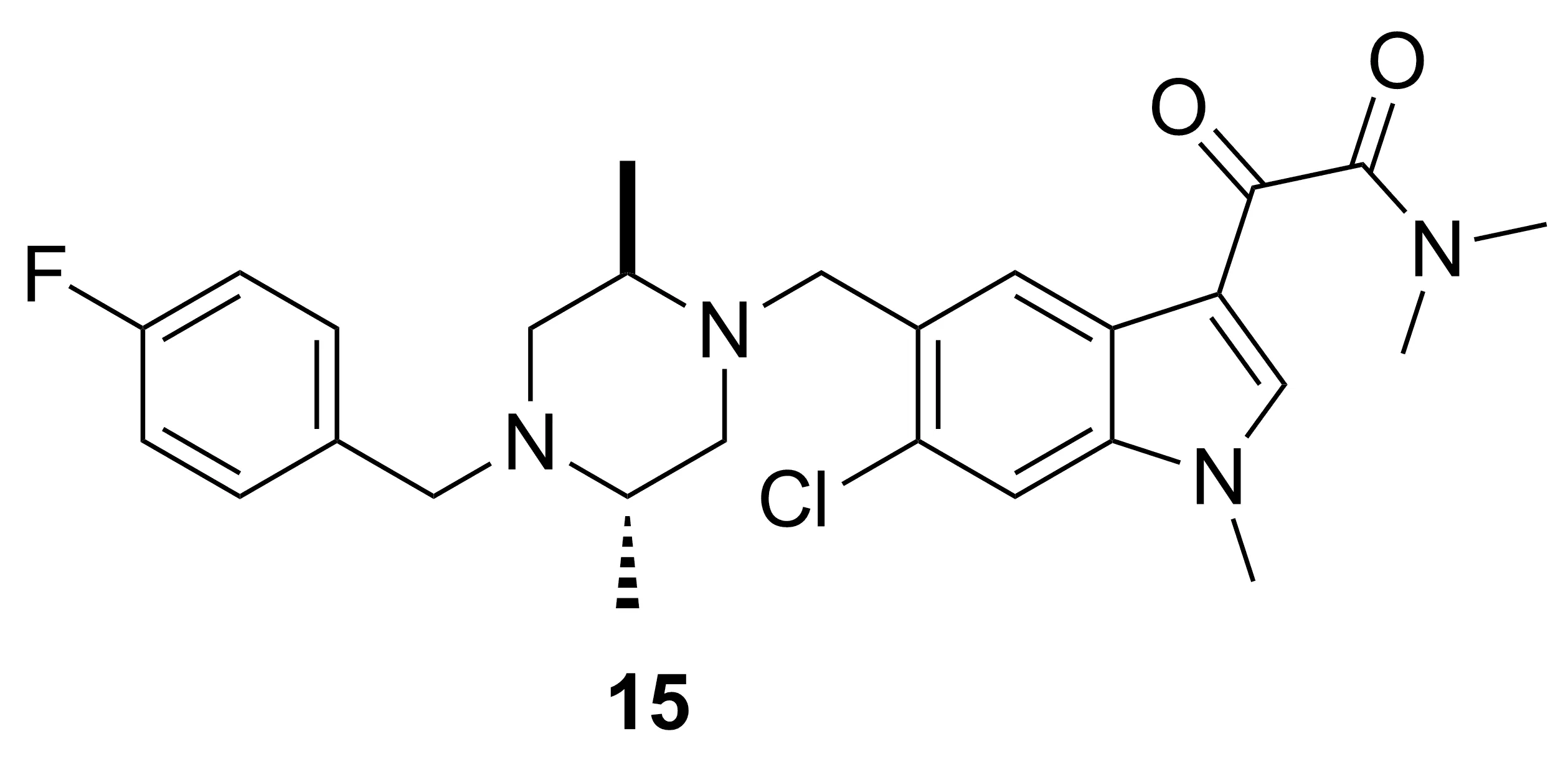
Chart 10
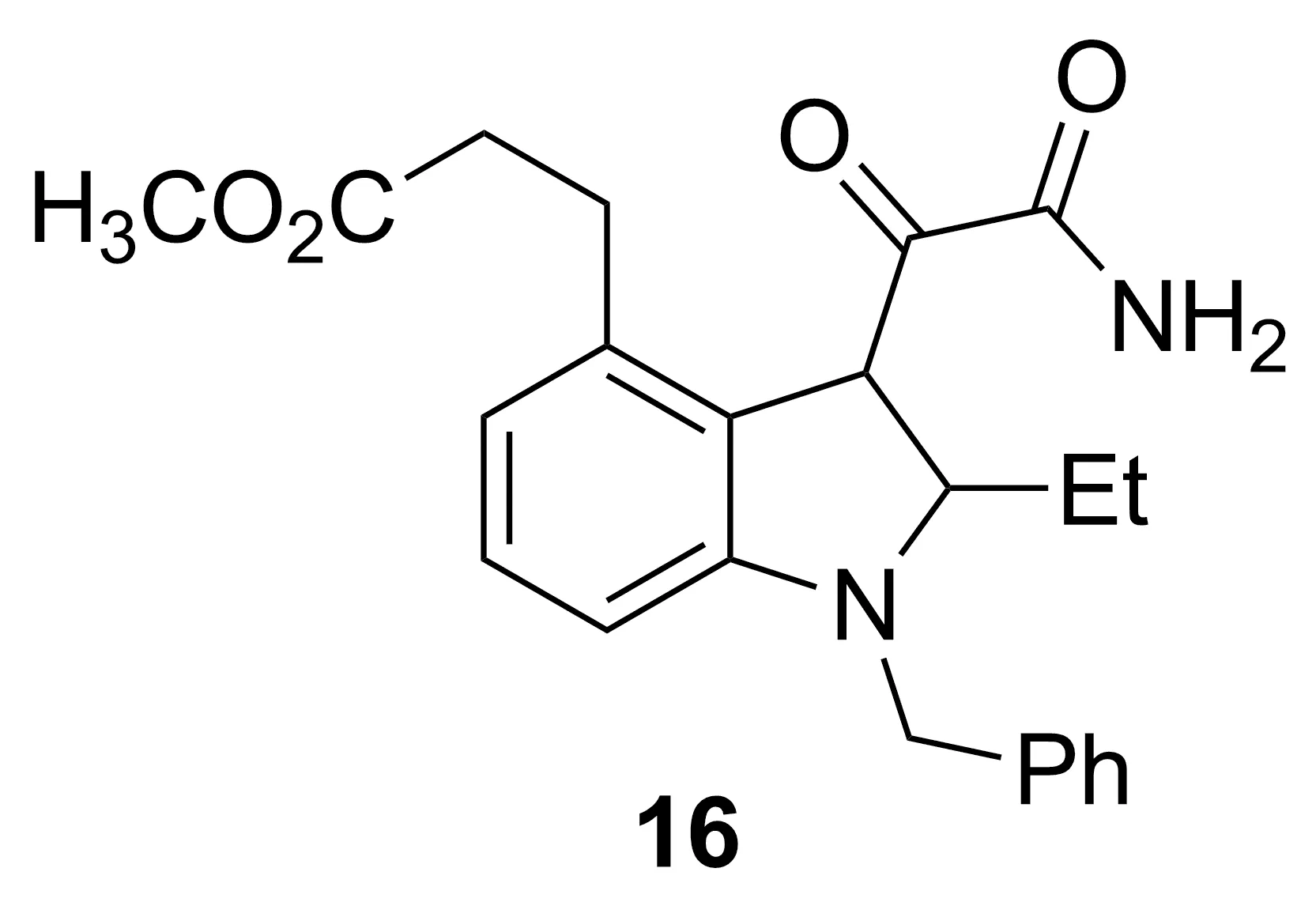
Chart 11
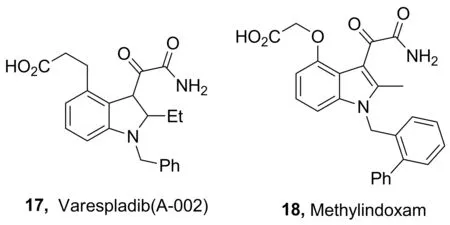
Chart 12
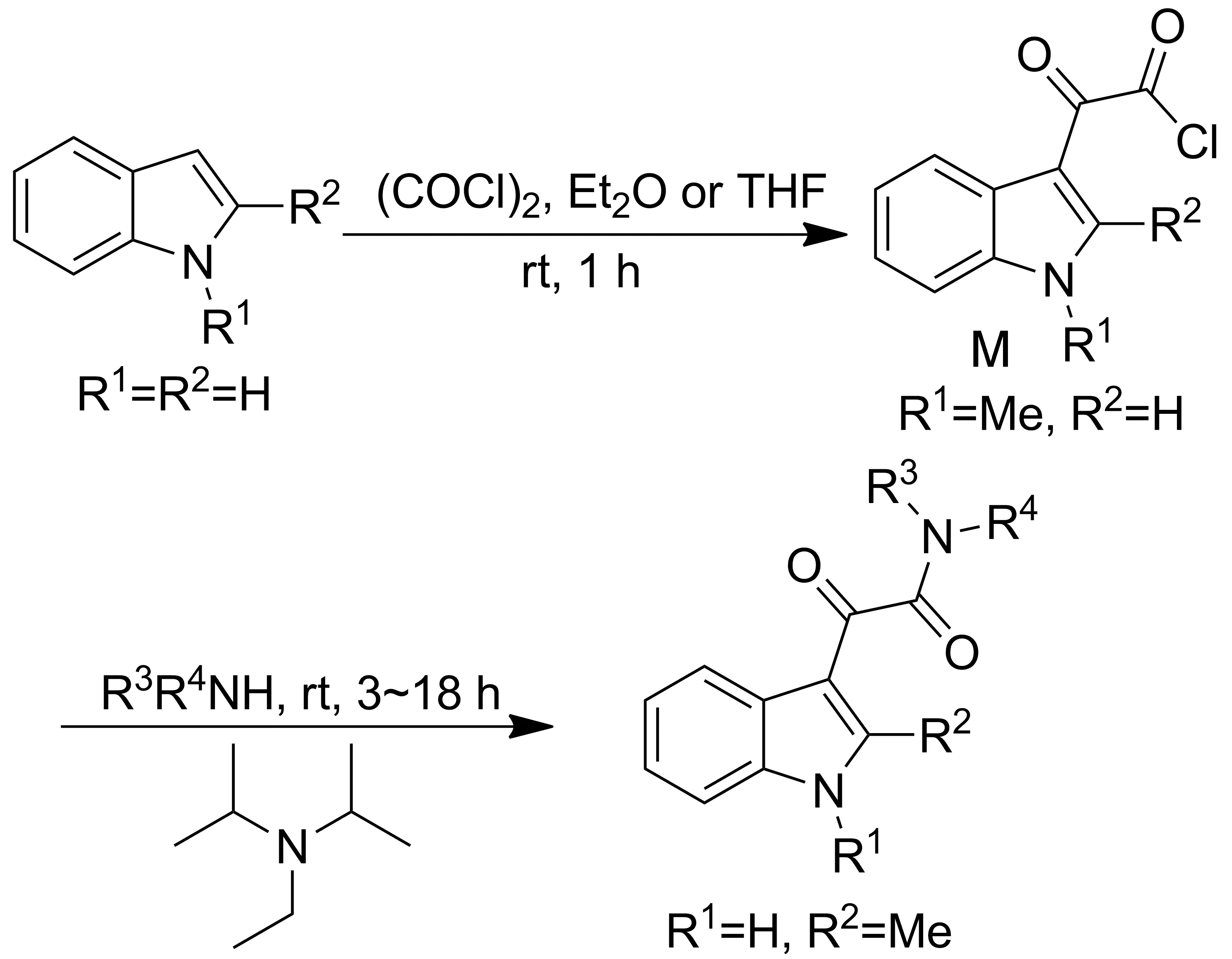
Scheme 1
(2) sPLA2抑制剂
PLA2是一种促使多种炎症因子产生的关键性酶,包括涉及信号传导的3种细胞亚型(cPLA2)和十种分泌亚型分泌型磷脂酶A2(sPLA2)。 sPLA2代表了一个脂蛋白磷脂水解酶家族,可激活验证通路。体内试验显示Ⅱ型sPLA2有促炎症反应,和RA的发病有关,关节滑液中sPLA2的水平与RA的严重程度相关。在早期的临床研究中,Lilly公司生产的sPLA2抑制剂LY333013(16, Chart 11)在单药注射3 d后,与安慰剂组相比,16能显著减轻患者关节疼痛和肿胀。Bradley等[25]发现,16用于RA治疗12 w,作为传统缓解疾病的抗性药物的辅助药物,耐受性良好,但是疗效欠佳。
sPLA2还具有促进巨噬细胞通过非清道夫受体介导的途径导致胆固醇增加的生理功能。在未来的研究中,高的sPLA2-IIA水平可能被用于预测急性冠脉综合征和稳定性冠心病患者中的主要不良心血管事件。
Rosenson等[26]发现,sPLA2抑制剂Varespladib[A-002(17), Chart 12]可用于急性冠脉综合征(ACS)的治疗,目前已经通过了二期临床实验。Rosenson等[27]还发现,与ACS患者常规疗法的药物(阿托伐他汀,80 mg·d-1)相比,17可有效降低低密度脂蛋白胆固醇和炎症标志物。
此外,Hui等[28]发现,PLA2抑制剂methyl indoxam(18)可抑制小鼠饮食诱导肥胖和葡萄糖不耐症。这表明18可作为一种潜在的治疗肥胖和糖尿病的药物。
2 ID的合成
ID的合成方法主要为[29-32]:吲哚母核与乙酰氯在乙醚(或THF)中,于室温反应1 h,制得含草酰氯结构的中间体(M); M与取代胺基化合物和二异丙基胺乙基胺反应3~18 h合成ID(Scheme 1)。
吲哚-3-乙醛酰胺类化合物(ID)在抗肿瘤、抗病毒、抗菌、抗炎、腺苷受体功能调节、缓解疼痛和抗类风湿关节炎等方面均具有较好的生物活性。ID作为微管蛋白抑制剂成为近年制药技术领域的热点。
[1] Liu X Y, Ouyang G P. Research advance on indoles as anticancer drugs[J].Fine Chemical Intermediates,2010,40(5):1-8.
[2] 刘雄伟,周根,姚震,等. 异噁唑拼接吡咯螺环氧化吲哚化合物的合成及其抗肿瘤活性[J].合成化学,2016,24(5):389-392.
[3] 彭礼军,周根,韩朔楠,等. 新型芳姜黄酮拼合吡咯螺环氧化吲哚类化合物的合成及其抗肿瘤活性[J].合成化学,2016,24(8):669-672.
[4] 张文会,王丹丹,刘欢欢,等. 新型六氢吡啶-2,3-并吲哚化合物的合成及其抗肿瘤活性[J].合成化学,2016,24(5):380-383.
[5] Tan Y J, Cao J. Study on antitumor activity mechanism of indole derivates[J].Qilu Pharmaceutical affairs,2009,28(7):422-424.
[6] Polizzi D, Pratesi G, Tortoreto M,etal. A novel taxane with improved tolerability and therapeutic in a panel of human tumor xenografts[J].Cancer Research,1999,59(5):1036-1340.
[7] Kuppens M. Current state of the art of new tubulin inhibitors in the clinic[J].Current Clinical Pharmacology,2006,1:57-70.
[8] Bacher G, Becjers T, Emig P,etal. New small molecule tubulin inhibitors[J].Pure and Applied Chemistry,2001,73(9):1459-1464.
[9] Knaack M, Emig P, Bats J W,etal. Synthesis and characterization of the biological active 2-[1-(4- chlorobenayl)-1H-indol-3-yl]-2-oxo-N-pyridin-4-yl acctamide[J].European Journal Organic Chemistry,2001,20:3843-3847.
[10] Bacher G, Nickel B, Emig P,etal. D-24851,a novel synthetic microtubule inhibitor,experts curative antitumoral activityinvivo,show efficacy toward multidrug-resistant tumor cells,and lacks neurotoxicity[J].Cancer Research,2001,61:392-399.
[11] Oostendorp R L, Witteveen P O, Schwartz B,etal. Dose-finding and pharmacokinetic study of orally administered indibulin(D-24851) to patients with advancedsolid tumors[J].Investigational New Drugs,2010,28:163-170.
[12] Hu C B, Chen C P, Yeh T K,etal. BPR0C261 is a novel orally active antitumor agent with antimitotic and anti-angiogenic activities[J].Cancer science,2011,102(1):182-191.
[13] Colley H E, Muthana M, Danson S J,etal. An orally bioavailable,indole-3-glyoxylamide based series of tubulin polymerization inhibitors showing tumor growth inhibition in a mouse xenograft model of head and neck cancer[J].Journal of Medicinal Chemistry,2015,58(23):9309-9333.
[14] Thompson M J, Borsenberger V, Louth J C,etal. Design,synthesis,and structure-activity relationship of indole-3-glyoxylamide libraries possessing highly potent activity in a cell line model of prion disease[J].Journal of Medicinal Chemistry,2009,52:7503-7511.
[15] Thompson M J, Louth J C, Freeara S,etal. Structure-activity relationship refinement and further assessment of indole-3-glyoxylamides as a lead series against prion disease[J].ChemMedChem,2011,6:115-130.
[16] Thompson M J, Louth J C, Freeara S,etal. Discovery of 6-substituted indole-3-glyoxylamides as lead antiprion agents with enhanced cell line activity,improved microsomal stability and low toxicity[J].European Journal of Medicinal Chemistry,2011,46:4125-4132.
[17] Xing S F, Siliciano R F. Targeting HIV latency:Pharmacologic strategies toward eradication[J].Drug Discovery Today,2013,18:541-551.
[18] Wang T, Yin Z W, Zhang Z X,etal. Inhibitors of human immunodeficiency virus type 1(HIV-1) attachment. 5. an evolution from indole to azaindoles leading to the discovery of 1-(4-benzoylpiperazin-1-yl)-2- (4,7-dimethoxy-1H-pyrrolo[2,3-c]pyridin-3-yl) ethane-1,2-dione(BMS488043),a drug candidate that demonstrates antiviral activity in HIV-1-infected subjects[J].Journal of Medicinal Chemistry,2009,52:7778-7787.
[19] Takhi M, Singh G, Murugan C,etal. Novel and potent oxazolidinone antibacterials featuring 3-indolylglyoxamide substituents[J].Bioorganic & Medicinal Chemistry Letters,2008,18:5150-5155.
[20] Lee Y J, Han Y R, Park W K,etal. Synthetic analogs of indole-containing natural products as inhibitors of sortase A and isocitrate lyase[J].Bioorganic & Medicinal Chemistry Letters,2010,20:6882-6885.
[21] Draheim R, Egerland U, Rundfeldt C. Antiinflammatory potential of the selective phosphodiesterase-4 inhibitorN-(3,5-dichloro-pyrid-4-yl)-[1-(4-fluorobenzyl)-5-hydroxy-indole-3-yl]-glyoxylic acid amide (AWD12-281),in human cell preparations[J].The Journal of Pharmacology and Experimental Therapeutics,2004,308(2):555-563.
[22] Taliani S, Trincavelli M L, Cosimelli B,etal. Modulation of A2B adenosine receptor by 1-benzyl-3-ketoindole derivatives [J].European Journal of Medicinal Chemistry,2013,69:331-337.
[23] Cottrell J A, Meyenhofer M, Medicherl A S,etal. Analgesic effects of p38 kinase inhibitor treatment on bone fracture healing[J].PAIN,2009,142:116-126.
[24] Cohen S, Fleischmann R. Kinase inhibitors:A new approach to rheumatoid arthritis treatment[J].Current Opinion in Rheumatology,2010,22:330-335.
[25] Bradley J D, Dmitrienko A A, Kivitz A J,etal. A randomized,double-blinded,placebo-controlled clinical trial of LY333013,a selective inhibitor of group II secretory phospholipase A2,in the treatment of rheumatoid arthritis[J].Journal of Rheumatol,2005,32:417.
[26] Rosenson R S, Hislop C, McConnell D,etal. Effects of 1-H-indole-3-glyoxamide(A-002) on concentration of secretory phospholipase A2(PLASMA study):A phase II double-blind,randomised,placebo-controlled trial[J].Lancet,2009,373:649-658.
[27] Rosenson R S, Hislop C, Elliott M,etal. Effects of varespladib methyl on biomarkers and major cardiovascular events in acute coronary syndrome patients[J].Journal of the American college of cardiology,2010,56:1079-1088.
[28] Hui D Y, Cope M J, Labonté,etal. The phospholipase A2 inhibitor methyl indoxam suppresses diet-induced obesity and glucose intolerance in mice[J].British Journal of Pharmacology,2009,157:1263-1269.
[29] Thompson M J, Borsenberger V, Louth J C,etal. Design,synthesis,and structure-activity relationship of indole-3-glyoxylamide libraries possessing highly potent activity in a cell line model of prion disease[J].Journal of medicinal chemistry,2009,52(23):7503-7511.
[30] Hélio A, Stefani, Stanley N S V,etal. One-pot three-component synthesis of indole-3-glyoxyl derivatives and indole-3-glyoxyl triazoles[J].Tetrahedron Letters,2013,54(43):5821-5825.
[31] Yeon J L, Yu R H, Wanki P,etal. Synthetic analogs of indole-containing natural products as inhibitors of sortase A and isocitrate lyase[J].Bioorganic & Medicinal Chemistry Letters,2010,20(23):6882-6885.
[32] Sabrina T, Maria L T, Barbara C,etal. Modulation of A2B adenosine receptor by 1-benzyl-3-ketoindole derivatives[J].European Journal of Medicinal Chemistry,2013,69:331-337.
Research Progress on the Synthesis and Bioactivities of Indole-3-glyoxylamide Derivatives
HU Hong-yu1, WANG Fei2, ZHAO Sheng-xian3, FANG Mei-juan2*
(1. Xingzhi College, Zhejiang Normal University, Jinhua 321004, China;2. School of Pharmaceutical Sciences, Xiamen University, Xiamen 361102, China;3. Zhejiang Prododebond Pharmaceutical Co., Ltd., Dongyang 322118)
The synthesis and bioactivities of indole-3-glyoxylamide derivatives(ID) were reviewed with thirty two references. ID, which exhibited well bioactivities in antitumor, antivirus, antibacterial, anti-inflammatory, adenosine regulation, etc, were widely applied in pharmaceutical chemistry. The main method for synthesizing ID was as follows: the intermediate containing oxalyl chloride(M) was obtained by the reaction of indole nuclear parent with acetylchloride in diethyl ether(or THF) by reaction rt for 1h. ID were synthesized by the reaction of M with substituted amino compound andN,N-diisopropylethylamine. The forecast of the application of ID was briefly proposed.
indole-3-glyoxylamide; biological activity; synthesis; research progress; review
O626.13
A
10.15952/j.cnki.cjsc.1005-1511.2017.02.16207
2016-08-12; 修订时间: 2016-11-15
国家自然科学基金资助项目(81302652)
胡鸿雨(1984-),男,汉族,浙江兰溪人,博士研究生,主要从事药物化学的研究。
方美娟,副教授, E-mail: fangmj@xmu.edu.cn
——水芹主要害虫识别与为害症状

