新疆哈萨克族人群高血压与血浆免疫球蛋白GN-糖基组的关联分析
高 晴,王 皓,赵飞飞,多力坤·买买提玉素甫,彭红莉,刘姣男,张 杰,王友信,吴立娟,郭秀花,宋曼殳*
·论著·
新疆哈萨克族人群高血压与血浆免疫球蛋白GN-糖基组的关联分析
高 晴1,2,王 皓1,2,赵飞飞1,2,多力坤·买买提玉素甫3,彭红莉1,2,刘姣男1,2,张 杰1,2,王友信1,2,吴立娟1,2,郭秀花1,2,宋曼殳1,2*
目的 分析新疆哈萨克族人群高血压与血浆免疫球蛋白G(IgG)N-糖基组的关联,寻找高血压疾病状态的潜在分子标志物。方法 采用简单随机抽样,选取2014年2—6月于新疆伊犁哈萨克自治州琼博拉乡卫生院建立健康档案的哈萨克族居民92例为研究对象,根据高血压诊断标准,将研究对象分为血压正常组(n=35)、正常高值组(n=27)和高血压组(n=30)。采用液相色谱-电喷雾质谱联用技术检测血浆IgG N-糖基组。结果 每例受试者的各IgG亚型均检测到G0、G0F、G0FN、G0N、G1、G1F、G1FN、G1FNS、G1FS、G1N、G1NS、G1S、G2、G2F、G2FN、G2FNS、G2FS、G2N、G2NS、G2S等20种聚糖结构。除G0外,不同IgG亚型各N-聚糖水平比较,差异均有统计学意义(P<0.05)。高血压组IgG1亚型G0F、G0FN、G1FS水平高于血压正常组,G2、G2FS水平低于血压正常组;正常高值组IgG1亚型G2F水平低于血压正常组,高血压组IgG1亚型G2F水平低于血压正常组、正常高值组(P<0.05)。正常高值组IgG2/3亚型G0FN、G0N水平高于血压正常组,G2、G2S水平低于血压正常组;高血压组IgG2/3亚型G0、G0F、G0FN、G0N水平高于血压正常组,G2、G2F、G2FS、G2NS、G2S水平低于血压正常组,G2FN、G2FNS水平低于血压正常组、正常高值组(P<0.05)。高血压组IgG4亚型G0FN水平高于血压正常组、正常高值组(P<0.05)。正常高值组IgG1亚型半乳糖基化水平低于血压正常组,高血压组IgG1亚型半乳糖基化水平低于血压正常组和正常高值组(P<0.05)。正常高值组、高血压组IgG2/3亚型半乳糖基化、唾液酸化水平低于血压正常组,高血压组IgG2/3亚型半乳糖基化水平低于正常高值组(P<0.05)。结论 新疆哈萨克族人群不同血压状态与其血浆IgG N-糖基组谱型变化相关,IgG1亚型G2F水平及IgG1、IgG2/3亚型半乳糖基化水平的改变可能是该人群高血压疾病状态潜在的早期预警分子标志物和治疗新靶点。
高血压;免疫球蛋白G;糖基化;生物学标记
本研究创新点:
鉴于血浆N-糖基组的特定谱型可即时反映机体多种生理、病理改变,可作为高血压疾病状态的潜在分子标志物。本研究首次分析高血压患病率较高的新疆哈萨克族人群不同血压状态组之间血浆免疫球蛋白G(IgG)各亚型的N-糖基组变异,探究高血压与血浆IgG N-糖基组的关联,寻找人群特异性的高血压疾病状态的潜在N-糖基组分子标志物。以往研究表明,血浆IgG总体水平的N-糖基组改变与收缩压、舒张压均相关,但关于特定人群血浆IgG各亚型的N-糖基组与血压状态的关联分析,目前尚未见报道。本研究发现,不同血压状态下,哈萨克族人群血浆IgG各亚型的多种N-聚糖水平及糖基化水平出现不同程度的改变;IgG1亚型G2F水平以及IgG1、IgG2/3亚型半乳糖基化水平的改变,可能作为新疆哈萨克族人群高血压疾病状态潜在的早期预警分子标志物和治疗新靶点,并有助于深入理解高血压发生的分子机制及其临床疗效的个体差异。
糖基化是最普遍、最复杂的蛋白翻译后修饰[1]。已有研究表明,免疫球蛋白G(IgG)亚型N-糖基化水平及糖链结构的变化常伴随多种炎性疾病的发生、发展[2-5]。炎性因子在高血压的发病过程中发挥重要作用[6],提示高血压病理过程中出现的血浆IgG N-糖基组的改变可能是高血压疾病状态的潜在分子标志物,并可能提示高血压发病的新机制和治疗的新靶点。我国新疆哈萨克族隔离人群是探究原发性高血压人群特异性病因的适宜人群[7]。本研究旨在通过分析新疆哈萨克族人群不同血压状态组间的血浆IgG N-糖基组差异,探究该人群特异性的高血压疾病状态的潜在IgG亚型N-糖基组分子标志物,为高血压的病因及治疗提供依据。
1 对象与方法
1.1 研究对象 采用简单随机抽样,选取2014年2—6月于新疆伊犁哈萨克自治州察布查尔锡伯自治县琼博拉乡卫生院建立健康档案的哈萨克族居民92例为研究对象,其中男38例,女54例;平均年龄(45.1±12.8)岁。纳入标准:(1)至少3代以内无异族通婚史;(2)年龄≥18岁;(3)过去两周内未服用药物;(4)同意参与本研究。排除标准:患有继发性高血压、严重心脑血管、肝脏、肾脏、代谢性疾病及肿瘤等重大疾病。研究对象均签署知情同意书,本研究获得首都医科大学伦理委员会授权。
依据2010年颁布的中国高血压防治指南[8],研究对象分为血压正常组〔平均收缩压<120 mm Hg(1 mm Hg=0.133 kPa)和舒张压<80 mm Hg,35例〕、正常高值组(平均收缩压为120~139 mm Hg和/或舒张压为80~89 mm Hg,27例)、高血压组(平均收缩压≥140 mm Hg和/或舒张压≥90 mm Hg,30例)。血压正常组男15例,女20例;平均年龄(41.1±11.5)岁。正常高值组男12例,女15例;平均年龄(47.2±14.0)岁。高血压组男11例,女19例;平均年龄(48.0±12.4)岁。各组性别、年龄比较,差异无统计学意义(χ2=0.411,P=0.814;F=2.943,P=0.058)。
1.2 方法
1.2.1 体格检查 由经过统一培训的护士采用统一的水银柱血压计测量血压两次,取平均值。受试者休息至少10 min,取坐位、测量右臂血压,两次测量间隔不少于30 s。
1.2.2 样品采集与处理 受试者晨起空腹,采用真空抗凝采血管采集肘部外周静脉血液样本5 ml,立即置于冰盒中保存运送。血液样本在低温离心机中以3 000 r/min离心10 min(离心半径18 cm),迅速吸取上层血浆,置于1.5 ml离心管,-80 ℃冰箱中保存备用。
1.2.3 血浆IgG N-糖基组检测方法
1.2.3.1 血浆IgG提取 采用96孔蛋白G提取板(斯洛文尼亚BIA分离公司)提取血浆IgG。首先用2 ml超纯水清洗蛋白G提取板,然后用2 ml 1×磷酸盐缓冲液(PBS,pH=7.4)进行平衡。50 μl血浆样本用结合缓冲液进行稀释(1∶10),加入到96孔蛋白G提取板中,使用1 ml结合缓冲液清洗5次,以去除未结合的蛋白。1 ml甲酸溶液(1 mol/L)将IgG洗脱,用96孔板进行收集。该步骤均在真空装置下进行。
1.2.3.2 IgG胰蛋白酶水解 吸取50 μl IgG洗脱液到新的96孔板中。用20 mmol/L冰醋酸将胰蛋白酶溶解至浓度为0.4 μg/μl,用凉超纯水进一步稀释为0.02 μg/μl。每个样本加入20 μl胰蛋白酶溶液,并在37 ℃下孵育过夜。
1.2.3.3 IgG N-糖肽纯化 利用反向固相萃取技术对糖肽进行纯化。采用孔径为10 μm的96孔过滤板,每孔加入5 mg的C18磁珠(德国Macherey-Nagel公司)。固定相采用3×200 μl 80%乙腈溶液〔含1%三氟乙酸(TFA)〕进行活化,然后用3×200 μl 0.1% TFA进行清洗。IgG消化产物使用0.1% TFA溶液稀释10倍后加入到C18磁珠上,然后利用200 μl 0.1% TFA溶液清洗3次。以上操作均在真空装置下进行。之后在C18磁珠上加入90 μl 18%乙腈溶液(含0.1% TFA),500 r/min离心10 min(离心半径18 cm),收集洗脱液。洗脱液进行挥干后用20 μl超纯水再次溶解,-20 ℃冰箱中保存备用。
1.2.3.4 IgG N-糖基组分析 采用液相色谱-电喷雾质谱联用技术进行血浆IgG N-糖基组检测。纯化后的IgG N-糖肽利用Ultimate 3000高效液相系统(美国Dionex公司)进行分离。分离后的样本进入安装有电喷雾装置的时间飞行质谱(美国micrOTOF-Q公司)进行分析。质谱峰扫描质荷比(m/z)为300~2 000,每个样本分析时间为16 min,分析软件为Chromeleon Client Version 6.8 和micrOTOF Control Version 2.3。每个样本数据均利用已知的糖肽进行内部校准,使用Xtractor2D(www.ms-utils.org/Xtractor2D)进行转化,并与数据库(http://glycobase.nibrt.ie)进行比对。由于IgG亚型IgG2和IgG3的糖链在技术上难以分离,本研究将血浆IgG糖链分离为IgG1、IgG2/3和IgG4。
1.2.3.5 IgG的各种N-糖基化水平计算 依据检测到的聚糖结构的相对水平,计算半乳糖基化、唾液酸化、平分型N-乙酰葡萄糖胺和岩藻糖基化4种类型的糖基化水平,计算公式参照文献[9],半乳糖基化水平=(G1F+G1FN+G1FS+G1FNS+G1+G1N+G1S)×0.5+G2F+G2FN+G2FS+G2FNS+G2+G2N+G2S,唾液酸化水平=G1FS+G2FS+G1FNS+G2FNS+G1S+G2S,平分型N-乙酰葡萄糖胺水平=G0FN+G1FN+G2FN+G1FNS+G2FNS+G0N+G1N+G2N,岩藻糖基化水平=G0F+G1F+G2F+G0FN+G1FN+G2FN+G1FS+G2FS。
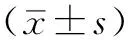
2 结果
2.1 不同IgG亚型的各N-聚糖水平分析 每例受试者的各IgG亚型均检测到G0、G0F、G0FN、G0N、G1、G1F、G1FN、G1FNS、G1FS、G1N、G1NS、G1S、G2、G2F、G2FN、G2FNS、G2FS、G2N、G2NS、G2S等20种N-聚糖结构。不同IgG亚型的G0水平比较,差异无统计学意义(P>0.05);不同IgG亚型的其余N-聚糖水平比较,差异均有统计学意义(P<0.05,见表1,各N-聚糖结构详见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.2 不同血压组各IgG亚型的各种N-聚糖水平分析 各组IgG1亚型G0F、G0FN、G1FS、G2、G2F、G2FS水平比较,差异有统计学意义(P<0.05);其中,高血压组G0F、G0FN、G1FS水平高于血压正常组,G2、G2FS水平低于血压正常组;正常高值组G2F水平低于血压正常组,高血压组G2F水平低于血压正常组、正常高值组,差异有统计学意义(P<0.05,见表2)。
各组IgG2/3亚型G0、G0F、G0FN、G0N、G2、G2F、G2FN、G2FNS、G2FS、G2NS、G2S水平比较,差异有统计学意义(P<0.05);其中,正常高值组G0FN、G0N水平高于血压正常组,G2、G2S水平低于血压正常组;高血压组G0、G0F、G0FN、G0N水平高于血压正常组,G2、G2F、G2FS、G2NS、G2S水平低于血压正常组,G2FN、G2FNS水平低于血压正常组、正常高值组,差异有统计学意义(P<0.05,见表3)。
各组IgG4亚型G0FN水平比较,差异有统计学意义(P<0.05),其中高血压组G0FN水平高于血压正常组、正常高值组,差异有统计学意义(P<0.05,见表4)。
2.3 不同血压组各IgG亚型的各类型N-糖基化水平比较 各组IgG1亚型半乳糖基化水平比较,差异有统计学意义(P<0.05);其中正常高值组IgG1亚型半乳糖基化水平低于血压正常组,高血压组IgG1亚型半乳糖基化水平低于血压正常组和正常高值组,差异有统计学意义(P<0.05)。各组IgG2/3亚型半乳糖基化、唾液酸化水平比较,差异有统计学意义(P<0.05);其中正常高值组、高血压组IgG2/3亚型半乳糖基化、唾液酸化水平低于血压正常组,高血压组IgG2/3亚型半乳糖基化水平低于正常高值组,差异有统计学意义(P<0.05)。各组IgG4亚型各类型N-糖基化水平比较,差异均无统计学意义(P>0.05,见表5)。
Table 1 Comparison of levels of the N-glycans among different IgG subtypes
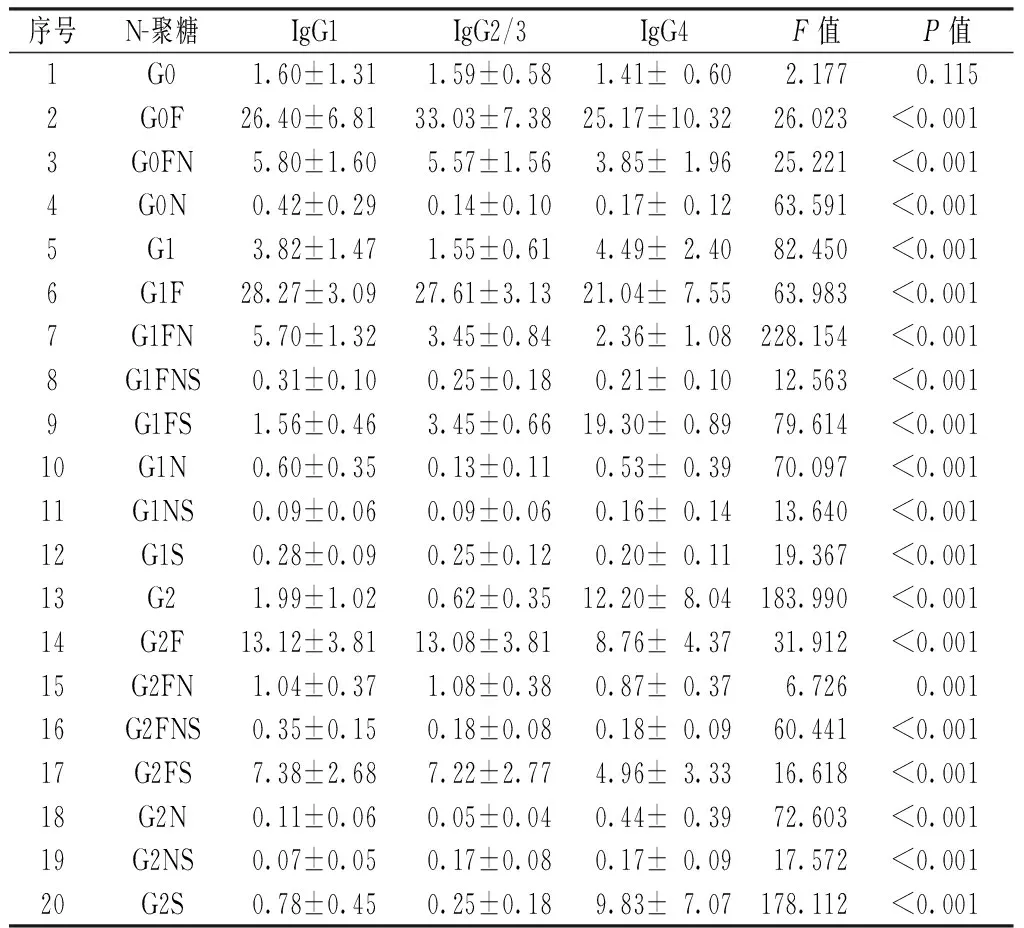
序号N-聚糖IgG1IgG2/3IgG4F值P值1G01.60±1.311.59±0.581.41±0.602.1770.1152G0F26.40±6.8133.03±7.3825.17±10.3226.023<0.0013G0FN5.80±1.605.57±1.563.85±1.9625.221<0.0014G0N0.42±0.290.14±0.100.17±0.1263.591<0.0015G13.82±1.471.55±0.614.49±2.4082.450<0.0016G1F28.27±3.0927.61±3.1321.04±7.5563.983<0.0017G1FN5.70±1.323.45±0.842.36±1.08228.154<0.0018G1FNS0.31±0.100.25±0.180.21±0.1012.563<0.0019G1FS1.56±0.463.45±0.6619.30±0.8979.614<0.00110G1N0.60±0.350.13±0.110.53±0.3970.097<0.00111G1NS0.09±0.060.09±0.060.16±0.1413.640<0.00112G1S0.28±0.090.25±0.120.20±0.1119.367<0.00113G21.99±1.020.62±0.3512.20±8.04183.990<0.00114G2F13.12±3.8113.08±3.818.76±4.3731.912<0.00115G2FN1.04±0.371.08±0.380.87±0.376.7260.00116G2FNS0.35±0.150.18±0.080.18±0.0960.441<0.00117G2FS7.38±2.687.22±2.774.96±3.3316.618<0.00118G2N0.11±0.060.05±0.040.44±0.3972.603<0.00119G2NS0.07±0.050.17±0.080.17±0.0917.572<0.00120G2S0.78±0.450.25±0.189.83±7.07178.112<0.001
注:G0、G1、G2分别表示糖链结构中含有0、1、2个半乳糖,F为岩藻糖,N为平分型N-乙酰葡萄糖胺,S为唾液酸化糖苷

表2 不同血压组IgG1亚型的各种N-聚糖水平比较
注:与血压正常组比较,aP<0.05;与正常高值组比较,bP<0.05

表3 不同血压组IgG2/3亚型的各种N-聚糖水平比较
注:与血压正常组比较,aP<0.05;与正常高值组比较,bP<0.05

表4 不同血压组IgG4亚型的各种N-聚糖水平比较
注:与血压正常组比较,aP<0.05;与正常高值组比较,bP<0.05

Table 5 Comparison of levels of the N-glycosylation of each IgG subtype among different blood pressure groups

组别例数IgG1半乳糖基化 唾液酸化 平分型N-乙酰葡萄胺 岩藻糖基化血压正常组3547.16±7.9911.30±3.2313.93±3.1390.10±3.31正常高值组2743.60±6.81a10.48±2.8515.22±1.9689.76±4.58高血压组3039.96±6.31ab10.20±3.5415.35±2.6290.05±2.88F值8.2441.0252.8190.076P值0.0010.3630.0650.927组别IgG2/3半乳糖基化 唾液酸化 平分型N-乙酰葡萄胺 岩藻糖基化血压正常组43.44±7.5212.87±3.6410.61±2.1694.93±1.83正常高值组38.59±6.10a10.79±2.44a11.86±1.8794.73±1.77高血压组36.02±7.84ab10.74±2.98a11.17±2.1595.04±1.98F值8.8354.9472.7250.194P值<0.0010.0090.0710.824组别IgG4半乳糖基化 唾液酸化 平分型N-乙酰葡萄胺 岩藻糖基化血压正常组53.70±11.1417.75±6.218.74±2.7669.84±15.26正常高值组53.23±13.7218.10±8.199.06±2.1867.12±21.45高血压组48.20±9.9316.95±5.4710.12±2.9672.12±14.97F值2.1200.2312.2620.600P值0.1260.7940.1100.551
注:与血压正常组比较,aP<0.05;与正常高值组比较,bP<0.05
3 讨论
高血压是遗传与环境因素相互作用导致的复杂疾病,其致病机制尚未完全阐明。血浆IgG N-糖基组的特定谱型是反映机体各种细胞功能,乃至各种疾病过程的一组重要的中间表型,可作为反映机体遗传和环境因素相互作用的即时指标[10]。因此,某一特定糖型的改变将会对高血压的早期监测有更高的特异度和灵敏度,可作为潜在的高血压疾病状态分子标志物。
IgG的Fc-或Fab-片段糖基化修饰在前炎性反应或抗炎信号通路中具有增强或阻滞作用[11]。IgG1的高半乳糖基修饰决定其对FcγRIIB或C-type lectin-like receptor dectin-1的结合力,以此调节抗炎活性[12-13]。而不同程度的唾液酸化修饰则可以控制内在抗炎活性从稳态向炎症作用的转变[14]。本研究也表明,不同血压状态下血浆IgG N-糖基化结构与水平出现了不同程度的改变,提示在高血压发生的病理过程中,IgG N-糖基化修饰发生改变,引发炎性反应从而导致高血压的发生。
遗传变异是造成个体疾病易患性及其疗效差异性的重要原因。由于不同民族间存在人群特异性的疾病和药物代谢相关的遗传易患基因[15],推测高血压相关的血浆IgG N-糖基组谱型(各聚糖的结构与水平)也存在民族差异。近年来的流行病学研究表明,世代聚居的新疆哈萨克族是高血压患病率较高的民族之一,患病率高达36.7%[16];该人群具有独特的遗传背景和生活习惯,是探究高血压发病特点及疾病变异谱的适宜人群[7]。基于中国汉族人群和克罗地亚人群的研究结果显示,血浆IgG总体水平的半乳糖基化、核心岩藻糖基化和唾液酸化水平与收缩压、舒张压均存在相关性[17]。
本研究分析了新疆哈萨克族不同血压组人群血浆IgG各亚型的N-糖基组改变,结果显示,不同血压状态下,机体血浆IgG各亚型的各种N-聚糖水平及糖基化水平出现不同程度的改变,与WANG等[18]基于中国汉族人群、克罗地亚人群和苏格兰人群关于血浆IgG总体水平与血压的关联研究结果一致。本研究还发现,随着血压水平的升高,IgG1亚型G2F水平,及IgG1、IgG2/3亚型半乳糖基化水平呈下降趋势,提示这些糖基组特定谱型的改变可能是新疆哈萨克族人群高血压发生的早期事件,可能是该人群高血压疾病状态潜在的分子标志物,也可为该人群高血压的早期筛检和寻找治疗新靶点提供参考。
由于本研究选取的研究对象为居住在交通不便的西北偏远山区的新疆哈萨克族人群,样本的获得及运输相对困难,因而本研究样本量较小,有待进一步的大样本队列研究对本研究结果进行验证。
作者贡献:高晴进行课题设计与实施、资料收集整理、撰写论文、成文并对文章负责;王皓、赵飞飞、彭红莉、刘姣男进行课题实施、评估、资料收集;多力坤·买买提玉素甫、张杰、王友信、吴立娟、郭秀花进行课题设计、实施,论文撰写的指导;宋曼殳进行课题设计与实施,论文撰写的全程质量控制及审校。
本文无利益冲突。
[1]HIRABAYASHI J,ARATA Y,KASAI K,et al.Glycome project:concept,strategy and preliminary application to caenorhabditis elegans[J].Proteomics,2001,1(2):295-303.
[2]连高焱,俞飚.蛋白质的化学糖基化研究进展[J].中国科学:化学,2012,42(12):1746-1759. LIAN G Y,YU B.Research progress of chemical glycosylation of protein[J].Scientia Sinica(Chimica),2012,42(12):1746-1759.
[3]VARKI A P,BAUM L G,BELLIS S L,et al.Working group report:the roles of glycans in hemostasis,inflammation and vascular biology[J].Glycobiology,2008,18(10):747-749.
[4]NOVOKMET M,LUKIC E,VUCKOVIC F,et al.Changes in IgG and total plasma protein glycomes in acute systemic inflammation[J].Sci Rep,2014(4):43-47.
[5]THEODORATOU E,CAMPBELL H,VENTHAM N T,et al.The role of glycosylation in IBD[J].Nat Rev Gastroenterol Hepatol,2014,11(10):588-600.
[6]王胜利,刘应才.慢性炎症:高血压的一种发病机制[J].医学综述,2008,14(22):3447-3450. WANG S L,LIU Y C.Hypertension and chronic inflammation[J].Medical Recapitulate,2008,14(22):3447-3450.
[7]刘芬,马依彤,杨毅宁,等.新疆不同民族高血压现况的流行病学调查[J].中华医学杂志,2010,90(46):3259-3263. LIU F,MA Y T,YANG Y N,et al.Current status of primary hypertension in Xinjiang:an epidemiological study of Han,Uygur and Hazakh populations[J].National Medical Journal of China,2010,90(46):3259-3263.
[8]中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华高血压杂志,2011,19(8):701-743. Writing Group of 2010 Chinese Guidelines for the Management of Hypertension.2010 Chinese guidelines for the management of hypertension[J].Chinese Journal of Hypertension,2011,19(8):701-743.
[9]HUFFMAN J E,PUCIC-BAKOVIC M,KLARIC L,et al.Comparative performance of four methods for high-throughput glycosylation analysis of immunoglobulin G in genetic and epidemiological research[J].Mol Cell Proteomics,2014,13(6):1598-1610.
[10]VARKI A,CUMMINGS R,ESKO J,et al.Essentials of glycobiology[M].2nd ed.New York:Cold Spring Harbor Laboratory Press,1999:387-402.
[11]WRIGHT A,MORRISON S L.Effect of glycosylation on antibody function:implications for genetic engineering [J].Trends Biotechnol,1997,15(1):26-32.
[12]KARSTEN C M,PANDEY M K,FIGGE J,et al.Anti-inflammatory activity of IgG1 mediated by Fc galactosylation and association of FcγRⅡB and dectin-1[J].Nat Med,2012,18(9):1401-1406.
[13]VUCKOVIC F,KRITIC J,GUDELJ I,et al.Association of systemic lupus erythematosus with decreased immunosuppressive potential of the IgG glycome [J].Arthritis Rheumatol,2015,67(11):2978-2989.
[14]KANEKO Y,NIMMERJAHN F,RAVETCH J V.Anti-inflammatory activity of immunoglobulin G resulting from Fc sialylation [J].Science,2006,313(5787):670-673.
[15]LI J Z,ABSHER D M,TANG H,et al.Worldwide human relationships inferred from genome-wide patterns of variation[J].Science,2008,319(5866):1100-1104.
[16]马晓佳,张眉,郭淑霞,等.新疆农村地区维吾尔族、哈萨克族与汉族人群高血压患病率[J].中华高血压杂志,2013,21(12):1164-1168. MA X J,ZHANG M,GUO S X,et al.Prevalence of hypertension in Uygur and Kazak and Han population in rural area of Xinjiang[J].Chinese Journal of Hypertension,2013,21(12):1164-1168.
[17]LU J P,KNEŽEVIC A,WANG Y X,et al.Screening novel biomarkers for metabolic syndrome by profiling human plasma N-glycans in Chinese Han and Croatian populations [J].J Proteome Res,2011,10(11):4959-4969.
[18]WANG Y X,KLARIC L,YU X,et al.The association between glycosylation of immunoglobulin G and hypertension :a multiple ethnic cross-sectional study[J].Medicine(Baltimore),2016,95(17):e3379.
(本文编辑:吴立波)
Association between Hypertension and IgG N-glycome in Xinjiang Kazakh Population
GAOQing1,2,WANGHao1,2,ZHAOFei-fei1,2,DUOLIKUN·Maimaitiyusufu3,PENGHong-li1,2,LIUJiao-nan1,2,ZHANGJie1,2,WANGYou-xin1,2,WULi-juan1,2,GUOXiu-hua1,2,SONGMan-shu1,2*
1.SchoolofPublicHealth,CapitalMedicalUniversity,Beijing100069,China
2.BeijingMunicipalKeyLaboratoryofClinicalEpidemiology,Beijing100069,China
3.CollegeofLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China
Objective To analyze the association between hypertension and IgG N-glycome in Xinjiang Kazakh population,and to explore the potential biomarkers of the state of hypertension disease.Methods Ninety-two Kazakh participants who had established health records in health center of Qapqal County,Xinjiang Yili Kazakh Autonomous Prefecture from February to June 2014 were recruited as research objects by simple random sampling method.According to the diagnostic criteria of hypertension,the subjects were divided into normal blood pressure group (n=35),normal high-value group (n=27) and hypertension group (n=30).The plasma IgG N-glycome was detected by liquid chromatography-electrospray ionization mass spectrometry.Results Twenty glycans (G0,G0F,G0FN,G0N,G1,G1F,G1FN,G1FNS,G1FS,G1N,G1NS,G1S,G2,G2F,G2FN,G2FNS,G2FS,G2N,G2NS,G2S) were all detected in various IgG subtypes of each subject.Except for G0,there were significant differences in each N-glycome levels of different IgG subtypes (P<0.05).The level of G0F,G0FN and G1FS of IgG1 subtypes in hypertension group was higher than that in normal blood pressure group,while the levels of G2 and G2FS was lower;the level of G2F of IgG1 subtypes in normal high-value group was lower than that in normal blood pressure group,the level of G2F of IgG1 subtypes in hypertension group was lower than that in normal blood pressure group and normal high-value group (P<0.05).In normal high-value group,the level of G0FN and G0N of IgG2/3 subtypes was higher than that in normal blood pressure group,and the level of G2 and G2S was lower;in hypertension group,the level of G0,G0F,G0FN and G0N of IgG2/3 subtypes was higher and the level of G2,G2F,G2FS,G2NS and G2S was lower than that in normal blood pressure group,and the level of G2FN and G2FNS was lower than that in normal blood pressure group and normal high-value group(P<0.05).The levels of G0FN of IgG4 subtypes in hypertension group was higher than that in normal blood pressure group and normal high-value group(P<0.05).The level of galacosylation of IgG1 subtypes in normal high-value group was significantly lower than that in normal blood pressure group,and the level of galacosylation of IgG1 subtypes in hypertension group was significantly lower than that in normal blood pressure group and normal high-value group (P<0.05).The levels of galacosylation and sialylation of IgG2/3 subtypes in normal high-value group and hypertension group were significantly lower than those in normal blood pressure group,and the level of galacosylation of IgG2/3 subtypes in hypertension group was significantly lower than that in normal high-value group (P<0.05).Conclusion The different states of blood pressure is associated with its plasma IgG N-glycome changes of Xinjiang Kazakh population,the changes in the levels of G2F of IgG1 subtypes and galactosylated levels of IgG1 and IgG2/3 subtypes may be the potential biomarkers and novel therapeutic targets for hypertension status among this population.
Hypertension;Immunoglobulin G;Glycosylation;Biological markers
国家自然科学基金资助项目(81573215);北京市属高等学校青年拔尖人才培育计划项目(CIT&TCD201404185)
R 544.1
A
10.3969/j.issn.1007-9572.2017.05.012
2016-07-31;
2016-12-07)
1.100069北京市,首都医科大学公共卫生学院
2.100069北京市,临床流行病学北京市重点实验室
3.830046新疆乌鲁木齐市,新疆大学生命科学与技术学院
*通信作者:宋曼殳,副教授;E-mail:songms@ccmu.edu.cn
高晴,王皓,赵飞飞,等.新疆哈萨克族人群高血压与血浆免疫球蛋白G N-糖基组的关联分析[J].中国全科医学,2017,20(5):563-568.[www.chinagp.net]
GAO Q, WANG H, ZHAO F F, et al.Association between hypertension and IgG N-glycome in xinjiang kazakh population[J].Chinese General Practice,2017,20(5):563-568.
*Correspondingauthor:SONGMan-shu,Associateprofessor;E-mail:songms@ccmu.edu.cn

