可控酶解蚕蛹蛋白制备抗氧化活性多肽的研究
左振宇,叶 川
(武汉科技大学化学与化工学院,湖北 武汉 430081)
可控酶解蚕蛹蛋白制备抗氧化活性多肽的研究
左振宇,叶 川
(武汉科技大学化学与化工学院,湖北 武汉 430081)
以脱脂、脱色后的蚕蛹蛋白粉为原料,选取碱性蛋白酶、胰蛋白酶、中性蛋白酶、木瓜蛋白酶和胃蛋白酶对超声处理后的蚕蛹蛋白溶液进行单酶以及复合酶水解实验,以蛋白水解度、多肽得率和水解产物的抗氧化活性为指标筛选出最适单酶和最适复合酶,采用响应面法确定可控酶解蚕蛹蛋白制备抗氧化活性多肽的最佳工艺条件为:选用碱性蛋白酶+中性蛋白酶(碱性蛋白酶∶中性蛋白酶=1.3∶1)作为最适水解酶,超声处理(10 min,工作3 s,间歇2 s)蚕蛹蛋白溶液,pH值 7.47、固液比1∶10(g∶mL)、加酶量2.1%、水解时间2.7 h、温度59.2 ℃。在此工艺条件下,蛋白水解度为41.73%,多肽得率为33.29%,水解产物的羟基自由基清除率为59.48%、超氧阴离子自由基清除率为40.57%。
蚕蛹蛋白;活性多肽;可控酶解;抗氧化活性;水解度
蚕蛹蛋白是一种优质全价的蛋白资源[1],占蚕蛹干重的45%~50%[2]。它含有18种氨基酸,其中包括占氨基酸总量40%以上的8种人体必需氨基酸[3]。蛋白质水解可以产生具有生物活性功能的多肽,活性多肽是含有数个到数十个氨基酸组成的具有特殊生理功能的多肽片段[4]。不仅能满足基本的氨基酸代谢需求和为人体生长提供必需的营养物质,同时还有其它重要的生理功能,如抗氧化、抗衰老等生物活性[5-6]。和蛋白质相比,活性多肽在保持生物学活性的同时更容易被人体吸收代谢。目前,活性多肽的研究已经成为食品行业和营养等相关领域研究的热点课题。
蛋白质的酶促降解过程会受到诸多因素(酶种类、pH值、固液比、加酶量、水解时间、温度、酶比例等)影响,通过控制水解条件达到可控酶解制备活性多肽的效果。作者以脱脂、脱色的蚕蛹蛋白粉为原料,以蛋白水解度、多肽得率、水解产物抗氧化活性为指标,研究可控酶解蚕蛹蛋白制备抗氧化活性多肽的工艺。
1 实验
1.1 材料与仪器
蚕蛹由湖北省农科院蚕业研究所提供;碱性蛋白酶、中性蛋白酶、胰蛋白酶,Biosharp公司;木瓜蛋白酶和胃蛋白酶,Sigma公司;其它试剂均为国产分析纯试剂。
HH-4型数显恒温水浴锅,国华电器有限公司;FA2004N型电子天平,奥豪斯国际商贸有限公司;1-14型离心机,Sigma公司;PB-10型pH计,Sartorius公司;GL-1800型干式恒温器,海门其林贝尔仪器制造有限公司;752N型紫外可见分光光度计,上海精宏公司;SB-5200DTN型超声破碎仪,宁波新芝公司。
1.2 方法
1.2.1 单酶及复合酶的筛选
(1)单酶筛选。固定水解反应的固液比、加酶量、水解时间、pH值、温度,对蚕蛹蛋白溶液超声处理后使用5种不同来源的蛋白酶进行水解实验。测定蛋白水解度、多肽得率以及水解产物的抗氧化活性,选择水解效果最好的酶作为最适单酶体系。
(2)复合酶筛选。固定水解反应的固液比、加酶量、水解时间、酶比例、pH值、温度,对蚕蛹蛋白溶液超声处理后使用不同蛋白酶组合进行水解实验。测定蛋白水解度、多肽得率以及水解产物的抗氧化活性,选择水解效果最好的组合酶作为最适复合酶体系。
1.2.2 可控酶解工艺的确定及优化
(1)单因素实验。使用最适复合酶体系可控酶解蚕蛹蛋白,研究不同单因素(pH值、固液比、加酶量、水解时间、温度、酶比例)对酶解的影响,得到酶解工艺参数。
(2)响应面优化。采用Design-Expert8.0.6软件进行响应面分析及优化,确定可控酶解蚕蛹蛋白制备抗氧化活性多肽的工艺并对优化工艺进行验证。
1.2.3 检测方法
(1)多肽抗氧化活性检测。选用羟基自由基清除法[7-11]和超氧阴离子自由基清除法[12-14],通过两种方法的相互验证最终确定蚕蛹蛋白水解产物的抗氧化活性。
(2)水解度测定。水解度是蛋白水解的一个重要指标,在水解过程中选用甲醛滴定法[15]对水解度进行测定。
(3)多肽得率测定。采用TCA(三氯乙酸)沉淀蛋白法测定,离心取上清液加入双缩脲试剂测定吸光值,并辅助卵清蛋白标准曲线的方法测得[16]。
2 结果与讨论
2.1 单酶筛选
将蚕蛹蛋白溶液超声处理(功率140 W,10 min,工作3 s,间歇2 s)后,选用5种蛋白酶进行水解实验。设置水解反应固液比1∶20(g∶mL,下同),水解时间3 h,加酶量3%,pH值和温度在各酶的最适pH值和最适温度下进行。测定蚕蛹蛋白水解度、多肽得率以及水解产物的抗氧化活性,结果如表1所示。
表1 5种单酶水解蚕蛹蛋白的效果/%

Tab.1 The effect of 5 kinds of single enzymatic hydrolysis of silkworm pupa protein/%
由表1可知,碱性蛋白酶、中性蛋白酶、胰蛋白酶对蚕蛹蛋白的水解效果较好,而木瓜蛋白酶、胃蛋白酶对蚕蛹蛋白的水解效果较差。同时碱性蛋白酶、中性蛋白酶水解蚕蛹蛋白多肽得率较高,水解产物也具有较强的抗氧化活性;而胰蛋白酶、木瓜蛋白酶、胃蛋白酶水解蚕蛹蛋白多肽得率较碱性蛋白酶、中性蛋白酶的低,水解产物的抗氧化活性也较差。综上,单酶水解蚕蛹蛋白效果最好的为碱性蛋白酶。
2.2 复合酶筛选
以碱性蛋白酶为基础,将其它4种酶与碱性蛋白酶组合,对蚕蛹蛋白溶液超声处理(功率140 W,10 min,工作3 s,间歇2 s)后,进行复合酶水解实验,设置水解反应固液比1∶20,水解时间3 h,加酶量3%,复合酶比例1∶1,pH值和温度在各复合酶的最适pH值平均值和最适温度平均值下进行。测定蚕蛹蛋白水解度、多肽得率和水解产物的抗氧化活性,结果如表2所示。
表2 4种复合酶水解蚕蛹蛋白的效果/%
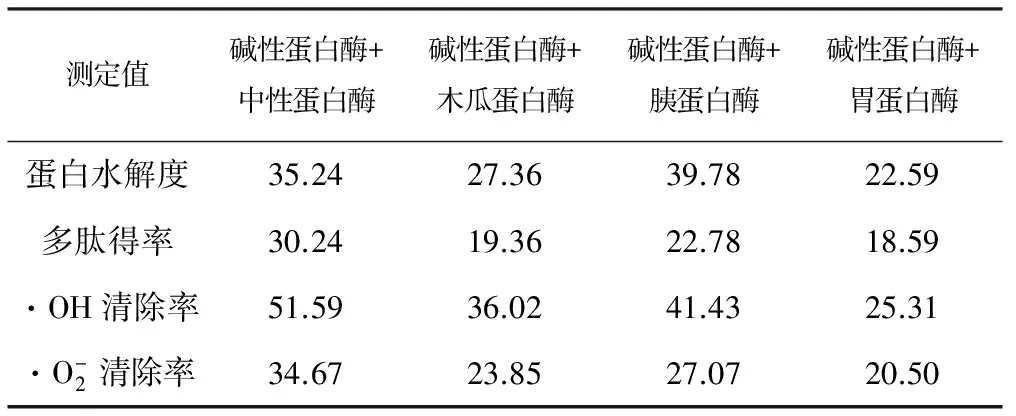
Tab.2 The effect of 4 kinds of compound enzymatic hydrolysis of silkworm pupa protein/%
由表2可知,碱性蛋白酶分别和中性蛋白酶、胰蛋白酶复合水解蚕蛹蛋白的水解度较大,多肽得率和水解产物的抗氧化活性很高,而和木瓜蛋白酶、胃蛋白酶复合水解蚕蛹蛋白的水解度、多肽得率、水解产物的抗氧化活性都相对较低。综合比较,选择碱性蛋白酶+中性蛋白酶作为最适复合酶体系。
2.3 复合酶水解单因素实验
初始反应条件为:pH值 7.65、固液比1∶20、加酶量3%、水解时间3 h、温度51 ℃、酶比例(碱性蛋白酶∶中性蛋白酶,下同)1∶1,每个单因素最佳值被确定后会固定到后续单因素实验中,结果如图1所示。
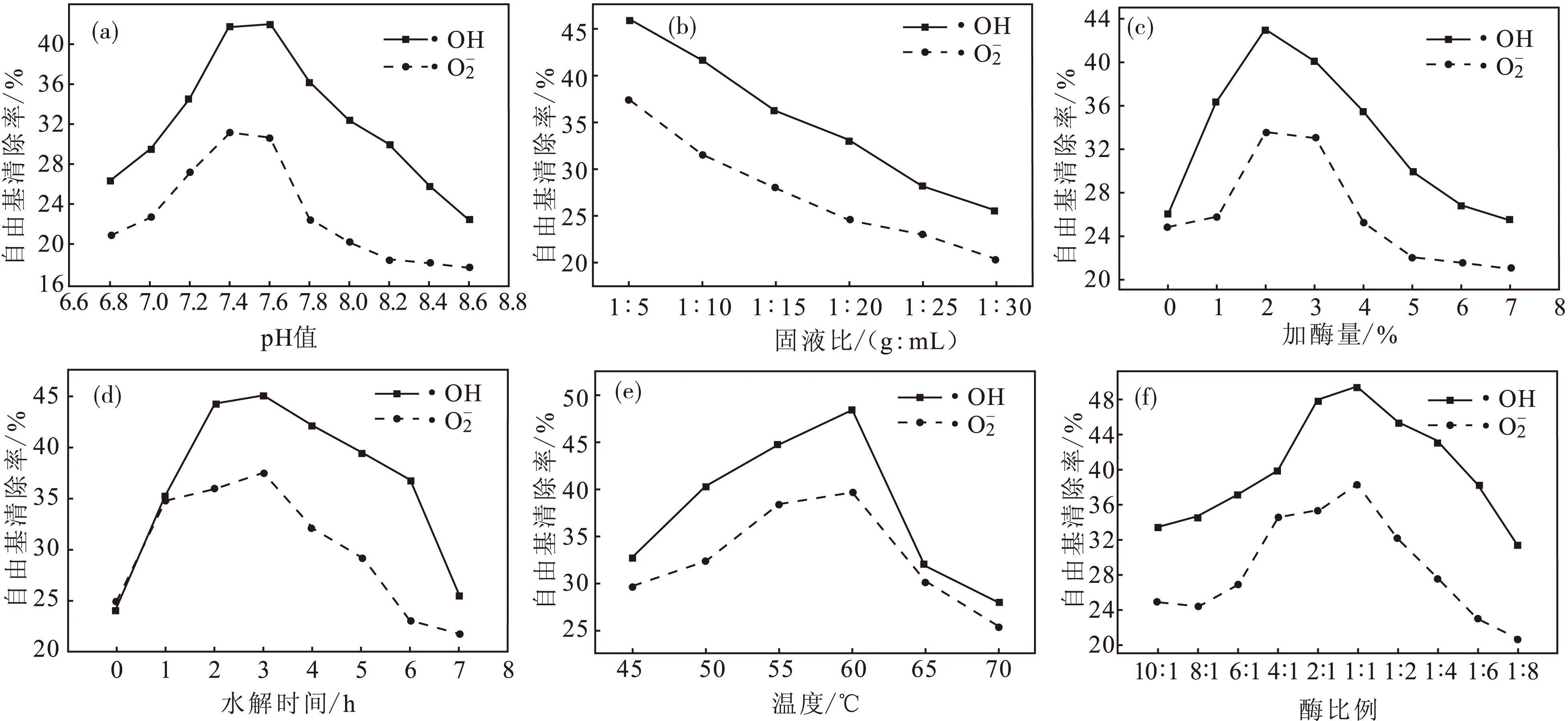
图1 各因素对复合酶水解蚕蛹蛋白产物的抗氧化活性的影响Fig.1 The effect of various factors on the antioxidant activity of hydrolysis products of silkworm pupa protein by compound enzyme
由图1a可知,水解产物的抗氧化活性随着pH值的增大而增强,在7.5左右达到最大值,超过7.5以后随着pH值的增大而减弱;由图1b可知,水解产物的抗氧化活性随着固液比的减小而减弱,综合考虑,固液比1∶10较为适宜;由图1c可知,水解产物的抗氧化活性随着加酶量的增大而增强,在2%左右达到最大值,超过2%以后随着加酶量的增大而减弱;由图1d可知,水解产物的抗氧化活性随着水解时间的延长而增强,在3 h左右达到最大值,超过3 h以后随着水解时间的延长而减弱;由图1e可知,水解产物的抗氧化活性随着温度的升高而增强,在60 ℃左右达到最大值,超过60 ℃以后随着温度的升高而减弱;由图1f可知,水解产物的抗氧化活性随着碱性蛋白酶比例的减小而增大,在酶比例为1∶1左右达到最大值,随着碱性蛋白酶比例的继续减小水解产物的抗氧化活性减弱。
由图1结果初步确定最佳复合酶水解工艺参数分别为:pH值7.5,固液比1∶10,加酶量2%,水解时间3 h,温度60 ℃,酶比例1∶1。
2.4 响应面实验
根据单因素实验结果,采用Box-Behnken设计原理,以自由基清除率为响应值,选取pH值(A)、加酶量(B)、水解时间(C)、温度(D)、酶比例(E)进行5因素3水平的响应面实验,结果如表3所示。
表3 复合酶水解蚕蛹蛋白的响应面实验结果

Tab.3 The response surface experiment results of compound enzymatic hydrolysis of silkworm pupa protein
2.4.1 对羟基自由基清除率的分析
对羟基自由基清除率进行了响应面回归模型的方差分析,见表4。
表4 羟基自由基清除率的响应面回归模型的方差分析

Tab.4 Variance analysis of the response surface regression model of scavenging rate of hydroxyl free radical
使用Design-Expert 8.0.6分析统计软件进行回归拟合分析,得到pH值(A)、加酶量(B)、水解时间(C)、温度(D)、酶比例(E)之间的响应面回归模型为:羟基自由基清除率(%)=60.12683+0.239312A+2.482313B+1.062C-0.39144D+0.306313E+0.0845AB+0.20025AC-0.20225AD-0.13125AE-0.19275BC-0.4765BD-0.3465BE+0.3215CD-0.1135CE-2.229DE-3.64263A2-7.77146B2-4.09671C2-3.31963D2-5.64029E2。
分析统计软件获得pH值、加酶量、水解时间、温度、酶比例相互之间的响应曲面,部分因素相互之间的响应曲面三维图形见图2。
从表4和图2 可以看出,B、C、DE、A2、B2、C2、D2、E2对羟基自由基清除率的影响极显著(P<0.01),其它各项对羟基自由基清除率的影响不显著(P>0.05),各因素对羟基自由基清除率的影响大小顺序为:加酶量>水解时间>温度>酶比例>pH值。该模型回归性极显著(P<0.0001),失拟项P=0.3983,差异不显著,说明该模型拟合精确、可信,可用于预测、分析复合酶水解蚕蛹蛋白的水解产物对羟基自由基清除率的影响。

图2 各因素对羟基自由基清除率的响应曲面Fig.2 The response surface between various factors on the scavenging rate of hydroxyl radical
2.4.2 对超氧阴离子自由基清除率的分析
对超氧阴离子自由基清除率进行了响应面回归模型的方差分析,见表5。
表5 超氧阴离子自由基清除率的响应面回归模型的方差分析

Tab.5 Variance analysis of the response surface regression model of scavenging rate of superoxide anion free radical
使用Design-Expert 8.0.6分析统计软件进行回归拟合分析,得到pH值(A)、加酶量(B)、水解时间(C)、温度(D)、酶比例(E)之间的响应面回归模型为:超氧阴离子自由基清除率(%)=40.39733-1.51813A+0.884875B+1.079313C-1.4945D+0.708938E-0.707AB-0.04375AC+0.46525AD+0.772AE-0.1195BC+0.4815BD-1.076BE-0.39525CD+0.18025CE+0.215DE-3.75108A2-6.55242B2-4.25633C2-3.59108D2-2.88667E2。分析统计软件获得pH值、加酶量、水解时间、温度、酶比例相互之间的响应曲面,部分因素相互之间的响应曲面三维图形见图3。
从表5和图3可以看出,A、B、C、D、E、A2、B2、C2、D2、E2对超氧阴离子自由基清除率的影响极显著(P<0.01)外,BE对超氧阴离子自由基清除率的影响显著(P<0.05),其它各项对超氧阴离子自由基清除率的影响不显著(P>0.05),各因素对超氧阴离子自由基清除率的影响大小顺序为:pH值>温度>水解时间>加酶量>酶比例。该模型回归性极显著(P<0.0001),失拟项P=0.1651,差异不显著,说明该模型拟合精确、可信,可用于预测、分析复合酶水解蚕蛹蛋白的水解产物对超氧阴离子自由基清除率的影响。
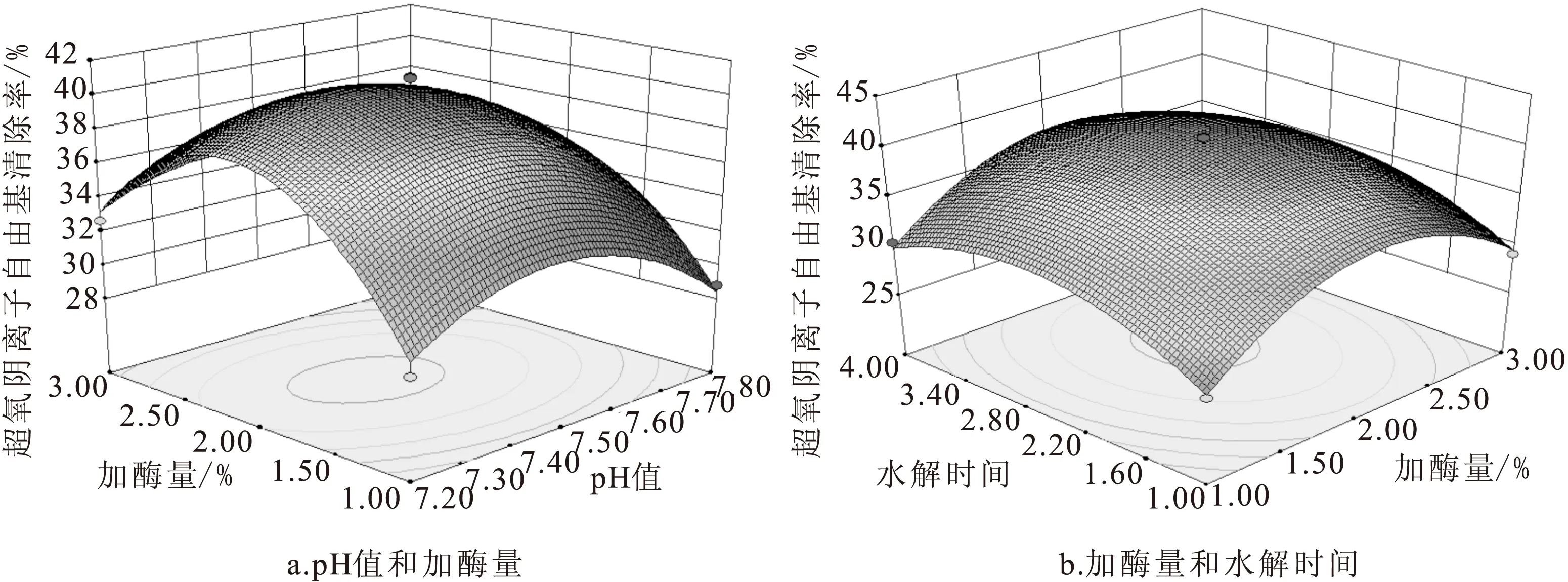
图3 各因素对超氧阴离子自由基清除率的响应曲面Fig.3 The response surface between various factors on the scavenging rate of superoxide anion free radical
2.5 响应面法优化工艺条件及水解效果验证
通过响应面分析和预测,得到复合酶水解蚕蛹蛋白的优化工艺条件为:采用碱性蛋白酶+中性蛋白酶复合酶,pH值 7.47,固液比1∶10,加酶量2.1%,水解时间2.7 h,温度59.2 ℃,酶比例(碱性蛋白酶∶中性蛋白酶)1.3∶1,在该工艺条件下预测羟基自由基清除率为60.30%,超氧阴离子自由基清除率为40.78%。
为了验证优化工艺条件的可靠性,进行了验证实验,结果为蛋白水解度41.73%,多肽得率33.29%,水解产物的羟基自由基清除率59.48%、超氧阴离子自由基清除率40.57%。结果显示实测值和预测值相差不大,证明实验模型有效、可信,可用于指导蚕蛹蛋白可控酶解制备抗氧化活性多肽。
3 结论
对蚕蛹蛋白进行了单酶和复合酶水解实验,确定了可控酶解蚕蛹蛋白制备抗氧化活性多肽的最佳工艺条件为:采用碱性蛋白酶+中性蛋白酶复合酶,pH值 7.47,固液比1∶10,加酶量2.1%,水解时间2.7 h,温度59.2 ℃,酶比例(碱性蛋白酶∶中性蛋白酶)1.3∶1。在此工艺条件下,蚕蛹蛋白水解度为41.73%,多肽得率为33.29%,水解产物的羟基自由基清除率为59.48%、超氧阴离子自由基清除率为40.57%。该抗氧化活性多肽生产工艺操作简单,条件温和,对蚕蛹蛋白水解情况好,抗氧化活性多肽得率较高,酶解程度可控。本研究可为蚕蛹蛋白的深加工和综合利用提供有效借鉴。
[1] 胡建平,刘可桃.蚕蛹蛋白的提取工艺及综合利用研究进展[J].安徽农学通报,2011,17(11):185-186.
[2] ZHOU J,HAN D.Proximate,amino acid and mineral composition of pupae of the silkwormAntheraeapernyiin China[J].Journal of Food Composition & Analysis,2006,19(8):850-853.
[3] 李高扬.蚕蛹抗氧化多肽的制备及分离纯化研究[D].广州:华南理工大学,2011.
[4] 王浩.蚕蛹蛋白肽的制备及其功能活性研究[D].长春:吉林农业大学,2007.
[5] ARIHARA K.Strategies for designing novel functional meat pro-ducts[J].Meat Science,2006,74(1):219-229.
[6] 李勇.生物活性肽研究现况和进展[J].食品与发酵工业,2007,33(1):3-9.[7] 卢楠,廖鲜艳,翁新楚,等.蚕蛹抗氧化肽的制备及其体外抗氧化活性评价[J].上海大学学报(自然科学版),2013,19(2):215-220.
[8] 邓乾春,陈春艳,潘雪梅,等.白果活性蛋白的酶法水解及抗氧化活性研究[J].农业工程学报,2005,21(11):155-159.
[9] 朱晓燕,邬建敏,贾之慎.佛手多糖的化学组成及体外抗氧化活性研究[J].高等学校化学学报,2005,26(7):1264-1267.
[10] 张丽霞,赵丽娟.金针菇多糖的抗氧化活性研究[J].西南农业学报,2014,27(1):240-243.
[11] JE J Y,QIAN Z J,BYUN H G,et a1.Purification and characterization of all antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J].Process Biochemistry,2007(5):840-846.
[12] 景临林,马慧萍,范小飞,等.甘松不同溶剂提取物的抗氧化活性研究[J].化学研究与应用,2014(10):1591-1596.
[13] 秦樱瑞,罗金凤,黄先智,等.缫丝蚕蛹蛋白酶解产物体外抗氧化能力研究[J].食品工业科技,2014,35(19):93-96.
[14] FARAGGI M,HOUÉE-LEVIN C.Some aspects of the chemistry and biology of the superoxide radical anion[J].Journal de Chimie Physique et de Physico-Chimie Biologique,1999,96(1):71-84.
[15] 徐英操,刘春红.蛋白质水解度测定方法综述[J].食品研究与开发,2007,28(7):173-176.
[16] 李理,张静.蛋白水解产物中多肽得率的测定方法研究[J].现代食品科技,2010,26(8):884-888.
Optimization of Controllable Enzymatic Hydrolysis Conditions for Preparation of Antioxidant Active Polypeptide from Silkworm Pupa Protein
ZUO Zhen-yu,YE Chuan
(CollegeofChemistryandChemicalEngineering,WuhanUniversityofScienceandTechnology,Wuhan430081,China)
Inthisstudy,usingdefattedanddecoloredsilkwormpupaproteinpowderasrawmaterials,theenzymatichydrolysisoftheproteinbydifferentsourcesofsingleenzyme(alkalineprotease,trypsin,neutralprotease,papain,pepsin)andcompoundenzymewasinvestigatedbyconsideringcomprehensiveindexofproteinhydrolysisdegree,polypeptideyield,andantioxidantactivityofhydrolysisproducttodeterminethemostsuitablesingleenzymeandcompoundenzyme.Theoptimalconditionsofpreparingantioxidantactivepolypeptidebycontrollableenzymatichydrolysisofsilkwormpupaproteinwereasfollowsbyaresponsesurfacemethodology:compoundenzymes(alkalineprotease∶neutralprotease=1.3∶1)weretheoptimalhydrolysisenzymes,silkwormpupaproteinpowderwastreatedbyultrasonic(10min,on3s,off2s),andhydrolyzedat59.2 ℃for2.7hwithpHvalue7.47,solid-liquidratio1∶10(g∶mL),enzymedosage2.1%.Undertheseconditions,theproteinhydrolysisdegreewas41.73%,thepolypeptideyieldwas33.29%,andthescavengingratesofhydroxylfreeradicalandsuperoxideanionfreeradicalofhydrolysisproductswere59.48%and40.57%,respectively.
silkwormpupaprotein;activepolypeptide;controllableenzymatichydrolysis;antioxidantactivity;hydrolysisdegree
湖北省自然科学基金资助项目(2014CFB802)
Q 556.9
A
1672-5425(2017)01-0032-07
左振宇,叶川.可控酶解蚕蛹蛋白制备抗氧化活性多肽的研究[J].化学与生物工程,2017,34(1):32-38,65.

