丹参酮IIA对大鼠肝纤维化的干预作用及其调控AngⅡ的分子机制
张翼宙 卢冬冬 董颖 郑如回
浙江中医药大学 杭州 310053
丹参酮IIA对大鼠肝纤维化的干预作用及其调控AngⅡ的分子机制
张翼宙 卢冬冬 董颖 郑如回
浙江中医药大学 杭州 310053
[目的]观察丹参酮IIA(tanshinone IIA,TSN)对四氯化碳(carbontetrachloride,CCl4)致大鼠肝纤维化的干预作用,并以血管紧张素II(angiotensin II,Ang II)受体为靶点探讨相关的作用机制。[方法]SD大鼠随机分为5组,每组6只。除空白对照组外,其余各组大鼠用CCl4诱导肝纤维化模型。治疗组分别给予剂量为21.3mg/(kg·d)、14.2mg/(kg·d)、7.1 mg/(kg·d)的TSN与5%的黄蓍树胶混悬液,模型组和空白对照组给予等容积的5%黄蓍树胶溶液,灌胃1次/d。用药10周后,测定各组大鼠血清中丙氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartate transferase,AST)、Ang II的含量,并对各组大鼠肝组织进行HE染色和羟脯氨酸(hydroxyl proline,Hyp)测定,实时荧光定量逆转录PCR(RT-PCR)和免疫组化法(immunohistochemistry,IHC)分别检测I型胶原蛋白(collagen type I,Col I)、缺氧诱导因子-1α(hypoxia inducibleFactor-1α,HIF-1α)、血管内皮细胞生长因子(vascular endothelial growthFactor,VEGF)及血管紧张素II 1型受体(angiotensin II type 1 receptor,AT1R)的mRNA和蛋白表达。[结果]TSN能明显降低肝纤维化大鼠血清中ALT、AST、Ang II的水平,降低肝组织中Hyp的含量,抑制胶原纤维的表达,降低Col I、HIF-1α、VEGF及AT1R各mRNA和蛋白表达。[结论]TSN有明显的抗肝纤维化作用,其机制与改善肝脏微循环、减少细胞外基质合成、抑制胶原纤维密切相关。
TSN;肝纤维化;Ang II;AT1R;HIF-1α;VEGF
肝纤维化继发于慢性肝脏损伤后的组织修复过程,是各种慢性肝脏疾病发展为肝硬化和肝癌的共同病理过程,也是肝硬化发展的必经阶段[1]。肝星状细胞(hepatic stallate cell,HSC)的活化增殖是肝纤维化发生、发展的核心环节[2],由于血管活性物质调节剂——血管紧张素Ⅱ(angiotensin II,AngⅡ)能引起HSC的收缩和增殖,因此Ang II及其受体成为近年来抗肝纤维化的研究热点[3]。本实验采用四氯化碳(carbontetrachloride,CCl4)致大鼠肝纤维化模型,研究丹参的主要有效成分丹参酮IIA(tanshinone IIA,TSN)对肝纤维化的干预作用,并以AngⅡ受体为靶点探讨相关的分子机制,为其临床应用提供科学的依据。
1 材料
1.1 药品与试剂 TSN(纯度≥98%,批号:121103)由西安鸿生生物技术有限公司提供;CCl4由上海凌峰化学试剂有限公司提供;黄蓍树胶粉(批号:FZ0071104)购自上海一基实业有限公司;橄榄油由北京京都利德食品有限公司提供。丙氨酸转氨酶(alanine transaminase,ALT)检测试剂(批号:27030/972024/1)和天冬氨酸转氨酶(aspartate transaminase,AST)检测试剂(批号:26024/962018/1)购自德赛诊断系统(上海)有限公司。Ang II酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(批号:50R-E.1519R)由BIOVALUE公司提供。浓缩型DAB试剂盒(ZLI-9032,批号:60882801)由北京中杉金桥生物技术有限公司生产。Total RNA提取试剂盒(批号:AKA2405)、荧光定量 PCR试剂盒(批号:AK6801)、逆转录试剂盒(批号:AK3901)均购自TaKaRa公司。羟脯氨酸(hydroxyl proline,Hyp)测试盒(批号:20130318)购自南京建成生物工程研究所。
1.2 动物与分组 雄性SD大鼠30只,体质量(200± 20)g,购自上海西普尔-必凯实验动物有限公司,实验动物生产许可证号:SCXK(沪)2013-0016,饲养于浙江中医药大学动物实验研究中心,实验动物使用许可证号:SYXK(浙)2013-0184。普通饲料饲养1周,自由进食,每日更换饮水,保持大鼠生活环境通风及清洁。经观察进食、饮水、活动、大小便等情况后,将大鼠随机分为5组,每组6只,即空白对照组、模型组和治疗组(TSN低、中、高剂量组)。
1.3 仪器 STP120脱水机、AP280-2包埋机、HM335E切片机(MICROM 公司);Nikon eclipse 80i显微镜、CCD:DS-Fi1 500万像素(Nikon公司);Carl ZeissImagingSystems(Carl Zeiss公司);BG-270隔水式电热恒温箱(上海博迅实业有限公司医疗设备厂);日立7020全自动生化分析仪。
2 方法
2.1 模型制备 模型组及治疗组大鼠皮下注射含40%CCl4的橄榄油溶液,空白对照组大鼠皮下注射橄榄油。大鼠给药剂量均为2.5mL·kg-1,每周2次,连续12周[4]。
2.2 给药与样本采集 造模后第3周开始给药,各治疗组大鼠分别灌胃给予21.3mg/(kg·d)(TSN高剂量组)、14.2mg/(kg·d)(TSN中剂量组)、7.1mg/(kg·d)(TSN低剂量组)的TSN与5%黄蓍树胶混悬液(TSN高剂量组、中剂量组和低剂量组中TSN与黄蓍树胶比例分别为1:23.5、1:35.2和1:70.4),模型组和空白对照组灌胃给予等容积的5%黄蓍树胶溶液,每组每天上午给药1次,连续灌胃给药10周。用药10周后,大鼠禁食12h,予戊巴比妥钠40mg·kg-1,腹腔麻醉,剪开腹腔,下腔静脉取全血,3000 r/min离心10min,留取血清备用。摘取肝脏,称重后,剪取肝组织备用。
2.3 大鼠肝组织HE染色 取肝组织,经脱水、透明石蜡包埋。肝脏石蜡切片作HE染色,光镜下观察肝组织病理学改变。肝纤维化大鼠肝组织炎症评分及纤维化评分按文献[5]中的方法进行记分。
2.4 大鼠肝组织Hyp测定 取肝组织,经水解及离心,测定各管吸光度,按说明书计算Hyp的含量。
2.5 血清及肝组织生化指标检测 取大鼠血清,采用全自动生化分析仪检测ALT、AST的水平,采用ELISA法测定AngII的水平。
2.6 免疫组化方法检测 取肝组织,采用免疫组织化学方法进行染色、制片,显微镜下拍摄每张切片所要分析的部位,照片进行图像分析。用DAB显色的免疫组化切片阳性区域为棕黄色,阳性指数表示总光密度均分到该照片的值,即所拍摄照片的黄度,值越大,照片越黄,以此评价照片所对应组织的阳性程度,从而检测肝组织I型胶原蛋白(collagen type I,Col I)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、血管内皮细胞生长因子(vascular endothelial growth factor VEGF)及血管紧张素II 1型受体(angiotensin II type 1 receptor,AT1R)的表达量。
2.7 Real time RT-PCR检测 取100mg肝组织于1mL RNAiso PLus中匀浆提取总RNA,30μL反应体系反转录获得cDNA,反应条件:37℃ 15min,85℃ 5s。25μL反应体系中进行Real time RT-PCR,检测肝组织中,AT1RmRNA、col ImRNA、HIF-1αmRNA以及VEGF mRNA的含量。反应条件:95℃ 3min;95℃10s;60℃ 30s,扩增40个循环;溶解曲线:从55℃开始,每30s升高0.5℃,直到95℃,循环1次。所有反应信息资料由Bio-Rad iQ5实时荧光定量PCR仪收集,Ct值通过PCR仪的配套软件测量和计算,转录水平通过公式2-△△CT计算,得出各指标含量。
2.8 统计学方法 应用SPSS19.0软件统计分析。计量资料统计描述结果以均数±标准差(x±s)方式表示;多组间均数差异性比较采用单因素方差分析;组间多重比较,方差齐性时采用LSD检验,方差不齐时采用Dunnett’sT3检验。检验水准α=0.05,P<0.05被认为有统计学差异。
3 结果
3.1 动物生存状态观察 空白对照组大鼠饮食、活动及二便无明显变化,精神状态佳,皮毛顺滑光泽,体重增长较快。模型组和TSN低剂量组大鼠饮食及活动减少,小便量较多,时有稀溏便,精神不振,皮毛凌乱缺乏光泽,体重增长较慢,甚至不增长。TSN中剂量组和TSN高剂量组大鼠饮食、活动及二便与空白对照组相近,饮食、活动无明显变化,皮毛光滑,体重增长平稳。
3.2 各组大鼠肝组织肉眼观察 空白对照组大鼠肝脏色泽鲜红,表面光滑,边缘锐利,质地软、脆,触之易碎。模型组大鼠肝脏色泽偏暗,表面有粟粒状小结节,肝脏边缘明显变钝、厚,质地硬。TSN低剂量组大鼠肝脏色泽偏暗,表面不太光滑,肝脏边缘变厚,质韧。TSN中、高剂量组大鼠肝脏色泽鲜红,表面光滑,边缘锐利,质地较软。
3.3 大鼠肝质量与肝脏指数 各治疗组及模型组末次肝质量均明显高于空白对照组,差异有统计学意义(P<0.01);模型组以及TSN低、中剂量组肝脏指数明显高于空白对照组,差异有统计学意义(P<0.01),TSN高剂量组肝脏指数明显低于模型组,差异有统计学意义(P<0.05)。见表1。
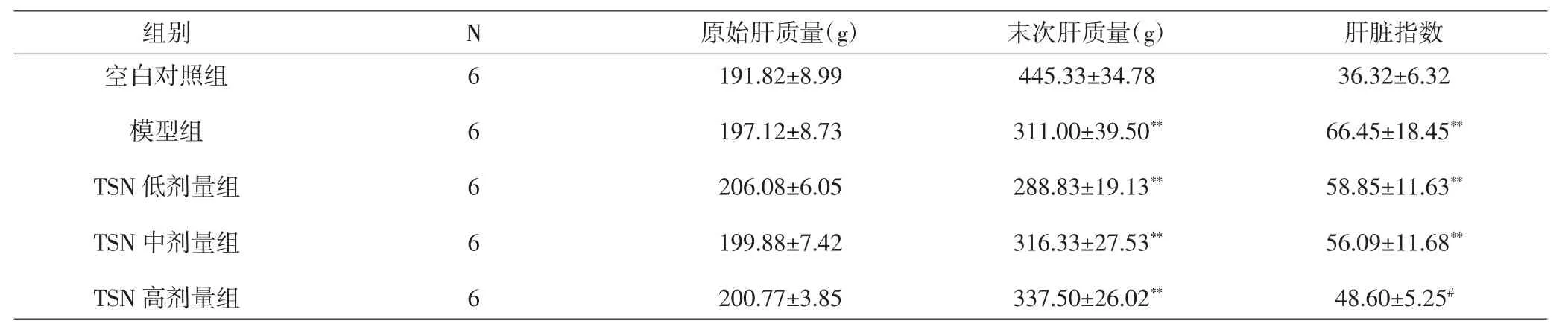
表1 各组大鼠肝质量与肝脏指数测定结果(x±s)Tab.1 Body weight and liver index of rats in groups(x±s)
3.4 各组大鼠肝组织HE染色结果 空白对照组大鼠肝小叶结构清晰,肝细胞索排列整齐,肝细胞大小均匀,无变性、坏死,无炎细胞浸润,肝组织无异常现象。模型组大鼠肝小叶正常结构被破坏,肝索排列紊乱,肝细胞出现广泛气球样变,汇管区及部分中央静脉周围可见纤维结缔组织增生形成细小的条索,大量炎性细胞浸润,胶原纤维沉积并陷入肝组织分割包绕肝细胞形成纤维间隔,部分严重损伤区域已出现大小不等的由胶原纤维分隔出的假小叶,假小叶内肝细胞明显肿胀、变性及呈点状坏死。治疗组肝组织病理改变明显改善。其中TSN高、中剂量组治疗效果较好,肝细胞索排列基本清晰,肝小叶结构基本完整,只有轻微破坏,胶原纤维增生较少,未出现假小叶,少量炎细胞浸润,肝细胞有少量脂肪变性,汇管区有少量肝细胞坏死;TSN低剂量组治疗效果较不明显,肝细胞出现气球样变性,纤维组织增生明显,且由汇管区向周围延伸,部分区域可见已成形的假小叶,肝细胞脂肪变性、坏死及细胞肿胀情况仍较严重。见图1。
3.5 各组大鼠肝组织Hyp检测结果 模型组Hyp含量明显高于空白对照组,差异有统计学意义(P<0.05);TSN高剂量组低于模型组,差异有统计学意义(P<0.05),而TSN低、中剂量组与模型组相比,差异无统计学意义(P>0.05)。提示TSN高剂量能降低肝纤维化大鼠Hyp含量。见表2。
表2 各组大鼠肝组织Hyp测定结果(±s)Tab.2 Results of Hyp measurement of rats liver tissue in groups(±s)
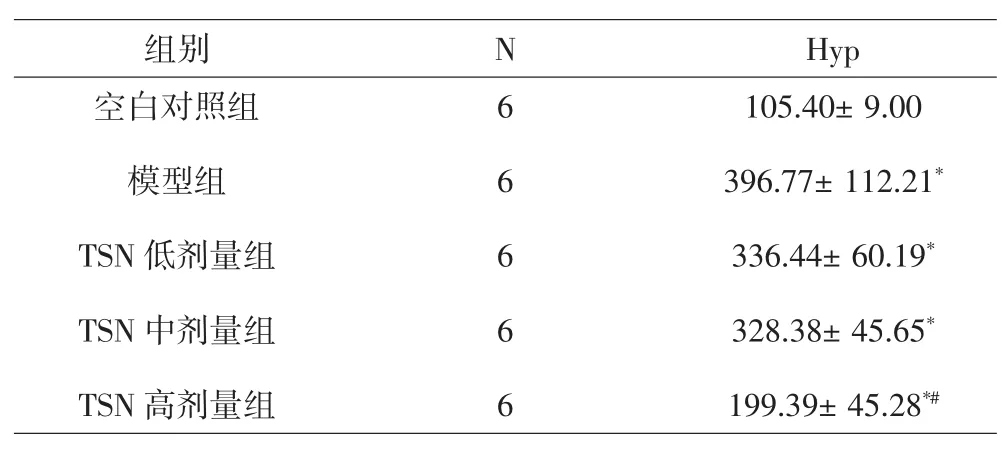
表2 各组大鼠肝组织Hyp测定结果(±s)Tab.2 Results of Hyp measurement of rats liver tissue in groups(±s)
注:与空白对照组比较,*P<0.05;与模型组比较,#P<0.05。Note:Compared with normal group,*P<0.05;Compared with model group,#P<0.05.
组别 N Hyp空白对照组模型组TSN低剂量组TSN中剂量组TSN高剂量组6 6 6 6 6 105.40±9.00 396.77±112.21*336.44±60.19*328.38±45.65*199.39±45.28*#
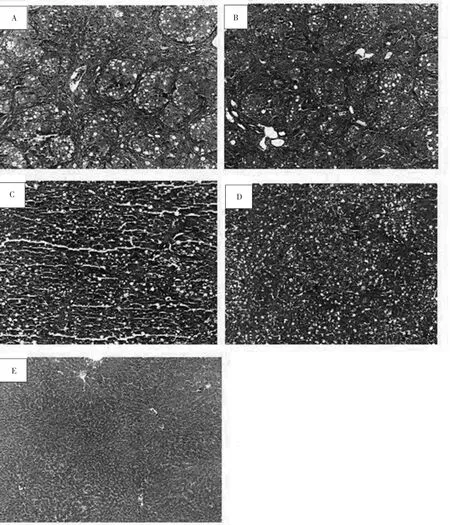
图1 各组大鼠肝组织HE染色结果(400×)Fig.1 HE staining results of rats liver tissue in groups(400×)
3.6 各组大鼠血清ALT、AST、AngII测定结果 与空白对照组相比,模型组及各治疗组大鼠血清中ALT、AST含量明显升高,差异有统计学意义(P<0.05,P<0.01)。与空白对照组相比,模型组、TSN低剂量组及TSN中剂量组血清中AngII明显升高,差异有统计学意义(P<0.05,P<0.01);与模型组相比,TSN中剂量组与TSN高剂量组血清中AngII含量显著降低,差异有统计学意义(P<0.01)。见表3。
3.7 免疫组化检测结果 空白对照组大鼠肝组织Col I仅在肝组织中央静脉和汇管区有少量的浅棕黄色着色。模型组大鼠肝组织 Col I表达明显增强,广泛分布于坏死灶周围、汇管区,在纤维间隔及肝窦呈棕黄色,且纤维间隔部位及汇管区的部分细胞核呈棕褐色染色。AT1R在空白对照组组织可见弱表达,模型组中表达明显,其阳性细胞主要定位于窦周间隙,呈椭圆形或不规则形,可见其突入肝细胞之间。HIF-1α在空白对照组大鼠肝组织可见弱表达,在模型组中表达明显,阳性细胞主要在间质细胞及部分肝细胞。VEGF在空白对照组组织可见弱表达,模型组中表达明显,主要定位于窦旁细胞、血管内皮细胞及纤维隔内成纤维细胞。见图2~图5。
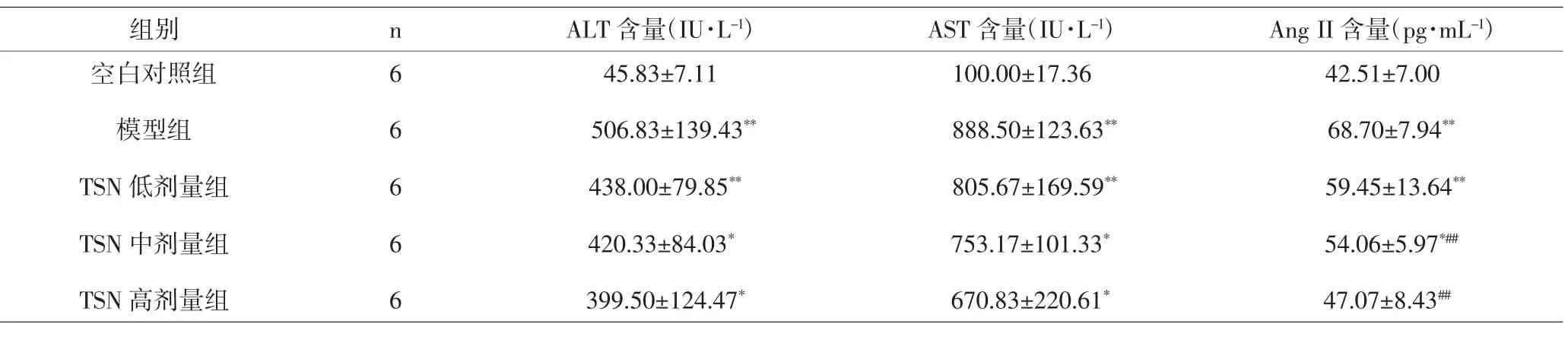
表3 各组大鼠血清ALT、AST及AngII测定结果(x±s)Tab.3 Results of ALT,AST and Ang II content of rats serum in groups(x±s)
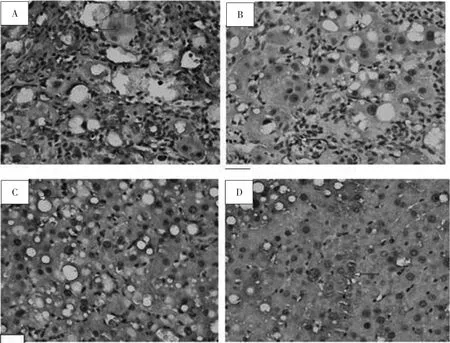
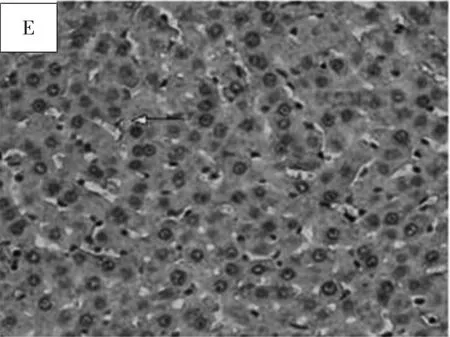
图2 各组大鼠肝组织Col I免疫组化染色结果(400×)Fig.2 Col I IHC results of rats liver tissue in groups(400×)
各观察指标表达水平以阳性指数表示(为便于各组间区分,把HIF-1α指数增加到1000倍),结果显示,模型组ColⅠ、HIF-1α、VEGF及AT1R表达水平明显高于空白对照组,差异有统计学意义(P<0.05,P<0.01)。各治疗组ColⅠ、HIF-1α及VEGF阳性指数均低于模型组,差异有统计学意义(P<0.05))。TSN中、高剂量组AT1R阳性指数明显低于模型组,差异有统计学意义(P<0.05,P<0.01)。见表4。
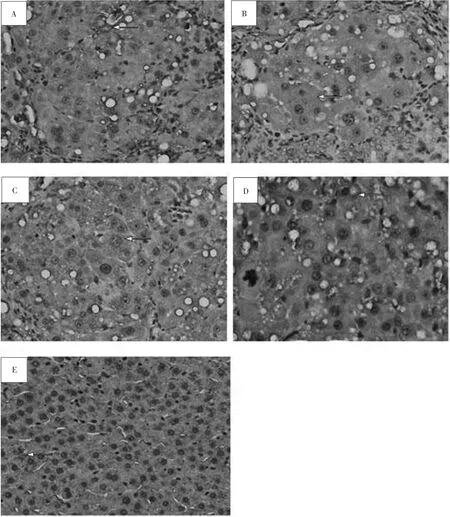
图3 各组大鼠肝组织AT1R免疫组化染色结果(400×)Fig.3 AT1R IHC results of rats liver tissue in groups(400×)
3.8 Real time RT-PCR检测结果 与空白对照组相比,模型组、TSN低剂量组和TSN中剂量组Col I mRNA相对表达量明显升高,差异有统计学意义(P<0.01);与模型组与低剂量组相比,TSN中、高剂量组相对表达量显著降低,差异有统计学意义(P<0.01)。与模型组相比,TSN中剂量组AT1R mRNA相对表达量降低,差异有统计学意义(P<0.05)。模型组HIF-1αmRNA表达水平与空白对照组相比较,差异有统计学意义(P<0.01),表明模型组明显高于空白对照组;TSN低剂量组大鼠HIF-1αmRNA表达水平高于空白对照组,差异有统计学意义(P<0.05);与模型组相比,TSN中、高剂量组明显降低,差异有统计学意义(P<0.01);与TSN低剂量组相比,TSN中、高剂量组HIF-lα mRNA表达下降,差异有统计学意义(P<0.05,P<0.01)。模型组大鼠VEGF mRNA表达水平明显高于空白对照组,差异有统计学意义(P<0.01);与模型组相比,TSN低、中、高剂量组明显降低,差异均有统计学意义(P<0.01);与TSN低剂量组相比,TSN中、高剂量组表达量明显降低,差异有统计学意义(P<0.05,P<0.01)。见表5。

图4 各组大鼠肝组织HIF-1α免疫组化染色结果(400×)Fig.4 IF-1α IHC results of rats liver tissue in groups(400×)

图5 各组大鼠肝组织VEGF免疫组化染色结果(400×)Fig.5 VEGF IHC results of rats liver tissue in groups(400×)
4 讨论
4.1 CCL4诱导肝纤维化大鼠模型 本实验采用CCl4致肝纤维化大鼠模型,研究TSN对肝纤维化的干预作用及其机制。由于CCl4诱导形成的纤维化自愈倾向明显,故采用预防给药方式。本实验大鼠造模12周后,根据模型组大鼠的外在表现、肝脏情况以及各生化指标的结果提示模型组大鼠具有肝纤维化典型改变,证实了本实验动物造模成功。
4.2 TSN能降低肝组织Hyp含量以及Col I的表达在肝纤维化发生、发展过程中,活化的HSC大量增殖,并转化为肌成纤维细胞,进而产生大量的细胞外基质。以Col I为主的胶原是细胞外基质的主要组分,而Hyp是胶原蛋白的主要成分,在纤维化过程中,肝组织Col I和Hyp表达逐渐增加,是评估肝纤维化程度的重要指标[6]。本研究结果显示,高剂量TSN能有效降低肝组织中Hyp的含量,而各剂量TSN都能有效抑制Col I的表达,以中、高剂量尤其明显。高剂量TSN既能降低肝组织Hyp含量,又能抑制Col I的表达,具有明显的抗肝纤维化作用。肝功能是否正常也影响着肝纤维化的进程,具体表现为血清或血浆中相关酶活性水平[7]。本研究中,各治疗组血清ALT、AST含量均低于模型组,说明TSN还对肝功能有一定保护作用,从而阻止肝纤维化进程。
表4 各组大鼠肝组织Col I、HIF-1α、VEGF及AT1R蛋白表达(±s)Tab.4 Col I,HIF-1α,VEGF and AT1R protein expression of rats liver tissue in groups±s)
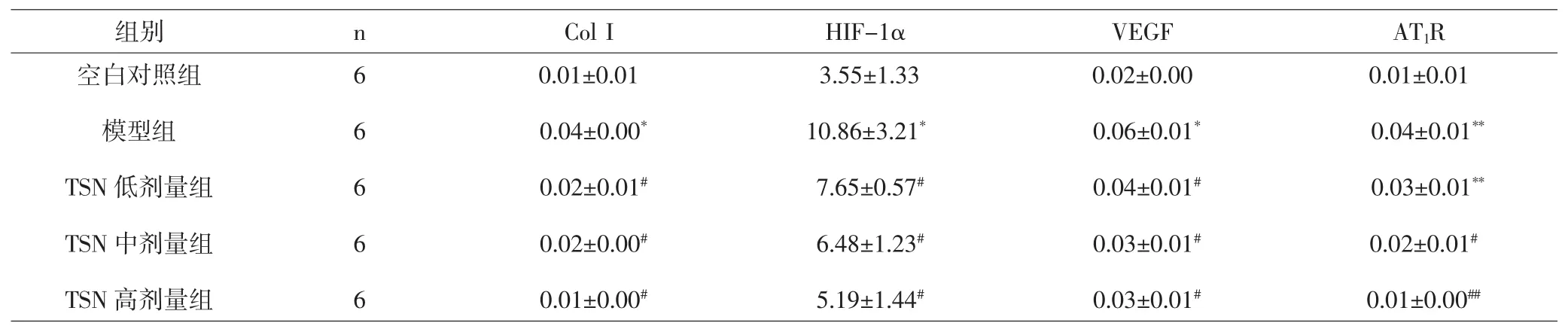
表4 各组大鼠肝组织Col I、HIF-1α、VEGF及AT1R蛋白表达(±s)Tab.4 Col I,HIF-1α,VEGF and AT1R protein expression of rats liver tissue in groups±s)
注:与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。Note:Compared with normal group,*P<0.05,**P<0.01;Compared with model group,#P<0.05,##P<0.01.
表5 各组大鼠肝组织Col I、AT1R、HIF-1α及VEGF mRNA表达(±s)Tab.5 Results ofCol I,HIF-1α,VEGF and AT1R mRNA of rats liver tissue in groups(±s)
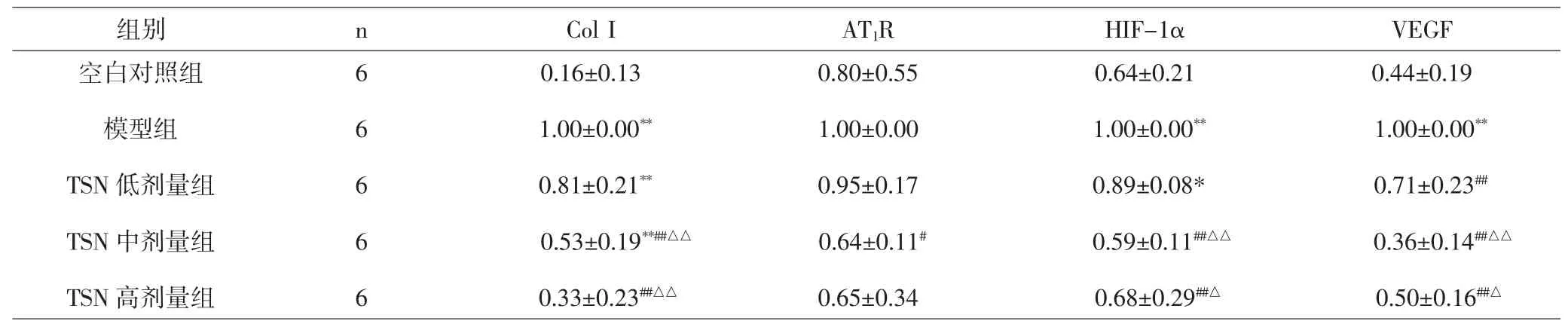
表5 各组大鼠肝组织Col I、AT1R、HIF-1α及VEGF mRNA表达(±s)Tab.5 Results ofCol I,HIF-1α,VEGF and AT1R mRNA of rats liver tissue in groups(±s)
注:与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与低剂量组相比,△P<0.05,△△P<0.01。Note:Compared with normal group,*P<0.05,**P<0.01;Compared with model group,#P<0.05,##P<0.01;compared with low-dosage group,△P<0.05,△△P<0.01.
?
4.3 TSN降低Ang II的含量及其1型受体的表达Ang II是肾素-血管紧张素系统(renin angiotensin system,RAS)中最主要的生物活性物质,Ang II除存在于循环RAS中,也存在于肝脏局部[8],能引起HSC收缩,增加肝脏微循环阻力,促进肝纤维化,因此是肝纤维化的重要干预靶点。Bataller等[9]首次从培养活化的人HSC上发现了AT1R,并且发现AngⅡ可以与HSC上的AT1R结合,诱导HSC内钙离子浓度的升高,从而引起HSC的收缩及增殖。王卫卫等[10]发现纤维化肝脏组织AT1R阳性表达细胞数明显多于正常肝脏组,并随着Ⅰ型胶原面积的增加而明显增加。龚浩等[11]研究显示AngⅡ能够剂量依赖性和时间依赖性地引起HSC的收缩,使肝窦收缩,从而增加肝脏微循环阻力,进一步加重肝纤维化的形成。肝纤维化在中医学中属于癥结范畴,血瘀是其基本病机。本实验中模型组大鼠血清Ang II水平与Ang II受体AT1R 的mRNA表达都相对升高,说明大量HSC收缩与增殖,肝脏微循环阻力增大,致血瘀证的产生。本研究结果显示,各剂量的TSN都能降低血清Ang II的含量,还可下调AT1R的mRNA水平,说明TSN能通过改善肝脏微循环,减少HSC的收缩与增殖,产生抗肝纤维化作用,但未发现明显的剂量相关性。
4.4 TSN改善肝脏微循环 VEGF为目前已知最重要的促血管内皮细胞再生的细胞因子,缺血或缺氧是诱导其异常表达的主要因素,受转录因子HIF-1调控[12-13]。本实验中模型组大鼠肝组织VEGF及HIF-1α的表达与空白对照组相比明显增强,说明在肝纤维化的过程中,肝组织出现缺血、缺氧状态,表明肝脏存在血瘀证。TSN治疗组中VEGF和HIF-1α的表达水平与模型组相比均有降低,说明活血化瘀改善了肝脏微循环,使得缺血、缺氧状态明显改善。
综上所述,TSN有显著的抗肝纤维化作用,其机制与保护肝细胞、改善肝脏微循环、减少HSC的收缩与增殖、抑制胶原纤维的合成等有关,通过调控Ang II及其受体AT1R的生成、降低肝组织HIF-1α及VEGF表达发挥作用。
References:
[1] Bracht T,Schweinsberg V,Trippler M,et al.Analysis of disease-associated protein expression using quantitative proteomics-Fibulin-5 is expressed in association with hepatic fibrosis[J].J Proteome Res,2015,14(5):2278-2286.
[2] 丁宁.肝星状细胞与肝纤维化[J].中国中医药现代远程教育,2011,9(18):83-85. DING Ning.Hepatic Stellate Cells and Liver Fibrosis[J]. Chinese Medicine Modern Distance Education of China, 2011,9(18):83-85.
[3] 黄海洋.血管紧张素II受体1结合蛋白(ATRAP)在大鼠肝星形细胞(HSC-T6)中的表达及其在局部肾素血管紧张素系统中的作用[D].广州:南方医科大学,2014:33-37. HUANG Haiyang.ATRAP plays a role in regulating the local renin-angiotensin system in HSC-T6 cells[D].Southern Medical University,2014:33-37.
[4] 李政通,李俊,黄成,等.CCl4诱导的大鼠肝纤维化模型肝纤维化逆转与MAPK信号通路的研究[J].中国药理学通报, 2011,27(6):809-814. LI Zhengtong,LI Jun,HUANG Cheng,et al.Dynamic expression of MAPK signaling pathway on recovery hepatic fibrosis rats induced by CCl4[J].Chinese Pharmacological Bulletin,2011,27(6):809-814.
[5] Oh W Y,Pyo S,Lee K R,et al.Effect of Holotrichia diomphalia larvae on liver fibrosis and hepatotoxicity in rats[J].J Ethnopharamacol,2003,87(2-3):175-180.
[6]WANG B,SUN MY,LONG AH,et al.Yin-Chen-Hao-Tang alleviates biliary obstructive cirrhosis in rats by inhibiting biliary epithelial cell proliferation and activation [J].Pharmacogn Mag,2015,11(42):417-425.
[7] 尹连红,于浩,彭金咏.四氯化碳诱导肝损伤的分子机制及中药干预的研究进展[J].中国现代应用药学,2015,32(9): 1147-1155. YIN Lianhong,YU Hao,PENG Jinyong.Molecular Mechanism and Intervention of Chinese Medicine of Carbon Tetrachloride Induced LiverInjury[J].Chinese Journal of Modern Applied Pharmacy,2015,32(9):1147-1155.
[8] 喻剑华,黄兆胜.虎金颗粒对大鼠肝纤维化的作用及其对肝脏AngⅡ含量及其受体AT1的影响[J].中国中医药科技, 2012,19(2):114-116. YU Jianhua,HUANG Zhaosheng.Effects of Hujin granule on rats’liver fibrosis and Ang II and AT1 receptor contents in livers[J].Chinese Journal of Traditional Medical Science and Technology,2012,19(2):114-116.
[9] Bataller R,Gines P,Nicolas JM,et al.AngiotensinⅡinduces contraction and proliferation of human hepatic stellate cells[J].Gastroenterology,2000(118):1149-1156.
[10]王卫卫,杨希山,李旭,等.血管紧张素Ⅱ1型受体在肝纤维化形成过程中表达变化的研究[J].中华消化杂志,2004,24 (3):131-134. WANG Weiwei,YANG Xishan,LI Xu,et al.Change of expression of angiotensinⅡ type 1 receptor in the formation of liver fibrosis[J].Chinese Journal of Digestion, 2004,24(3):131-134.
[11]龚浩,王宇,张忠涛,等.血管紧张素II及其受体拮抗剂对肝星状细胞收缩的影响[J].中华肝胆外科杂志,2006,12(10): 695-698. GONG Hao,WANG Yu,ZHANG Zhongtao,et al.Effects of angiotensin II and its receptor antagonist on contraction of hepatic stellate cells[J].Chinese Journal of Hepatobiliary Surgery,2006,12(10):695-698.
[12]YANG L,ZHANG Y,ZHU M,et al.Resveratrol attenuates myocardial ischemia/reperfusion injury through upregulation of vascular endothelial growth factor B[J].Free Radic Biol Med,2016(101):1-9.
[13]Ahmed NE,Murakami M,Kaneko S,et al.The effects of hypoxia on the stemness properties of human dental pulp stem cells(DPSCs)[J].Sci Rep,2016(10):1-9.
Intervention and Molecular Mechanism of Ang II Regulation of Tanshinone IIA on Liver Fibrosis in Rats
ZHANG Yizhou,LU Dongdong,DONG Ying, et al Zhejiang Chinese Medical University,Hangzhou(310053)
[Objective]To study the protective effect of Tanshinone IIA(TSN)on hepatic fibrosis in rats induced by carbontetrachloride(CCl4).[Methods]SD rats were divided into 5 groups with 6 in each group.The hepatic fibrosis rat model was established by CCl4.The rats in TSN groups were ig administrated with TSN(21.3mg/(kg·d),14.2 mg/(kg·d),7.1 mg·/(kg·d))and 5%Tragacanth gum mixed suspension,the rats in control and model group with 5%Tragacanth gum mixed suspension,once daily.After ten weeks,the activities of alanine transaminase(ALT),aspartate transferase(AST),angiotensin II(Ang II)were tested,and rat liver tissue was tested by Hematoxylin-eosin(HE)staining,hydroxyl proline(Hyp)testing,immunohisto-chemical detection,Real time RT-PCR method. [Results]TSN can obviously inhibit ALT,AST,AngII rise in liver fibrosis rats serum,reduce Hyp in liver tissue and collagen type I(Col I)content,inhibit the increase of collagen fibers,also can reduce the mRNA transcription level of HIF-1α,VEGF and AT1R and protein expression.[Conclusion]TSN has obvious anti liver fibrosis effect,and the mechanism is closely related with improving the hepatic microcirculation,decreasing extracellular matrix synthesis, inhibiting the increase of collagen fiber.
TSN;hepatic fibrosis;Ang II;AT1R;HIF-1α;VEGF
R331
A
1005-5509(2017)01-0001-10
10.16466/j.issn1005-5509.2017.01.001
2016-08-08)
浙江省自然科学基金(LY12H29006)
Fund project:Zhejiang Provincial Natural Science Foundation of China(LY12H29006)

