注射用乳糖酸阿奇霉素与吸入用布地奈德混悬液的配伍稳定性考察
任进民,沈 军,孙 莉,马江曼,崔晓红
(1.河北医科大学第二医院药学部,河北 石家庄 050000;2.河北出入境检验检疫局河北国际旅行卫生保健中心,河北 石家庄 050051)
注射用乳糖酸阿奇霉素与吸入用布地奈德混悬液的配伍稳定性考察
任进民1,沈 军2,孙 莉1,马江曼1,崔晓红1
(1.河北医科大学第二医院药学部,河北 石家庄 050000;2.河北出入境检验检疫局河北国际旅行卫生保健中心,河北 石家庄 050051)
目的考察注射用乳糖酸阿奇霉素与吸入用布地奈德混悬液配伍稳定性,以及两药与注射用盐酸氨溴索的配伍稳定性。方法参考临床用药方法,以0.9%氯化钠注射液为溶媒将注射用乳糖酸阿奇霉素与吸入用布地奈德混悬液、注射用盐酸氨溴索制备配伍溶液,采用液相色谱-串联质谱联用法(liquid chromatography-tandem mass spectrum,LC-MS/MS)测定法,考察3种药物在室温、冷藏(4 ℃)及避光保存条件下的含量、配伍溶液外观及其pH变化。结果配伍溶液保存2 d时,3种药物组分含量均不低于0 h时的95%,但保存3 d时,3种药物含量降低到0 h时的70%~90%,保存7 d时,药物含量均低于0 h时的50%。保存温度对含量变化无显著影响;配伍溶液保存7 d时,其外观无明显变化;配伍溶液保存3 d时,其pH无显著变化, 但保存7 d时则显著降低。不同保存温度下阿奇霉素、布地奈德浓度均呈下降趋势,不同时点间差异有统计学意义(P<0.05),组间差异无统计学意义(P>0.05),组间·不同时点间交互作用差异无统计学意义(P>0.05)。结论注射用乳糖酸阿奇霉素与吸入用布地奈德混悬液、注射用盐酸氨溴索可作为外用制剂配伍使用,宜常温保存,滴鼻使用时间不宜超过3 d。
阿奇霉素;布地奈德;氨溴索;药物稳定性
阿奇霉素属于大环内酯类抗生素,其抗菌谱广,作用时间长,疗程短,目前广泛用于衣原体、支原体和淋球菌感染及敏感细菌的治疗[1-2]。氨溴索是溴己新的体内活性代谢物,具有黏液排促作用及溶解分泌物的特性,常与阿奇霉素联合使用治疗呼吸系统相关疾病,如肺炎、哮喘及慢性阻塞性肺疾病等[3-5]。布地奈德是不含卤素的糖皮质激素,具有高效快速的局部抗炎作用,临床上通过雾化吸入给药进行治疗[6-9]。目前耳鼻喉科常用乳糖酸阿奇霉素联合布地奈德,或者乳糖酸阿奇霉素、布地奈德、盐酸氨溴索3种药同时配伍,治疗急、慢性鼻窦炎,鼻息肉[10-12]等疾病,疗效比较满意。2种或3种药物配伍制备外用制剂治疗急、慢性鼻窦炎,以滴鼻灌注给药,1~2次/d,疗程5~7 d,疗效肯定,方法简便,但关于注射用乳糖酸阿奇霉素、布地奈德、盐酸氨溴索3种药配伍稳定性的研究未见文献报道。本研究参考3种药物的临床使用剂量,对注射用乳糖酸阿奇霉素、布地奈德、盐酸氨溴索的配伍稳定性进行考察,旨在为临床安全用药提供依据。
1 仪器与试验
1.1 仪器 API 4000+型液相色谱-三重四级杆质谱联用仪,配有电喷雾离子化源和Analust 1.6.1数据处理系统(美国AB公司);Prominence CBM-20A型液相色谱仪(日本岛津公司);XW-80A涡旋混合器(上海医科大学仪器厂);CPA225D型电子分析天平(德国Sartorius公司);KQ-300B型超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药 注射用乳糖酸阿奇霉素(东北制药集团沈阳第一制药有限公司,批号:141204,规格:125 mg);吸入用布地奈德混悬液[澳大利亚Astrazeneca,批号:LOT317629,规格:2 mL(1 mg)];注射用盐酸氨溴索(沈阳新马药业有限公司,批号:14122511,规格:30 mg);内标氯霉素(河北医科大学药理教研室提供);乙腈和甲醇均为色谱纯;乙酸铵、甲酸为色谱纯;试验用水为屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司北京饮料分公司,批号:GB1723)。
1.3 统计学方法 应用SPSS 13.1统计学软件分析数据,计量资料比较采用重复测量的方差分析。P<0.05为差异有统计学意义。
2 方法与结果
2.1 配伍溶液的制备 A组:用无菌注射器在100 mL 0.9%氯化钠注射液袋中取出4 mL,取注射用乳糖酸阿奇霉素(125 mg)1支,用无菌注射器分别注入2 mL 0.9%氯化钠注射液溶解,然后注入该氯化钠注射液袋中;再用另1支无菌注射器抽取吸入用布地奈德混悬液[2 mL(1 mg)]2支,注入该袋中充分混合,制备阿奇霉素与布地奈德的配伍溶液第1个样本(A1)。重复上述操作,制备2种药物配伍溶液样本A2~A10,共有10个样本。
B组:用无菌注射器在100 mL 0.9%氯化钠注射液袋中取出6 mL,取注射用乳糖酸阿奇霉素(125 mg)1支,取注射用盐酸氨溴索(30 mg)1支,用无菌注射器分别注入2 mL 0.9%氯化钠注射液溶解,然后注入该氯化钠注射液袋中,再用另1支无菌注射器抽取吸入用布地奈德混悬液[2 mL(1 mg)]2支,注入袋中充分混合,制备阿奇霉素与布地奈德、盐酸氨溴索的配伍溶液第1个样本(B1),重复上述操作,制备3种药物配伍溶液B2~B10,共有10个样本。
将A1~A5、B1~B5常温避光保存,A6~A10、B6~B10在4 ℃(2~8 ℃)避光冷藏。配伍溶液制备后,于0 h、12 h、1 d、2 d、3 d、5 d、7 d不同时刻取配伍液1 mL,置于具塞离心管,在-70 ℃低温冰箱保存至测定。
2.2 外观观察 在室温条件下,取“2.1”项下的配伍溶液适量,用空白0.9%氯化钠注射液作对照组,于配伍溶液制备后0 h、12 h、1 d、2 d、3 d、5 d、7 d用目测法观察配伍溶液的外观变化,该配伍溶液为透明溶液,肉眼未观察到絮状物、浑浊或沉淀产生现象,7 d内颜色没有改变。
2.3 pH测定 在室温条件下,分别在制备后0 h、12 h、1 d、2 d、3 d、5 d、7 d测定“2.1”项下的配伍溶液的pH,每个样本连测3次,记录平均值。结果显示各组配伍溶液保存0~3 d内pH无明显变化,但在3 d后pH开始降低。见图1。
2.4 药物含量测定
2.4.1 色谱条件 色谱柱:Inertsil ODS-3 C18色谱柱(150×4.6 mm,5 μm);流动相:乙腈-5 mmol/L乙酸铵水溶液(含0.1%甲酸)80∶20(v/v);流速:0.8 mL/min;柱温:30 ℃,进样量:5 μL。
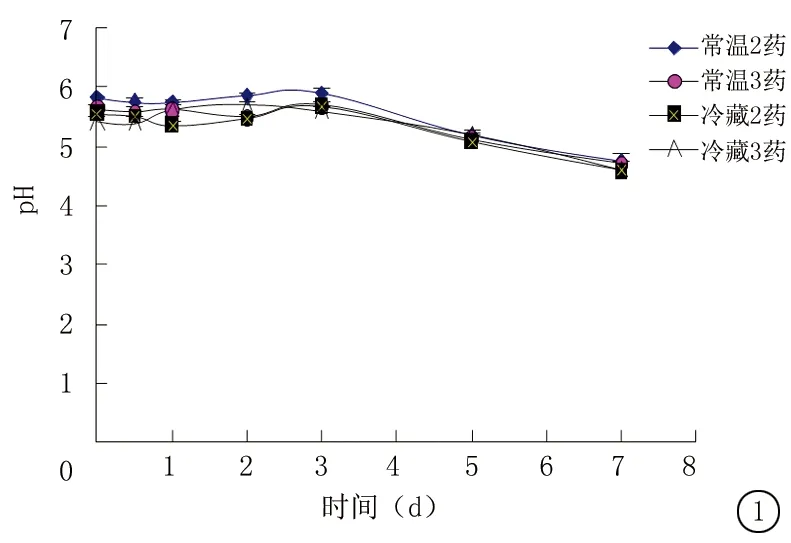
图1 配伍溶液的pH变化(n=5)
Figure 1 pH value of the compatibility solution(n=5)
2.4.2 质谱条件 离子化方式:电喷雾离子化;离子源喷射电压5 500 V;离子源温度:550 ℃;气帘气压力:25 Pa;源内气体1压力:55 Pa;源内气体2压力:50 Pa;碰撞气压力:4 Pa;离子检测方式:正离子多反应监测;用于定量分析的离子反应分别为m/z375.4→591.7(阿奇霉素),解离电压:65.65,轰击能量:20.17,m/z430.9→413.0(布地奈德),解离电压:65.56,轰击能量:14.28,m/z379.2→263.8(氨溴索),解离电压:64.47,轰击能量:25.14,m/z323.3→275.1(内标氯霉素),解离电压:66.38,轰击能量:19.09。
在上述试验条件下,对介质效应和携带效应进行了考察,结果提示无明显介质效应和携带效应。内源性杂质不干扰待测药物的含量测定,阿奇霉素、布地奈德、氨溴索及内标的保留时间分别为1.4、3.4、1.6、2.3 min。色谱图见图2。
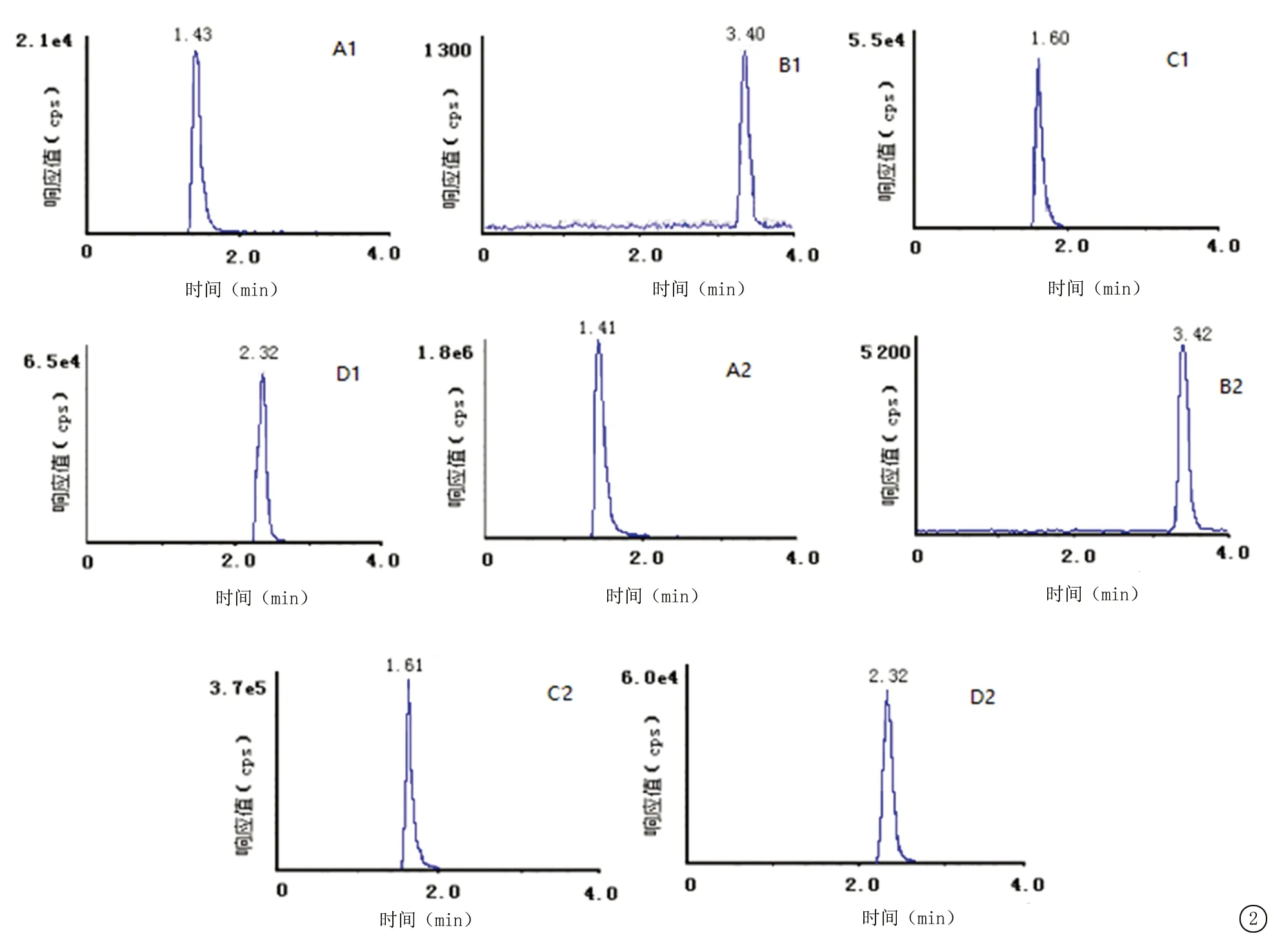
图2 LC-MS/MS色谱图
A.阿奇霉素;B.布地奈德;C.氨溴索;D内标(1.最低定量限;2.配伍溶液样品)
Figure 2 The LC-MS/MS chromatograms
2.4.3 标准工作液的制备 精密称取乳糖酸阿奇霉素40.3 mg(相当于阿奇霉素22.5 mg)于50 mL容量瓶中,用50%甲醇水定容摇匀,再用移液管取0.5 mL于50 mL容量瓶定容摇匀,制得浓度为9 000 μg/L的储备液。用移液管精密量取5 mL于10 mL容量瓶中,用甲醇水定容,混匀,得浓度为4 500 μg/L溶液,标记为(ST6)。然后用移液管取储备液2 mL到10 mL离心管,再加甲醇水4 mL,混匀得浓度为3 000 μg/L溶液,标记为(ST5)。用移液管取储备液0.5 mL到10 mL离心管,再加甲醇水4.5 mL,混匀得浓度为900 μg/L溶液,标记为(ST4)。依法操作,分别得到300 μg/L(ST3)、90.0 μg/L(ST2)、30.0 μg/L(ST1)的阿奇霉素系列浓度的标准液。按照上述方法,吸取吸入用布地奈德混悬液 2 mL,用甲醇水(50%)稀释配制浓度依次150、75.0、37.5、18.8、9.38、4.69 μg/L布地奈德标准溶液,取注射用盐酸氨溴索63.1 mg(相当于盐酸氨溴索18.0 mg),配制浓度依次为为1 800、900、450、225、112、56.3 μg/L的盐酸氨溴索标准溶液。
内标工作液的制备:精密称取氯霉素20.0 mg于50 mL量瓶中,用50%甲醇水溶解并定容配成浓度为400 mg/L的储备液。
2.4.4 样品预处理 将低温保存的样本于室温下溶解,涡旋30 s,精取待测样品50 μL到10 mL离心管,用移液管加入4.5 mL甲醇水(50%, v/v),混匀,再取150 μL到2 mL离心管,用移液管加入1.35 mL甲醇水,混匀,得1.5 mL稀释1 000倍的样品溶液,再加入100 μL内标工作液,混匀,取200 μL加入进样瓶,进样5 μL测定。
2.4.5 标准曲线的制备 取3种药物的标准溶液各0.5 mL于2 mL离心管中,涡旋混匀,依法操作处理其余5个浓度,得乳糖酸阿奇霉素质量浓度为1 500、1 000、300、100、30.0、10.0 μg/L;布地奈德质量浓度为50.0、25.0、12.5、6.25、3.13、1.56 μg/L;盐酸氨溴索质量浓度为600、300、150、75.0、37.5、18.8 μg/L的系列标准工作液。按“2.4.4”项下的处理测定,记录样品峰和内标峰面积。以样品的浓度x为横坐标,以样品峰与内标的峰面积比y为纵坐标,用加权最小二乘法(W=1/C2)进行回归计算。阿奇霉素线性方程为y=0.065 56x+0.027 06(r=0.998 5),本法阿奇霉素的最低定量限为10.0 μg/L,相对标准差(relative standard deviation,RSD)<5%(n=6)。结果表明阿奇霉素浓度在10.0~1 500 μg/L范围内线性关系良好;布地奈德线性方程为y=0.003 68x+0.0113 9(r=0.999 8),本法布地奈德的最低定量限为1.56 μg/L,RSD<6.3%(n=6)。结果表明布地奈德浓度在1.56~50.0 μg/L范围内线性关系良好;氨溴索线性方程为y=0.149 37x+0.025 01(r=0.997 0),本法氨溴索的最低定量限为18.8 μg/L;RSD<3.9%(n=6)。结果表明氨溴索浓度在18.8~600 μg/L范围内线性关系良好。
2.4.6 精密度和准确度试验 分别配制阿奇霉素、布地奈德、氨溴索低(30.0、3.13、37.5 μg/L)、中(300、12.5、150 μg/L)、高(1 500、37.5、400 μg/L)3种浓度的质控样品,共6份,按“2.4.4”项下的操作处理,进样分析,记录峰面积,以标准曲线法计算药物浓度,考察其批内精密度;连续配制3个分析批次并测定,考察其批间精密度。
阿奇霉素、布地奈德、盐酸氨溴索低、中、高3种浓度的质控样品的批内RSD<7.0%,批间RSD<12.0%,方法回收率为98.7%~108.5%。结果见表1。
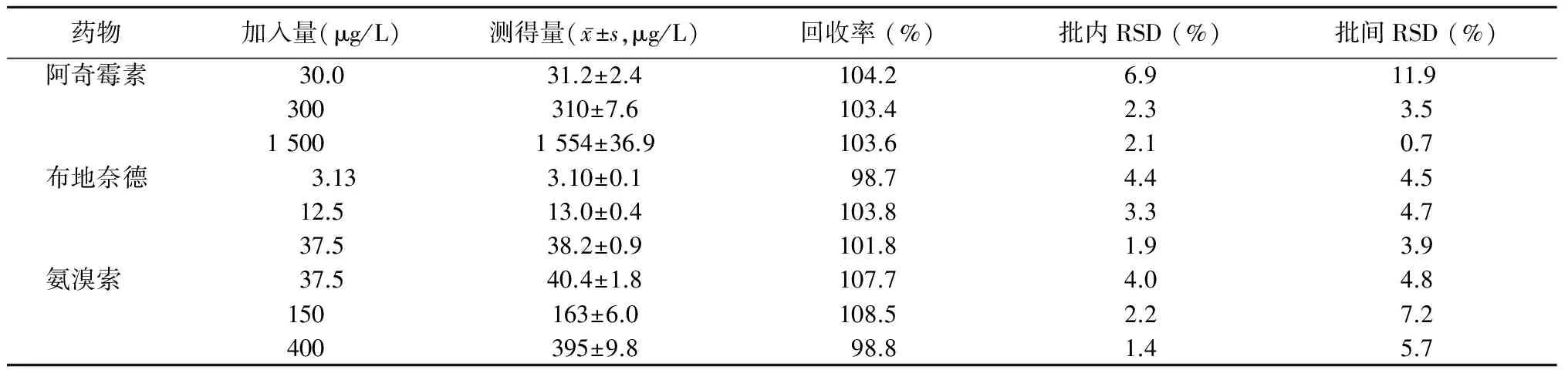
表1 测定方法的准确度与精密度 Table 1 Accuracy and precision of the determination method (n=6)
2.4.7 稳定性试验 配制阿奇霉素、布地奈德、氨溴索低(30.0、3.13、37.5 μg/L)、高(1 500、37.5、400 μg/L)2种浓度的模拟样品,样品预处理后室温放置12 h后、反复冻融3次及在-70 ℃冷冻7 d后,按“2.4.4”项下的操作进样分析测定,记录样品峰面积,以标准曲线法计算3种药物浓度。结果提示阿奇霉素、布地奈德、氨溴索3种药物的RSD均小于7%,提示在本法考察的保存条件下均稳定。
2.4.8 配伍溶液中药物含量的测定 取“2.1”项下的配伍溶液样本,按“2.4.4”项下的操作处理样,同时测定阿奇霉素、布地奈德、氨溴索3种药物含量,记录峰面积,以标准曲线法计算配伍溶液中的药物含量,以配伍溶液制备0 h的含量为100%,计算不同保存时间的3种药物相对百分含量。配伍溶液保存2 d时,3种药物组分含量均不低于0 h时的95%,配伍溶液保存3 d时,阿奇霉素含量降低,相当于0 h时的80%~90%,布地奈德含量相当于0 h时的60%~70%,氨溴索含量相当于0 h时的60%~70%,保存7 d时,3种药物浓度均显著降低,低于0 h时的50%。不同保存温度下阿奇霉素、布地奈德浓度均呈下降趋势,不同时点间差异有统计学意义(P<0.05),组间差异无统计学意义(P>0.05),组间·不同时点间交互作用差异无统计学意义(P>0.05)。见表2。
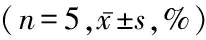
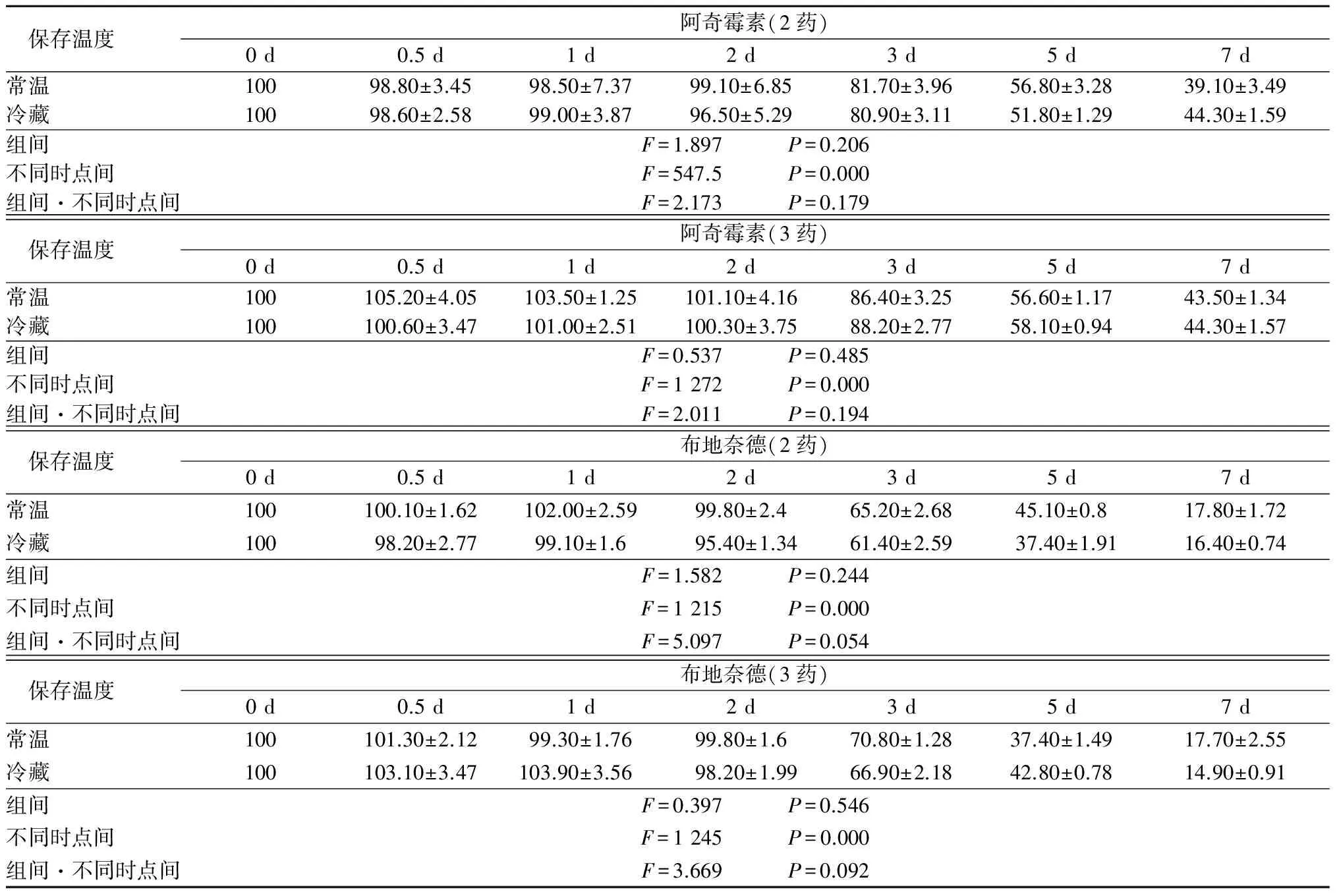
保存温度 阿奇霉素(2药)0d0.5d1d2d3d5d7d常温 10098.80±3.4598.50±7.3799.10±6.8581.70±3.9656.80±3.2839.10±3.49冷藏 10098.60±2.5899.00±3.8796.50±5.2980.90±3.1151.80±1.2944.30±1.59组间 F=1.897 P=0.206不同时点间 F=547.5 P=0.000组间·不同时点间F=2.173 P=0.179保存温度 阿奇霉素(3药)0d0.5d1d2d3d5d7d常温 100105.20±4.05103.50±1.25101.10±4.1686.40±3.2556.60±1.1743.50±1.34冷藏 100100.60±3.47101.00±2.51100.30±3.7588.20±2.7758.10±0.9444.30±1.57组间 F=0.537 P=0.485不同时点间 F=1272 P=0.000组间·不同时点间F=2.011 P=0.194保存温度 布地奈德(2药)0d0.5d1d2d3d5d7d常温 100100.10±1.62102.00±2.5999.80±2.465.20±2.6845.10±0.817.80±1.72冷藏 10098.20±2.7799.10±1.695.40±1.3461.40±2.5937.40±1.9116.40±0.74组间 F=1.582 P=0.244不同时点间 F=1215 P=0.000组间·不同时点间F=5.097 P=0.054保存温度 布地奈德(3药)0d0.5d1d2d3d5d7d常温 100101.30±2.1299.30±1.7699.80±1.670.80±1.2837.40±1.4917.70±2.55冷藏 100103.10±3.47103.90±3.5698.20±1.9966.90±2.1842.80±0.7814.90±0.91组间 F=0.397 P=0.546不同时点间 F=1245 P=0.000组间·不同时点间F=3.669 P=0.092
3 讨 论
目前在治疗急、慢性鼻窦炎时,临床上多以阿奇霉素与布地奈德联合使用治疗[10-12],或根据病情需要,以阿奇霉素、布地奈德及氨溴索3种药物配伍制备成滴鼻剂,通过滴鼻灌注给药,每次每个鼻孔使用3~5 mL,灌注给药时间保持至少5 min,2次/d,一般疗程为为7 d,临床疗效比较满意。虽然药物配伍使用可现用现配,或者每个药物分别滴鼻使用,但患者在治疗应用中存在困难,难以在临床推广使用。为了提供安全有效以及便捷的临床治疗方案,提高患者治疗的依从性,本研究配伍溶液均参照临床用药比例配置,通过对注射用乳糖酸阿奇霉素配合吸入用布地奈德混悬液以及注射用乳糖酸阿奇霉素、吸入用布地奈德混悬液、注射用盐酸氨溴索3种药物配伍稳定性的考察,以期为临床合理用药提供理论依据。结果提示,在避光条件下,各组配伍溶液,均澄清,外观无明显变化;配伍溶液保存2 d时,各组分含量变化不明显,均在95%以上,与相关报道一致[13],且pH无显著变化;配伍溶液保存3 d时,pH变化不大,但阿奇霉素含量下降到0 h的80%,布地奈德和氨溴索含量下降到0 h的70%;配伍溶液保存3 d后,pH开始明显降低;配伍溶液保存7 d时,阿奇霉素、布地奈德和氨溴索的含量均低于0 h的50%。结果表明乳糖酸阿奇霉素与布地奈德、盐酸氨溴索可配伍使用,常温、冷藏保存均可,由于采用滴鼻途径给药,若冷藏后使用对鼻腔黏膜刺激较大,宜常温保存。配伍溶液保存2 d内,3种药物含量较稳定,使用是安全的,配伍溶液保存3 d后,3种药物含量显著降低,安全性较差,因此配伍溶液最长使用时间不宜超过3 d。
在建立分析方法时,首先考虑选择高效液相色谱法测定,经过反复探索,不论更换色谱柱还是调整流动相组成或比例,3种组分的保留时间和测定波长不理想,均难以同时对3种药物组分进行准确测定,因此最终选择使用液相色谱-质谱联用法进行分析测定。 在色谱柱的选择上,开始试用XTerra RP18色谱柱测定,虽然布地奈德、氨溴索色谱峰较理想,但阿奇霉素峰型不理想,有拖尾现象,改用Inertsil ODS-3 C18色谱柱后,所有的待测组分峰型均较理想。参考文献报道,流动相初步确定为乙腈-0.1%甲酸水70∶30(v/v),但氨溴索峰型有拖尾现象,流动相比例最终调整为为80∶20后,氨溴索峰型改善,比较理想;流动相中加入1 mmol/L乙酸铵可改善峰形,但阿奇霉素拖尾现象改善不明显,调整为5 mmol/L后,其峰形拖尾现象改善较好。本研究建立了快速准确的液相色谱-质谱联用法,同时测定阿奇霉素、布地奈德和氨溴索的含量,适用于阿奇霉素、布地奈德和氨溴索的配伍稳定性研究。
[1] Han MK,Tayob N,Murray S,et al. Predictors of chronic obstructive pulmonary disease exacerbation reduction in response to daily azithromycin therapy[J]. Am J Respir Crit Care Med,2014,189(12):1503-1508.
[2] 吴磊.阿奇霉素联合布地奈德雾化吸入治疗小儿支原体肺炎疗效观察[J].中国现代药物应用,2015,9(2):130-131.
[3] 李培燕.78例新生儿吸入性肺炎的临床诊疗分析[J].河北医科大学学报,2015,36(2):159-161.
[4] 杨莉.哮喘患儿应用阿奇霉素与盐酸氨溴索联合治疗的疗效分析[J].北方药学,2015,12(8):121.
[5] 李慧,李向东,郑世良.氨溴索联合阿奇霉素对稳定期慢性阻塞性肺病患者氧化应激的影响[J].临床合理用药杂志,2014,7(5B):1-2,3.
[6] 炳征,刘雪萍.氨溴索与布地奈德配伍雾化吸入治疗小儿毛细支气管炎68例[J].陕西医学杂志,2013,42(5):609-611.
[7] 沈玉祥.布地奈德联合盐酸氨澳索雾化吸入对小儿支气管肺炎的疗效分析[J].河北医科大学学报,2012,33(6):712-714.
[8] 李军.布地奈德联合抗生素雾化吸入治疗慢性咽炎疗效观察[J].中国社区医师,2015,31(24):16,18.
[9] 古力扎尔·克日木拉,王韶华,布再娜普·如孜麦麦提.雾化吸入糖皮质激素在老年慢性阻塞性肺疾病合并陈旧性肺结核治疗中的作用[J].河北医科大学学报,2014,35(9):1044-1047.
[10] 朱旭辉.观察阿奇霉素联合布地奈德喷鼻治疗慢性鼻窦炎鼻息肉术后疗效[J].药物与人,2014,27(5):47.
[11] 林庆红.鼻内镜手术联合阿奇霉素口服布地奈德喷鼻治疗鼻慢性鼻窦炎伴鼻息肉疗效观察[J].河南外科学杂志,2015,21(2):50-51.
[12] Maniakas A,Desrosiers M. Azithromycin add-on therapy in high-risk postendoscopic sinus surgery patients failing corticosteroid irrigations:a clinical practice audit[J]. Am J Rhinol Allergy, 2014,28(2):151-155.
[13] 王慧明,徐帆,冯恩富,等.阿奇霉素与氨溴索的配伍稳定性考察[J].中国药师,2013,16(8):1252-1254.
(本文编辑:赵丽洁)
Study on the compatible stability of Azithromycin Lactobionate and Budesonide
REN Jin-min1, SHEN Jun2, SUN Li1, MA Jiang-man1, CUI Xiao-hong1
(1.Department of Pharmacy, the Second Hospital of Hebei Medical Unversity, Shijiazhuang 050000,China;2.Hebei International Travel Healthcare Center, Hebei Entry-Exit Inspection and Quarantine Bureau, Shijiazhuang 050051, China)
Objective To investigate the compatible stability of Azithromycin Lactobionate for injection with budesonide and ambroxol hydrochloride for injection. Methods Basing on clinical medication methods, azithromycin lactobionate, budesonide, ambroxol hydrochloride were prepared to compatibility solution with 0.9% sodium chloride injection. The contents of three drugs within 7 days were determined by liquid chromatography-mass spectrometry/mass spectrometry(LC-MS/MS). The appearance and pH value of mixture were investigated. Results The contents of azithromycin lactobionate, budesonide and ambroxol hydrochloride changed less than 5% within 2 days, and the contents of three drugs was equal to 70%-90% of 0 h at 3 days, the contents of three drugs decreased significantly after 3 days, only less than 50% of 0 h. When azithromycin lactobionate and budesonide were put in different compatible solutions and stored at different temperatures, the concentration of azithromycin and budesonide were decreased. There was statistical significance difference between time points(P<0.05), but there was no significant difference between groups(P>0.05), and the interaction between groups and time(P>0.05). Conclusion Azithromycin lactobionate, budesonide and ambroxol hydrochloride are compatible, should be preserved at room temperature, and should not exceed 3 days for nose drops use.
azithromycin; budesonide; ambroxol; drug stability
2016-01-22;
2016-02-16
任进民(1967-),男,河北无极人,河北医科大学第二医院主任药师,理学博士,从事药物体内药代动力学研究。
R965.3
A
1007-3205(2017)01-0066-06
10.3969/j.issn.1007-3205.2017.01.016

