白藜芦醇对人食管癌EC9706细胞生物学行为的影响及其作用机制
李 扬,苏军华,杨丽娟,魏宏莲
(1.河北医科大学第二医院医务处,河北 石家庄 050000;2.河北医科大学第二医院检验科,河北 石家庄 050000;3.河北医科大学基础医学院免疫学教研室,河北 石家庄 050017)
白藜芦醇对人食管癌EC9706细胞生物学行为的影响及其作用机制
李 扬1,苏军华2,杨丽娟3,魏宏莲2
(1.河北医科大学第二医院医务处,河北 石家庄 050000;2.河北医科大学第二医院检验科,河北 石家庄 050000;3.河北医科大学基础医学院免疫学教研室,河北 石家庄 050017)
目的探索白藜芦醇对人食管癌EC9706细胞生物学行为的影响及其作用机制,为白藜芦醇用于防治食管癌提供理论依据。方法不同浓度白藜芦醇处理食管癌EC9706细胞并作用不同时间,倒置相差显微镜下观察细胞形态学改变;电镜下观察细胞内微形态改变;四甲基偶氮唑盐微量酶反应比色法测定细胞增殖水平;流式细胞术检测细胞周期分布和细胞凋亡相关蛋白表达。结果白藜芦醇处理使EC9706细胞胞浆内颗粒增粗增多,胞质减少,细胞变圆变小,形态呈多样性;核染色质电子密度增加,浓缩并聚集于核膜,部分细胞膜向外层呈锐角突起,细胞质内有空泡化变性;白藜芦醇抑制EC9706细胞增殖,并具有量效和时效关系;白藜芦醇处理使EC9706细胞G0/G1期前出现亚二倍体凋亡峰,凋亡率增加,G0/G1期比例增高,而S期和G2/M期比例减少(P<0.01);4、白藜芦醇处理使EC9706细胞bcl-2蛋白表达降低,bax蛋白表达升高(P<0.01)。结论白藜芦醇可抑制人食管癌EC9706细胞增殖并诱导其凋亡,使细胞周期阻滞在G0/G1期;这种作用可能与其影响凋亡基因bcl-2和bax有关。
食管肿瘤;白藜芦醇;细胞增殖;细胞凋亡
食管癌是全球癌症死亡的第六大原因,在中国发病率也很高。近年来,尽管在手术、放疗、化疗治疗食管癌方面有了突飞猛进的发展,但患者的预后仍然不佳,5年存活率估计只有15%,2年存活率为20%~30%[1]。尤其是化疗药物常存在不良发应,患者不易耐受。因此,从天然生物中寻找低毒高效的抗肿瘤药物已成为近年的研究热点。Jang等[2]发现白藜芦醇对癌症各阶段具有抑制作用,这使白藜芦醇成为癌症领域研究的热点之一。目前认为白藜芦醇具有多种生物活性,主要包括抗炎抗氧化活性、免疫调节、生长抑制活性、雌激素样活性等抗肿瘤作用。但其对食管癌是否具有防治作用尚未明确。本研究采用人食管癌细胞株EC9706细胞作为研究对象,检测白藜芦醇对其增殖、凋亡和细胞周期的影响,并初步探讨作用机制,旨在为白藜芦醇用于食管癌防治提供实验依据,报告如下。
1 资料与方法
1.1 实验材料 选取由河北医科大学第四医院科研中心提供的人食管癌EC9706细胞株;白藜芦醇、碘化丙啶购于美国Sigma公司;FITC标记的羊抗鼠二抗单克隆抗体、鼠抗人bcl-2蛋白、鼠抗人bax蛋白单克隆抗体购于美国Santa Cruz公司;MTT、RPMI 1640培养液、胰蛋白酶、二甲基亚砜购自美国Promega公司;胎牛血清购自杭州四季青公司;余试剂纯由河北医科大学第四医院科研中心提供。
1.2 主要仪器 普通光学显微镜、倒置相差显微镜(LH50A型)购自日本OLYMPUS公司;透射电子显微镜(H-7500)购自日本日立公司;CO2培养箱(TC 2323型)购自美国SHELDON公司;流式细胞仪(ACS420型)购自美国B.D公司;全自动定量酶标仪购自奥地利Anthos公司;超净工作台购自苏州苏净集团安泰公司;高速离心机(SCR20B型)购自日本HITACHI公司;全自动高压蒸汽消毒器(MLS-3750型)购自日本三洋公司;-80 ℃超低温冰柜(Universal)购于德国Hettich公司。
1.3 细胞培养 细胞复苏后接种于含10%胎牛血清的RPMI 1640培养液(链霉素 100 mg/L,青霉素 1×105U/L)的细胞培养瓶中,置于37 ℃,5% CO2恒温培养箱中培养,隔天换培养液,约3 d传代1次,最后选取对数生长期细胞用于实验。
1.4 倒置相差显微镜观察EC9706细胞形态 细胞接种在放有盖玻片的6孔培养板上,并于CO2培养箱中培养,当细胞生长至对数期后,分别加入含或不含有白藜芦醇的新鲜培养液,使白藜芦醇终浓度分别为0、100、500、1 000、2 000 mmol/L,置于CO2培养箱继续培养,于24、48、72 h时定时观察细胞的形态学变化,分别记录各不同浓度及不同时间的细胞生长抑制率。
1.5 透射电子显微镜观察EC9706细胞微形态 加入终浓度分别为0、500 mmol/L的白藜芦醇培养液于对数生长期的EC9706细胞培养液中,使细胞分散良好,继续培养72 h,然后收集细胞,固定(2.5%戊二醛),后固定(10 g/L锇酸),脱水(丙酮系列),包埋(Epon821环氧树脂),切片(KB-1型超薄切片机),双重染色(醋酸铀与柠檬酸铅),然后在透射电子显微镜下观察细胞微形态变化。
1.6 四甲基偶氮唑盐微量酶反应比色(methylthiazoliltetracolium colorimetric enzyme reactions trace, MTT)法试验 选取对数生长期细胞,制成细胞悬液(浓度为1×106/mL),然后分5组将细胞悬液接种于96孔培养板中,每组设12个复孔,每孔200 μL,细胞培养24 h后,细胞贴壁,吸去培养液,随机选4组分别加入含白藜芦醇 100、500、1 000、2 000 mmol/L的培养液,剩余1组为对照组,含白藜芦醇0 mmol/L,分别培养24、48、72 h。并在培养结束前4 h,每孔加入20 μL,浓度为5 g/L的 MTT,培养结束后,弃上清,然后在每孔加入150 μL 二甲基亚砜,避光振荡 15 min。自动酶标仪波长 492 nm检测各孔光密度值(optical density,OD 值)。结果判定:抑制率(%)=(对照组OD值-实验组OD值)/对照组OD值×100%。
1.7 流式细胞术检测细胞凋亡情况 白藜芦醇终浓度分别为0、500和1 000 mmol/L,调整细胞浓度为1×106/mL,将细胞转移至一次性离心管内,1 000 r/min离心5 min,弃上清,用冰块上预冷的无菌PBS漂洗2次, 离心(1 500 r/min,5 min),分散细胞(70%预冷的乙醇),固定过夜(4 ℃)。过夜后的细胞,离心(1 500 r/min,10 min),用PBS 漂洗1次,再以生理盐水洗涤2次, 离心(1 500 r/min,5 min),以碘化丙锭染液(PI:50 mg/L,Triton X-100:1.0%,RNase A:10 mg/L),在4 ℃环境下避光染色30 min,染色完成后过滤。用 488 nm 激发光在流式细胞仪上检测细胞 DNA 的含量,并对各样品进行分析,计算细胞凋亡率(MuticycleAV 软件)。
1.8 流式细胞术测定白藜芦醇对凋亡相关蛋白bcl-2和bax含量的影响 分别收集白藜芦醇终浓度为0、500和1 000 mmol/L的细胞悬液,PBS洗涤2次, 离心(1 500 r/min,5 min),分散细胞(70%预冷的乙醇),固定过夜(4 ℃)。过夜后的细胞,离心(1 500 r/min,10 min),用PBS 漂洗1次,再以生理盐水洗涤2次, 离心(1 500 r/min,5min),分别加入的bax鼠抗人单克隆抗体和0.1 mL的bcl-2,室温孵育 30 min,PBS 洗涤1次,加入0.1 mL羊抗鼠 FITC-IgG二抗,室温孵育 30 min(避光),然后以PBS洗涤未结合的多余荧光抗体,加入0.1 mL PBS,过滤(500目铜网),然后用488 nm激发光在流式细胞仪上检测,并且设有阴性对照及一抗或二抗的本底对照。最后使用Expo 32ADC 软件进行数据分析,以荧光指数表示蛋白定量表达。计算公式为:荧光指数=样品蛋白表达的平均荧光强度/正常对照样品平均荧光强度。
1.9 统计学方法 应用SPSS 18.0软件进行统计学分析,计量资料比较分别采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 倒置显微镜下观察EC9706细胞的形态学变化 不同浓度白藜芦醇作用于EC9706细胞24 h后即可见少量细胞变圆,48 h后可见细胞之间距离增大,胞浆内颗粒增多增粗,72 h后越来越多的细胞变圆,部分细胞脱落然后悬浮于培养基中,在少数贴壁生长的细胞中可见细胞膜破裂,并呈细胞坏死状。
2.2 透射电镜下观察EC9706细胞的微形态学变化 白藜芦醇 500 mmol/L作用于EC9706细胞72 h后,部分细胞膜向外层呈锐角突起,细胞质内有空泡化变性,可见核染色质浓缩边集于核膜,电子密度增加(图1)。
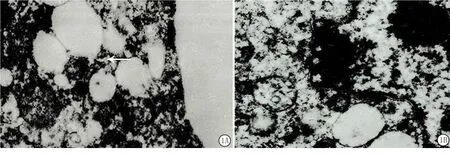
图1 EC9706细胞的微形态学变化
A.细胞质内有空泡化变性;B.核染色质浓缩边集于核膜
Figure 1 The micro morphological changes of EC9706 cells
2.3 白藜芦醇抑制EC9706细胞增殖 在EC9706细胞增殖过程中,不同浓度的白藜芦醇均可产生抑制作用,表现出剂量-效应关系和时间-效应关系,即随着白藜芦醇浓度的增加,细胞增殖的抑制率逐渐增加(P<0.05),随着培养时间的延长,细胞增殖的抑制率也逐渐增加(P<0.05),见表1。
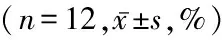
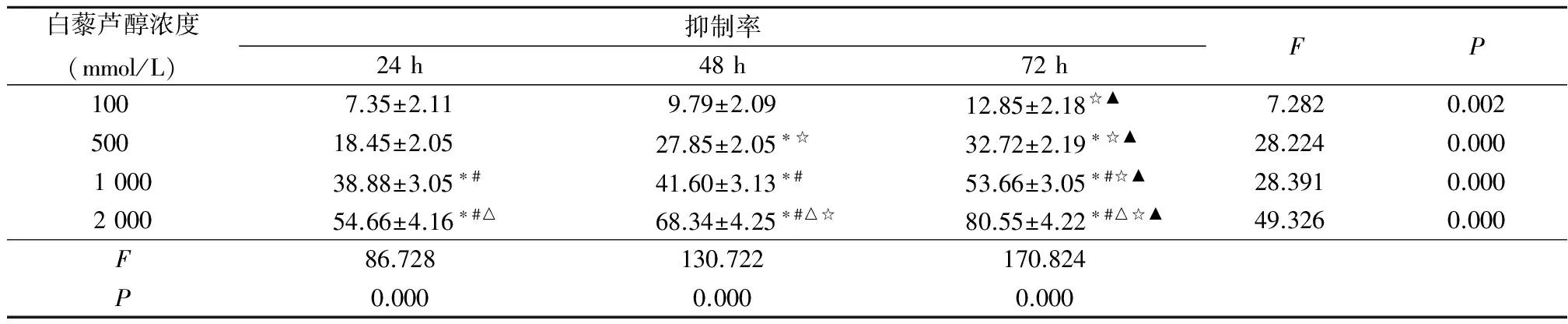
白藜芦醇浓度(mmol/L)抑制率24h48h72hFP100 7.35±2.119.79±2.0912.85±2.18☆▲7.2820.002500 18.45±2.0527.85±2.05∗☆32.72±2.19∗☆▲28.2240.000100038.88±3.05∗#41.60±3.13∗#53.66±3.05∗#☆▲28.3910.000200054.66±4.16∗#△68.34±4.25∗#△☆80.55±4.22∗#△☆▲49.3260.000F86.728130.722170.824P0.0000.0000.000
*P<0.05与100 mmol/L组比较 #P<0.05与500 mmol/L组比较 △P<0.05与1 000 mmol/L组比较 ☆P<0.05与24 h比较
▲P<0.05,与48 h比较(SNK-q检验)
2.4 白藜芦醇对EC9706细胞凋亡和细胞周期及细胞凋亡相关蛋白bcl-2和bax表达的影响 白藜芦醇500、1 000 mmol/L作用于EC9706细胞72 h后,随着各组白藜芦醇浓度增加,在细胞周期中G0/G1期的比例逐渐增加,S期和G2/M期的比例逐渐减少,差异有统计学意义(P<0.05);随着各组白藜芦醇浓度增加,凋亡率和bax的荧光指数逐渐增加,bcl-2的荧光指数逐渐下降,差异有统计学意义(P<0.05)。见表2,图2。
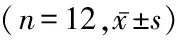
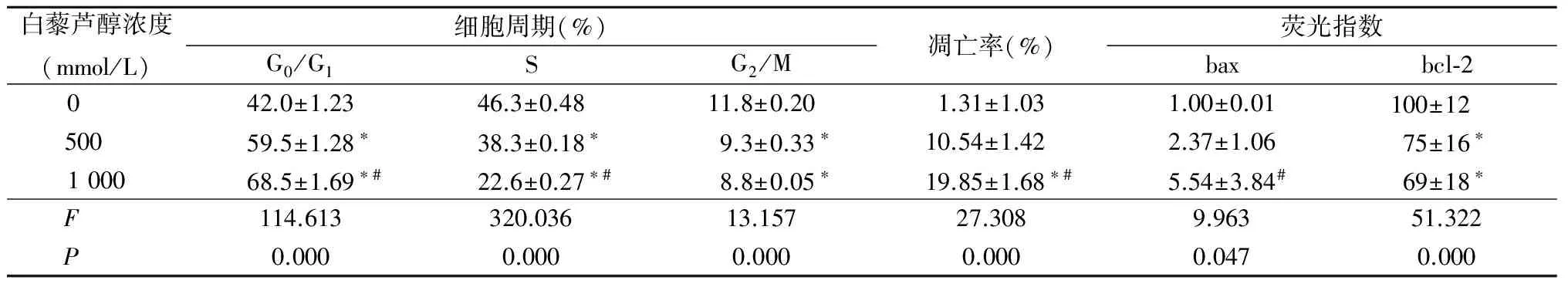
白藜芦醇浓度(mmol/L)细胞周期(%)G0/G1SG2/M凋亡率(%)荧光指数baxbcl⁃20 42.0±1.2346.3±0.4811.8±0.201.31±1.031.00±0.01100±12 500 59.5±1.28∗38.3±0.18∗9.3±0.33∗10.54±1.422.37±1.0675±16∗100068.5±1.69∗#22.6±0.27∗#8.8±0.05∗19.85±1.68∗#5.54±3.84#69±18∗F 114.613320.03613.15727.3089.96351.322P 0.0000.0000.0000.0000.0470.000
*P<0.05与0 mmol/L组比较 #P<0.05与500 mmol/L组比较(SNK-q检验)
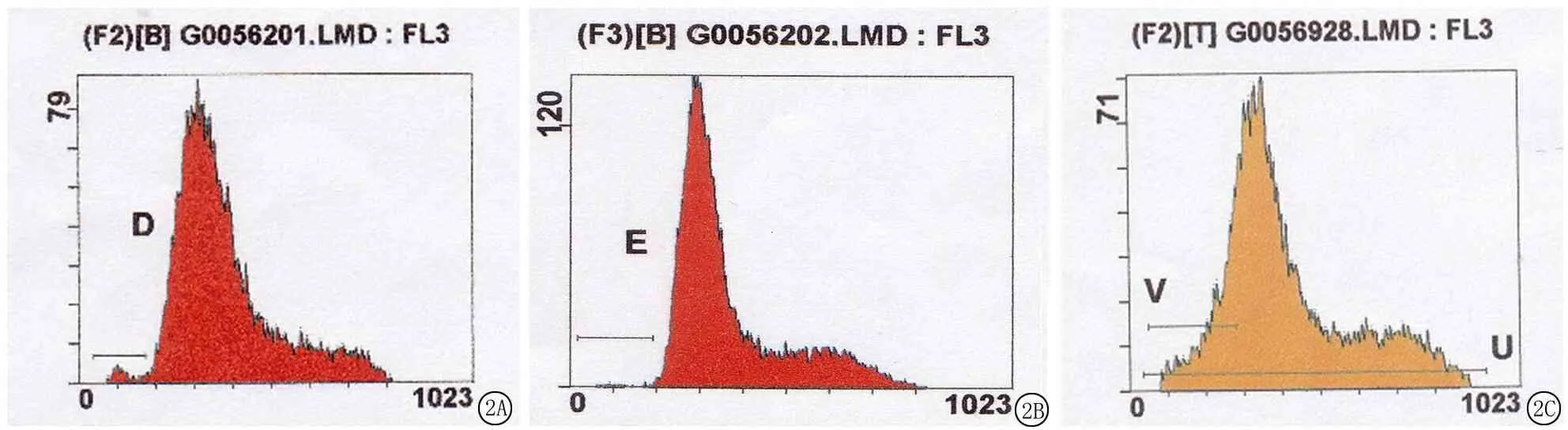
图2 流式细胞术检测EC9706细胞凋亡率结果
A.对照组细胞;B.500 mmol/L白藜芦醇作用于EC9706细胞;C.1 000 mmol/L白藜芦醇作用于EC9706细胞
Figure 2 Apoptotic rate of EC9706 cells detected by flow cytometry
3 讨 论
芪类结构的非黄酮类多酚类化合物,有顺、反2种构型,其中反式是稳定结构,因首先在欧洲白藜中被提取出来而得名[3]。现阶段约在21科31属的72种植物中发现了白藜芦,白藜芦醇化学名称为芪三酚,分子式为 C14H12O3,化学结构为 3,5,4′-三羟基二苯乙烯(3,5,4′-trihydroxy-stilbene) ,相对分子质量是228.2。首次从毛叶藜芦的根部提取得到一种含有醇,其中以虎杖、葡萄、花生中含量最高。白藜芦醇具有抗肿瘤活性,抗自由基、保护心血管、抗炎、抗激素活性、抗病毒、抗菌等方面多种生物活性作用。
食管癌预后较差,多数患者在确诊后1~2年内死亡, 20%的患者能生存 5 年以上[4]。虽然近年来其治愈率有了很大提高,但总有相当患者在就诊时或治疗过程中发生淋巴结转移,最终导致治疗失败。河北省是食管癌的高发区,尤以邯郸的涉县高发。目前在无更有效治疗手段条件下,预防是减少其发生率的有力手段。寻求一种高效低毒的抗肿瘤药物是治疗食管癌的当务之急。白藜芦醇作为一种植物提取素具有天然低毒的特性。国内外研究证实其作为肿瘤抑制剂在多种肿瘤中均具有高效性,包括肝癌、胃癌、血液病、前列腺癌、子宫癌、乳腺癌等[5-10]。但是,目前对白藜芦醇在食管癌的抗肿瘤中作用的研究尚少。本研究旨在进一步证实白藜芦醇在抗食管肿瘤中同样具有一定的作用,以便为白藜芦醇今后应用于食管癌的治疗提供相关实验证据。
本研究结果显示,白藜芦醇对EC9706细胞的作用呈时间-剂量依赖,但是在低浓度(100 mmol/L)时,细胞生长抑制率差别不大;在白藜芦醇同一浓度下,随着作用时间的延长白藜芦醇对EC9706细胞的抑制作用增强,大于72 h高浓度白藜芦醇作用下EC9706细胞悬浮于培养瓶中,无贴壁生长(细胞死亡)。以上证明了白藜芦醇在一定作用时间和一定浓度范围内,对食管癌细胞生长增殖具有抑制作用。
近年来研究发现,许多抗肿瘤药物的作用除抑制肿瘤细胞生长外,还可诱导其凋亡[11-12]。本研究应用流式细胞仪检测细胞凋亡,辅以透射电镜微观观察不同浓度白藜芦醇作用于EC9706细胞后,细胞的凋亡情况,结果显示对照组未发现凋亡的细胞,而白藜芦醇500、1 000 mmol/L组细胞凋亡明显;在DNA直方图中,也可以观察到较为明显的亚二倍体凋亡峰,细胞周期阻滞在G0/G1期;透射电镜镜下观察,白藜芦醇500 mmol/L组可见凋亡细胞特征,而对照组细胞生长良好。表明白藜芦醇可提高食管癌EC9706细胞凋亡率,使EC9706细胞的细胞周期阻滞在G0/G1期。因此,白藜芦醇抗食管肿瘤的主要机制可能是白藜芦醇能够诱导食管癌EC9706细胞凋亡。
Bcl-2是一种跨膜蛋白,存在于线粒体外膜、核膜和内质网膜上[13]。虽然bcl-2基因曾被认为是一种原癌基因,但随后的大量实验结果却表明该基因本身对细胞增殖没有影响,也不能促使细胞恶性转化。bax相对分子质量约为21 000,bax基因长约4.5 kb,bax是bcl-2的抑制因子,其与bcl-2具有21%的同源性[14]。bax和bcl-2在细胞凋亡的过程中发挥的作用相反,二者的比例发生变化,可以诱导凋亡的发生。研究发现,bcl-2和bax在前列腺癌、肝癌、乳腺癌等肿瘤细胞的细胞凋亡调控中发挥着重要作用,并且与食管癌细胞凋亡密切相关[15-20]。本研究应用流式细胞仪检测细胞内bcl-2和bax的表达情况,结果发现白藜芦醇可以明显上调bax的表达及下调bcl-2的表达,这可能是白藜芦醇诱导EC9706细胞凋亡的分子机制之一。
综上所述,白藜芦醇能够抑制EC9706细胞增殖并诱导其凋亡,使其细胞周期阻滞在G0/G1期;白藜芦醇可能通过影响凋亡基因bcl-2和bax,从而抑制细胞的增殖,并促进其凋亡。因此,白藜芦醇可能成为防治食管癌的有效药物之一用于临床治疗食管癌。
[1] Gao J,Zou Z,Gao J,et al. Increased expression of HMGB3:a novel independent prognostic marker of worse outcome in patients with esophageal squamous cellcarcinoma[J]. Int J Clin Exp Pathol,2015,8(1):345-352.
[2] Jang M,Cai L,Udeani GO,et al. Cancer chemopreventive activity of resveratrol,a natral product derived from grapes[J]. Scinence,1997,275(5297):218-220.
[3] Ferrero ME,Bertelli AA,Pellegatta F,et al. Phytoalexin resveratrol(3-4'-5-trihydroxystilbene) modulates granulocyte and monocyte endothelial adhesion[J]. Transplant Pro,1998,30(8):4191-4193.
[4] Zhang Y. Epidemiology of esophageal cancer[J]. World J Gastroenterol,2013,19(34):5598-5606.
[5] Fulda S,Debatin KM. Sensitization for tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis by the chemopreventive agent resveratrol[J]. Cancer Res,2004,64(1):337-346.
[6] Fulda S,Debatin KM. Resveratrol-mediated sensitisation to TRAIL- induced apoptosis depends on death receptor and mitochondrial signaling[J]. Fur J Cancer,2005,41(5):786-798.
[7] Rigolio R,Miloso M,Nicolini G,et al. Resveratrol interference with the cell cycle protects human neuroblastoma SH-SY5Y cell from paclitaxel induced apoptosis[J]. Neurochem Int,2005,46(3):205-211.
[8] Proviciali M,Re F,Donnin A,et al. Effect of resveratrol on the development of spontaneous mammary tumors in HER-2/neu transgenic mice[J]. Int J Cancer,2005,115(1):36-45.
[9] Kubota T,Uemura Y,Kobayashi M,et al. Combined effects of resveratrol and paclitaxel on lung cancer cells[J]. Anticancer Res,2003,23(5A):4039-4046.
[10] Sexton E,van Themsche C, LeBlanc K, et al. Resveratrol interferes with AKT activity and triggers apoptosis in human uterine cancer cells[J]. Mol Cancer,2006,5:45.
[11] Moore J,Boswell S,Hoffman R,et al. Mutant H-rasover- expression inhaibits a random apoptosis nuclease in myeloid leukemia cells[J]. Leuk Res,1993,17(8):703-709.
[12] Evan G,Littlewood T. A matter of life and cell death[J]. Science,1998,281(5381):1317-1322.
[13] Shimizu S,Tsujimoto Y. Proapoptotic BH3-only Bcl-2 family members induce cytochrome C release but not mitochondrial membrance potentical loss,and do not directly modulate voltage-dependent channel activity[J]. Proc Natl Acad Sci USA,2000,97(2):577-582.
[14] Zhou HB,Yan Y,Sun YN,et al. Resveratrol induces apoptosis in human esophageal carcinoma cells[J]. World J Gastroenterol,2003,9(3):408-411.
[15] Stevenson HS,Fu SW,Pinzone JJ,et al. BP1 transcriptionally activates bcl-2 and inhibits TNF alpha-induced cell death in MCF7 breast cancer cells[J]. Breast Cancer Res,2007,9(5):R60.
[16] Li Y,Desilvio M,Li R,et al. Bcl-2 and bax expression and prostate cancer outcome in men treaten with radiotherapy in Radiattion Therapy Oncology Group protocol 86-10[J]. Int J Radiat Oncol Biol Phys,2006,66(1):25-30.
[17] Batsi C,Markopoulou S,Kontargiris E,et al. Bcl-2 blocks 2-methoxyestradiol induced leukemia cell apoptosis by a p27(Kip1)-dependent G1/S cell cycle arrest in conjunction with NF-κB activation[J]. Biochem Pharmacol,2009,78(1):33-44.
[18] Sakinah SA,Handayani ST,Hawariah LP. Zerumbone induced apoptosis in liver cancer cells via modulation of Bax/Bcl-2 ratio[J]. Cancer Cell Int,2007,7:4.
[19] Kolluri SK,Zhu X,Zhou X,et al. A short Nur77-derived peptide converts Bcl-2 from a protector to a killer[J]. Cancer Cell,2008,14(4):285-298.
[20] Yu W,Fu YC,Wang W. Cellular and molecular effects of resveratrol in health and disease[J]. J Cell Biochem,2012,113(3):752-769.
(本文编辑:许卓文)
Effects of resveratrol on biological behavior of human esophageal cancer cell EC9706 and its mechanism
LI Yang1, SU Jun-hua2, YANG Li-juan3, WEI Hong-lian2
(1.Department of Medical Service, the Second Hospital of Hebei Medical University, Shijiazhuang 050000, China; 2.Department of Laboratory, the Second Hospital of Hebei Medical University, Shijiazhuang 050000, China; 3.Department of Immunology, School of Basic Medical, Hebei Medical University, Shijiazhuang 050017, China)
Objective To explore the effects of resveratrol on biological behavior of human esophageal cancer cell EC9706 and its mechanism, and to provide a theoretical basis for the clinical application of resveratrol to prevent or treat esophageal cancer. Methods Different concentrations of resveratrol were used to treat EC9706 cells for different time. Cell morphology was observed by inverted phase contrast microscope. Intracellular micro-morphological changes were observed under electron microscope. Methylthiazoliltetracolium colorimetric enzyme reactions trace method were used to determinate cell proliferation level. Flow cytometry method was used to detect cell cycle distribution and the expression of apoptosis related protein. Results Resveratrol treatment increased and thickened particles in EC9706 cytoplasm, reduced the cytoplasm, rounded cells and made cells more smaller and the cell shape more diversity, and made the nuclear chromatin condense on the boundary of the nuclear envelope. The electron density was increased, part of the cell membrane bulge was outward and form an acute angle. There was vacuoles degeneration in the cytoplasm. Resveratrol inhibited EC9706 cell proliferation in a dose and time-dependent manner. Resveratrol made sub-diploid nuclear peak(apoptotic peak) appear before G0/G1phase in EC9706 cells, and increased the rate of apoptosis together with proportion of G0/G1phase. In contrast, resveratrol decreased the S and G2/M phase fraction(compared with the control group,P<0.01). Resveratrol treatment also decreased expression of bcl-2 protein, and increased expression of bax protein(compared with the control group,P<0.01). Conclusion Resveratrol can inhibit the proliferation and induces apoptosis of EC9706 cells, and make the cell cycle arrest in G0/G1phase. This effect may be related to apoptosis gene bcl-2 and bax.
esophageal neoplasms; resveratrol; cell proliferation; apoptosis
2016-04-01;
2016-10-25
李扬(1977-),男,河北衡水人,河北医科大学第二医院主管检验师,医学硕士,从事临床检验学研究。
R735.1
A
1007-3205(2017)01-0011-06
10.3969/j.issn.1007-3205.2017.01.003

