脂肪细胞型脂肪酸结合蛋白与不同糖耐量人群胰岛细胞功能的相关性研究
白 婧,雷 营,祁范范,王 雪,王战建,周亚茹
(河北医科大学第三医院内分泌科,河北 石家庄 050051)
·论 著·
脂肪细胞型脂肪酸结合蛋白与不同糖耐量人群胰岛细胞功能的相关性研究
白 婧,雷 营,祁范范,王 雪,王战建,周亚茹*
(河北医科大学第三医院内分泌科,河北 石家庄 050051)
目的探讨不同糖耐量人群血循环中脂肪细胞型脂肪酸结合蛋白(adipocyte fatty acid-binding protein,A-FABP)的水平及其与肥胖程度、血压、血糖、血脂、胰岛素抵抗程度及胰岛素分泌功能之间的相关性。方法选取于河北医科大学第三医院就诊、并行口服葡萄糖耐量试验者120例,按照WHO制定的糖尿病诊断与分型标准将受试对象分为3组:2型糖尿病组(type 2 diabetes mellitus,T2DM,n=62)、葡萄糖调节受损组(impaired glucose regulation,IGR,n=32)、正常对照组(normal glucose tolerance,NGT,n=26)。根据《中国成人超重和肥胖症预防控制指南》确立的肥胖标准将T2DM组分为非肥胖组(A组,n=30,BMI<28,男性16例,女性14例)和肥胖组(B组,n=32,BMI≥28,男性22例,女性10例)。测定身高、体质量、腰围、臀围、收缩压、舒张压,计算体质量指数(body mass index,BMI)、腰臀比,测定胆固醇(total cholesterol,TC)、三酰甘油(concentrations of triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、血糖、HbA1c、胰岛素水平,并计算胰岛素曲线下面积(AUCINS)、血糖曲线下面积(AUCGLU)、胰岛素抵抗指数(HOMA-IR)、胰岛β细胞功能指数(HOMA-β)。结果T2DM组血清A-FABP水平最高,明显高于IGR及NGT组(P<0.05);IGR组血清A-FABP水平明显高于NGT组(P<0.05);T2DM B组BMI、WC、HC、UA、FINS、HOMA-IR、HOMA-β均高于T2DM A组(P<0.05);2型糖尿病肥胖组血清A-FABP水平明显高于非肥胖组(P<0.05);血清A-FABP水平与BMI、WC、HC、UA、TC、TG、FPG、2 hPG、AUCGLU、HOMA-IR呈显著正相关(P<0.05),与LDL-C、HDL-C、SBP、DBP、FINS、AUCINS、HOMA-β无相关(P>0.05)。多元逐步回归分析显示,BMI、HbA1c和UA为血清A-FABP水平的独立影响因素。结论血清A-FABP与肥胖、胰岛素抵抗和糖脂代谢密切相关,是代谢综合征的异常标志。
糖尿病,2型;葡糖耐量试验;肥胖症
脂肪细胞型脂肪酸结合蛋白(adipocyte fatty acid-binding protein,A-FABP)又称脂肪细胞脂类结合蛋白,aP2或P15蛋白,是全身胰岛素敏感性和脂质、葡萄糖代谢的重要调节器[1]。脂肪组织的内分泌功能异常是导致胰岛素抵抗的重要原因,作为脂肪因子之一的A-FABP与2型糖尿病、动脉粥样硬化、血脂紊乱、肥胖、胰岛素抵抗(insulin resistance,IR)和代谢综合征(metabolic syndrome,MS)等密切相关。本研究通过比较不同糖耐量人群血循环中A-FABP水平的变化,旨在明确其在2型糖尿病(type 2 diabetes mellitus,T2DM)发病中的作用,并进一步探寻其与肥胖程度、血压、血糖、血脂、胰岛素抵抗程度及胰岛素分泌功能之间的相关性,以期对高危人群进行早期干预,防止或延缓T2DM的发生、发展,降低其发病率及病死率,提高人们的生存质量。
1 资料与方法
1.1 一般资料 选取2012年1—10月就诊于河北医科大学第三医院、并行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)者120例,男性69例,女性51例,年龄42~65岁,平均(55.98±8.92)岁。根据1999年世界卫生组织制定的糖尿病诊断标准将受试对象分为正常对照组(normal glucose tolerance,NGT)26例,糖调节受损组(impaired glucose regulation,IGR)32例,T2DM组62例。将符合T2DM组入选条件的患者根据《中国成人超重和肥胖症预防控制指南》确立的肥胖标准分为2个亚组:T2DM A组(30例,男性16例,女性14例,BMI<28);T2DM B组(32例,男性22例,女性10例,BMI≥28)。所有研究对象均无严重心、肝、肺、肾及脑血管等重大疾患;无任何感染;无其他内分泌代谢性疾病;无手术及其他应激情况;近期末使用抗生素、甾体或非甾体类药物。
本研究获得河北医科大学第三医院伦理委员会批准,所有研究对象均签署知情同意书。
1.2 研究方法
1.2.1 人体简易参数测量 测定受试者身高、体质量、腰围(waist circumference,WC)、臀围(hip circumference,HC)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP),并计算体质量指数(body mass index,BMI)、腰臀比(waist to hip ratio,WHR)。
1.2.2 生化指标及A-FABP测定 所有研究对象均抽取空腹肘静脉血,离心后-20 ℃保存,集中测定。①A-FABP测定:应用美国Biovendor公司人血清A-FABP试剂盒,采用酶联免疫吸附法测定血清A-FABP浓度,批内变异系数6.9%,批间变异系数10.1%。②生化指标测定:应用日立全自动生化分析仪,采用酶法测定胆固醇(total cholesterol,TC)、三酰甘油(concentrations of triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)(OLYMPUSAU-2700,日本);葡萄糖氧化酶法测定血糖(VITROS FUSION 5.1,日本);采用放射免疫法测定胰岛素(XH6020-γ放射免疫计数器,西安)。
1.3 指标评估 HOMA胰岛素抵抗指数(HOMA-insulin resistance index,HOMA-IR)= FPG×FINS/22.5,评估胰岛素抵抗程度;HOMA胰岛β细胞功能指数(HOMA-β cell function index,HOMA-β)= 20×FINS/(FPG-3.5);采用近似梯形面积公式计算胰岛素曲线下面积(AUCINS),评估胰岛细胞分泌功能;同时计算血糖曲线下面积(AUCGLU)。
1.4 统计学方法 应用SPSS 13.0统计软件分析数据。计量资料比较分别采用单因素方差分析、SNK-q检验和t检验;相关性分别采用Pearson相关分析及多元逐步回归分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 一般资料比较 NGT组、IGR组、T2DM组(包括T2DM A组及T2DM B组)间年龄、性别比、SBP、DBP、HDL-C、LDL-C差异均无统计学意义(P>0.05)。T2DM组TC、TG、UA、FPG、2 hPG、HbA1c、HOMA-IR均显著高于NGT和IGR组(P<0.05),T2DM组WC高于NGT组,T2DM组HC高于IGR组(P<0.05);HOMA-β显著低于NGT、IGR组(P<0.05);IGR组2hPG、HbA1c显著高于NGT组(P<0.05)。 T2DM B组BMI、WC、HC、UA、FINS、HOMA-IR、HOMA-β均高于 T2DM A组(P<0.05)。见表1,2。
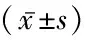

组别例数年龄(岁)性别(例数)男女BMIWC(cm)HC(cm)WHRSBP(mmHg)NGT2655.12±13.21141224.95±2.8184.50±9.4194.71±8.750.89±0.044134.65±24.08IGR3254.75±10.67151726.66±4.9585.33±13.0993.39±10.090.91±0.07138.00±18.45T2DM6250.87±10.47382427.32±3.5992.94±16.96∗100.12±8.48#0.93±0.13132.16±15.95 F/χ21.5771.3223.4334.4847.1421.1431.045 P0.2110.3120.0360.0130.0010.3220.355组别例数DBP(mmHg)TC(mmol/L)TG(mmol/L)HDL⁃C(mmol/L)LDL⁃C(mmol/L)UA(mmol/L)NGT2683.54±15.234.74±0.921.51±0.651.11±0.272.87±0.83262.59±50.05IGR3283.34±14.874.57±1.061.62±0.931.07±0.323.06±1.50279.11±32.56T2DM6285.94±7.075.41±1.29∗#2.18±0.95∗#1.08±0.313.20±0.89355.88±71.08∗# F0.7026.3166.9080.1170.86327.753 P0.4980.0030.0010.8900.4250.000组别例数FPG(mmol/L)2hPG(mmol/L)FINS(mmol/L)HbA1c(%)HOMA⁃IRHOMA⁃βNGT264.95±0.456.57±1.2112.62±9.05.89±0.332.86±2.18172.61±99.28 IGR325.20±0.629.04±1.48∗13.68±9.146.25±0.27∗3.21±2.28168.77±110.83T2DM628.67±3.08∗#17.60±4.93∗#14.49±13.387.89±1.53∗#5.17±3.84∗#87.42±125.80∗# F37.858106.3960.25031.8766.7537.998 P0.0000.0000.7790.0000.0020.001
*P<0.05与NGT组比较 #P<0.05与IGR组比较(q检验)
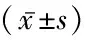
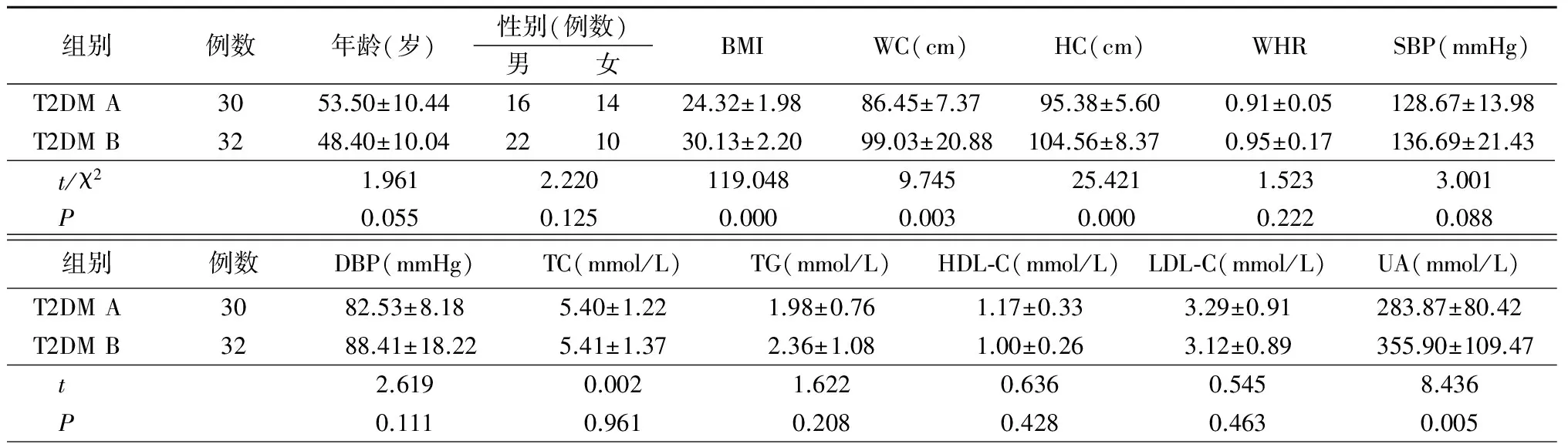
组别例数年龄(岁)性别(例数)男女BMIWC(cm)HC(cm)WHRSBP(mmHg)T2DMA3053.50±10.44161424.32±1.9886.45±7.3795.38±5.600.91±0.05128.67±13.98T2DMB3248.40±10.04221030.13±2.2099.03±20.88104.56±8.370.95±0.17136.69±21.43 t/χ21.9612.220119.0489.74525.4211.5233.001 P0.0550.1250.0000.0030.0000.2220.088组别例数DBP(mmHg)TC(mmol/L)TG(mmol/L)HDL⁃C(mmol/L)LDL⁃C(mmol/L)UA(mmol/L)T2DMA3082.53±8.185.40±1.221.98±0.761.17±0.333.29±0.91283.87±80.42T2DMB3288.41±18.225.41±1.372.36±1.081.00±0.263.12±0.89355.90±109.47 t2.6190.0021.6220.6360.5458.436 P0.1110.9610.2080.4280.4630.005
表2 (续)
2.2 各组血清A-FABP浓度比较 T2DM B组血清A-FABP水平最高,明显高于NGT组、IGR组和T2DM A组,T2DM A组高于NGT组和IGR组,IGR组高于NGT组,差异均有统计学意义(P<0.05),见表3。

表3 各组间A-FABP浓度比较Table 3 The level of A-FABP in each group
*P<0.05与NGT组比较 #P<0.05与IGR组比较 △P<0.05与T2DM B组比较(q检验)
2.3 血清A-FABP浓度与各因素的相关性 校正性别、年龄后,A-FABP与BMI、WC、HC、FPG、HOMA-IR、2 hPG、HbA1c、AUCGLU、TG、TC均呈显著正相关(P<0.05),与WHR、SBP、DBP、FINS、HOMA-β、AUCINS、LDL-C、HDL-C(P>0.05)无相关,见表4。
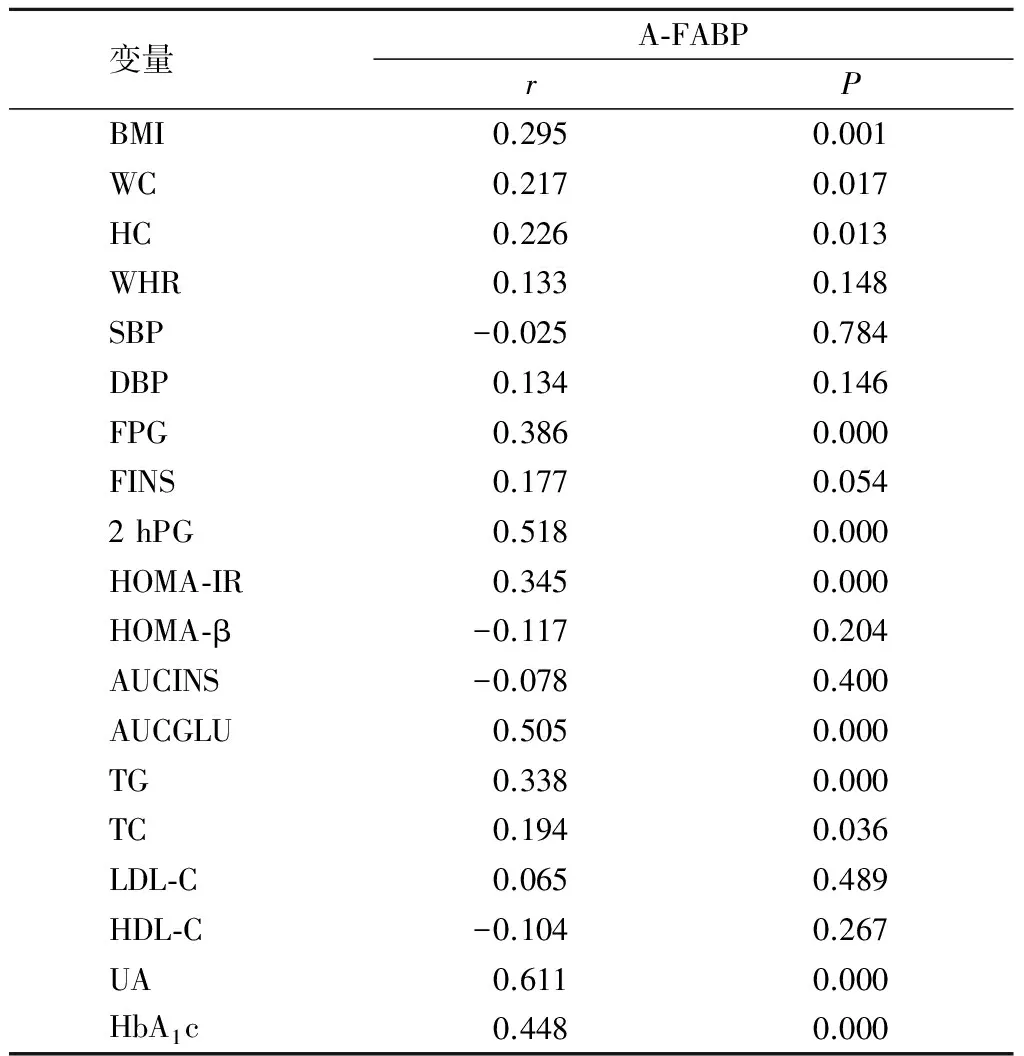
表4 A-FABP与各因素的相关分析Table 4 The correlation between A-FABP and various anthropometric and biochemical measures
2.4 多元逐步回归分析 以A-FABP(Y)为因变量,其他因素为自变量,进行多元逐步回归分析,结果显示UA、HbA1c、BMI是A-FABP的独立影响因素,见表5,6。
表5 A-FABP变量赋值表Table 5 The variable assignment table of A-FABP
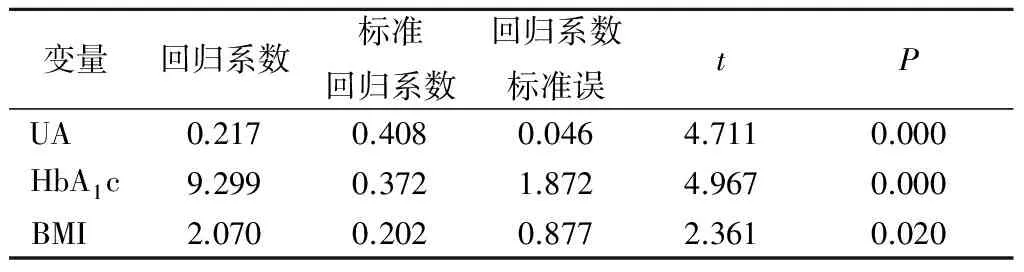
表6 A-FABP多元逐步回归分析Table 6 The multiple stepwise regression analysis of A-FABP
3 讨 论
近年来,世界各国T2DM的患病率急剧增加,最新研究结果显示目前全球成年糖尿病患者人数接近3.5亿[2]。糖尿病不仅仅是工业化发达国家的“富贵病”,包括中国在内的发展中国家已经成为糖尿病的重灾区。全球范围内IGR的患病率与糖尿病一样,呈逐年增高趋势,而在IGR阶段即存在多种危险因素,其危险程度与糖尿病基本相当。如何及早发现IGR人群,在其发展为糖尿病的前期进行干预成为目前研究热点。
A-FABP是成熟脂肪细胞的主要细胞溶质蛋白,含量丰富,占胞内总蛋白的6%,主要存在于哺乳动物的各种组织和细胞,如胎儿甲状腺、胎盘、脂肪细胞、阑尾细胞等组织中,也可分泌入血存在于血清中。A-FABP作为脂肪酸的分子伴侣,促进体内脂肪酸的转运,有利于体内能量的贮存,在脂肪细胞中具有沉积TG的作用,又被称为肌内脂肪的候选基因。近年来研究表明,A-FABP与多种临床疾病如T2DM、血脂紊乱、肥胖、胰岛素抵抗(insulin resistance,IR)和MS等密切相关[3]。
肥胖被认为是一种慢性低水平炎症状态,脂肪细胞的大小及数量会直接影响肥胖的病理变化,A-FABP与肥胖之间的关系已被证实,肥胖者脂肪组织增多,分泌的A-FABP含量相应增多,其表达的失衡可能会导致脂肪组织的代谢和分化异常,从而影响肥胖的病理变化。既往Xu等[4]研究发现,成年人肥胖和超体质量患者中血清A-FABP的浓度明显高于正常人群,并与WC、WHR、游离脂肪酸等呈正相关。Thomas等[5]观察到,肥胖儿童减体质量后其A-FABP水平较减体质量前显著降低,证实A-FABP与BMI密切相关。本研究观察到,T2DM B组血清A-FABP水平显著高于T2DM A组,血清A-FABP水平与WC、HC、BMI等肥胖相关指数呈正相关。与上述研究结果一致,进一步证实血清A-FABP与肥胖的发生密切相关,肥胖可能是血清A-FABP水平升高的因素之一。
A-FABP对脂质代谢和胰岛素敏感性的影响主要是由于其对细胞内和全身脂肪酸的转运和合成作用,A-FABP可将脂肪酸从细胞膜运输到脂肪氧化、TG及磷脂的合成场所,促进TG在脂肪细胞中的沉积[6-8]。本研究表明,无论是T2DM A组、B组还是IGR组,A-FABP水平高的人群其TC和TG的水平也较高,A-FABP水平与血清TC和TG水平呈正相关。此前Xu等[4]报道,成年肥胖和超体质量患者的血清A-FABP浓度和TG、LDL-C、血压之间存在正相关关系。与HDL-C、脂联素呈负相关关系;黄岚等[9]在研究A-FABP与青少年腹型肥胖的相关性研究中观察到,A-FABP与TG、TC、LDL-C、SBP、DBP有显著的正相关性。本研究结果与上述文献报道相一致,提示A-FABP与血脂代谢紊乱密切相关,不同的是本研究未发现A-FABP与血压之间的相关性,下一步应扩大样本量,进一步探讨A-FABP与血压之间的关系。
另外,本研究结果显示,T2DM组无论肥胖与否,其UA水平均显著高于NGT、IGR组,且血清A-FABP与UA密切相关。多元逐步回归分析显示,UA进入A-FABP的回归方程,故UA可能是影响血清 A-FABP水平的独立影响因素,或是两者互为影响。目前国内外尚无UA与A-FABP之间关系的报道,A-FABP与UA的关系及其两者之间的作用机制尚需要进一步深入探讨。
国外研究报道,A-FABP通过增强IKK-NF-κB信号传导通路,激活NF-κB,并诱导促炎症因子的产生(如肿瘤坏死因子α、白细胞介素1α等),从而激活细胞因子信号转导抑制因子3,抑制胰岛素受体底物1的酪氨酸磷酸化,导致IR[10]。在肥胖小鼠模型中,A-FABP基因敲除不但可以改善外周组织胰岛素抵抗,还可以保护胰岛β细胞功能、降低血浆TG和TC水平[11-12]。本研究观察到,T2DM的HOMA-IR和A-FABP水平均高于IGR组和NGT组。另外,本研究发现,血清A-FABP与HOMA-IR密切相关,与AUCINS、HOMA-β无相关性。由此笔者认为血清A-FABP可能是导致靶组织发生IR的一个新的脂肪因子。
Tso等[13]对544例非糖尿病中国人群血清A-FABP水平进行基线和10年后水平检测,结果显示IGT或IGR人群的基线血清A-FABP水平明显高于NGT(P<0.01),在排除肥胖、IR和血糖指数影响的情况下,血清A-FABP水平升高,可以独立预测T2DM的发生。叶文慧等[14]应用整群分层随机抽样法抽取255例社区居民,观察社区人群血清A-FABP水平与T2DM的相关性,结果显示血清A-FABP水平在NGT组、IGR组和T2DM组呈升高趋势(P=0.000),且A-FABP浓度与FPG、餐后2 hPG、FINS、HbA1c、BMI、WC、SBP及IR呈直线正相关(P=0.000),而与HDL-C呈负相关(P=0.000),与身高、DBP无相关性(P>0.05)。因此,他们认为外周血清A-FABP水平与糖脂代谢紊乱密切相关,并且高A-FABP水平提示T2DM的发生、发展。本研究结果显示,T2DM患者血清A-FABP水平最高,明显高于IGR组及NGT组;IGR组血清A-FABP水平明显高于NGR组;A-FABP水平与FPG、2 hPG、HbA1c呈正相关。与上述文献报道相一致。表明血清A-FABP参与IGT、糖尿病的发病过程,与糖代谢紊乱的发生发展密切相关。与既往文献报道不同的是,本研究通过多元逐步回归分析发现,HbA1c最终进入A-FABP的回归方程,由此笔者认为A-FABP有望成为反映血糖代谢紊乱的敏感指标。
总之,血清A-FABP与肥胖、IR和糖脂代谢、高尿酸血症等密切相关,是MS的异常标志,血清A-FABP水平测定能否作为T2DM的一个独立预测因素,为T2DM的早期防治提供理论依据,还有待于基础研究的继续深入和临床应用研究的广泛开展。
[1] Makowski L,Hotamisligil GS. Fatty acid binding proteins-the evolutionary crossroads of inflammatory and metabolic responses[J]. J Nutr,2004,134(9):2464S-2468S.
[2] Danaei G,Finucane MM,Lu Y,et al. National,regional,and global trends in fasting plasma glucose and diabetes prevalence since 1980:systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2-7 million participants[J]. Lancet,2011,378(9785):31-40.
[3] Furuhashi M,Hotamisligil GS. Fatty acid-binding proteins:role in metabolic diseases and potential as drug targets[J]. Nat Rev Drug Discov,2008,7(6):489-503.
[4] Xu A,Wang Yu,Xu JY,et al. Adipocyte fatty acid-binding protein is a plasma biomarker closely associated with obesity and metabolic syndrome[J]. Clin Chem,2006,52(3):405-413
[5] Thomas R,Birgit S,Christain L,et al. Adipocyte fatty acid binding protein in obese children before and after weight loss[J]. Metabolism,2007,56:1735-1741.
[6] Hertzel AV,Smith LA,Berg AH,et al. Lipid metabolism and adipokine levels in fatty acid-binding protein null and transgenic mice[J]. Am J Physiol Endocrinol Metab,2006,290:E814-823.
[7] Park SE,Rhee EJ,Lee WY,et al. The role of serum adipocyte fatty acid-binding protein on the development of metabolic syndrome is independent of pro-inflammatory cytokines[J]. Nutr Metab Cardiovasc Dis,2012,22(6):525-532.
[8] Baar RA,Dingfelder CS,Smith LA,et a1. Investigation of in vivo fatty acid metabolism in A-FABP/aP2(-/-) mice[J]. Am J Physiol Endocrinol Metab,2005,288(1):E187-193.
[9] 黄岚,董萍,吴鸿,等,血清脂肪细胞脂肪酸结合蛋白:青少年腹型肥胖的重要标志物[J].中华内分泌代谢,2009,25(4):391-393.
[10] Makowski L,Brittinqham KC,Reynolds JM,et al. The fatty acid-binding protein,aP2,coordinates macrophage cholesterol trafficking and inflammatory activity. Macrophage expression of aP2 impacts peroxisome proliferator-activated receptor gamma and IkappaB kinase activities[J]. J Biol Chem,2005,280:12888-12895.
[11] Erbay E,Babaev VR,Mayers JR,et al. Reducing endoplasmic reticulum stress through a macrophage lipid chaperone alleviates atherosclerosis[J]. Nat Med. 2009,15(12):1383-1391.
[12] Hui X,Li H,Zhou Z,et al. Adipocyte fatty acid-binding protein modulates inflammatory responses in macrophages through a positive feedback loop involving c-Jun NH2-terminal kinases and activator protein-1[J]. J Biol Chem,2010,285(14):10273-10280.
[13] Tso AW,Xu A,Sham PC,et al. Serum adipocyte fatty acid binding protein as a new biomarker predicting the development of type 2 diabetes:a 10-year prospective study in a Chinese cohort[J]. Diabetes Care,2007,30:2667-2672.
[14] 叶文慧,彭湘杭,艾雅琴,等.血清脂肪细胞脂肪酸结合蛋白与社区人群2型糖尿病的相关性[J].南方医科大学学报,2011,31(3):508-511.
(本文编辑:刘斯静)
Relationship between serum adipocyte fatty acid-binding protein and islet beta cell function in individuals with different glucose tolerance
BAI Jing, LEI Ying, QI Fan-fan, WANG Xue, WANG Zhan-jian, ZHOU Ya-ru*
(Department of Endocrinology, the Third Hospital of Hebei Medical University, Shijiazhuang 050051, China)
Objective To investigate the level of serum adipocyte fatty acid-binding protein(A-FABP) and the relationship between serum A-FABP and body mass index(BMI), blood pressure, blood glucose, blood lipid, HOMA-insulin resistance index(HOMA-IR), insulin levels in Han Chinese population with different glucose tolerance. Methods A total of 120 subjects were enrolled in this study. They were divided into 3 groups according to 75 g oral glucose-tolerance-test(OGTT), including normal glucose tolerance(NGT,n=26), impaired glucose regulation(IGR,n=32), and type 2 diabetes mellitus(T2DM,n=62). The T2DM group was divided into 2 subgroups by BMI according to the guidelines of the prevention and treatment adiposity in China, which included group A(non-obese subjects) and group B(obese subjects). Clinical and biochemical metabolic parameters were measured. Results The levels of serum A-FABP were significantly higher in T2DM subjects than those of IGR and NGT subjects(P<0.01). Compared with NGT group, fasting serum A-FABP levels were significantly increased in IGR group(P<0.01). Compared with T2DM group, BMI、WC、HC、UA、FINS、HOMA-IR、HOMA-βlevels were significantly increased in IGR group(P<0.05). The level of serum A-FABP was significantly higher in T2DM obese subjects than T2DM non-obese subjects(P<0.01). Serum A-FABP was correlated positively with BMI、WC、HC、UA、TC、TG、FPG、2 hPG、AUCGLU and HOMA-IR(allP<0.05). There was no correlation between serum AFABP and LDL-C、HDL-C、SBP、DBP、FINS、AUCINS、HOMA-β(allP>0.05). Multiple regression analysis showed that BMI, HbA1c and UA were independently related factors for serum A-FABP levels. Conclusion The level of A-FABP is associated with obesity, insulin resistance, abnormal glucose and lipid metabolism. Measurement of serum A-FABP concentrations might be useful for diagnosis and prevention of T2DM.
diabetes mellitus, type 2; glucose tolerance test; obesity
2016-05-13;
2016-07-18
河北省医学科学研究重点课题(20120108)
白婧(1987-),女,山西临汾人,现为河北省沧州市人民医院医师,医学硕士,从事内分泌代谢疾病诊治研究。
*通讯作者。E-mail:lzhouyaru@gmail.com
R587.1
A
1007-3205(2017)01-0001-06
10.3969/j.issn.1007-3205.2017.01.001

